登革2型病毒E基因DⅢ区的原核表达及血清学诊断应用
2016-02-05王金章翁育伟严延生
王金章 翁育伟 严延生
350001福州,福建省疾病预防控制中心福建省人兽共患病研究重点实验室
登革2型病毒E基因DⅢ区的原核表达及血清学诊断应用
王金章 翁育伟 严延生
350001福州,福建省疾病预防控制中心福建省人兽共患病研究重点实验室
目的表达登革2型病毒E基因DⅢ区重组蛋白并应用于血清登革病毒IgM抗体检测。方法构建包含登革2型病毒E基因DⅢ区片段的重组表达质粒,并在E.coli BL21(DE3)中表达,利用重组蛋白建立间接ELISA法用于血清登革病毒IgM抗体检测。结果成功构建重组表达质粒并表达重组蛋白,纯化的重组蛋白用于血清登革病毒IgM抗体检测,以IFTA作为参照标准,灵敏度为93.75%,特异度为91.25%;与Panbio Dengue IgM Capture ELISA试剂盒检测结果相比,二者具有较高的一致性(χ2=0.214,P>0.05;Kappa=0.825)。结论在大肠杆菌中成功表达登革2型病毒E基因DⅢ区重组蛋白,并能够应用于血清登革病毒IgM抗体检测。
Fund programs:National High⁃tech R&D Program of China(863 Program)(2011AA02A114);National Science and Technology Major Project of China(2012ZA10004⁃210);Fujian Provincial Medical Innovation Project(2015⁃CXB⁃13)
登革热(Dengue fever,DF)是一种经蚊媒传播的急性自然疫源性传染病。人体感染4种血清型的登革病毒(DENV)后多数病例症状和体征较轻,但少数病例可发展成为严重的、病死率高的登革出血热、登革休克综合征[1]。近年来随着商旅活动的频繁和全球气候条件的变化,DF病例不断扩散,已有128个国家和地区约39亿人口受到DENV的威胁[2]。自1978年我国广东省佛山市首次报告DF暴发疫情以来,近几十年DF在我国的分布范围逐渐扩大,但主要集中在广东、广西、福建、云南、海南等东南沿海地区[3,4]。由于DF的输入不确定性、突发性等原因易导致误诊、漏诊,从而导致疫情发现和处理不及时造成疫情的蔓延,因此,实验室检测结果成为发现DF疫情的关键,通过快速准确的早期检测技术及时发现并控制传染源是有效开展DF防治的重要基础[5]。
由于DF的病毒血症期很短,抗原检测方法受采样时间限制较大,血清抗体诊断方法成为目前的主要早期诊断方法[6]。近年来,已有多家国内外试剂公司成功研制并推出了相应的商品化试剂盒,但这些试剂盒要么灵敏度和特异度不够理想,要么价格昂贵、采购困难,难以在基层普及。本研究旨在通过在大肠杆菌(Escherichia coli,E.coli)中表达登革2型病毒(DENV2)E基因DⅢ区截短多肽,获得高表达量、高免疫反应性的重组蛋白,以纯化后的重组蛋白为抗原建立登革病毒IgM抗体的间接ELISA检测方法,应用于DF的早期诊断。
1 材料与方法
1.1 材料
1.1.1 细胞株、表达载体、菌毒株和标本:E.coli DH5α感受态细胞购自大连TAKARA公司,C6/36细胞、载体质粒pET⁃30a(+)、E.coli BL21(DE3)、DENV2(NGC)病毒株和待检血清标本(包括80份正常人血清、80份DF、6份乙脑、9份流行性出血热、10份恙虫病、15份疟疾、5份黄热病、8份甲肝患者血清)均为本实验室所保存。
1.1.2 主要试剂、耗材:细胞培养所用试剂购自美国HyClone公司;One step RT⁃PCR试剂盒、QIAamp Viral RNA Mini Kit购自德国QIAGEN公司;NdeI和XhoI限制性内切酶、DNA Ligation Kit购自大连TAKARA公司;蛋白质分子量标准(低)、琼脂糖凝胶DNA回收试剂盒和质粒提取试剂盒均购自北京TIANGEN公司;空白的酶标板条、封闭液、样品稀释液、酶标二抗及酶稀释液由厦门英科新创公司提供。Dengue IgM Capture ELISA试剂盒(以下简称Panbio试剂盒)购自澳大利亚Panbio公司。
1.2 方法
1.2.1 引物合成:E蛋白DⅢ区片段RT⁃PCR扩增引物引入NdeI和XhoI酶切位点(划线部分)并由TAKARA公司合成,正向引物序列5′⁃TTTCATATG GCAGAAACACAA⁃3′,反向引物序列5′⁃TATCTCG AGTTGGCCGATAGA⁃3′。
1.2.2 病毒培养及抗原片制作:C6/36细胞在含10%胎牛血清(FBS)的1640培养液中于5%CO2、28℃条件下培养至单层后,接种DENV2 NGC病毒株,静置吸附1 h,加入含2%FBS的1640培养液,置于5%CO2、28℃条件下培养至出现细胞病变,收集培养上清,细胞用以制作抗原片备用,方法参照文献[7]。
1.2.3 E蛋白DⅢ区基因片段的获得:取140 μl培养上清提取病毒RNA,提取方法参照QIAGEN公司QIAamp Viral RNA Mini Kit说明书;E蛋白DⅢ区基因片段RT⁃PCR扩增方法参照QIAGEN公司One step RT⁃PCR试剂盒说明书;扩增产物回收纯化方法参照TIANGEN公司琼脂糖凝胶DNA回收试剂盒说明书。
1.2.4 E蛋白DⅢ区基因重组表达质粒的构建:纯化后E蛋白DⅢ区基因片段及表达载体pET30a(+)经NdeI、XhoI双酶切后,按TAKARA公司DNA Ligation Kit说明书连接。连接产物转化E.coli DH5α感受态细胞,涂布含50 μg/ml卡那霉素(Kan)的LB培养皿,置于37℃培养箱过夜孵育后挑取单菌落,于含Kan 50 μg/ml的LB培养液37℃摇床160 rpm振荡孵育过夜后,提取质粒并做NdeI、XhoI双酶切鉴定。鉴定正确的重组质粒送TAKARA公司测序,测序结果分析用LaserGene软件包进行。
1.2.5 重组蛋白诱导表达及免疫反应性鉴定:重组质粒转化E.coli BL21(DE3),待重组菌培养至对数生长期时,加入1 mmol/L IPTG进行诱导表达,表达产物经15%SDS⁃PAGE分析鉴定,然后经电洗脱纯化,以15%SDS⁃PAGE评价重组蛋白的纯化效果,用Western blot对其进行免疫反应性鉴定,SDS⁃PAGE电泳、电洗脱纯化及Western blot操作参照《分子克隆实验指南》[8]进行。
1.2.6 间接免疫荧光(IFTA)检测临床血清:利用1.2.2中制成的抗原片,80份DF感染者血清和80份正常人血清标本用0.01 mmol/L PBS按1∶100稀释后作为一抗,以FITC标记的羊抗人IgM做为二抗,操作步骤参见文献[6,9]。
1.2.7 重组蛋白建立ELISA检测待检血清并对结果进行分析:用100 ng/孔的纯化重组蛋白作为抗原建立间接ELISA检测方法(以下简称iELISA)对待测血清进行检测,具体操作参见文献[7,10]。以IFTA结果为金标准比较,计算iELISA检测登革病毒IgM抗体的灵敏度和特异度;与Panbio试剂盒检测登革病毒IgM抗体结果比较,计算Kappa值,判断两种ELISA法检测结果的一致性,差异性比较用χ2检验,统计标准取α=0.05。通过对53份确诊其他疾病的血清抗体进行检测,了解iELISA与其他病原体相关抗体的交叉反应情况。
2 结果
2.1 E基因DⅢ区的扩增及构建的重组质粒酶切鉴定E基因DⅢ区的扩增片段(D2E⁃DⅢ)长度264 bp,NdeⅠ/XhoⅠ双酶切后D2E⁃DⅢ与载体pET30a(+)构成的重组质粒命名为pET30a⁃D2E⁃DⅢ,pET30a⁃D2E⁃DⅢ用NdeⅠ/XhoⅠ双酶切后电泳,D2E⁃DⅢ片段插入载体pET30a(+)前后的位置一致。同时对插入片段的测序结果表明,其序列与DENV2(NGC)株相应位置的序列完全相符,表明目标重组质粒构建成功(图1)。
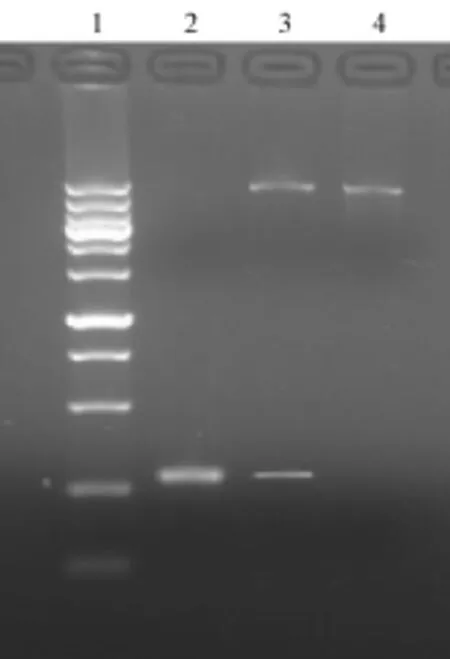
1:100⁃6 000 bp Wide Range DNA Marker;2:酶切后的D2E⁃DⅢ;3:酶切后的pET30a⁃D2E⁃DⅢ;4:酶切后的pET30a图1 重组质粒pET30a⁃D2E⁃DⅢ的NdeI/XhoI双酶切1:100⁃6 000 bp Wide Range DNA Marker;2:D2E⁃DⅢdigested by NdeI/XhoI;3:pET30a⁃D2E⁃DⅢdigested by NdeI/XhoI;4:pET30a digested by NdeI/XhoIFig.1 Identification of the recombinant plasmid pET30a⁃D2E⁃DⅢby digestion with NdeI/XhoI
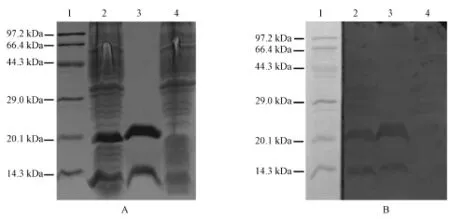
A:15%SDS⁃PAGE;B:Western blot免疫反应性鉴定1:蛋白质分子量标准(低);2:纯化前的重组蛋白;3:纯化后的重组蛋白;4:pET30a表达产物(对照)图2 重组蛋白15%SDS⁃PAGE及Western blot分析鉴定A:Analysis results by 15%SDS⁃PAGE;B:Immune reactivity by Western blot1:Protein Molecular Weight Marker(Low);2:recombinant protein before purification;3:purified recombinant protein;4:expression of pET30a(control)Fig.2 Analysis of the recombinant proteins by 15%SDS-PAGE and Western blot
2.2 重组蛋白的诱导表达与Western blot免疫反应性鉴定重组质粒pET30a⁃D2E⁃DⅢ及pET30a分别转化于BL21(DE3)经IPTG诱导后,用15%SDS⁃PAGE电泳,结果如图2(A)所示:10kDa附近有一条明显的蛋白带,与预期分子量9.75 kDa相符;另在20kDa附近也同时出现一条明显的蛋白带,切取10kDa附近蛋白电洗脱纯化后的15%SDS⁃PAGE电泳结果也同样在20 kDa附近出现这一蛋白带,表明这一蛋白带是重组蛋白所形成的多聚体。重组蛋白Western blot免疫反应性鉴定在10 kDa和20 kDa附近均有特异性反应带出现,位置与15%SDS⁃PAGE电泳结果相一致(图2),说明重组蛋白具有较好的免疫反应性,且在经电洗脱纯化后仍保留相应的免疫反应性。
2.3 重组蛋白的应用
2.3.1 重组蛋白应用于检测登革病毒IgM抗体:构建的iELISA、IFTA及Panbio试剂盒检测80份DF感染者血清、80份正常人血清登革病毒IgM,具体结果见表1。以IFTA为金标准,iELISA检测登革病毒IgM的灵敏度为93.75%,特异度为91.25%;以Panbio试剂盒为参比试剂对照,iELISA与其检测结果差异无统计学意义(χ2=0.214,P>0.05),且两检测方法具有较高的一致性(Kappa=0.825);所有DF感染者待检血清中经PCR分型确认型别的标本分别有DENV1型11份、DENV2型13份、DENV3型8份,这些血清经iELISA与Panbio试剂盒检测IgM抗体均为阳性,提示iELISA无法用于血清分型。
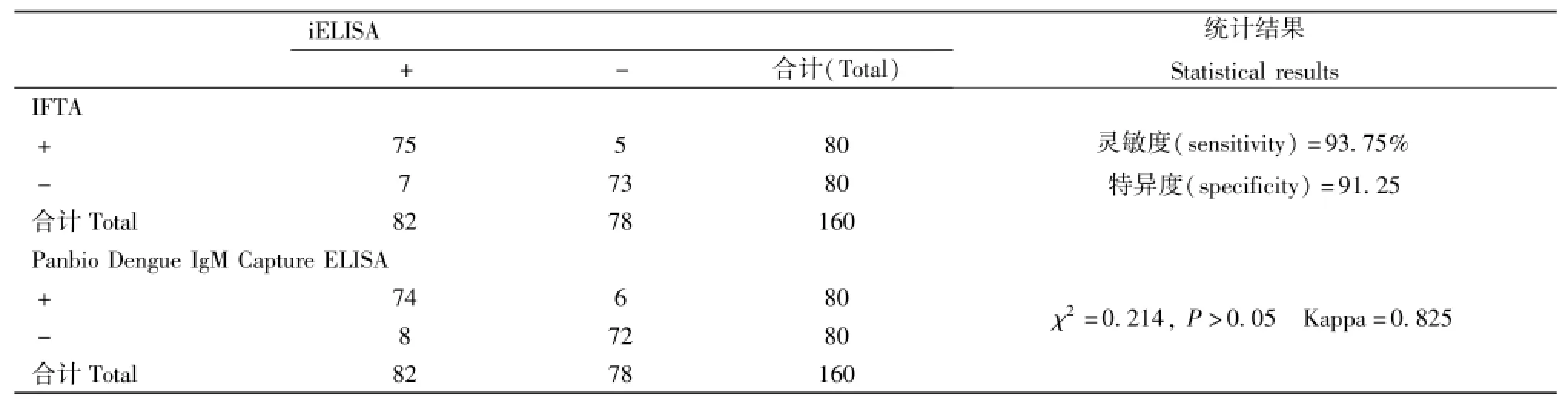
表1 iELISA、IFTA及Panbio试剂盒检测160份待测血清登革病毒IgMTab.1 Detection of anti⁃dengue virus IgM in 160 serum specimens by the iELISA,IFTA and Panbio Dengue IgM Capture ELISA
2.3.2 重组蛋白与其他病原体相关抗体的交叉反应:本研究另收集了乙脑、流行性出血热、恙虫病、疟疾、黄热病、甲肝患者血清共53份,通过iELISA与Panbio试剂盒同时对这些标本进行检测,结果如表2所示,iELISA未发现对流行性出血热的交叉反应;两个检测方法均对恙虫病和疟疾存在交叉反应。

表2 iELISA交叉反应分析Tab.2 Cross reaction analysis of iELISA constructed
3 讨论
登革病毒E蛋白包含了3个结构域(DomainⅠ⁃Ⅲ),其中DⅢ区含有多个中和表位和宿主细胞受体识别位点,能够诱导产生有效的中和抗体[11],因此国内外的研究者常把E蛋白DⅢ区作为检测试剂研发的候选抗原。Simmons等成功表达了登革病毒DIII区重组蛋白并建立了具有较高的敏感性和特异性的登革病毒抗体间接ELISA检测方法[12]。以大肠杆菌为宿主的原核表达系统具有成本低,繁殖快等优点,但由于密码子使用偏好等原因可导致某些基因无法在大肠杆菌中表达[13],为了减少稀有密码子对表达过程的影响,本研究选择E基因DⅢ区的截短片段,通过原核表达系统获得高产量的重组蛋白,应用于血清学检测。
IFTA具有敏感性高、特异性强等特点,能够较正确的对血清中登革病毒IgM抗体进行判断,本研究选用IFTA作为金标准能较准确的判断iELISA的灵敏度和特异度。另外澳大利亚Panbio公司试剂盒是目前国内外实验室常用的登革病毒IgM抗体检测试剂盒,以该试剂盒作为参比对照,能够较为直观的了解本研究ELISA方法的应用前景。将两种方法与iELISA方法对既往保存80份的DF阳性血清及80份正常人血清进行登革病毒IgM检测,结果显示iELISA具有较高的灵敏度和特异度,通过χ2检验显示其与Panbio试剂盒的检测差异无统计学意义,检测结果具有效高的一致性。因此,本研究所获得的重组蛋白及所建立的间接ELISA检测方法能在DF早期检测有良好的应用前景。
从iELISA检测结果上看,所获得的重组蛋白将无法应用于血清学分型,但由于其对多个血清型的DF均能产生免疫反应,这也为研制通用型的DF检测试剂提供了便利;为了解重组蛋白与其他传染病血清抗体之间交叉反应的情况,收集53份此类标本对进行检测方法的进一步验证,该重组蛋白可对疟疾、恙虫病产生交叉反应,但并不明显;在未来的研究中还需对试剂的组装条件、检测流程等进行优化,并通过进一步增加检测标本量来评估检测方法的可靠性。
[1] MartinaBE,KorakaP,OsterhausAD.Denguevirus pathogenesis:an integrated view[J].Clin Microbiol Rev,2009,22(4):564⁃581.doi:10.1128/CMR.00035⁃09.
[2] Brady OJ,Gething PW,Bhatt S,Messina JP,Brownstein JS,Hoen AG et al.Refining the global spatial limits of Dengue virus transmission by evidence⁃based consensus[J].PLoS Negl Trop Dis.2012,6(8):e1760.doi:10.1371/journal.pntd.0001760.
[3] 陈武,吴生根,洪荣涛,等.福建省2004⁃2013年登革热流行特征分析[J].中国公共卫生,2015,31(1):1⁃4.doi:10. 11847/zgggws2015⁃31⁃01⁃01.
[4] Liu C,Liu Q,Lin H,et al.Spatial analysis of Dengue fever in Guangdong Province,China,2001⁃2006[J].Asia Pac J Public Health,2014,26(1):58⁃66.doi:10.1177/10105395124 72356.Epub 2013 Jan 22.
[5] 张顺先,王英,闰磊,等.我国2005⁃2012年登革热流行特征分析[J].中国医药指南,2013,11(16):401⁃402.doi:10.3969/j.issn.1671⁃8194.2013.16.309.
[6] 张志珊,严延生,翁育伟.登革2型病毒E基因的表达及应用于血清学检测[J].中国人兽共患病学报,2012,28(5):421⁃424.doi:10.3969/j.issn.1002⁃2694.2012.05.003.
[7] 王金章.登革病毒2型外膜E蛋白基因DⅢ区的表达及其在血清学诊断方面的应用研究[D].福州:福建医科大学,2013:11⁃12.
[8] Sambrook J,Russell DW,著,黄培堂,等译.分子克隆实验指南(3版)[M].北京:科学出版社,2002:1228⁃1258.
[9] 张志珊.1⁃4型登革病毒外膜蛋白基因DⅢ区的表达及其在血清学诊断和免疫保护方面的应用研究[D].福州:福建医科大学,2007:12⁃13.
[10] AnandaRao R,Swaminathan S,Fernando S,et al.Recombinant multiepitope protein for early detection of Dengue infections[J]. Clin Vaccine Immunol,2006,13(1):59⁃67.doi:10.1128/CVI.13.1.59⁃67.2006.
[11] Van Der Schaar HM,Wilschut JC,Smit JM.Role of antibodies in controlling dengue virus infection[J].Immunobiology,2009,214(7):613⁃629.doi:10.1016/j.imbio.2008.11.008.
[12] Simmons M,Porter RR,Escamilla J.Evaluation of recombinant Dengue viral envelope B domain protein antigen for the detection of Dengue complex⁃specific antibodies[J].Am J Trop Med Hyp,1998,58(2):144⁃151.
[13] Gustafsson C,Govindarajan S,Minshull J.Codon bias and heterologous protein expression[J].Trends Biotechnol,2004,22(7):346⁃353.doi:10.1016/j.tibtech.2004.04.006.
Prokaryotic expression and serological diagnosis application of the domainⅢregion of Dengue virus type 2 envelope glycoprotein
Wang Jinzhang,Weng Yuwei,Yan Yansheng
Fujian Provincial Center for Disease Control and Prevention,Fuzhou 350001,China
Yan Yansheng,Email:yysh@fjcdc.com.cn
ObjectiveTo express the domainⅢof Dengue virus type 2 envelope glycoprotein in Escherichia coli.and establish an in⁃house diagnostic assay for IgM antibodies against dengue viruses.MethodsThe DNA fragment for domainⅢof the envelope glycoprotein was amplified bv RT⁃PCR and cloned into vector pET⁃30a(+),so as to construct the expression plasmid pET30a⁃D2E⁃DⅢ.The recombinant plasmid was transformed into Escherichia coli competent cells BL2l(DE3)and induced by IPTG.The expressed products were analyzed by SDS⁃PAGE and Western blot.Purified by electroelution,the recombinant protein was attempted to establish an indirect ELISA assay for IgM antibody against dengue viruses.in⁃house ELISA assay was assessed by conventional IFTA or Panbio Dengue IgM Capture ELISA.ResultsThe 264 bp in length DNA fragment for domainⅢwas amplified and the expression plasmid pET30a⁃D2E⁃DⅢwas successfully constructed and expressed in E.coli BL2l(DE3).The indirect ELISA assay obtained a sensitivity of 93.75%and a specificity of 91.25%by comparing with IFTA.Furthermore,the in⁃house ELISA assay was consistent with results by using Panbio Dengue IgM Capture ELISA(χ2=0.214,P>0.05,Kappa=0.825).ConclusionsThe expression plasmid pET30a⁃D2E⁃DⅢis stably expressed in E.coli BL2l(DE3)and the recombinant protein is suitalbe as a component antigen in serum diagnosis of dengue virus infection.
Dengue virus;DomainⅢ;Recombinant protein;Gene expression
严延生,Email:yysh@fjcdc.com.cn
10.3760/cma.j.issn.1003⁃9279.2016.06.000
登革病毒;DⅢ区;重组蛋白;基因表达
国家高技术研究发展计划(863计划)(2011AA02A114);国家科技重大专项(2012ZA10004⁃210);福建省医学创新课题(2015⁃CXB⁃13)
2016⁃07⁃07)
