人用狂犬病疫苗中糖蛋白抗原检测方法的建立及适用性研究
2016-02-05曹守春张全福王云鹏刘洋李阿茜李川孙丽娜梁米芳
曹守春 张全福 王云鹏 刘洋 李阿茜 李川 孙丽娜 梁米芳
北京,100050中国食品药品检定研究院(曹守春、王云鹏);北京102206,中国疾病预防控制中心病毒病预防控制所(张全福、刘洋、李川、李阿茜、孙丽娜、梁米芳)
·技术方法·
人用狂犬病疫苗中糖蛋白抗原检测方法的建立及适用性研究
曹守春 张全福 王云鹏 刘洋 李阿茜 李川 孙丽娜 梁米芳
北京,100050中国食品药品检定研究院(曹守春、王云鹏);北京102206,中国疾病预防控制中心病毒病预防控制所(张全福、刘洋、李川、李阿茜、孙丽娜、梁米芳)
曹守春、张全福同为第一作者
目的建立可快速检测人用狂犬病疫苗中糖蛋白抗原含量的方法并进行适用性验证。方法取2株抗狂犬病病毒糖蛋白的基因工程抗体,采用双抗体夹心ELISA技术,方阵滴定法确定包被单抗和酶标二抗的最佳工作浓度。对该方法进行特异性,灵敏度,重复性和适用性验证。结果包被抗体的使用浓度为200 ng/孔,HRP酶标二抗的最佳稀释比例为1:2000。验证结果显示该方法具有良好的特异性和灵敏性,变异系数<15%,对于不同疫苗生产毒株CTN株、aG株PM1503株和PV株均可有效检测。结论成功建立了适用于人用狂犬病疫苗糖蛋白ELISA检测方法,这对于人用狂犬病疫苗生产质控及效价测定方法替代奠定基础,具有重要意义。
狂犬病是由狂犬病病毒感染引起的一种人畜共患病,一旦发病,几乎100%死亡,人用狂犬病疫苗在狂犬病的预防控制中起着重要作用。狂犬病毒糖蛋白是主要保护性抗原,可以诱导机体产生中和抗体[1]。糖蛋白抗原含量高低基本上可以决定疫苗的效价的高低。因此在人用狂犬病疫苗的质量控制研究中,糖蛋白含量的检测对于疫苗生产和质量评价具有较强的指导意义。本研究利用抗狂犬病病毒糖蛋白的两株基因工程抗体建立了双抗体夹心ELISA方法,可用于人用狂犬病疫苗中的糖蛋白含量的快速检测,现报道如下。
1 材料与方法
1.1 实验材料抗狂犬病病毒糖蛋白的基因工程抗体(编号:RVAB09和RVAB22)。96孔板购自Costar公司,酶联免疫仪,HRP快速标记试剂盒(购自北京雁栖湾生物技术有限公司),人用狂犬病疫苗国际标准品(6th,07/162,购自英国NIBSC),人用狂犬病疫苗(国内不同生产企业疫苗产品各1批)、流感病毒裂解疫苗、出血热疫苗、甲型肝炎灭活疫苗和乙型脑炎疫苗均为国内疫苗生产公司赠送。其他化学试剂均为分析纯。
1.2 糖蛋白检测双抗体夹心ELISA方法的建立
1.2.1 微孔板包被:配置NaHCO3(pH9.0)包被液,将抗狂犬病病毒糖蛋白基因工程抗体RVAB09按一定浓度(50 ng/孔,100 ng/孔,50 ng/孔,200 ng/孔)加入,100 μl/孔,4℃过夜。
1.2.2 酶标二抗的制备:取抗狂犬病病毒糖蛋白基因工程抗体RVAB22,按HRP快速标记试剂盒说明书操作,最终获得酶标二抗溶液(1 mg/ml)。HRP标二抗工作浓度设1∶100,1∶200,1∶400;1∶800;1∶1000,1∶2000和1∶4000系列梯度。采用方阵滴定法确定包被单抗和酶标二抗的最佳工作浓度。
1.2.3 标准品曲线绘制:取人用狂犬病疫苗国际标准品,2倍稀释,最高稀释至2 048倍,2倍开始上板,100 μl/孔,37℃温育1 h,洗板3次,加入酶标二抗,37℃温育0.5 h,洗板6次后450 nm比色并记录A450 nm值。试验中标准品、阴性对照和空白组均设复孔。以糖蛋白抗原含量(IU/ml)和相应吸光度值作散点图,糖蛋白抗原含量为Y轴,吸光度值为X轴,用EXCEL软件进行二项式回归,得回归方程(Y=a∗X2+bX+C)。将待测样品的吸光度值代入回归方程即可计算出糖蛋白的含量。
1.3 糖蛋白检测双抗体夹心ELISA方法学验证
1.3.1 特异性验证:参考文献[2]取流感裂解疫苗等其他非狂犬人用疫苗原倍浓度上样检测,100 μl/孔,记录A450nm值,根据Cut⁃off值,对检测结果作出判定。为验证人用狂犬疫苗中辅料成分是否有非特异反应,取不同浓度人血白蛋白(10%),右旋糖苷(40%)等疫苗中常见的辅料进行检测。
1.3.2 重复性验证:组内重复性试验,取人用狂犬病疫苗国际标准品复溶64倍稀释后(糖蛋白含量为0.103 IU/ml),平行10份,进行ELISA检测,记录A450nm值。组间重复性试验,取上述64倍稀释的国家标准品100 μl进行ELISA检测,记录A450nm值,于不同工作日内各重复6次。
1.3.3 灵敏度验证:取人用狂犬病疫苗国际标准品进行2倍系列稀释,各取100 μl进行ELISA检测,设立阴性对照及空白孔。Cut⁃off值=(A450nm阴性对照⁃A450nm空白)×2.1。
1.3.4 适用性验证:取疫苗生产毒株分别为CTN,aG,PM1503和PV株的人用狂犬病疫苗各1批,系列倍比稀释后,各取100 μl进行双抗体夹心ELISA检测,记录A450 nm值。并根据标准曲线回归方程计算出待检样品中糖蛋白抗原含量。
2 结果
2.1 人用狂犬病疫苗中糖蛋白检测方法的建立
采用方阵滴定法最终确定包被抗狂犬病病毒糖蛋白基因工程抗体RVAB09的最佳浓度为200 ng/孔,HRP酶标二抗(标记前抗体浓度为1 mg/ml)的最佳工作浓度为1∶2 000倍稀释。采用第6批人用狂犬病疫苗国际标准品作为ELISA试验定量检测用标准品,该批国际标准品采用1 ml双蒸水复溶,则糖蛋白抗原含量为3.3 IU/ml。对该标准品进行2倍稀释检测后,取糖蛋白抗原含量和相应吸光度值做散点图(图1),可见典型的抛物线型,用EXCEL软件进行二项式回归,二项式方程为y=0.015x2+0.0767x+0.0042,R2=0.9984。
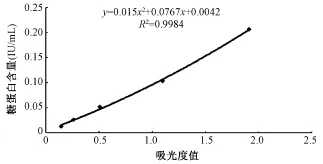
图1 糖蛋白抗原含量检测标准品检测回归曲线Fig.1 Standard regression curve of detection for glycoprotein antigen
2.2 糖蛋白检测双抗体夹心ELISA方法学验证
2.2.1 特异性:选用流感病毒裂解疫苗、出血热疫苗、甲型肝炎灭活疫苗和乙型脑炎疫苗原倍浓度下进行检测,检测结果均为阴性。为验证疫苗中辅料成分对实验的影响程度,对人血清白蛋白,右旋糖苷等疫苗中常见的辅料进行了检测,结果亦为阴性。其中人血清白蛋白浓度在1%浓度下时450 nm下的吸光度值平均仅为0.058(Cut⁃off值为0.1365)。以上结果显示该ELISA糖蛋白检测方法与非狂犬病疫苗及人血清白蛋白等疫苗辅料成分无交叉反应,特异性良好。
2.2.2 重复性:重复性验证分组内重复性和组间重复性两方面进行验证,64倍稀释的标准品(糖蛋白含量为0.103 IU/ml),平行10次检测,450 nm下的吸光度值分别为1.078、1.136、1.109、1.076、1.084、1.118、1.122、1.081、1.128和1.079,计算得组内变异系数为2.2%;同一样品在不同时间段平行6次检测,450 nm下的吸光度值分别为1.078、1.096、 1.116、1.057、0.921、1.277,组间变异系数为10.5%。综上,该ELISA方法具有较好一致性,精密度良好。
2.2.3 灵敏度:将人用狂犬病疫苗国际标准品(6.6 IU/ml)进行2倍系列稀释,可见在2048倍稀释后,对应糖蛋白含量仅为0.0016 IU/ml,ELISA检测450 nm吸光度值为0.028,远大于Cut⁃off值,结果为明显阳性(详见表1)。表明该ELISA检测方法的灵敏度能够用于对狂犬病病毒糖蛋白的抗原含量的测定检测,线性范围为0.002⁃0.1 IU/mL。

表1 灵敏度验证结果(Cut⁃off值:0.015)Tab.1 Validation of the sensitivity

表2 对不同狂犬病疫苗株的检测结果(Cut⁃off值:0.024)Tab.2 Results of different rabies vaccine strains
2.2.4 适用性验证:目前国内人用狂犬病疫苗企业所用毒株主要有CTN株,aG株和PV株。为了解ELISA方法对不同毒株人用狂犬病疫苗的检测效果,每毒株随机取1个批次进行检测,总计3批次人用狂犬病疫苗,所用疫苗均为上市产品。将疫苗进行20、40、80和160倍稀释后,进行检测。结果显示上述3种人用狂犬病疫苗的不同稀释度的吸光度值呈量效关系,选取吸光度值在1.0左右的稀释度进行计算(表2),虽然不同毒株疫苗的检测稀释倍数有一定的差异,但均可检测。
3 讨论
狂犬病是由狂犬病病毒感染引起的致死性疾病,疫苗是目前有效的重要预防手段之一,目前,人用狂犬病疫苗主要是由灭活狂犬病病毒组成[1,3]。狂犬病病毒抗原根据组分和功能不同,主要有核衣壳抗原和糖蛋白抗原。其中,糖蛋白抗原位于病毒的包膜和刺突上,是狂犬病病毒唯一能诱导宿主产生中和抗体的蛋白,此特性主要依赖于其三维结构的维持。糖蛋白也能有效地刺激T淋巴细胞的增生,是诱发细胞免疫和体液免疫的主要抗原物质,能引起抗感染免疫功能[1]。确保人用狂犬病疫苗的安全有效对于该疫苗质量控制致关重要,其中用于评价狂犬病疫苗效力的试验是美国国立卫生研究院(NIH)方法[4,5],但该方法实验周期长(28 d),操作复杂,不适用于疫苗纯化过程中的监测。近年来国内外已开展了一系列的体外试验,以寻求便捷可靠的替代方法。基于3R原则和国际动物保护协会对实验动物的制约,狂犬病疫苗效力的鉴定迫切需要改进并与国际接轨。因而建立快速、准确且不用动物的狂犬病疫苗效力检测方法势在必行[6]。
ELISA方法是一种快速、准确、廉价、简便的免疫学检测手段,国内外很多研究者[7⁃9]一直在探索体外检测糖蛋白抗原含量替代动物检测疫苗效力的方法。其所采用的包被抗体一般为鼠源单抗,酶标二抗为多抗,或者两者均为多抗,多克隆抗体测定中易受可溶糖蛋白的干扰,会过高估计疫苗的抗原性[10]。本研究采用2株抗狂犬病病毒糖蛋白的基因工程抗体进行配对,建立了可以快速检测人用狂犬病疫苗中糖蛋白含量的双抗体夹心ELISA方法。与之前文献报道的糖蛋白检测ELISA方向相比,而本研究中所用包被抗体和酶标二抗均为抗糖蛋白的基因工程抗体,重组基因工程抗体的活性相对稳定,而且制备方法相对简便。
本研究所建立的方法,经过方法学验证,具有良好的特异性和重复性,检测灵敏度可达0.0016 IU/ml,线性范围为0.002⁃0.1 IU/ml。通过检测国内不同毒株的上市疫苗产品,均有检测信号,疫苗的不同稀释度的吸光度值呈量效关系。因此本研究所建立的方法可用于CTN株,aG株,PM1503株和PV株所生产的人用狂犬病疫苗糖蛋白抗原含量的检测,可用于疫苗生产中的原液质量控制,指导半成品的配制。另外,本研究也发现单纯糖蛋白抗原含量与传统动物法的NIH效价之间对应关系不理想,但对于相同毒株,同一企业的疫苗产品则存在一定的量效关系(数据未展示)。
虽然ELISA检测糖蛋白抗原方法尚不能替代NIH法,但是对寻找替代人用狂犬病疫苗效价测定方法具有一定参考价值[11]。近年来国内外研究人员做了大量的研究工作,并取得可喜的成果[12]。本研究所建立的方法对于人用狂犬病疫苗生产质控及效价测定方法替代奠定基础,具有重要意义。
[1] 俞永新.狂犬病和狂犬病疫苗.2版.北京:中国医药科技出版社,2009.
[2] 曹守春,唐建蓉,胡巧玲,等.人用狂犬病疫苗ELISA快速鉴别试验的建立及验证[J].药物分析杂志,2011,31(9):1754⁃1757.
[3] Wang,Y,Guo SY.Research progress of rabies vaccine.Journal of Applied Virology,2012,1(1):10⁃18.doi:http://dx.doi. org/10.21092/jav.v1i1.9.
[4] 国家药典委员会.中华人民共和国药典[M].北京,中国医药科技出版社,2015.
[5] WorldHealthOrganization.WHOExpertConsultationon Rabies:second report[M].World Health Organization,2013.
[6] 刘金花,董关木.狂犬病疫苗有效抗原含量检测方法的研究进展[J].中国生物制品学杂志,2010,23(4):437⁃440. doi:http://dx.doi.org/10.13200/j.cjb.2010.04.107. liujh.020.
[7] 朱蓉,徐葛林,孙文,等.双抗体夹心ELISA与NIH法在狂犬病疫苗抗原检测中的比较.中国病毒学,2005,20(6):623⁃625.
[8] 曾鸣,王玉琳.ELISA法和NIH法检测狂犬病疫苗抗原量的比较研究[J].微生物学免疫学进展,1996,24(3):20⁃22.
[9] 苏文全,廖辉,商一行,等.双抗夹心ELISA法快速检测人用狂犬病疫苗的效价[J].药学服务与研究,2008,8(6):443⁃447.
[10] Perrin P,Morgeaux S,Sureau P.In vitro rabies vaccine potency appraisal by ELISA:advantages of the immunocapture method with a neutralizing anti⁃glycoprotein monoclonal antibody[J]. Biologicals,1990,18(4):321⁃330.doi:http://dx.doi.org/10.1016/1045⁃1056(90)90037⁃Z.
[11] 王玉琳,封多佳,吕宏亮,等.双抗体夹心ELISA法检测狂犬病疫苗抗原活性组分.微生物学免疫学进展,1999,27(3):31⁃33.
[12] Gibert R,Alberti M,Poirier B,et al.A relevant in vitro ELISA test in alternative to the in vivo NIH test for human rabies vaccine batch release[J].Vaccine,2013,31(50):6022⁃6029.doi:http://dx.doi.org/10.1016/j.vaccine.2013.10.019.
Validation of the rapid identification test on rabies vaccine by ELISA methods
Cao Shouchun,Zhang Quanfu,Wang Yunpeng,Liu Yang,Li Aqian,Li Chuan,Sun Linan,Liang Mifang
National Institute for the Food and Drug Control,Beijing,100050,China(Cao SC,Wang YP);National Institute for viral Disease Control and Prevention,Chinese Center for Disease Control and Prevention,Beijing 102206,China(Zhang QF,Liu Y,Li AQ,Li C,Sun LN,Liang MF)
Cao Shouchun and Zhang Quanfu contributed equally to this work
Liang Mifang,mifangl@vip.sina.com
ObjectiveTo establish a rapid detection method for the glycoprotein antigens of rabies vaccine.MethodUse two strains gene engineering antibody of anti⁃rabies virus glycoprotein to set up sandwich ELISA assay.Phalanx titration had been used to determine the best working concentration of the coated antibody and HRP labeled antibody.Then the specificity,sensitivity,repeatability and applicability were been validated.ResultsThe coated antibody concentration was 200 ng/well,and the best dilution ratio of HRP⁃antibody was 1:2000.The method has fine specificity and sensitivity.The coefficient of variation of is below 15%.Different vaccines producing by CTN,aG,PM1503 and PV strain can be effective detected.ConclusionGlycoprotein detection method by ELISA was successfully established,and is suitable for rabies vaccine.It is of great significance for quality control of rabies vaccine,and laying the groundwork for the alternative potency test.
Rabies vaccine;Human use;Glycoprotein detection;Validation
梁米芳,Email:mifangl@vip.sina.com
10.3760/cma.j.issn.1003⁃9279.2016.06.000
人用狂犬病疫苗;糖蛋白检测;验证
)
