运动区Beta节律的活动特点及功能意义*
2016-02-02郝俊懿
郝俊懿 廖 渝
(苏州大学教育学院, 苏州 215123)
1 引言
理解大脑工作的奥秘根植于揭示“脑—心理—行为”三者是如何关联的。在探索大脑运动皮层工作机制的研究领域, 研究者自上世纪中叶就发现人体的运动(行为)会引起大脑电信号特定频段(脑)的变化(Chatrian, Petersen, & Lazarte, 1959;Jasper & Penfield, 1949)。早期的研究发现, 当人处于非运动状态时, 大脑运动区的Mu节律(8~14 Hz)和Beta (15~30 Hz)节律能量较高, 反映了运动皮层神经元活动的同步化状态(Pfurtscheller, 1981);而当人处于运动状态时, Mu和Beta节律的能量会受到显著的抑制, 反映了运动皮层神经元的去同步化状态(Pfurtscheller, 1981)。随后的研究发现运动区的Mu与Beta能量不仅受到主动运动(Active Movement) (Leocani, Toro, Manganotti, Zhuang, &Hallett, 1997; Pfurtscheller & Aranibar, 1977)的调制, 并且这种能量的抑制在被动运动(Passive Movement) (Cassim et al., 2001), 甚至运动准备(Caetano, Jousmäki, & Hari, 2007), 想像运动(McFarland, Miner, Vaughan, & Wolpaw, 2000), 或是观察他人运动(Cochin, Barthelemy, Roux, & Martineau,1999; Cochin, Barthelemy, Lejeune, Roux, & Martineau,1998)等非运动的状态下都会出现。这些研究指出,运动区Mu与Beta节律与运动的表征有关系(Cheyne,2013), 并且与运动的模仿、推断他人的行为意图等复杂的社会认知过程密切相关(Cochin et al., 1999;Järveläinen, Schuermann, & Hari, 2004)。
上述这类研究中, Beta节律是与Mu节律一同作为反映与运动相关的大脑活动来看待的。由于Beta节律所在的频段处于Mu节律的谐波的范围中(Pfurtscheller & da Silva, 1999), 所以有学者认为Beta节律可能是Mu节律的谐波, 而非一个独立的成分(Jürgens, Rösler, Hennighausen, & Heil,1995)。但是另一些研究则指出运动区的Beta节律并不是单纯伴随 Mu节律存在的, 它有其独立于Mu节律的活动方式, 并且可能对应不同的心理过程(Tiihonen, Kajola, & Hari, 1989; Pfurtscheller,1981; Salmelin & Hari, 1994; Nagamine, Kajola,Salmelin, Shibasaki, & Hari, 1996)。这些研究重点关注Beta节律对应的运动状态的变化特点, 发现了Beta节律与Mu节律具有不同的活动特点, 这些不同主要集中在运动的开始之前和运动结束之后, 例如在运动停止后, Mu节律的能量会回复到运动前的基线水平, 而Beta节律的能量则会上升至高于运动前的基线水平并持续一段时间(Pfurtscheller,1981; Salmelin & Hari, 1994; Nagamine et al., 1996;Cheyne, 2013)。此外, Beta节律与Mu节律可能反映的心理意义也不同。大量研究揭示 Mu节律和人的社会功能关系紧密。Mu节律主要与镜像神经元系统有关(Perry & Bentin, 2009), 部分中央Mu节律(13~20 Hz)还与交感神经的活动有关(Triggiani et al., 2015)。在自闭症的研究中, Mu节律常被作为检验镜像神经元系统功能的指标(Oberman et al.,2005; Bernier, Dawson, Webb, & Murias, 2007)。而Beta成分更多的与动作本身的特点有关, 如运动速度的变化(Avanzini et al., 2012), 或动作抑制(Picazio, Ponzo, & Koch, 2015)。
由上文的概述可以看出, 目前的研究在运动区脑电活动与运动行为之间的关联方面已经有许多现象描述的积累, 对这些现象的重复观测也在推动相应理论的提出和发展, 本文基于现有的成人以及儿童的相关研究, 重点梳理这些“脑—行为”连接相关联的“心理”过程。主要包括:1)运动区Beta节律相对于Mu节律的共同性和特异性; 2)Mu节律与Beta节律共同作为运动的脑机制所反映的心理过程; 3) Beta节律独立作为运动的脑机制所反映的心理过程。在此基础上, 本文将展望该领域的未来研究。
2 运动区Beta节律与Mu节律的共性及Beta节律的特异性
2.1 运动区Beta节律及Mu节律共同的活动特征
很多研究将运动区的Beta节律与Mu节律同时作为与运动相关的脑电成分来研究, 它们被共同看作大脑中央区域的空闲(idling)节律(Pfurtscheller,Stancak, & Neuper, 1996), 其中Mu节律被称为中央Mu节律的10 Hz成分, Beta节律被称为中央Mu节律的 20 Hz成分(Hari, 2006), 为叙述方便, 后文将在提及的研究中, 把运动区 Beta节律和 Mu节律看作一个联合的指标时, 将其统一称为运动区Mu-Beta成分。对于成人的研究比较一致地发现, 相比于没有运动时, 被试在执行动作之前、执行动作的过程中、想象动作或感知他人动作时,中央顶区Mu-Beta节律均会被显著抑制(Cochin et al.,1999, 1998; McFarland et al., 2000; Caetano et al.,2007)。运动区Mu-Beta节律的这一活动特征使得研究者们认为它们是人在静止状态下的空闲节律(Pfurtscheller et al., 1996)。与此同时, 对婴儿和儿童的研究验证了年龄低至9个月的婴儿也表现出类似成人的大脑活动, 即其 Mu节律在执行运动时和观察他人运动时均会相对于静止状态产生明显的能量下降(Southgate, Johnson, Osborne, & Csibra,2009; Reid, Striano, & Iacoboni, 2011; Marshall &Meltzoff, 2014; Liao, Acar, Makeig, & Deak, 2015)。然而, 大部分婴儿与儿童的研究并没有对 20 Hz成分, 即Beta节律进行报告。Liao等人在其研究中让4岁左右的孩子和其母亲在触摸屏上共同完成了一个轮流操作的屏幕游戏, 并对儿童在观察和执行动作时的 EEG (Electroencephalogram, 脑电图)做了全频段(1~35 Hz)的分析, 结果发现4岁左右的儿童与成人一样, 在观察他人运动时, Mu和Beta节律都有明显的能量降低(Liao et al., 2015)。目前, 从以Beta节律为主要研究对象的儿童研究来看, 对Beta节律最早记录到的年龄也在4岁左右(Cheyne, Jobst, Tesan, Crain, & Johnson, 2014)。
如前所述, 运动区的Beta节律与Mu节律常被同时观测到且活动特征有颇多相似, 这表明它们可能是一个联合的脑电成分。支持这一观点的另一个原因在于, 从信号形成的角度来说, 当使用经典的傅立叶变换来构建非正弦波形时, 必须用基础波及其倍频来共同实现建构, 而运动区的Mu节律恰好是一个非正弦波, 因此有研究认为处于其倍频范围的运动区Beta节律有可能是运动区 Mu节律的组成部分, 而并非一个独立的成分(Jürgens et al., 1995)。但是, 越来越多的研究从多个方面提出证据说明, Beta节律更有可能是一个独立于Mu节律的成分, 并具有独立的功能意义。
2.2 运动区Beta节律与Mu节律的不同活动特征
首先, 从 EEG能量随时程的变化来看, 运动区Beta和Mu节律能量的上升与下降并不是同步变化的(Tiihonen et al., 1989; Pfurtscheller, 1981;Salmelin & Hari, 1994; Nagamine et al., 1996)。具体来说, Beta和Mu均会在被试准备做动作而实际没有做时就开始出现能量的抑制(Swann et al., 2009),但是 Mu节律的抑制出现更早(Hari, 2006), 这一抑制在两个频段上都会一直持续到运动停止。当运动停止后, 尽管Beta和Mu均会出现能量的回复, 但此时 Mu节律的能量仅仅回复到运动前的基线水平, 而Beta节律不仅在时间上更早开始能量的回复, 而且在强度上其能量会上升至高于运动前的基线水平, 这一现象被称为运动后Beta回复增强(post-movement Beta rebound, PMBR)。PMBR现象被很多研究稳定地观察到, 同步记录肌电与脑电活动的研究发现, PMBR出现于肌电活动终止(运动停止)后的 300~400 ms, 并且持续时间超过500 ms (Pfurtscheller, 1981; Salmelin & Hari,1994; Nagamine et al., 1996; Cheyne, 2013)。相似的情况也会在被动刺激之后出现, 例如电刺激被试位于手部的正中神经之后(Salmelin & Hari,1994)或给予被试触觉输入(如使用刷子刷手指)之后(Cheyne et al., 2003; Gaetz & Cheyne, 2006)。
其次, 源定位的研究也表明运动区Beta与Mu节律并非同源, Beta、Mu节律在EEG分析中一般分析 C3、Cz、C4 点。Hari, Salmelin, Mäkelä, Salenius和Helle (1997)使用MEG (Magnetoencephalogram,脑磁图)的偶极子源定位来考察运动区Mu节律与Beta节律, 发现 Mu节律的源位于初级体感区的中央沟后壁, 而Beta节律的源位于初级运动区的中央沟前壁。McFarland等人(2000)使用拉普拉斯算法(Hjorth, 1975)考察了想象运动, 发现 Mu节律与Beta节律也有不同的头皮拓扑图, Beta节律的抑制分散在颅顶(Cz)周围, 而 Mu节律的抑制在中央后回的两侧(CP3和CP4)。相比在运动过程中所产生的Beta节律抑制的源, 运动后Beta节律的回复增强(PMBR)的源则具有躯体特异性, Salmelin,Hámáaláinen, Kajola和Hari (1995)使用MEG发现,嘴动后产生的PMBR会出现在沿着中央沟较外的两侧, 手指运动后产生的PMBR会比嘴动后产生的PMBR更靠近颅顶一些的手区, 脚动后产生的PMBR则会出现在颅顶附近, 而这些动作对应的Mu节律变化始终出现在运动皮层手区附近。类似的, Jurkiewicz, Gaetz, Bostan和Cheyne (2006)使用合成孔径磁场定位法(synthetic aperture magnetometry,SAM)考察被试手指运动, 发现Beta与Mu节律的抑制发生在中央后回手区两侧, 而PMBR则发生在中央前回手区两侧。总的来说, 从已有的研究结果看来, PMBR和运动过程中的Beta节律的抑制并不是同源的(Gaetz, Edgar, Wang, & Roberts,2011), 但研究所报告PMBR的源定位结果并不一致,初级运动皮层和运动辅助区都有发现(Brovelli,Battaglini, Naranjo, & Budai, 2002; Jurkiewicz et al.,2006; Koelewijn, van Schie, Bekkering, Oostenveld,& Jensen, 2008; Neuper & Pfurtscheller, 1996; Salmelin et al., 1995; Stančák, Feige, Lücking, & Kristeva-Feige, 2000)。与此同时, 皮层脑电(electrocorticographic,ECoG)的研究比较一致地认为PMBR并不源于某个单独的特定区域, 而是分散于整个前运动皮层和感觉运动皮层中(Crone et al., 1998; Ohara et al.,2000; Pfurtscheller, Graimann, Huggins, Levine, &Schuh, 2003; Sochůrková, Rektor, Jurák, & Stančák,2006; Szurhaj et al., 2003)。
再次, 从脑认知功能发展的角度来看, 运动区的Beta节律和Mu节律随年龄变化的趋势也并不一致。一些对于婴儿运动的研究指出, 9到14个月的婴儿在运动时运动区 Mu节律被抑制的现象已经很容易被检测到(Southgate et al., 2009; Marshall,Young, & Meltzoff, 2011; Saby, Marshall, & Meltzoff,2012; Warreyn et al., 2013)。然而现有研究对儿童运动时运动区Beta节律变化的最早记录年龄是4岁左右(Gaetz, MacDonald, Cheyne, & Snead, 2010;Cheyne et al., 2014; Liao et al., 2015)。另外, Gaetz等人(2010)使用MEG比较了儿童(5.5 ± 0.6岁)、青少年(12.5 ± 0.6 岁)与成人(31.5 ± 6.15 岁)在运动时感觉运动区的Beta节律振荡的变化, 结果发现儿童与青少年组均有运动时Beta节律的抑制和运动后的PMBR, 而儿童组的PMBR要显著低于成人组, 表明 PMBR会随着儿童年龄的增长而增强。Wilson等人(2010)使用MEG在8至15岁儿童身上发现了与成人相似的运动前Beta节律抑制与运动后的 PMBR, 同时在运动之前和运动之中辅助运动区的 Beta和 Gamma节律也被激活, 并且在运动前与运动后的小脑皮质也发现了Beta节律的激活。Cheyne等人(2014)使用MEG发现3.2至 4.8岁的儿童在运动时不仅在感觉运动皮质有Mu节律与 Beta节律的变化, 而且右颞上回也被激活, 这一现象在成人研究中尚未被发现。在中老年被试的研究中发现, 休息时运动手对侧 M1区的 Mu、Beta基线与年龄呈正相关。此外没有其他 Mu节律的特性与年龄有相关, 而运动时运动手同侧M1区Beta振幅的降低还与年龄呈正相关(Rossiter, Davis, Clark, Boudrias, & Ward, 2014)。总的来说, 尽管目前对运动区Beta节律和Mu节律发展轨迹的研究还相当匮乏, 但是我们不难看出, 两者之间并没有随年龄变化的同步发展, 其中 Mu节律受运动的调制在婴儿期就已出现, 这表明它可能是一种天生的脑机制; 而Beta节律的出现可能相对较晚, 且运动后的PMBR随年龄的增加有所增强, 这表明它更可能反映了后天习得的心理过程和脑机制。
除此以外, 支持运动区Beta节律和Mu节律并不是联合的成分的证据还有至少以下两个方面。第一, 运动区Beta节律与肌肉活动的类型直接相关。这种皮质–肌肉相关性(cortex-Muscle coherence,CMC)的特点体现在, 当同时记录被试第一骨间背侧肌(1DI)等长收缩时的肌电信号(EMG)和大脑运动区的MEG信号时, 相对于放松状态, 肌肉收缩时EMG信号中20 Hz左右的成分会出现能量升高, 而同时肌肉对侧大脑运动区 MEG信号中 20 Hz左右的成分(Beta节律所在的频段)会出现能量降低(Conway et al., 1995)。与此同时, 皮质信号还会先于肌电信号, 这种延迟在肱二头肌最短, 并随着皮质到肌肉的距离增长而延长, 这与从皮质到肌肉的传导时间一致(Salenius, Portin, Kajola,Salmelin, & Hari, 1997)。此外, Feige, Aertsen 和Kristeva-Feige (2000)还发现PMBR成分也与Beta频段的肌电信号具有相关性。第二, 运动区 Beta节律特异性地受抑制性神经递质 GABA (γ-氨基丁酸)的调节(Jensen et al., 2005)。Hall, Barnes, Furlong,Seri和 Hillebrand (2010)以及 Hall等人(2011)给被试使用5 mg地西泮(促进GABA释放)后导致运动皮质Beta节律显著增强, 并持续30至40分钟。Gaetz等人(2011)也发现初级运动区GABA浓度与PMBR能量呈显著正相关。
综上所述, 运动区所能记录的 Beta节律与Mu节律尽管与人体运动状态的关联有相似之处,但二者更可能反应了不同的心理过程。其中伴随运动前和运动过程中的 Beta节律与运动后的PMBR所反应的心理过程也有不同。本文将在下文中对这几个不同的过程及目前所提出的理论解释进行更进一步梳理。
3 运动区Beta节律与Mu节律反映了镜像神经元的活动
在对猴子大脑的研究中, 有学者发现猴子腹前运动皮质中的F5区存在“镜像神经元”, 当猴子进行手部的有目的的运动和观察其他猴子或人类进行类似的运动时, “镜像神经元”均会放电。自此“镜像神经元”被认为能够直接联系观察动作与执行动作两者(Gallese, Fadiga, Fogassi, & Rizzolatti,1996; Rizzolatti, Fadiga, Gallese, & Fogassi, 1996)。
一些fMRI (Functional Magnetic Resonance Imaging, 功能性磁共振成像)研究表明, 人类大脑也存在相似的镜像系统(Buccino, Vogt et al., 2004;Grèzes, Armony, Rowe, & Passingham, 2003; Iacoboni et al., 1999)。Iacoboni等人(1999)发现被试在执行手指运动与观察手指运动时, 人脑 Brodmann44区和顶上小叶(superior parietal lobule)的血氧水平依赖(BOLD)均会增加。后又发现被试在观察动作和模仿动作时, 颞上沟(superior temporal sulcus,STS)均会被激活(Iacoboni et al., 2001)。Buccino,Binkofski和 Riggio (2004)使用 fMRI技术发现, 被试在观察手部、嘴部和脚部运动时, 布洛卡区和前运动皮质的不同部分被激活。以上研究表明镜像神经元可能存在于更广的神经网络中(Fagg &Arbib, 1998; Oztop & Arbib, 2002)。Fadiga等人(1998)使用TMS (Transcranial Magnetic Stimulation, 经颅磁刺激)技术也发现当被试观察他人动作时, 运动诱发电位(MEPs)对TMS的反应增加, 并认为是由于镜像神经元活动造成的。这些研究表明, 人类的大脑也可能存在镜像神经元系统(Mirror-Neuron System, MNS), 这使人们可以在没有做出实际动作时, 通过脑内的动作表征来模拟观察到的动作, 从而成为模仿、理解他人动作的神经基础(Rizzolatti & Craighero, 2004), 并且镜像神经元可能对于理解他人的动作意图非常重要, 这使得人类有足够的信息调整自己之后的动作从而对他人的动作进行反应(Rizzolatti & Sinigaglia, 2010;Sinigaglia & Rizzolatti, 2011)。因此有研究认为镜像神经元系统也与心理理论、共情能力有关(Meltzoff & Decety, 2003)。
3.1 Mu-Beta节律反映了运动皮质存在“观察-执行”匹配系统
不少对成人的研究显示, 运动皮质对运动的加工存在“观察-执行”匹配系统, 而 Mu-Beta节律的活动特征显示了该系统存在的可能性。早先Gastaut和 Bert(1954)通过考察被试观看拳击比赛的过程, 发现当被试将自己感同身受地代入屏幕中的任何动作时, 运动区Mu节律就会受到抑制。后来的研究发现不论被试在执行动作还是感知人类动作时, 中央顶区 Mu-Beta节律均会显著地减弱(Caetano et al., 2007; Cochin et al., 1999, 1998; Liao et al., 2015)。在想象运动时, Mu-Beta节律的能量也会减弱(McFarland et al., 2000)。由此可见, 人在观察他人动作和自己做相同动作时, 其大脑活动的方式类似, 都表现出 Mu-Beta节律被抑制的特点。这一方式与MNS系统活动的方式也相似, 因此, Mu-Beta节律的抑制也被看作反映了人脑镜像神经元的活动(Hari, 2006)。
需要注意的是, 并不是所有的研究都同时检验了Mu节律和Beta节律, 但是成人研究中, 报告了Beta节律在执行、观察运动过程中表现的研究,都较为一致地报告了Beta节律在这些过程中能量是被抑制的。
儿童研究从发展的角度也讨论这个问题, 主要回答“观察-执行”匹配系统这一机制是否是婴儿早期就拥有的一个功能, 换句话说, 它更可能是一个先天的机制还是后天习得的机制?这类研究比较一致地发现, 低至 9个月大的婴儿在运动中、观察他人运动时, 其Mu节律均会相对于静止状态出现明显的能量下降(Southgate et al., 2009; Reid et al., 2011; Marshall & Meltzoff, 2014; Liao et al.,2015), 这表明“观察-执行”匹配系统更有可能是先天的机制(Marshall & Meltzoff, 2014)。但是, 可能是因为 Beta节律在生命初期的信号并不明显(Gaetz et al., 2010), 大部分婴儿和儿童的研究并没有检验 Beta节律在其中的变化。但 Liao等人(2015)使用EEG发现4岁左右的儿童在观察他人运动时, 观测到了与成人相似的Mu和Beta节律能量明显降低的情况。
总的来说, 运动区 Mu-Beta节律这一与镜像神经元系统相似的特性使得两者联系起来, 学者们猜想Mu-Beta节律的衰减可能是镜像神经元系统工作的指标, 它可能反映了人类在理解他人动作时镜像神经元系统的参与(Cochin et al., 1999,1998; Muthukumaraswamy, Johnson, & McNair,2004; Muthukumaraswamy & Johnson, 2004)。
3.2 PMBR也具有镜像神经元系统工作的特征
Beta节律在运动后的回复增强(PMBR)也表现出类似镜像神经元活动的特征。即当人们观察理解他人的动作时, 所产生的PMBR也同运动区Mu节律一样表现出能量的减弱。Hari等人(1998)用0.2 ms恒流脉冲以1.5 s的间隔刺激被试手腕的正中神经, 考察了不同条件下肌肉被动刺激结束后的 PMBR。结果发现, 基线条件下(仅接受脉冲刺激), PMBR在刺激结束后能量最高, 而运动执行条件下(接受脉冲刺激的同时做手部动作),PMBR会减弱甚至消失。有趣的是在观察运动条件下(接受脉冲刺激的同时观察他人手部动作),刺激结束后PMBR也有明显的减弱。观察他人运动时和执行运动时均出现的PMBR能量减弱表明被试的初级运动皮质在两个条件下有相似的活动特点。这与运动区 Mu节律在执行、观察运动时的抑制特点类似, Hari认为PMBR也反映了运动皮质镜像神经元的活动。
另有研究表明, 被试观察现场进行的动作所产生的 PMBR比观察视频中的动作所产生的PMBR要强15%~20%, 这说明PMBR的程度可能与被试感同身受的程度有关(Järveläinen, Schürmann,Avikainen, & Hari, 2001)。Järveläinen 等人(2004)发现, 被试观察目标导向的移动筷子动作时产生的PMBR比观察非目标导向的移动筷子动作时产生的PMBR要弱15%~17%。这种差异与被试去年的筷子使用频率呈正相关, 这表明运动皮质的激活可能与观察者自身的动作技能有关, 运动皮质Beta节律的变化可能与动作的理解和模仿有关。Koelewijn等人(2008)还发现PMBR的激活程度与动作理解中动作的正确与否有关。以上研究均为观察他人动作时PMBR产生的变化, 为PMBR现象与镜像神经元系统的联系提供了支持的证据。
综上所述, 有学者认为PMBR与Mu节律衰减一样可能是镜像神经元系统工作的指标(Hari et al.,1998; Järveläinen et al., 2001)。
4 Beta节律特殊的功能意义
如前文所述, 尽管运动区Beta节律与Mu节律通常同时被观察到, 但是Beta相对于Mu节律至少在以下两个方面具有不同的活动特征, 其一是运动前由运动线索所引起的 Beta节律的变化,其二是在运动后的 PMBR。下文中我们将分别介绍这两个运动相关 Beta节律的功能意义的理论观点。
4.1 PMBR所反映的心理过程
空闲状态(Idling)假说Idling假说认为PMBR反映了相应脑区从处理运动信息的工作状态转换至空闲(idling)的无工作状态(Pfurtscheller et al., 1996)。研究表明, 当大脑皮质数以百万计的神经元(约占1 cm²大脑皮层组织)活动节律同步时,相应区域的EEG能量会升高, 而当这些神经元活动节律转为不同步时, EEG能量便会降低。在大脑皮层的某些区域, 皮质节律的去同步化表明该皮层组织处于工作状态(例如睁眼时枕叶Alpha节律去同步化), 而同步化则表明该皮质组织没有工作(non-working) (Klimesch, 1999)。运动皮质在运动/非运动状态的能量变化也反映出运动皮质神经元在工作时趋于去同步化、没有工作时趋于同步化的特点。基于此, 运动后Beta节律的回复增强被认为和运动后 Mu节律相对于运动中的能量有明显上升一样, 都是运动区神经元由运动时的激活状态向运动停止后的休息状态转化的标志。支持这一观点的实验证据有, 当利用 TMS的技术手段, 通过刺激被试头皮的运动区引发拇短展肌(abductor pollicis brevis, APB)的运动诱发电位(motor- evoked potentials, MEPs), 并以MEP振幅为因变量来考察运动皮质兴奋性时, 其结果表明,Beta回复增强与运动皮质神经元兴奋性降低的时间进程一致(Chen, Yaseen, Cohen, & Hallett, 1998),即Beta节律升高的同时运动区神经元的兴奋性会降低。
在快速手指运动后与慢速手指运动后产生的PMBR有相似的振幅和地形图, 其均源自运动区。Pfurtscheller等人认为 PMBR可以被解释为与一种主动抑制的神经结构有关, 或与运动后初级运动区的空闲(Idling)状态有关(Pfurtscheller, Stancák,& Edlinger, 1997)。因此 Cassim 等人(2001)认为Pfurtscheller更倾向于将PMBR看作是MI区信号传出的终止, 而非运动感受器信号再传入的终止。
体感信号传入的终止假说Cassim等人(2001)质疑PMBR反映了运动皮质神经元在自发动作的启动与执行之后恢复空闲(idling)状态的观点, 认为不能仅将其解释为自上而下的运动指令停止,还需考虑自下而上的体感信息处理, 因为他们在被动手指运动中也观察到了PMBR。Cassim等人进一步解释, 被动运动中Beta节律的回复增强是由本体觉或指尖皮肤感受器输入的体感信号停止而产生的, 这反映了主动运动或被动运动后自下而上感觉反馈信号传入的终止。
Cassim等人的这一观点与运动区神经元具有感受器功能的研究结果一致。在非人灵长类中,超过75%的运动神经元对被动运动有响应(Lemon,Hanby, & Porter, 1976)。具体来说, Jones于1983年指出体感信号可能通过躯体感觉区与运动区的皮质–皮质联结传输至运动神经元(引自Cassim et al.,2001)或通过丘脑(Lemon, 1981)直接传输至运动神经元。在人类被试中, 运动区的感受器功能也被通过多种技术检测到。例如:通过测量局部脑血流量(rCBF)发现, 被试主动或被动地做右肘的屈伸运动时, 对侧感觉运动区的 rCBF均会显著增加(Weiller et al., 1996)。使用fMRI技术发现, 在被试被动地接受手腕运动时, 对侧初级感觉运动区、前运动区和辅助运动区均显著被激活(Alary et al.,1998)。手指被动运动时, 在运动区可以记录到皮层电位(Lee, Lüders, Lesser, Dinner, & Morris, 1986)。使用 MEG技术也发现, 手指被动运动所诱发的磁场的一些成分可以在 Brodmann 4区被记录到(Xiang et al., 1997)。
Cassim等人的研究指出, 部分Beta成分可能是感觉运动信号传导的中介, 他们使用气囊包裹被试手臂并充气来阻断感觉传入, 以此诱发缺血性神经阻滞所导致的功能性传入神经阻滞, 并同时刺激被试的食指正中神经, 以观察刺激结束后的PMBR变化。结果表明, 此时感觉运动信号的传输被阻滞, 使得PMBR消失(Cassim et al., 2001)。随后, Gaetz和Cheyne (2006)发现手部在接受体感触觉刺激后亦会出现PMBR, 这一结果与 Cassim等人的假设一致, 表明PMBR可能是一种关闭响应(OFF-response), 即PMBR可能是本体觉或体感信号传入停止时的生理指标。
动作系统重置假说Kilavik, Zaepffel, Brovelli,MacKay和Riehle (2013)在其对Beta节律的综述中提出, PMBR也可能是动作系统的重新校准或重置, 以此为面对新的情况做出准备。Kilavik等人质疑Gaetz和Cheyne (2006)认为触觉刺激后PMBR仅仅反映关闭响应(OFF-response)的观点, 认为PMBR可能具有更复杂的功能。其直接的反驳理由是, 有研究发现对手指触觉刺激的关闭响应在体感区的潜伏期不会超过140 ms, 远早于PMBR在运动结束后约 300~500 ms的始发时间(Onishi et al., 2010)。Kilavik等人进一步解释, 在 Gaetz和Cheyne (2006)的实验中, 触觉刺激之后的Beta回复上升反映了之后手部运动的准备过程。但是这一观点目前尚未有任何直接的实验证据。
尽管上述 3个假说各有其证据, 但还没有一个假说占据优势。然而, 大部分研究往往仅关注了成人的数据, 如果我们从已有的儿童发展的数据来看, 其结果并不支持上文提到的前两个假说,即空闲状态假说和体感信号传入终止假说。因为从发展的阶段的角度来看, 无论是大脑的空闲状态还是对体感信号终止的标记, 都更可能是儿童早期就已经具有的一种生理机能, 然而研究表明,PMBR在学龄期儿童的相应活动中仍很不明显,其强度会随着儿童年龄的增长而增强, 且 11~13岁的青少年 PMBR仍低于成人水平(Gaetz et al.,2010), 国内近期的研究数据也与此一致(郝俊懿,张晓芸, 潘婷, 廖渝, 2015)。这一结果并不支持PMBR对应空闲或者是体感信号终止这类从生命开始就被频繁使用的功能。当然 Gaetz等(2010)认为这一结果是由于青少年动作抑制能力较弱造成的。但是支持体感信号传入终止假说的证据,即被动运动(Cassim, 2001)和触觉输入(Gaetz &Cheyne, 2006)停止后均有PMBR出现的结果并不支持 PMBR对应动作中自上而下的主动抑制过程。由此可见, PMBR所标记的心理过程更可能是后天习得的更为复杂的心理过程和脑机制, 而并非空闲和体感信号输入的终止这样最基本的生理机能。相对而言, 上述3个假说中, 动作系统的重置假说与儿童发展的研究结果并不违背。人类的成长发育是一个从简单到复杂的过程, 人类的动作技能也从婴儿早期的相对较为随机、无序、无目的的行为逐渐变得有计划、有目的、高效率, 这样的变化必定伴随着更发达的脑机制去提高上一个动作与下一个动作之间的连接效率, 而 PMBR出现的时间和其随年龄的变化特征使得其很有可能发挥着这个作用。
另外, 从EEG信号传播的角度来说, Alpha、Theta这样大振幅、低频率的节律更适合远距离的信号传播, 从而组织各个脑区神经网络的激活。而Beta节律的频率较高(15~25 Hz), 可能更适合近距离的信号传播(Buzsáki, 2010; Uhlhaas, Roux,Rodriguez, Rotarska-Jagiela, & Singer, 2010)。如果要为之后的动作做准备, 其涉及的脑区应该更多集中于运动皮层范围内, 这种较近距离的组织符合Beta节律这一频率的特性。
但是, 已有的研究中也存在不完全支持动作重置假说的结果, 在Gaetz和Cheyne (2006)的实验中, 被试在接受触觉刺激后并没有做手部运动。并且为了防止预期对实验的影响, 在记录MEG的过程中被试都被要求盯着屏幕中央的注视点, 被试右侧有视觉障碍物以防止被试看见主试的活动和接受触觉刺激的过程, 且刺激均为随机呈现。此外, PMBR与刺激消失时刻而非呈现时刻的高度锁定, 表明被试对刺激的期望对 PMBR并无影响。Gaetz和Cheyne (2006)的研究中PMBR定位在中央前回两侧的手区, 而Onishi等人(2010)的研究则定位在中央后回, 因此动作系统重置理论仍存在争议。
4.2 线索诱发的运动区 Beta节律反映了动作准备的心理状态
研究指出, Beta节律的抑制开始于被试准备做动作而尚未执行时(Cheyne, 2013)。在Go/No-Go任务中, 猕猴(Zhang, Chen, Bressler, & Ding, 2008)、癫痫病人(Swann et al., 2009)在No-Go条件下成功停止动作时, 运动区的Beta节律也会如同执行动作时一样发生抑制现象。类似的, 在使用MEG考察的健康人类被试中, 也发现了执行动作前 Beta节律、Mu节律就已经出现抑制的现象(Caetano et al.,2007)。这些研究显示, Beta节律的抑制可能与运动准备有关。
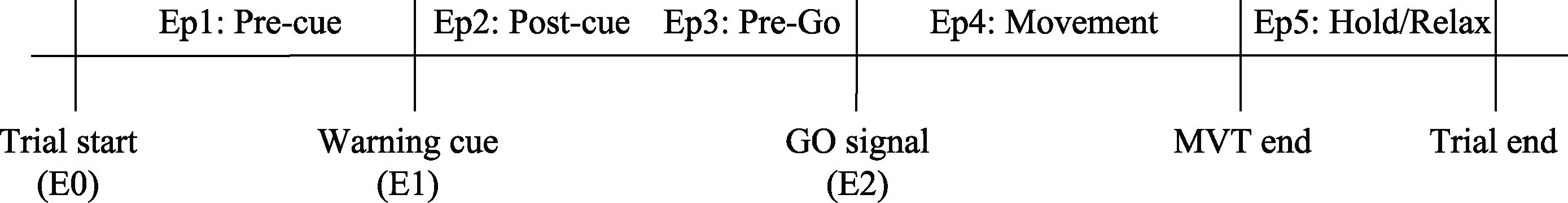
图1 延迟任务(Kilavik et al., 2013)
Beta节律的抑制由线索诱发并调制。针对运动前 Beta节律的变化, 不少研究使用延迟任务(delay tasks)来研究(参见图1)。延迟任务是指在有动作参与的反应任务中, 在运动信号(Go signal)E2之前给被试一个提示线索(Warning Cue)E1, 以告知被试 E2信号即将到来。Beta节律抑制的现象在E1呈现之后的300~500 ms便会出现, 且在对侧感觉运动区的抑制更强(Alegre et al., 2003; Doyle,Yarrow, & Brown, 2005; Tzagarakis, Ince, Leuthold,& Pellizzer, 2010)。Mu节律在E1呈现后也会受到抑制, 但由于Beta节律的抑制具有躯体特异性的特点, 并且 Beta节律对皮质激活的反应快于 Mu节律, 这表明Beta节律与运动准备的关系更清晰,因此大多数运动准备的研究只考察Beta节律(Kaiser,Birbaumer, & Lutzenberger, 2001)。运动前Beta节律的抑制会受提示线索(Warning Cue)内容的影响。EEG研究发现, 相对于不包含预测运动信息的线索(例如:50%有效的运动提示), 包含预测动作信息的线索(例如:100%有效的运动提示)会诱发感觉运动区 Beta节律更强的抑制(van Wijk,Daffertshofer, Roach, & Praamstra, 2009)。类似的,MEG研究发现, 当线索更有效时, 即提示线索所表明的运动方向信息确定性越高时, Beta节律受到的抑制越大, 并且反之亦然(Tzagarakis et al., 2010)。这一结果与另一组EEG研究结果一致, 即当运动信号(Go signal)E2很难预测时, E2出现前的Beta节律能量降低会变得很少或几乎没有(Alegre et al.,2003, 2006)。以上研究表明, 对于运动的准备越充分, 在提示线索出现时Beta节律受到的抑制越强,这说明 Beta节律的抑制可能是运动准备的指标(Cheyne, 2013)。
执行动作前, 运动区 Beta节律也会受到抑制。研究表明, 运动前的Beta节律振幅对运动的类型不敏感。在EEG研究中, 快速食指运动与慢速食指运动(Stančák & Pfurtscheller, 1995, 1996)、简单与持续手腕运动(Cassim et al., 2000)之间, 运动前Beta节律振幅没有显著差异。但是, 当在做快速自发食指伸展时, 若同时在食指上施加外力负重, 运动前 Beta节律抑制则会增加(Stančák,Riml, & Pfurtscheller, 1997)。在速度—正确率权衡中, 强调速度而非正确率时, 运动前 Beta节律的抑 制 也 会 增 强 (Pastötter, Berchtold, & Bäuml,2012)。以上两个研究中运动准备的状态都被改变,而Beta节律只在运动前有差异, 而运动时则无差异, 这表明Beta节律的抑制可能反映了运动准备的过程。
上述结果均支持Beta节律的抑制可能反映了运动准备相关的感觉运动区激活程度的增加(Kilner, Bott, & Posada, 2005; Wheaton, Carpenter,Mizelle, & Forrester, 2008)的观点。然而, 运动准备是一个复杂的操作, 包含了许多不同时程的心理过程, 比如刺激识别、反应选择、动作计划等(Kilavik et al., 2013)。在已知将要运动的手具体是哪一只的情况下, 对侧脑区Beta节律的抑制更大,这表明Beta节律的抑制与反应选择有关(Doyle et al.,2005)。而动作计划对 Beta节律的影响还存在争议。因为在方向不确定的情况下依然会产生Beta节律的抑制。而这时是无法做出有效的动作计划的(Tzagarakis et al., 2010)。运动前Beta节律的抑制与运动执行时Beta节律的抑制之间的差异目前尚不明确, Kilavik等人认为这两个成分可能有同样的基础过程(Kilavik et al., 2013)。
5 总结及展望
基于本文梳理的内容, 我们至少可以做出以下总结。其一, 人类运动时源于大脑运动皮层的Beta节律与Mu节律均有被抑制的现象。并且被试在观察他人运动时, 也会产生运动区 Mu节律的去同步化与Beta节律的PMBR现象。这表明Beta节律与Mu节律可能都与“镜像神经元”系统有关。其二, Beta节律有独立于Mu节律的特殊活动形式,其中线索诱发的Beta节律降低、运动前Beta节律降低和运动后PMBR都是其不同于Mu节律的活动形式, 直接表明了运动区Beta节律有其特殊的心理意义。其三, 线索诱发的Beta节律降低和运动前Beta节律降低表明, Beta节律的抑制可能是运动准备的指标, 反映了运动准备的过程。最后,对运动后PMBR现象可能的解释有:1) PMBR是运动区神经元由运动时的激活状态向运动停止后的休息状态转化的标志; 2) PMBR反映了主动运动或被动运动后感觉反馈信号传入的终止; 3)PMBR是动作系统的重置的标志。同时本文基于儿童研究的数据, 从发展的角度对这三个假说进行了评述, 认为与运动相关的 Mu节律的变化更可能反映了人类天生的心理过程, 而运动区 Beta节律的变化更可能反映了某些人类后天习得的心理过程, 因此Beta节律的心理机制更有可能是动作系统重置或者其它更为复杂的、需要后天习得的心理过程。但是目前的研究尚未有任何直接的证据能支持这一假说。由于运动区Mu节律和Beta节律更可能反映的是独立的心理过程, 因此进一步明确Mu节律与Beta节律可能反映的不同心理过程将是值得推进的方向。就运动准备阶段Beta节律的降低而言, 由于研究者观察到此阶段 Beta节律的变化是更清晰的, 因此几乎没有研究直接比较Mu与Beta在运动准备阶段的差异, 但这样的比较在未来的研究中是有必要的。另一方面,运动准备包含了多个心理过程, 因此Beta节律的变化具体对应哪一个或者哪几个过程有待进一步的研究。
就运动结束后的PMBR而言, 未来的研究可通过操纵组合动作中, 后续动作对完成目标的必要性的方式来调节动作系统重置的必要性, 从而检验其对Beta节律在动作结束后PMBR的影响,进而检验动作重置理论。由于PMBR具有随年龄变化逐渐增强的特征, 因此相应的研究应结合不同年龄儿童的数据来分析, 进而加深对PMBR的理解。
郝俊懿, 张晓芸, 潘婷, 廖渝. (2015, 9月). Beta节律回复增强的年龄变化研究(摘要). 第二届ERP研究与应用研讨会, 重庆.
Alary, F., Doyon, B., Loubinoux, I., Carel, C., Boulanouar, K.,Ranjeva, J. P., ... Chollet, F. (1998). Event-related potentials elicited by passive movements in humans: Characterization,source analysis, and comparison to fMRI.NeuroImage,8(4), 377–390.
Alegre, M., Gurtubay, I. G., Labarga, A., Iriarte, J., Malanda,A., & Artieda, J. (2003). Alpha and beta oscillatory changes during stimulus-induced movement paradigms: Effect of stimulus predictability.Neuroreport, 14(3), 381–385.
Alegre, M., Imirizaldu, L., Valencia, M., Iriarte, J., Arcocha,J., & Artieda, J. (2006). Alpha and beta changes in cortical oscillatory activity in a go/no go randomly-delayed- response choice reaction time paradigm.Clinical Neurophysiology,117(1), 16–25.
Avanzini, P., Fabbri-Destro, M., Dalla Volta, R., Daprati, E.,Rizzolatti, G., & Cantalupo, G. (2012). The dynamics of sensorimotor cortical oscillations during the observation of hand movements: An EEG study.PLoS One, 7(5),e37534.
Bernier, R., Dawson, G., Webb, S., & Murias, M. (2007).EEG mu rhythm and imitation impairments in individuals with autism spectrum disorder.Brain and Cognition, 64(3),228–237.
Brovelli, A., Battaglini, P. P., Naranjo, J. R., & Budai, R. (2002).Medium-range oscillatory network and the 20-Hz sensorimotor induced potential.NeuroImage, 16(1), 130–141.
Buccino, G., Binkofski, F., & Riggio, L. (2004). The mirror neuron system and action recognition.Brain and Language,89(2), 370–376.
Buccino, G., Vogt, S., Ritzl, A., Fink, G. R., Zilles, K., Freund,H. J., & Rizzolatti, G. (2004). Neural circuits underlying imitation learning of hand actions: An event-related fMRI study.Neuron, 42(2), 323–334.
Buzsáki, G. (2010). Neural syntax: Cell assemblies, synapsembles,and readers.Neuron, 68(3), 362–385.
Caetano, G., Jousmäki, V., & Hari, R. (2007). Actor’s and observer’s primary motor cortices stabilize similarly after seen or heard motor actions.Proceedings of the National Academy of Sciencesof the United States of America,104(21), 9058–9062.
Cassim, F., Monaca, C., Szurhaj, W., Bourriez, J.-L., Defebvre,L., Derambure, P., & Guieu, J.-D. (2001). Does post-movement beta synchronization reflect an idling motor cortex?Neuroreport, 12(17), 3859–3863.
Cassim, F., Szurhaj, W., Sediri, H., Devos, D., Bourriez, J.-L.,Poirot, I., … Guieu, J.-D. (2000). Brief and sustained movements:Differences in event-related (de)synchronization (ERD/ERS)patterns.Clinical Neurophysiology, 111(11), 2032–2039.
Chatrian, G. E., Petersen, M. C., & Lazarte, J. A. (1959). The blocking of the rolandic wicket rhythm and some central changes related to movement.Electroencephalography and Clinical Neurophysiology, 11(3), 497–510.
Chen, R., Yaseen, Z., Cohen, L. G., & Hallett, M. (1998). Time course of corticospinal excitability in reaction time and self-paced movements.Annals of Neurology, 44(3), 317–325.
Cheyne, D. O. (2013). MEG studies of sensorimotor rhythms:A review.Experimental Neurology, 245, 27–39.
Cheyne, D., Gaetz, W., Garnero, L., Lachaux, J. P., Ducorps,A., Schwartz, D., & Varela, F. J. (2003). Neuromagnetic imaging of cortical oscillations accompanying tactile stimulation.Cognitive Brain Research, 17(3), 599–611.
Cheyne, D., Jobst, C., Tesan, G., Crain, S., & Johnson, B. (2014).Movement-related neuromagnetic fields in preschool age children.Human Brain Mapping, 35(9), 4858–4875.
Cochin, S., Barthelemy, C., Lejeune, B., Roux, S., & Martineau,J. (1998). Perception of motion and qEEG activity in human adults.Electroencephalography and Clinical Neurophysiology, 107(4), 287–295.
Cochin, S., Barthelemy, C., Roux, S., & Martineau, J. (1999).Observation and execution of movement: Similarities demonstrated by quantified electroencephalography.European Journal of Neuroscience, 11(5), 1839–1842.
Conway, B. A., Halliday, D. M., Farmer, S. F., Shahani, U., Maas, P.,Weir, A. I., & Rosenberg, J. R. (1995). Synchronization between motor cortex and spinal motoneuronal pool during the performance of a maintained motor task in man.The Journal of Physiology, 489(3), 917–924.
Crone, N. E., Miglioretti, D. L., Gordon, B., Sieracki, J. M.,Wilson, M. T., Uematsu, S., & Lesser, R. P. (1998). Functional mapping of human sensorimotor cortex with electrocorticographic spectral analysis. I. Alpha and beta event-related desynchronization.Brain, 121(Pt 12), 2271–2299.
Doyle, L. M. F., Yarrow, K., & Brown, P. (2005). Lateralization of event-related beta desynchronization in the EEG during pre-cued reaction time tasks.Clinical Neurophysiology,116(8), 1879–1888.
Fadiga, L., Buccino, G., Craighero, L., Fogassi, L., Gallese,V., & Pavesi, G. (1998). Corticospinal excitability is specifically modulated by motor imagery: A magnetic stimulation study.Neuropsychologia, 37(2), 147–158.
Fagg, A. H., & Arbib, M. A. (1998). Modeling parietal- premotor interactions in primate control of grasping.Neural Networks,11(7-8), 1277–1303.
Feige, B., Aertsen, A. D., & Kristeva-Feige, R. (2000).Dynamic synchronization between multiple cortical motor areas and muscle activity in phasic voluntary movements.Journal of Neurophysiology, 84(5), 2622–2629.
Gaetz, W., & Cheyne, D. (2006). Localization of sensorimotor cortical rhythms induced by tactile stimulation using spatially filtered MEG.NeuroImage, 30(3), 899–908.
Gaetz, W., Edgar, J. C., Wang, D. J., & Roberts, T. P. L. (2011).Relating MEG measured motor cortical oscillations to resting γ-Aminobutyric acid (GABA) concentration.NeuroImage, 55(2), 616–621.
Gaetz, W., MacDonald, M., Cheyne, D., & Snead, O. C. (2010).Neuromagnetic imaging of movement-related cortical oscillations in children and adults: Age predicts postmovement beta rebound.NeuroImage, 51(2), 792–807.
Gallese, V., Fadiga, L., Fogassi, L., & Rizzolatti, G. (1996).Action recognition in the premotor cortex.Brain, 119(2),593–610.
Gastaut, H. J., & Bert, J. (1954). EEG changes during cinematographic presentation (Moving picture activation of the EEG).Electroencephalography and Clinical Neurophysiology, 6, 433–444.
Grèzes, J., Armony, J. L., Rowe, J., & Passingham, R. E. (2003).Activations related to “mirror” and “canonical” neurones in the human brain: An fMRI study.NeuroImage, 18(4),928–937.
Hall, S. D., Barnes, G. R., Furlong, P. L., Seri, S., & Hillebrand,A. (2010). Neuronal network pharmacodynamics of GABAergic modulation in the human cortex determined using pharmacomagnetoencephalography.Human Brain Mapping, 31(4),581–594.
Hall, S. D., Stanford, I. M., Yamawaki, N., McAllister, C. J.,Rönnqvist, K. C., Woodhall, G. L., & Furlong, P. L. (2011).The role of GABAergic modulation in motor function related neuronal network activity.NeuroImage, 56(3), 1506–1510.
Hari, R. (2006). Action–perception connection and the cortical mu rhythm.Progress in Brain Research, 159,253–260.
Hari, R., Forss, N., Avikainen, S., Kirveskari, E., Salenius,S., & Rizzolatti, G. (1998). Activation of human primary motor cortex during action observation: A neuromagnetic study.Proceedings of the National Academy of Sciencesof the United States of America, 95(25), 15061–15065.
Hari, R., Salmelin, R., Mäkelä, J. P., Salenius, S., & Helle,M. (1997). Magnetoencephalographic cortical rhythms.International Journal of Psychophysiology, 26(1-3), 51–62.
Hjorth, B. (1975). An on-line transformation of EEG scalp potentials into orthogonal source derivations.Electroencephalography and Clinical Neurophysiology,39(5), 526–530.
Iacoboni, M., Koski, L. M., Brass, M., Bekkering, H., Woods,R. P., Dubeau, M. C., ... Rizzolatti, G. (2001). Reafferent copies of imitated actions in the right superior temporal cortex.Proceedings of the National Academy of Sciences of the United States of America, 98(24), 13995–13999.
Iacoboni, M., Woods, R. P., Brass, M., Bekkering, H., Mazziotta,J. C., & Rizzolatti, G. (1999). Cortical mechanisms of human imitation.Science, 286(5449), 2526–2528.
Järveläinen, J., Schürmann, M., Avikainen, S., & Hari, R.(2001). Stronger reactivity of the human primary motor cortex during observation of live rather than video motor acts.Neuroreport, 12(16), 3493–3495.
Järveläinen, J., Schürmann, M., & Hari, R. (2004). Activation of the human primary motor cortex during observation of tool use.NeuroImage, 23(1), 187–192.
Jasper, H., & Penfield, W. (1949). Electrocorticograms in man: Effect of voluntary movement upon the electrical activity of the precentral gyrus.Archiv für Psychiatrie und Nervenkrankheiten, 183(1–2), 163–174.
Jensen, O., Goel, P., Kopell, N., Pohja, M., Hari, R., & Ermentrout,B. (2005). On the human sensorimotor-cortex beta rhythm:Sources and modeling.NeuroImage, 26(2), 347–355.
Jürgens, E., Rösler, F., Hennighausen, E., & Heil, M. (1995).Stimulus-induced gamma oscillations: Harmonics of alpha activity?.Neuroreport, 6(5), 813–816.
Jurkiewicz, M. T., Gaetz, W. C., Bostan, A. C., & Cheyne, D.(2006). Post-movement beta rebound is generated in motor cortex: Evidence from neuromagnetic recordings.NeuroImage,32(3), 1281–1289.
Kaiser, J., Birbaumer, N., & Lutzenberger, W. (2001). Eventrelated beta desynchronization indicates timing of response selection in a delayed-response paradigm in humans.Neuroscience Letters, 312(3), 149–152.
Kilavik, B. E., Zaepffel, M., Brovelli, A., MacKay, W. A., &Riehle, A. (2013). The ups and downs of beta oscillations in sensorimotor cortex.Experimental Neurology, 245,15–26.
Kilner, J., Bott, L., & Posada, A. (2005). Modulations in the degree of synchronization during ongoing oscillatory activity in the human brain.European Journal of Neuroscience, 21(9),2547–2554.
Klimesch, W. (1999). EEG alpha and theta oscillations reflect cognitive and memory performance: A review and analysis.Brain Research Reviews, 29(2-3), 169–195.
Koelewijn, T., van Schie, H. T., Bekkering, H., Oostenveld,R., & Jensen, O. (2008). Motor-cortical beta oscillations are modulated by correctness of observed action.NeuroImage,40(2), 767–775.
Lee, B. I., Lüders, H., Lesser, R. P., Dinner, D. S., & Morris,H. H. (1986). Cortical potentials related to voluntary and passive finger movements recorded from subdural electrodes in humans.Annals of Neurology, 20(1), 32–37.
Lemon, R. N. (1981). Variety of functional organization within the monkey motor cortex.The Journal of Physiology,311(1), 521–540.
Lemon, R. N., Hanby, J. A., & Porter, R. (1976). Relationship between the activity of precentral neurones during active and passive movements in conscious monkeys.Proceedings of the Royal Society B: Biological Sciences, 194(1116),341–373.
Leocani, L., Toro, C., Manganotti, P., Zhuang, P., & Hallett,M. (1997). Event-related coherence and event-related desynchronization/synchronization in the 10 Hz and 20 Hz EEG during self-paced movements.Electroencephalography and Clinical Neurophysiology/Evoked Potentials Section,104(3), 199–206.
Liao, Y., Acar, Z. A., Makeig, S., & Deak, G. (2015). EEG imaging of toddlers during dyadic turn-taking: Mu-rhythm modulation while producing or observing social actions.NeuroImage, 112, 52–60.
Marshall, P. J., Young, T., & Meltzoff, A. N. (2011). Neural correlates of action observation and execution in 14-monthold infants: An event-related EEG desynchronization study.Developmental Science, 14(3), 474–480.
Marshall, P. J., & Meltzoff, A. N. (2014). Neural mirroring mechanisms and imitation in human infants.Philosophical Transactions of the Royal Society B: Biological Sciences,369(1644), 20130620.
McFarland, D. J., Miner, L. A., Vaughan, T. M., & Wolpaw,J. R. (2000). Mu and beta rhythm topographies during motor imagery and actual movements.Brain Topography,12(3), 177–186.
Meltzoff, A. N., & Decety, J. (2003). What imitation tells us about social cognition: A rapprochement between developmental psychology and cognitive neuroscience.Philosophical Transactions of the Royal Society B: Biological Sciences,358(1431), 491–500.
Muthukumaraswamy, S. D., & Johnson, B. W. (2004). Changes in rolandic mu rhythm during observation of a precision grip.Psychophysiology, 41(1), 152–156.
Muthukumaraswamy, S. D., Johnson, B. W., & McNair, N.A. (2004). Mu rhythm modulation during observation of an object-directed grasp.Cognitive Brain Research, 19(2),195–201.
Nagamine, T., Kajola, M., Salmelin, R., Shibasaki, H., &Hari, R. (1996). Movement-related slow cortical magnetic fields and changes of spontaneous MEG-and EEG-brain rhythms.Electroencephalography and Clinical Neurophysiology,99(3), 274–286.
Neuper, C., & Pfurtscheller, G. (1996). Post-movement synchronization of beta rhythms in the EEG over the cortical foot area in man.Neuroscience Letters, 216(1),17–20.
Oberman, L. M., Hubbard, E. M., McCleery, J. P., Altschuler,E. L., Ramachandran, V. S., & Pineda, J. A. (2005). EEG evidence for mirror neuron dysfunction in autism spectrum disorders.Cognitive Brain Research, 24(2),190–198.
Ohara, S., Ikeda, A., Kunieda, T., Yazawa, S., Baba, K., Nagamine,T., ... Shibasaki, H. (2000). Movement-related change of electrocorticographic activity in human supplementary motor area proper.Brain, 123(6), 1203–1215.
Onishi, H., Oyama, M., Soma, T., Kubo, M., Kirimoto, H.,Murakami, H., & Kameyama, S. (2010). Neuromagnetic activation of primary and secondary somatosensory cortex following tactile-on and tactile-off stimulation.Clinical Neurophysiology, 121(4), 588–593.
Oztop, E., & Arbib, M. A. (2002). Schema design and implementation of the grasp-related mirror neuron system.Biological Cybernetics, 87(2), 116–140.
Pastötter, B., Berchtold, F., & Bäuml, K.-H. T. (2012). Oscillatory correlates of controlled speed-accuracy tradeoff in a response-conflict task.Human Brain Mapping, 33(8),1834–1849.
Perry, A., & Bentin, S. (2009). Mirror activity in the human brain while observing hand movements: A comparison between EEG desynchronization in the μ-range and previous fMRI results.Brain Research, 1282, 126–132.
Pfurtscheller, G. (1981). Central beta rhythm during sensorimotor activities in man.Electroencephalography and Clinical Neurophysiology, 51(3), 253–264.
Pfurtscheller, G., & Aranibar, A. (1977). Event-related cortical desynchronization detected by power measurements of scalp EEG.Electroencephalography and Clinical Neurophysiology, 42(6),817–826.
Pfurtscheller, G., & Da Silva, F. H. L. (1999). Event-related EEG/MEG synchronization and desynchronization: Basic principles.Clinical Neurophysiology, 110(11), 1842–1857.
Pfurtscheller, G., Graimann, B., Huggins, J. E., Levine, S. P.,& Schuh, L. A. (2003). Spatiotemporal patterns of beta desynchronization and gamma synchronization in corticographic data during self-paced movement.Clinical Neurophysiology, 114(7), 1226–1236.
Pfurtscheller, G., Stancák, A., & Edlinger, G. (1997). On the existence of different types of central beta rhythms below 30 Hz.Electroencephalography and Clinical Neurophysiology,102(4), 316–325.
Pfurtscheller, G., Stancák, A., Jr., & Neuper, C. (1996). Postmovement beta synchronization. A correlate of an idling motor area?.Electroencephalography and Clinical Neurophysiology, 98(4), 281–293.
Picazio, S., Ponzo, V., & Koch, G. (2015). Cerebellar control on prefrontal-motor connectivity during movement inhibition.The Cerebellum, 1–8, doi: 10.1007/s12311-015-0731-3
Reid, V. M., Striano, T., & Iacoboni, M. (2011). Neural correlates of dyadic interaction during infancy.Developmental Cognitive Neuroscience, 1(2), 124–130.
Rizzolatti, G., & Craighero, L. (2004). The mirror-neuron system.Annual Review of Neuroscience, 27, 169–192.
Rizzolatti, G., Fadiga, L., Gallese, V., & Fogassi, L. (1996).Premotor cortex and the recognition of motor actions.Cognitive Brain Research, 3(2), 131–141.
Rizzolatti, G., & Sinigaglia, C. (2010). The functional role of the parieto-frontal mirror circuit: Interpretations and misinterpretations.Nature Reviews Neuroscience, 11(4),264–274.
Rossiter, H. E., Davis, E. M., Clark, E. V., Boudrias, M. H.,& Ward, N. S. (2014). Beta oscillations reflect changes in motor cortex inhibition in healthy ageing.NeuroImage, 91,360–365.
Saby, J. N., Marshall, P. J., & Meltzoff, A. N. (2012). Neural correlates of being imitated: An EEG study in preverbal infants.Social Neuroscience, 7(6), 650–661.
Salenius, S., Portin, K., Kajola, M., Salmelin, R., & Hari, R.(1997). Cortical control of human motoneuron firing during isometric contraction.Journal of Neurophysiology, 77(6),3401–3405.
Salmelin, R., Hámáaláinen, M., Kajola, M., & Hari, R.(1995). Functional segregation of movement-related rhythmic activity in the human brain.NeuroImage, 2(4), 237–243.
Salmelin, R., & Hari, R. (1994). Spatiotemporal characteristics of sensorimotor neuromagnetic rhythms related to thumb movement.Neuroscience, 60(2), 537–550.
Sinigaglia, C., & Rizzolatti, G. (2011). Through the looking glass: Self and others.Consciousness and Cognition,20(1), 64–74.
Sochůrková, D., Rektor, I., Jurák, P., & Stančák, A. (2006).Intracerebral recording of cortical activity related to self-paced voluntary movements: A Bereitschaftspotential and event-related desynchronization/synchronization. SEEG study.Experimental Brain Research, 173(4), 637–649.
Southgate, V., Johnson, M. H., Osborne, T., & Csibra, G. (2009).Predictive motor activation during action observation in human infants.Biology Letters, 5(6), 769–772.
Stančák, A., Jr., Feige, B., Lücking, C. H., & Kristeva-Feige,R. (2000). Oscillatory cortical activity and movementrelated potentials in proximal and distal movements.Clinical Neurophysiology, 111(4), 636–650.
Stančák, A., Jr., & Pfurtscheller, G. (1995). Desynchronization and recovery of β rhythms during brisk and slow selfpaced finger movements in man.Neuroscience Letters,196(1-2), 21–24.
Stančák, A., Jr., & Pfurtscheller, G. (1996). Event-related desynchronisation of central beta-rhythms during brisk and slow self-paced finger movements of dominant and nondominant hand.Cognitive Brain Research, 4(3),171–183.
Stančák, A., Jr., Riml, A., & Pfurtscheller, G. (1997). The effects of external load on movement-related changes of the sensorimotor EEG rhythms.Electroencephalography and Clinical Neurophysiology, 102(6), 495–504.
Swann, N., Tandon, N., Canolty, R., Ellmore, T. M., McEvoy, L.K., Dreyer, S., … Aron, A. R. (2009). Intracranial EEG reveals a time- and frequency-specific role for the right inferior frontal gyrus and primary motor cortex in stopping initiated responses.Journal of Neuroscience, 29(40),12675–12685.
Szurhaj, W., Derambure, P., Labyt, E., Cassim, F., Bourriez,J. L., Isnard, J., ... Mauguière, F. (2003). Basic mechanisms of central rhythms reactivity to preparation and execution of a voluntary movement: A stereoelectroencephalographic study.Clinical Neurophysiology, 114(1), 107–119.
Tiihonen, J., Kajola, M., & Hari, R. (1989). Magnetic mu rhythm in man.Neuroscience, 32(3), 793–800.
Triggiani, A. I., Valenzano, A., Del Percio, C., Marzano, N.,Soricelli, A., Petito, A., ... Babiloni, C. (2015). Resting state Rolandic mu rhythms are related to activity of sympathetic component of autonomic nervous system in healthy humans.International Journal of Psychophysiology,doi: 10.1016/j.ijpsycho.2015.02.009
Tzagarakis, C., Ince, N. F., Leuthold, A. C., & Pellizzer, G.(2010). Beta-band activity during motor planning reflects response uncertainty.Journal of Neuroscience, 30(34),11270–11277.
Uhlhaas, P. J., Roux, F., Rodriguez, E., Rotarska-Jagiela, A.,& Singer, W. (2010). Neural synchrony and the development of cortical networks.Trends in Cognitive Sciences, 14(2),72–80.
van Wijk, B. C. M., Daffertshofer, A., Roach, N., & Praamstra,P. (2009). A role of beta oscillatory synchrony in biasing response competition?Cerebral Cortex, 19(6), 1294–1302.
Warreyn, P., Ruysschaert, L., Wiersema, J. R., Handl, A.,Pattyn, G., & Roeyers, H. (2013). Infants’ mu suppression during the observation of real and mimicked goal-directed actions.Developmental Science, 16(2), 173–185.
Weiller, C., Jüptner, M., Fellows, S., Rijntjes, M., Leonhardt,G., Kiebel, S., … Thilmann, A. F. (1996). Brain representation of active and passive movements.NeuroImage, 4(2),105–110.
Wheaton, L. A., Carpenter, M., Mizelle, J. C., & Forrester, L.(2008). Preparatory band specific premotor cortical activity differentiates upper and lower extremity movement.Experimental Brain Research, 184(1), 121–126.
Wilson, T. W., Slason, E., Asherin, R., Kronberg, E., Reite,M. L., Teale, P. D., & Rojas, D. C. (2010). An extended motor network generates beta and gamma oscillatory perturbations during development.Brain and Cognition,73(2), 75–84.
Xiang, J., Hoshiyama, M., Koyama, S., Kaneoke, Y., Suzuki,H., Watanabe, S., … Kakigi, R. (1997). Somatosensory evoked magnetic fields following passive finger movement.Cognitive Brain Research, 6(2), 73–82.
Zhang, Y., Chen, Y., Bressler, S. L., & Ding, M. (2008). Response preparation and inhibition: The role of the cortical sensorimotor beta rhythm.Neuroscience, 156(1), 238–246.
