超高液相色谱法测定桔梗饮片和桔梗配方颗粒中桔梗皂苷D含量
2016-01-31桂双英王举涛彭代银陈培胜金传山
梁 心,桂双英,2,3,王举涛,彭代银,陈培胜,金传山,2
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽省中药制剂工程技术研究中心,安徽 合肥 230012;
3.安徽省中医药科学院药物制剂研究所,安徽 合肥 230012;4.安徽济人药业有限公司,安徽 亳州 236800)
超高液相色谱法测定桔梗饮片和桔梗配方颗粒中桔梗皂苷D含量
梁心1,桂双英1,2,3,王举涛1,彭代银1,陈培胜4,金传山1,2
(1.安徽中医药大学药学院,安徽 合肥230012;2.安徽省中药制剂工程技术研究中心,安徽 合肥230012;
3.安徽省中医药科学院药物制剂研究所,安徽 合肥230012;4.安徽济人药业有限公司,安徽 亳州236800)
[摘要]目的采用超高效液相色谱法建立桔梗饮片及桔梗配方颗粒中桔梗皂苷D的含量测量方法,为桔梗配方颗粒的质量控制提供实验依据。方法采用Waters Acquity UPLC HSS T3柱(2.1 mm×50 mm,1.8 μm),以乙腈和水为流动相,梯度洗脱,流速 0.25 mL/min,检测波长210 nm,柱温29 ℃。结果桔梗皂苷D进样量在0.504~2.520 μg范围内与峰面积的线性关系良好,平均加样回收率为99.89%,RSD为1.64%;桔梗饮片和桔梗配方颗粒中桔梗皂苷D的含量具有差异。结论本实验所建立的测定方法简便、准确、可靠,可用于桔梗饮片和桔梗配方颗粒中桔梗皂苷D含量的检测。
[关键词]桔梗饮片;桔梗配方颗粒;桔梗皂苷D;超高效液相色谱法
桔梗为桔梗科植物桔梗Platycodongrandiflorum(Jacq.)A.DC.的干燥根[1],具有宣肺、利咽、祛痰、排脓之功效。桔梗主产于安徽、山东及内蒙古等地,安徽省作为桔梗的主产区,桔梗栽培面积较大,产量颇丰[2]。桔梗的主要活性成分为三萜皂苷,目前已分离得到45个三萜皂苷类化学成分,其中桔梗皂苷D是含量相对较高的一种皂苷,药理学实验表明,桔梗皂苷D具有祛痰镇咳、降脂降糖以及抗癌作用[3-5]。临床配方有桔梗饮片和桔梗配方颗粒两种使用形式。桔梗饮片由桔梗药材炮制而成;桔梗配方颗粒是以桔梗饮片为原料,经提取、浓缩、干燥、制粒而成。为有效控制桔梗饮片和配方颗粒质量,本研究选取10批安徽产桔梗药材,分别制成桔梗饮片和配方颗粒,首次采用超高效液相色谱法测定桔梗饮片及桔梗配方颗粒中桔梗皂苷D的含量,并对二者相关性进行分析。
1仪器与材料
1.1仪器Waters Acquity超高效液相色谱仪H-class色谱系统,包括四元超高压溶剂系统、自动进样恒温样品管理器、PDA检测器、柱温箱及Empower 2色谱工作站:美国Waters公司;AG285型十万分之一电子分析天平:德国赛多利斯公司;KQ2200型超声仪:江苏昆山超声仪器有限公司;HFB-200型中药粉碎机:湖南吉首市中州市中药机械厂;DZF-6050型真空干燥箱:上海博讯医疗设备厂。
1.2材料10批桔梗药材分别于2013年10月至2014年1月收集于安徽不同地区,经安徽中医药大学金传山教授鉴定均为桔梗科植物桔梗Platycodongrandiflorum(Jacq.)A. DC.干燥根,并委托安徽济人药业有限公司由同批药材制得桔梗饮片、配方颗粒各10批(批号及药材具体来源见表1),桔梗饮片炮制方法按照《中华人民共和国药典》(2010年版)炮制方法,桔梗配方颗粒以桔梗饮片为原料,经水提取、浓缩、喷雾干燥制成的颗粒;桔梗皂苷D对照品(批号 13082211,购自成都曼思特生物科技有限公司,纯度99.6%);乙腈、甲醇为色谱纯;其余试剂均为分析纯;屈臣氏蒸馏水;硅胶G板(青岛海洋化工厂分厂)。
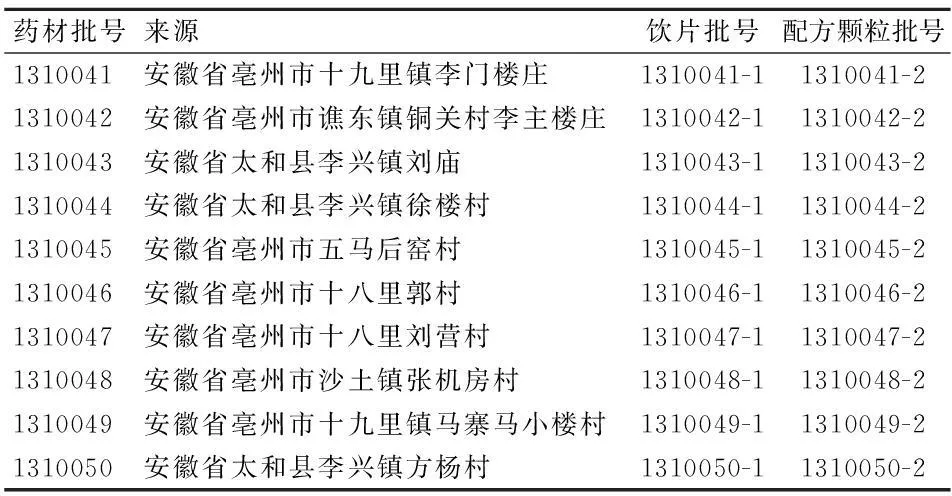
表1 桔梗药材来源及饮片、配方颗粒批号
2方法与结果
2.1色谱条件Waters Acquity 超高效液相色谱仪HSS T3柱(2.1 mm×50 mm,1.8 μm),流动相为乙腈(A)-水(B),梯度洗脱顺序为:(0~2 min,20% A;2~5 min,20% A;5~6 min,40% A;6~9 min,40% A;9~10 min,20% A),流速:0.25 mL/min,检测波长210 nm,柱温29 ℃,进样量:1 μL。色谱图见图1。
2.2对照品溶液的制备精密称定桔梗皂苷D对照品5.0 mg,置于10 mL容量瓶中,加甲醇溶解并定容到刻度,即得。
2.3供试品溶液的制备分别取干燥桔梗饮片粉末和桔梗配方颗粒(过2号筛)约2.0 g,精密称定,精密加入50%甲醇50 mL,称定质量,超声处理30 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,滤过,精密量取续滤液25 mL,置水浴上蒸干,残渣加水20 mL,微热使溶解,加水饱和正丁醇振摇提取3次,每次20 mL,合并正丁醇液,用氨试液50 mL洗涤,弃去氨液,再用正丁醇饱和的水50 mL洗涤,弃去水液,正丁醇液蒸干,残渣加甲醇溶解,转移至5 mL容量瓶中,加甲醇至刻度,摇匀,用微孔滤膜滤过(0.22 μm),即得。
2.4方法学考察
2.4.1线性关系考察精密吸取桔梗皂苷D对照品溶液(0.504 mg/mL)1、2、3、4、5 μL,注入超高效液相色谱仪,按“2.1”项下色谱条件测定桔梗皂苷D峰面积,以色谱峰峰面积(y)为纵坐标,以浓度(x)为横坐标,绘制标准曲线。回归方程:y=316 535.6x-45 859.6,r=0.999 95,表明桔梗皂苷D在0.504~2.520 μg范围内与峰面积的线性关系良好。
2.4.2精密度试验精密吸取桔梗皂苷D对照品溶液(0.504 mg/mL)1 μL,按“2.1”项下色谱条件,连续进样6次,测定峰面积。结果显示,桔梗皂苷D峰面积值的RSD为1.10%,结果表明仪器的精密度良好。
2.4.3稳定性试验取同一批次供试品溶液(批号 1310048-1),分别于0、2、4、8、12、24 h,按“2.1”项下色谱条件进样,测定峰面积。结果显示,桔梗皂苷D峰面积的RSD值为1.11%,表明样品溶液在24 h内较为稳定。
2.4.4重复性试验取同一批次桔梗饮片(批号 1310048-1),按照“2.3”项下方法制备6份样品溶液,依照“2.1”项下色谱条件进样,测定峰面积并计算桔梗皂苷D含量。结果表明,批号 1310048-1的桔梗饮片中桔梗皂苷D的平均含量为2.434 mg/g,RSD为1.15%,说明本法重复性良好。
2.4.5加样回收率实验精密称取已知含量同一批次的桔梗饮片(批号 1310048-1)粉末0.50 g,共6份,精密移取桔梗皂苷D对照品溶液(0.575 mg/L)2.0 mL加入到饮片粉末中,按“2.3”项下方法制备加样回收供试品溶液,按“2.1”项下色谱条件进样,每次1 μL,测定色谱峰面积并计算回收率,结果见表2。
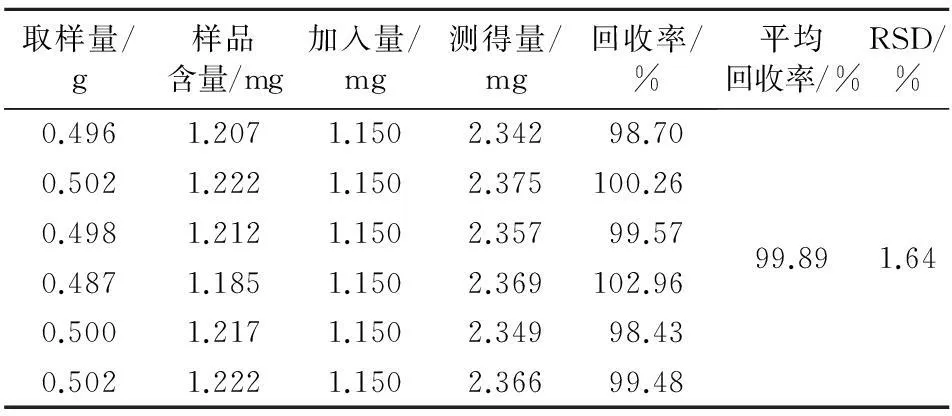
表2 桔梗皂苷D加样回收率试验结果
2.4.6样品含量测定结果分别取10批桔梗饮片和配方颗粒,按照“2.3”项下方法制成供试品溶液,按照“2.1”项下色谱条件依法测定,记录峰面积,计算桔梗皂苷含量,结果见表3和表4。

表3 各批次饮片中桔梗皂苷D含量
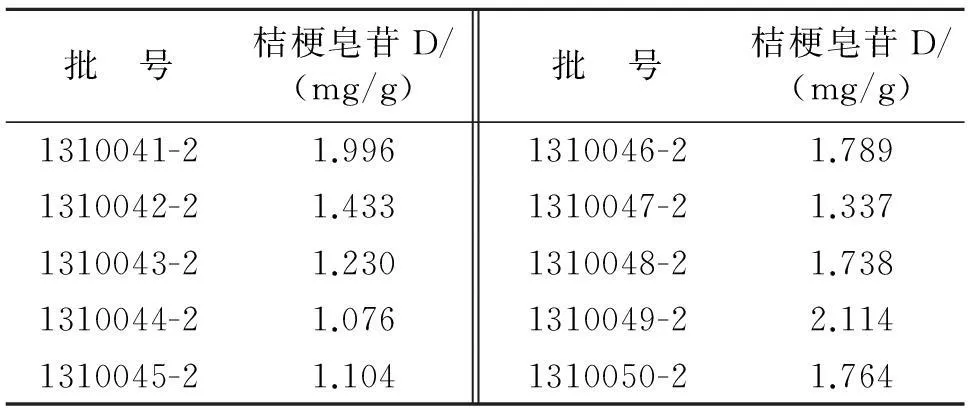
表4 各批次配方颗粒中桔梗皂苷D含量
根据《中华人民共和国药典》(2010年版)一部“桔梗”项下要求,桔梗饮片中桔梗皂苷D含量不得低于0.10%。因此,本次实验采用的10批桔梗饮片含量均符合药典标准。同时,根据对10批桔梗饮片及配方颗粒的样品含量测定结果进行对比,同批饮片和配方颗粒的桔梗皂苷D含量,大部分批次样品损失率在17%左右,少数批次可达到30%,桔梗配方颗粒能较好地保留饮片中有效成分桔梗皂苷D。此外,根据10批桔梗配方颗粒中桔梗皂苷D的含量实际测得值在1.076~2.114 mg/g,因此,桔梗配方颗粒每克含桔梗以桔梗皂苷D计,应不少于0.86 mg。
3讨论
3.1供试品溶液制备方法实验中供试品溶液制备时,曾尝试采用超声提取法制备样品溶液,但得到的样品溶液中杂质较多,特征峰难以分离;然后参考《中华人民共和国药典》(2010年版)“桔梗”项下超声提取、正丁醇萃取、硅胶柱分离的方法,结果样品杂质较少,但桔梗皂苷D损失较大。本课题组在实验中比较了直接萃取和萃取与硅胶柱分离结合两种纯化方式,结果表明,在本实验采用的色谱条件下,直接萃取桔梗皂苷D的色谱峰能够很好的分离,且可避免柱分离过程中桔梗皂苷D损失,因此采用超声提取、正丁醇萃取的制备方法。
3.2色谱条件目前文献已报道的对桔梗药材中桔梗皂苷D的测定方法有高效液相色谱-紫外检测器法[6-8]和高效液相色谱-蒸发光散射检测器法[9-10]。超高效液相色谱法是一种基于小颗粒填料的液相色谱技术,其理论基础为范德米特方程,通过降低颗粒度提高柱效和速度,可弥补传统高效液相系统的不足[11]。本实验采取的超高效液相色谱法进行含量测定,其谱峰的保留时间均在10 min以内,极大地缩短了分析时间,同时超高效液相色谱法的流速仅为0.25 μL/min,进样体积为1 μL,而高效液相色谱法流速多在0.7 mL/min,进样量在10 μL或以上,因此采取超高效液相色谱法进行测定可大大降低分析成本。经方法学验证,其还具有灵敏度高、重复性好、快速、准确的优点。
在流动相考察中,曾试用纯乙腈、乙腈-水(75∶25)、纯甲醇、甲醇-水(70∶30),但分离效果均不理想,出现洗脱较快、特征峰无法有效分离等问题,故采取梯度洗脱法进行分析,桔梗皂苷D分离效果良好。
参考文献:
[1]国家药典编委会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:259-260.
[2]张玲,王德群.安徽省桔梗科药用植物资源调查[J].安徽中医学院学报,2003,22(6):48-50.
[3]Shin CY, Lee WJ, Lee EB, et al. Platycodin D and D3 increase airway mucin releaseinvivoandinvitroin rats and hamsters [J]. Planta Med, 2002, 68(3): 221-225.
[4]Lee EJ, Kang M, Kim YS, et al. Platycodin D inhibits lipogenesis through AMPKα-PPARγ in 3T3-L1 cells and modulates fat accumulation in obese mice[J]. Planta Med,2012,78(14):1536-1542.
[5]Chun J, Joo EJ, Kang M, et al. Platycodin D induces anoikis and caspase-mediated apoptosis via p38 MAPK in AGS human gastric cancer cells[J]. J Cell Biochem,2013,114(2):456-470.
[6]李喜凤,杜云锋,谢新年,等.不同产地桔梗药材HPLC指纹图谱及桔梗皂苷D含量测定研究[J].中成药,2010,32(4):529-532.
[7]李伟,王梓,刘志,等.RP-HPLC同时测定桔梗中去芹糖桔梗皂苷D与桔梗皂苷D[J].中草药,2009,40(11):1823-1825.
[8]金传山,张伟,桂双英,等.不同产地桔梗中桔梗皂苷D及总多糖的含量比较[J].安徽医药,2014,18(2):246-249.
[9]李红燕,张蕊,冯晓川,等.HPLC-ELSD法测定复方枇杷止咳颗粒中桔梗皂苷D、熊果酸、齐墩果酸和贝母素甲[J].中成药,2013,35(7):1479-1484.
[10]丁大勇,高菲,姚琳,等.HPLC-ELSD法测定桑菊感冒片中桔梗皂苷D的含量[J].中国中医药信息杂志,2012,19(3):54-55.
[11]陈佳,王钢力,姚令文,等.超高效液相色谱(UPLC)在药物分析领域的应用[J].药物分析杂志,2008,28(11):1976-1981.
Determination of Platycodin-D inPlatycodongrandiflorumDecoction Piece and Its Formula Granule by Ultra-Performance Liquid Chromatography
LIANGXin1,GUIShuang-ying1,2,3,WANGJu-tao1,PENGDai-yin1,CHENPei-sheng4,JINChuan-shan1,2
(1.SchoolofPharmacy,AnhuiUniversityofChineseMedicine,AnhuiHefei230012,China; 2.AnhuiEngineeringResearchCenterforChineseMedicinePreparation,AnhuiHefei230012,China; 3.InstituteofPharmaceutics,AnhuiAcademyofChineseMedicine,AnhuiHefei230012,China; 4.AnhuiJirenPharmaceuticalCo.,Ltd.,AnhuiBozhou236800,China)
[Abstract]ObjectiveTo develop a method for determination of the content of platycodin-D in Platycodon grandiflorum Decoction Piece and its Formula Granule by ultra-performance liquid chromatography (UPLC), and to provide experimental evidence for the quality control of Platycodon grandiflorum Formula Granule. MethodsThe Waters Acquity UPLC HSS T3 column (2.1 mm × 50 mm, 1.8 μm) was used with a mobile phase of acetonitrile and water. The elution was performed in a gradient mode at a flow rate of 0.25 mL/min. The detection wavelength was 210 nm and the column temperature was 29 ℃. ResultsA good linear relationship with peak area was achieved when the amount of injected platycodin-D ranged between 0.504 and 2.520 μg. The recovery of the sample averaged 99.89% and the relative standard deviation was 1.64%. The content of platycodin-D varied between Platycodon grandiflorum Decoction Piece and its Formula Granule. ConclusionThis study establishes an easy, accurate, and reliable approach for determination of the content of platycodin-D in Platycodon grandiflorum and its Formula Granule.
[Key words]Platycodon grandiflorum Decoction Piece; Platycodon grandiflorum Formula Granule; platycodin-D; ultra-performance liquid chromatography
收稿日期:(2015-04-13;编辑:张倩)
通信作者:桂双英,guishy0520@126.com
作者简介:梁心(1990-),女,硕士研究生
基金项目:科技部十二五科技支撑计划项目(2011BAI04B06);安徽省科技攻关项目(12010402084)
[中图分类号]R927.2[DOI]10.3969/j.issn.2095-7246.2015.06.025
