铅胁迫对禾本科牧草生长、生理及Pb2+富集转运的影响
2016-01-28李慧芳王瑜袁庆华赵桂琴
李慧芳,王瑜,袁庆华*,赵桂琴
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.甘肃农业大学草业学院,甘肃 兰州 730070)
铅胁迫对禾本科牧草生长、生理及Pb2+富集转运的影响
李慧芳1,2,王瑜1,袁庆华1*,赵桂琴2
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.甘肃农业大学草业学院,甘肃 兰州 730070)
摘要:采用苗期盆栽试验,对14份禾本科牧草种质材料进行不同浓度(0,10,50,100,200,300 mg/kg)铅(Pb)胁迫处理,通过对株高、分蘖数、地上/地下生物量、脯氨酸含量、抗氧化酶(SOD、POD、CAT)活性、地上部与根中Pb2+含量等指标的测定与分析,探究Pb胁迫对禾草生长生理以及Pb2+富集转运的影响。结果表明,随着Pb浓度的增加,14份材料的株高、分蘖数、地上生物量均呈先上升后下降的趋势,地下生物量则逐渐降低,通过综合评价,来自土耳其的长穗冰草G5具有较强的耐Pb性。随着Pb浓度的增加,地上部与根中Pb2+含量逐渐升高,富集系数逐渐降低,转移系数逐渐降低(披碱草G7与G8除外),根中Pb2+含量显著高于地上部,为Pb2+的主要富集器官,披碱草地上部Pb2+含量高于其他材料,具有较强的Pb富集转运能力。7份材料的生理指标测定结果表明,随着Pb浓度的增加,7份材料的脯氨酸含量逐渐上升,CAT活性逐渐下降,POD和SOD活性则呈先上升后下降的趋势。
关键词:禾本科牧草;苗期;铅胁迫;生长和生理;富集转运
Effects of lead stress on growth, physiology, and lead ion accumulation and transportation in gramineous forages
LI Hui-Fang1,2, WANG Yu1, YUAN Qing-Hua1*, ZHAO Gui-Qin2
1.InstituteofAnimalScienceofCAAS,Beijing100193,China; 2.CollegeofGrasslandScience,GansuAgriculturalUniversity,Lanzhou730070,China
Abstract:Fourteen gramineous forages were stressed by different lead treatments (0, 10, 50, 100, 200, 300 mg/kg) at the seedling stage in pots. By measurement of plant height, tiller number, shoot and root biomass, antioxidant enzyme activities and shoot and root lead ion content, the effects of lead stress on growth, physiology, accumulation and transportation were analyzed. At low levels of lead exposure, plant height, tiller number and shoot biomass were generally increased, then reduced gradually with increasing lead exposure. Agropyron elongatum G5from Turkey was found to have a high lead tolerance. With increasing lead exposure, lead ion content in roots and shoots increased gradually, while the bio-concentration factor and transfer factor decreased gradually except for Elymus dahuricus G7and G8. The content of lead ions in roots was significantly higher than that in shoots, from which we concluded that the root was the main organ by which Poaceous forages accumulate lead ions. The content of lead ions in shoots of E. dahuricus G7and G8were higher than in other germplasm, indicating a high capacity for lead accumulation and transportation. From physiological analysis of seven evaluated varieties, it was found that with increased lead exposure, proline content increased gradually, and catalase (CAT) activity decreased gradually, while peroxidase (POD) and superoxide dismutase (SOD) were elevated at low levels of exposure, but decreased at higher levels of exposure.
Key words:gramineous forages; seedling stage; lead stress; growth and physiology; accumulation and transportation
铅(Pb)是最严重的环境重金属污染物之一[1]。Pb广泛存在于自然界,易被土壤吸附,不易被生物降解。Pb在植物根、茎、叶及籽粒中的累积,不仅严重影响植物的生长发育、降低产量和质量[2],并通过生物链富集而对人类健康造成严重的威胁,成为环境治理中越来越突出的问题。
重金属胁迫导致植物体内活性氧的增加是其毒害植物的重要机制之一。活性氧能够快速地与DNA、脂类、蛋白质等反应从而造成细胞损伤[3-4]。正常情况下,植物体内的活性氧物质主要通过抗氧化剂和抗氧化酶两者协同清除;在逆境胁迫下,植物体内的活性氧数量剧增,植物的抗氧化酶活性迅速升高,对清除活性氧起到重要的应激反应,成为环境胁迫下应激反应的重要检测指标[5]。已有研究表明,Pb胁迫会导致羽扇豆(Lupinusluteuscv. Ventus)与豌豆(Pisumsativum)根部、水稻(Oryzasativa)植株、玉米(Zeamays)愈伤组织等活性氧的增加与抗氧化酶活性的增强[6]。另有研究表明,Pb胁迫会导致假俭草(Eremochloaophiuroides)、结缕草(Zoysiajaponica)、多年生黑麦草(Loliumperenne)等植物体内脯氨酸含量的升高[7-8]。脯氨酸的积累可以调节细胞内的渗透势,维持水分平衡,保护细胞内重要代谢活动所需的酶类活性,为植物适应逆境胁迫的基本特征之一[9]。
我国拥有丰富的草种质资源,但这些资源并没有得到充分的利用,造成了资源的严重浪费。禾本科牧草适应性强,耐刈耐牧耐栽培,是优良的水土保持、防风固沙的绿化植物,在草地生态系统中具有重要作用。钱海燕等[10]研究发现黑麦草对Cu、Zn污染土壤有一定的耐性及修复作用;Tamas和Kovacs[11]认为早熟禾(Poaspp.)对Pb的吸收富集能力较强。本研究选取多年生黑麦草、老芒麦(Elymussibiricus)、鹅观草(Roegneriakamoji)、披碱草(Elymusdahuricus)、高羊茅(Festucaelata)、长穗冰草(Agropyronelongatum)和鸭茅(Dactylisglomerata)等禾草作为试验材料,通过对其在Pb胁迫下的形态指标(株高、分蘖数、地上/地下生物量)与生理指标(脯氨酸含量、抗氧化酶活性)的测定与分析,筛选受损程度较轻及耐Pb性较强的材料,并掌握Pb胁迫下禾草的生理响应机制,另外,通过对Pb2+在禾草植株内富集转运的研究,筛选Pb富集能力较强的禾草,为Pb污染土壤植物修复中禾草的选择提供依据。
1材料与方法
1.1 试验材料
供试14份禾草种质材料由中国农业科学院北京畜牧兽医研究所提供,材料名称及来源见表1。供试土由壤土、草炭土和营养土按1∶1∶1均匀混合,其理化性质如下:pH 6.5,全氮2.8 g/kg,全钾19 g/kg,全磷6.7 g/kg,Pb含量3.37 mg/kg。
1.2 试验方法
1.2.1材料的培养与处理试验于2013年3-8月在中国农业科学院北京畜牧兽医研究所廊坊试验基地温室中进行。将壤土、草炭土和营养土(1∶1∶1)均匀混合后装入无孔塑料花盆(高20 cm,底径15 cm,口径20 cm),每盆装土1.5 kg。装土完成后,在盆中点入已发芽试验材料种子,每材料点播3盆,每盆25株,待长出两片真叶后进行间苗,每盆留苗15株。
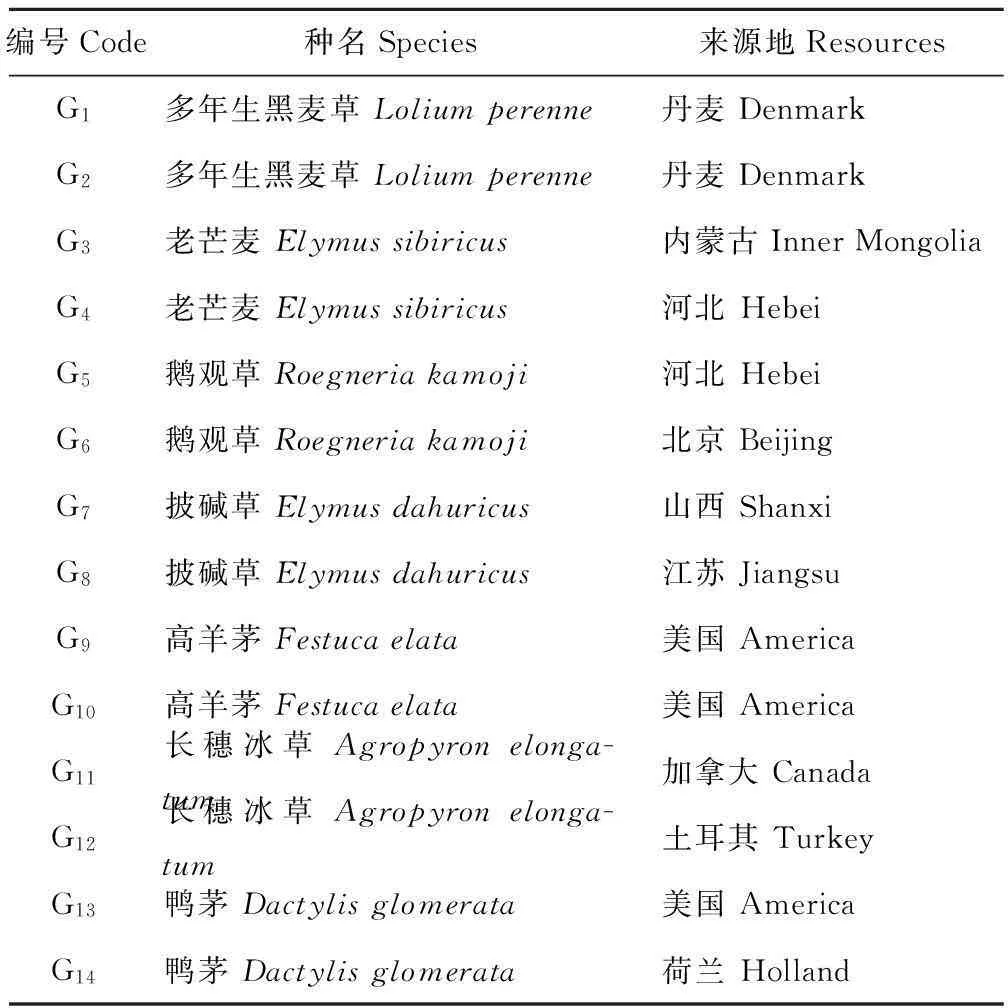
表1 试验材料及来源
间苗7 d后进行Pb处理,将硝酸铅Pb(NO3)2配制成一定浓度的溶液施入盆中。Pb处理共设置6个浓度梯度,0,10,50,100,200,300 mg/kg(风干土重),以纯Pb计,分别以CK、Pb10、Pb50、Pb100、Pb200和Pb300表示,每处理3个重复。Pb胁迫期间进行正常管理,定期定量浇水,以保持土壤含水量为最大持水量的70%。
Pb处理30 d后进行指标测定。
1.2.2生长指标的测定株高:用直尺测量植株地上部的垂直高度,以每盆中15株苗的平均值作为株高,精确到0.01 cm。相对株高=Pb处理植株的株高/对照植株的株高。
分蘖数:测定植株的分蘖,以每盆中15株苗的平均值作为分蘖数,精确到1个。相对分蘖数=Pb2+处理植株的分蘖数/对照植株的分蘖数。
地上与地下生物量:自来水冲洗下轻柔地将植株根部从土壤中分离并冲洗干净,蒸馏水冲洗干净后用剪刀将植株地上部与地下部分开,用纸包好后放入烘箱,105℃杀青30 min,之后70℃烘干至恒重(12 h)后进行称量。每盆15株苗地上部的总干重为地上生物量,地下部的总干重为地下生物量,精确到0.001 g。
1.2.3生理指标的测定分别从每个种中选择1份材料,共7份材料(G1、G3、G6、G7、G10、G12与G14)进行游离脯氨酸(Pro)含量、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性等生理指标的测定。Pro含量的测定参照李合生[12]的酸性茚三酮比色法, CAT活性的测定参照Dhindsa等[13]的紫外吸收法,POD活性的测定参照刘祖祺和张石城[14]的愈创木酚法, SOD活性的测定参照Cao等[15]的NBT光还原法。
1.2.4地上部与根部Pb2+含量的测定分别称取烘干磨细过0.5 mm筛的植株地上部与根部样品1.0 g于25 mL试管中,加入硝化液(5 mL浓硝酸、1 mL 60% 三氯乙酸、0.5 mL浓硫酸),90℃水浴硝解120 min,冷却后过滤,取50 μL滤液用超纯水定容至250 mL。利用美国热电公司的电感耦合等离子体发射光谱仪(ICP-MS)对Pb2+含量进行测定。
生物富集系数(bioconcentration factor, BCF)=植物地上或根系Pb2+积累浓度/土壤中Pb2+浓度[16];转运系数(translocation factor, TF)=地上部Pb2+积累浓度/根中Pb2+积累浓度[17];积累量=植物地上或根系Pb2+积累浓度×植物地上或根系生物量。
1.3 耐Pb性综合评价
利用株高、分蘖数、地上与地下生物量等生长指标,采用标准差系数赋予权重法[18]对14份禾草进行耐铅性综合评价。
1.4 数据处理
利用Microsoft Excel 2007软件进行数据统计分析和作图,采用SPSS 16.0软件的Duncan检验进行方差分析。
2结果与分析
2.1 Pb胁迫对禾草株高和分蘖数的影响
如表2所示,随Pb处理浓度的升高,14份材料的相对株高呈现先上升后下降的趋势。当Pb浓度为10,50,100 mg/kg时,分别有12,13和10份种质的相对株高高于对照,且最大增幅分别为15.2%,16.7%和19.6%,说明低浓度Pb对禾草的生长有促进作用。当Pb浓度增至300 mg/kg时,除G2外,其余各材料的株高明显低于对照,其中下降幅度最大的材料是来自河北木兰围场的鹅观草G5,降幅为29.9%。
在相同Pb浓度下,14份材料的相对分蘖数存在显著差异(P<0.05)。当Pb浓度为10 mg/kg时,供试材料相对分蘖数均显著高于对照,说明该浓度下,Pb对分蘖有促进作用。但随着Pb浓度的增加,相对分蘖数下降。在Pb浓度为300 mg/kg时,14份材料相对分蘖数均低于对照,其中降幅最大的是来自河北赤城的老芒麦G4,与对照相比下降了67.6%。

表2 Pb胁迫对相对株高和相对分蘖数的影响
注:F值表示材料间差异显著(P<0.05)。下同。
Note: TheFvalue show significant difference at the 0.05 level. The same as below.
2.2 Pb胁迫对禾草地上和地下生物量的影响
当Pb处理浓度为10 mg/kg时,有9份材料的相对地上生物量高于对照(表3)。随着Pb浓度的增加,各材料相对地上生物量逐渐降低,当Pb浓度增至300 mg/kg时,14份材料相对地上生物量与对照相比下降幅度为10.7%~45.7%,其中来自荷兰的鸭茅G14降幅最小,来自江苏丰县的披碱草G8降幅最大。
从表3可以看出,Pb浓度越大,14份材料相对地下生物量越低。当Pb浓度为100 mg/kg时,除G8外,其他材料的相对地下生物量均呈明显下降趋势,各材料间相对地上生物量存在显著差异(P<0.05)。当Pb浓度为300 mg/kg时,相对地下生物量降幅最大的是来自丹麦的多年生黑麦草G2,其次是来自加拿大的长穗冰草G11,分别比对照下降了61.0%和57.7%。
2.3 14份禾草耐Pb性综合评价
利用标准差系数赋予权重法对14份禾草的耐Pb性进行排序(表4),结果发现不同种之间以及同一种的不同来源地之间均存在差异,14份禾草的耐Pb性不存在种特异性。耐Pb性由强到弱排序为:G12>G9>G6>G3>G10>G13>G1>G8>G4>G11>G7>G14>G2>G5。来自于土耳其的长穗冰草G12耐Pb性最强,来自于河北的鹅观草G5耐Pb性最弱。
2.4 Pb胁迫对脯氨酸含量的影响
由图1可知,当Pb处理浓度为0时,鹅观草(G6)、高羊茅(G10)、长穗冰草(G12)、鸭茅(G14)叶片中脯氨酸含量均小于1 μg/g,多年生黑麦草(G1)、老芒麦(G3)、披碱草(G7)均大于1 μg/g,这可能是由于材料自身的差异造成的。7份材料叶片中脯氨酸含量均随着Pb浓度的增加而升高,当Pb浓度为300 mg/kg时,各材料脯氨酸含量与对照相比显著增加,鸭茅(G14)的增幅最大,较对照增长78.2倍,多年生黑麦草(G1)增幅最小,较对照增长28.3%。

表3 Pb胁迫对相对地上和地下生物量的影响

表4 14份禾草的耐铅系数、隶属函数值及综合评价D值
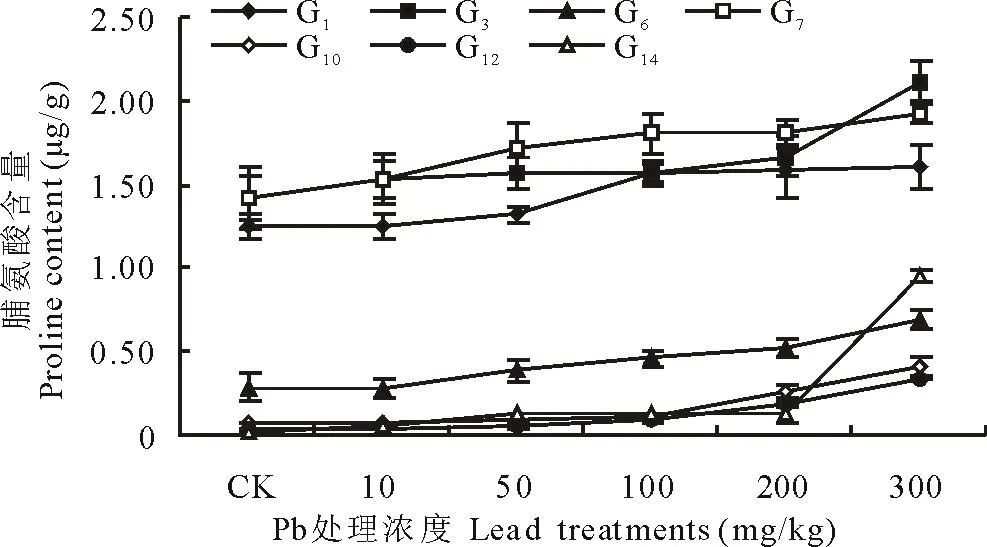
图1 Pb胁迫对禾草脯氨酸含量的影响Fig.1 The effects of lead stress on proline content of forage grasses
2.5 Pb胁迫对CAT活性的影响
由图2可知,随着Pb处理浓度的增加,各材料叶片中CAT活性呈现下降趋势。当Pb浓度为50 mg/kg时,多年生黑麦草(G1)、高羊茅(G10)、长穗冰草(G12)、鸭茅(G14)等4份材料的CAT活性较对照显著下降(P<0.05),降幅均大于50%。当Pb浓度为300 mg/kg时,7份材料CAT活性较对照均显著下降(P<0.05),降幅为69.9%~88.8%,多年生黑麦草(G1)的降幅最大(88.8%),鹅观草(G6)的降幅最小(69.9%)。
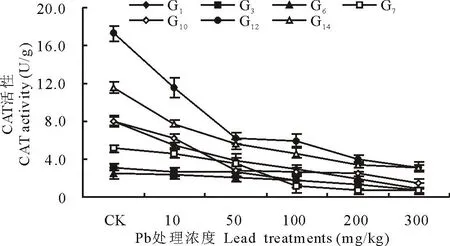
图2 Pb胁迫对禾草CAT活性的影响Fig.2 The effects of lead stress on CAT activity of forage grasses
2.6 Pb胁迫对POD活性的影响
由图3可以看出,随着Pb处理浓度的增加,7份材料的POD活性大体上都呈现出先上升后下降的趋势。其中,多年生黑麦草(G1)、老芒麦(G3)、鹅观草(G6)、长穗冰草(G12)和鸭茅(G14)等5份材料的POD活性在Pb浓度为100 mg/kg时达到峰值,披碱草(G7)与高羊茅(G10)则在Pb浓度为10 mg/kg时达到峰值。当Pb浓度为300 mg/kg时,披碱草(G7)与长穗冰草(G12)的POD活性仍旧高于对照,分别高于对照10.0%与3.9%,其余5份材料的POD活性均低于对照,与对照相比,5份材料POD活性的降幅为0~15.2%,多年生黑麦草(G1)降幅最大(15.2%)。
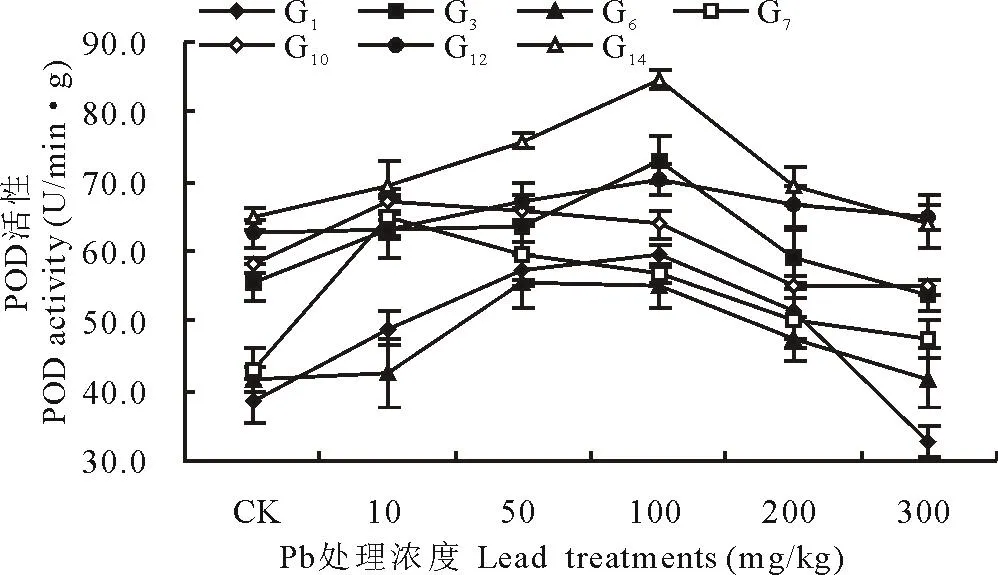
图3 Pb胁迫对禾草POD活性的影响Fig.3 The effects of lead stress on POD activity of forage grasses
2.7 Pb胁迫对SOD活性的影响
由图4可以看出,随着Pb处理浓度的升高,7份材料叶片中SOD活性呈现先上升后下降的趋势。多年生黑麦草(G1)、老芒麦(G3)、披碱草(G7)、高羊茅(G10)和鸭茅(G14)等5份材料在Pb浓度为50 mg/kg时达到峰值,其增幅为对照的24.6%~108.9%,披碱草(G7)的增幅最高(108.9%)。鹅观草(G6)和长穗冰草(G12)在Pb浓度为100 mg/kg时达到峰值,与对照相比,其增幅分别为95.7%和46.1%,均显著高于对照(P<0.05)。当Pb浓度为300 mg/kg时,7份材料的SOD活性仍均高于对照,高出比例为1.7%(鸭茅)~49.6%(披碱草)。

图4 Pb胁迫对禾草SOD活性的影响Fig.4 The effects of lead stress on SOD activity of forage grasses
2.8 不同Pb处理浓度下14份供试材料的富集系数和转移系数的变化
14份禾本科牧草体内Pb2+含量随着Pb处理浓度的升高而增加(表5)。在相同Pb处理浓度下,除披碱草G7和G8外,其余材料根部Pb2+含量明显高于叶片,说明禾本科牧草吸收Pb2+主要集中在根部,很少可以运输到地上部。各材料根与地上部富集系数(BCF)随着Pb处理浓度的升高而显著下降(P<0.05),根下降的幅度更大。
各禾本科牧草的转移系数(TF)由材料不同而表现出不同的趋势。披碱草(G7与G8)的TF随着Pb处理浓度的升高表现出先降低后升高再降低的趋势,当Pb处理浓度为200 mg/kg时,G7与G8的TF达到最大值且均大于1,分别为1.04与1.02;其他材料的TF则随着Pb处理浓度的升高而逐渐降低,且TF均小于1。
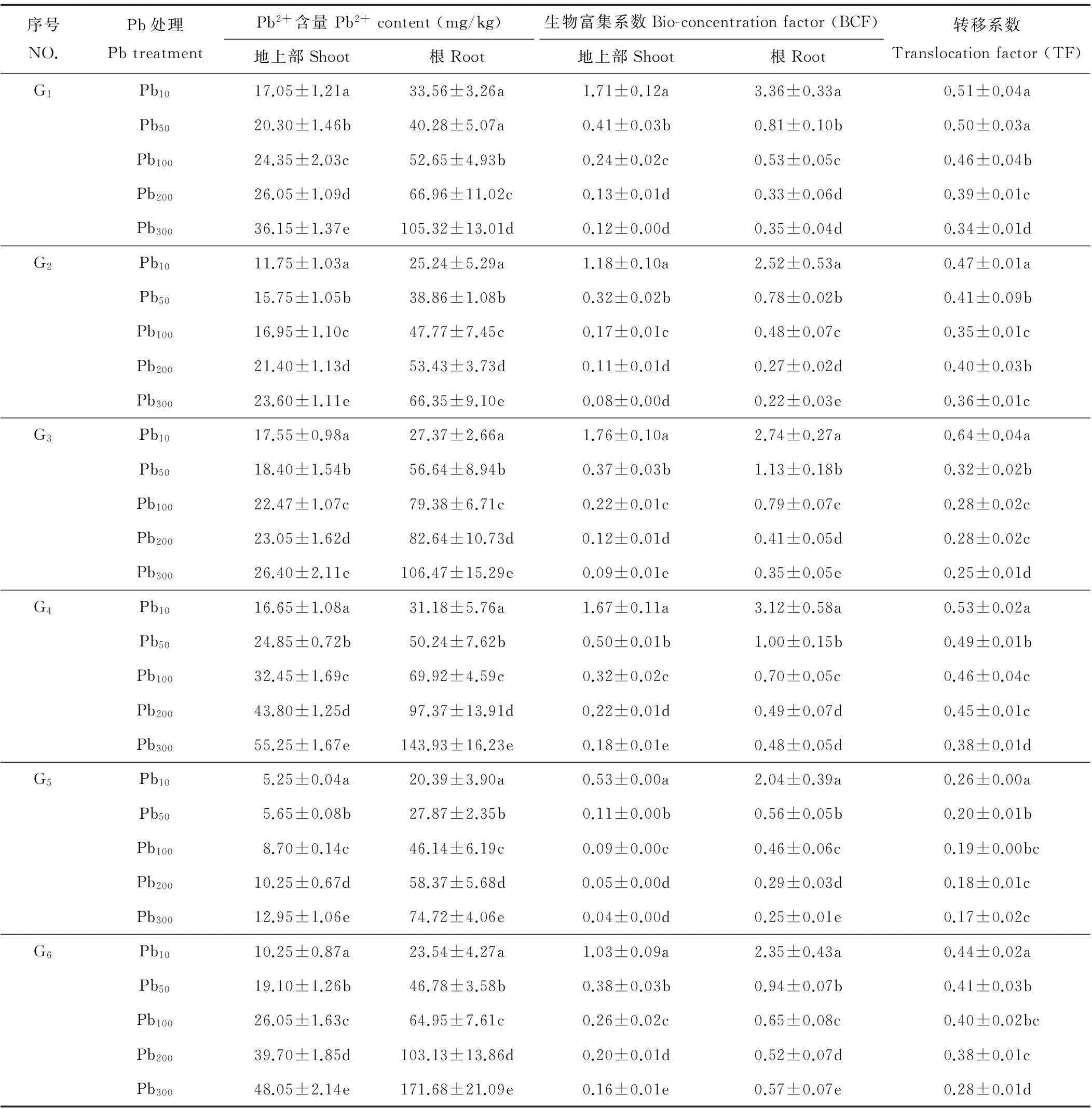
表5 Pb胁迫对禾本科牧草根和地上部中Pb2+含量的分布
续表5Continued

序号NO.Pb处理PbtreatmentPb2+含量Pb2+content(mg/kg)地上部Shoot根Root生物富集系数Bio-concentrationfactor(BCF)地上部Shoot根Root转移系数Translocationfactor(TF)G7Pb1027.45±1.63a32.73±4.17a2.75±0.16a3.27±0.42a0.84±0.04dPb5045.55±1.08b56.15±4.73b0.91±0.02b1.12±0.09b0.81±0.02ePb10064.10±2.16c73.42±6.29c0.64±0.02c0.73±0.06c0.87±0.03cPb20092.75±4.72d89.36±5.40d0.46±0.02d0.45±0.03d1.04±0.08aPb30094.23±6.51e96.74±10.32e0.31±0.02e0.32±0.03e0.97±0.06bG8Pb1028.60±1.81a39.54±1.92a2.86±0.18a3.95±0.19a0.72±0.08cPb5033.51±1.25b54.59±6.24b0.67±0.03b1.09±0.12b0.61±0.02dPb10058.37±2.03c63.87±4.78c0.58±0.02c0.64±0.05c0.91±0.04bPb20079.62±2.74d78.12±6.13d0.40±0.01d0.39±0.03d1.02±0.04aPb30093.84±5.19e90.57±8.56e0.31±0.02e0.30±0.03e1.00±0.06aG9Pb1015.30±1.15a25.75±3.46a1.53±0.12a2.58±0.35a0.59±0.03aPb5019.30±1.24b43.81±5.93b0.39±0.02b0.88±0.12b0.44±0.02bPb10023.05±1.51c61.35±7.11c0.23±0.02c0.61±0.07c0.38±0.02cPb20035.60±1.02d97.47±10.25d0.18±0.01d0.49±0.05d0.37±0.01cdPb30049.10±2.63e141.32±11.37e0.16±0.01d0.47±0.04d0.35±0.02dG10Pb1010.15±0.58a23.34±3.14a1.02±0.06a2.33±0.31a0.43±0.02aPb5017.70±0.91b45.52±5.69b0.35±0.02b0.91±0.11b0.39±0.02bPb10022.35±1.74c73.05±5.83c0.22±0.02c0.73±0.06c0.31±0.03cPb20032.60±1.30d102.80±9.28d0.16±0.01d0.51±0.05d0.32±0.01cPb30052.85±2.26e179.50±15.02e0.18±0.01d0.60±0.05e0.29±0.02dG11Pb1013.35±1.01a34.82±4.33a1.34±0.10a3.48±0.43a0.38±0.02aPb5014.25±1.37b55.24±2.78b0.29±0.03b1.10±0.06b0.26±0.05bPb10018.95±2.02c79.87±6.19c0.19±0.02c0.80±0.06c0.24±0.03cPb20025.90±2.15d116.26±12.06d0.13±0.01d0.58±0.06d0.22±0.01cPb30030.20±1.87e183.82±20.47e0.10±0.01e0.61±0.07e0.16±0.02dG12Pb1011.20±0.62a23.87±4.38a1.12±0.06a2.39±0.44a0.47±0.01aPb5018.25±1.03b48.35±7.21b0.37±0.02b0.97±0.14b0.38±0.01bPb10023.05±1.47c69.37±8.76c0.23±0.01c0.69±0.09c0.33±0.02cPb20026.30±1.83d85.97±5.47d0.13±0.01d0.43±0.03d0.31±0.03dPb30032.70±2.08e113.72±8.95e0.11±0.01e0.38±0.03e0.29±0.02eG13Pb1011.35±1.01a21.93±1.22a1.14±0.10a2.19±0.12a0.52±0.06aPb5014.20±0.74b39.15±3.56b0.28±0.01b0.78±0.07b0.36±0.02bPb10015.75±1.26c47.64±2.17c0.16±0.01c0.48±0.02c0.33±0.05bPb20017.90±1.53d58.29±7.03d0.09±0.01d0.29±0.04d0.31±0.02cPb30029.40±1.79e133.97±10.78e0.10±0.01d0.45±0.04e0.22±0.03dG14Pb108.70±0.34a18.86±2.03a0.87±0.03a1.89±0.20a0.46±0.02aPb5013.70±0.95b31.33±2.76b0.27±0.02b0.63±0.06b0.44±0.03bPb10019.80±1.23c57.96±6.14c0.20±0.01c0.58±0.06c0.34±0.02cPb20022.05±1.16d82.73±9.73d0.11±0.01d0.41±0.05d0.27±0.01dPb30033.90±1.87e153.52±11.25e0.11±0.01d0.51±0.04e0.22±0.02e
注:不同小写字母表示各材料不同浓度间差异显著(P<0.05)。
Note: Different small letters show significant difference between different concentration for each material (P<0.05).
3讨论与结论
Pb是一种有毒的重金属元素,外源重金属铅污染物进入土壤后,禾本科牧草可通过根系吸收土壤中的铅,进而运输到地上部分。Pb在植物体内的过度积累会导致根系受损、分蘖减少、地上部生长减缓[19]。本研究中,随着Pb处理浓度的增加,14份禾草的株高、分蘖数、地上生物量均呈现先升高后下降的趋势,地下生物量则呈现逐渐降低的趋势(G8除外)。可能是由于土壤中施入低浓度Pb(NO3)2后,Pb2+主要被根系吸收,使得根的生长受到抑制,而NO3-的施入提高了土壤肥力,从而使得地上部的生长受到促进;随着Pb(NO3)2施入浓度的增大,地上部积累的Pb2+也随之升高,地上部的生长也逐渐受到抑制,当Pb处理浓度为300 mg/kg时,14份禾草的生长均受到明显抑制。李西等[19]对假俭草、狗牙根(Cynodondactylon)、结缕草的研究表明,当Pb浓度为250 mg/kg时,3种草的生长均受到显著抑制,与本研究的结果基本一致。通过综合评价筛选出耐铅性最强的禾草为来自土耳其的长穗冰草G5。
植物体内游离脯氨酸含量的增加是植物对逆境胁迫的一种生理生化反应,脯氨酸作为细胞质渗透调节物质,具有稳定生物大分子结构的作用,植物通过体内游离脯氨酸的积累可防止细胞结构和功能受损以降低受伤害程度[7]。张呈祥等[20]研究发现当Pb浓度<100 mg/kg时,草地早熟禾(Poapratensis)体内的脯氨酸含量随着Pb浓度的增大持续升高,当Pb浓度>100 mg/kg时,脯氨酸含量逐渐下降。刘慧芹等[8]的研究表明,当Pb浓度<1000 mg/L时,多年生黑麦草体内的脯氨酸含量随着Pb浓度的增大而升高,当Pb浓度>1000 mg/L时,脯氨酸含量逐渐下降。本研究中,当Pb浓度<300 mg/kg时,7份禾草的脯氨酸含量均随着Pb处理浓度的增大而逐渐升高,表明在该浓度范围内7份禾草均可以通过脯氨酸含量的持续升高以缓解Pb对植物的毒害作用。
SOD、CAT和POD是控制植物体内活性氧积累的最主要的酶。SOD是活性氧防御体系的第一道防线,能歧化超氧阴离子自由基生成H2O2;CAT和POD又可以将H2O2歧化成无毒害的H2O和O2。李西等[19]研究发现,当Pb浓度为0~1000 mg/kg时,假俭草、狗牙根、结缕草的SOD、POD、CAT活性均随着Pb处理浓度的增大而逐渐升高。本研究中,随着Pb处理浓度的增大,7种禾草SOD与POD活性均先升高后降低,CAT活性则一直降低,表明SOD与POD在禾草体内超氧阴离子自由基的清除中发挥主要作用;当Pb浓度为100 mg/kg时,3种酶活性均处于降低状态,表明禾草体内活性氧的积累超出了自身的清除能力,此时大部分材料的地上与地下生物量均低于对照,生长受到抑制。
植物体内重金属含量与植株的生物量、品种的遗传特性、生长条件及土壤中Pb浓度的含量等因素直接相关[21]。本研究中,随着Pb处理浓度的升高,14份禾草地上部与根的富集系数逐渐降低,表明Pb胁迫的加剧降低了禾草对Pb的富集效率,另外,除披碱草(G7与G8)外,其余12份禾草的转移系数也呈现逐渐降低的趋势,并且转移系数均小于1,表明根是禾草富集Pb的主要器官,从根向地上部转移Pb的能力较弱,且会随着Pb胁迫的加剧更趋减弱。Pb超富集植物要求植株地上部Pb2+含量大于1000 mg/kg,地上部生物富集系数大于1,转移系数大于1,且在Pb污染土壤中能够生长良好,不会发生毒害现象[22]。本研究中,14份材料均未达到超富集植物的标准。披碱草(G7与G8)虽然在Pb处理浓度为200 mg/kg时的转移系数大于1,但其地上部Pb2+含量,地上部生物富集系数都远未达到超富集植物的标准。当Pb处理浓度为200和300 mg/kg时,G7与G8地上部Pb2+含量与转移系数均显著高于其他材料(P<0.05),说明其在高浓度Pb胁迫下具有较强的Pb吸收与富集转运能力,可作为Pb污染土壤修复的候选植物。
综合而言,来自土耳其的长穗冰草G5具有较强的耐Pb性,而披碱草G7与G8则具有较强的Pb富集转运能力,是否能将披碱草用于Pb污染土壤的生态修复还需要进一步的大田试验进行验证。
References:
[1]Qin T C, Wu Y S, Wang H X,etal. Effect of cadmium, lead and their interactions on the physiological and ecological characteristics of root system ofBrassicachinensis. Ecta Ecologica Sinica, 1998, 18(3): 320-325.
[2]Du L C. Lead-tolerant ecotypes and lead-tolerance mechanism of plant. Biology Teaching, 2007, 32(2): 2-3.
[3]Navari-lzzo F, Quartacci M F. Phytoremediation of metals-tolerance mechanisms against oxidative stress. Minerva Biotecnologica, 2001, 13(2): 73-83.
[4]Shah K, Kumar R G, Verma S,etal. Effect of cadmium on lipid peroxidation, superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings. Plant Science, 2001, 161(6): 1135-1144.
[5]Li X, Yue H, Wang S,etal. Research of different effects on activity of plant antioxidant enzymes. China Journal of Chinese Materia Medica, 2013, 38(7): 973-978.
[6]Reddy A M, Kumar S G, Jyothsnakumari G,etal. Lead induced changes in antioxidant metabolism of horsegram (Macrotylomauniflorum(Lam.) Verdc.) and bengalgram (Cicer arietinum L.). Chemosphere, 2005, 60(1): 97-104.
[7]Xie C J, Yang J H, Zhou S B,etal. Effects on physiological characteristics ofEremochloaophiuroidesandZoysiajaponicaunder progressive lead stress. Acta Prataculturae Sinica, 2008, 17(4): 65-70.
[8]Liu H Q, Han J C, Liu H P,etal. Influence of lead stress on the physiological and biochemical characteristics of perennial ryegrass (Loliumperenne) seedlings. Acta Prataculturae Sinica, 2012, 21(6): 57-63.
[9]Ji Y, Zhang X Q, Peng Y,etal. Effects of drought stress on lipid peroxidation, osmotic adjustment and activities of protective enzymes in the roots and leaves of orchardgrass. Acta Prataculturae Sinica, 2014, 23(3): 144-151.
[10]Qian H Y, Wang X X, Jiang P L,etal. The endurance and the restorative effect of coatinuous stubbles ryegrass on Cu and Zn pollution in soil. Acta Agriculturae Universitatis Jiangxiensis, 2004, 26(5): 801-804.
[11]Tamas J, Kovacs A. Vegetation pattern and heavy metal accumulation at a mine tailing at Gyongyosoroszi, Hungary. Zeitschrift fur Naturforschung Section C, 2005, 60(3-4): 362-367.
[12]Li H S. Plant Physiology and Biochemistry Experimental Principles and Techniques[M]. Beijing: Higher Education Press, 2002: 258-261.
[13]Dhindsa R S, Dhindsa P P, Thorpe T A. Leaf senescence: correlated with increased levels of membrane permeability and lipid peroxidation and decreased levels of superoxide dismutase and catalase. Journal of Experimental Botany, 1981, 32(1): 93-101.
[14]Liu Z Q, Zhang S C. Resistance Physiology of Plant[M]. Beijing: China Agriculture Press, 1994: 370-372.
[15]Cao Y, Zhang Z W, Xue L W,etal. Lack of Salicylic acid inArabidopsisprotects plants against moderate salt stress. Zeitschrift fur Naturforschung Section C, 2009, 64(3-4): 231.
[16]Chamberlain A C. Fallout of lead and uptake by crops. Atmospheric Environment, 1983, 17: 693-706.
[17]Baker A J M, Reeves R D, Hajar A S M. Heavy metal accumulation and tolerance in British populations of the metal lophyte Thlaspicaerulescens J&C. Presl (Brassicaceae). New Phytologist, 1994, 127: 61-68.
[18]Li Y, Liu G B, Gao H W,etal. A comprehensive evaluation of salt-tolerance and the physiological response ofMedicagosativaat the seedling stage. Acta Prataculturae Sinica, 2010, 19(4): 79-86.
[19]Li X, Wu Y J, Sun L X. Growth and physiological responses of three warm-season turfgrasses to lead stress. Acta Prataculturae Sinica, 2014, 23(4): 171-180.
[20]Zhang C X, Chen W F, Pei H C. Responses of Kentucky bluegrass to lead stress and accumulation characteristics of lead. Chinese Journal of Grassland, 2013, 35(1): 96-101.
[21]Zhao X L, Liu X. Differences in plant growth, Cd and nutrient uptake, Cd translocation between two tobacco cultivars under Cd stress. Journal of Soil and Water Conservation, 2009, 23(1): 117-121.
[22]Wang S L, Liao W B, Yu F Q. Hyperaccumulation of lead, zinc, and cadmium in plants growing on a lead/zinc outcrop in Yunnan Province, China. Environmental Geology, 2009, 58(3): 471-476.
参考文献:
[1]秦天才, 吴玉树, 王焕校, 等. 镉、铅及其相互作用对小白菜根系生理生态效应的研究. 生态学报, 1998, 18(3): 320-325.
[2]杜连彩. 植物耐铅生态型及对铅胁迫的耐性机理. 生物学教学, 2007, 32(2): 2-3.
[5]李璇, 岳红, 王升, 等. 影响植物抗氧化酶活性的因素及其研究热点和现状. 中国中药杂志, 2013, 38(7): 973-978.
[7]谢传俊, 杨集辉, 周守标, 等. 铅递进胁迫对假俭草和结缕草生理特性的影响. 草业学报, 2008, 17(4): 65-70.
[8]刘慧芹, 韩巨才, 刘慧平, 等. 铅梯度胁迫对多年生黑麦草幼苗生理生活特性影响. 草业学报, 2012, 21(6): 57-63.
[9]季杨, 张新全, 彭燕, 等. 干旱胁迫对鸭茅根、叶保护酶活性、渗透物质含量及膜质过氧化作用的影响. 草业学报, 2014, 23(3): 144-151.
[10]钱海燕, 王兴祥, 蒋佩兰, 等. 黑麦草连茬对铜、锌污染土壤的耐性及其修复作用. 江西农业大学学报, 2004, 26(5): 801-804.
[12]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2002: 258-261.
[14]刘祖祺, 张石城. 植物抗性生理学[M]. 北京: 中国农业出版社, 1994: 370-372.
[18]李源, 刘贵波, 高洪文, 等. 紫花苜蓿种质耐盐性综合评价及盐胁迫下的生理反应. 草业学报, 2010, 19(4): 79-86.
[19]李西, 吴亚娇, 孙凌霞. 铅胁迫对三种暖季型草坪草生长和生理特性的影响. 草业学报, 2014, 23(4): 171-180.
[20]张呈祥, 陈为峰, 裴洪翠. 草地早熟禾对铅的胁迫反应及积累特性. 中国草地学报, 2013, 35(1): 96-101.
[21]赵秀兰,刘晓. 同品种烟草生长和镉及营养元素吸收对镉胁迫响应的差异.水土保持学报, 2009, 23(1): 117-121.
李慧芳,王瑜,袁庆华,赵桂琴. 铅胁迫对禾本科牧草生长、生理及Pb2+富集转运的影响. 草业学报, 2015, 24(9): 163-172.
LI Hui-Fang, WANG Yu, YUAN Qing-Hua, ZHAO Gui-Qin. Effects of lead stress on growth, physiology, and lead ion accumulation and transportation in gramineous forages. Acta Prataculturae Sinica, 2015, 24(9): 163-172.
通讯作者*Corresponding author. E-mail:yuanqinghua@hotmail.com
作者简介:李慧芳(1987-),女,山西忻州人,在读硕士。 E-mail:lhf523-dxxz@163.com
基金项目:十二五国家科技支撑计划课题(2011BAD17B01),国家牧草产业体系(岗位专家)项目(CARS-35)和中国农业科学院北京畜牧兽医研究所基本科研业务费项目(2014ywf-zd-2)资助。
收稿日期:2014-07-03;改回日期:2015-02-26
DOI:10.11686/cyxb2014303http://cyxb.lzu.edu.cn
