多巴胺D5受体通过抑制氧化应激对扩张型心肌病的调节作用
2016-01-28王子皓胡永艳王文洁姜晓亮杨志伟
王子皓,胡永艳,王文洁,董 伟,姜晓亮,刘 星,杨志伟
(中国医学科学院北京协和医学院医学实验动物研究所,北京 100021)
多巴胺D5受体通过抑制氧化应激对扩张型心肌病的调节作用
王子皓,胡永艳,王文洁,董伟,姜晓亮,刘星,杨志伟
(中国医学科学院北京协和医学院医学实验动物研究所,北京100021)
【摘要】目的探讨多巴胺D5受体是否会通过抑制氧化应激来影响扩张型心肌病(dilated cardiomyopathy)的发生发展。 方法 建立心脏特异表达人多巴胺D5受体突变基因F173L(α-MHC-hD5F173L)和正常基因(α-MHC-hD5WT)转基因小鼠。用3月龄小鼠,首先检测比较转基因小鼠心脏内ROS的产量和NOX2的表达量。然后对α-MHC-hD5F173L小鼠通过皮下给NADPH氧化酶的抑制剂罗布麻宁(Apocynin)4周,同时给PBS作为对照组,然后检测各项心肌病相关指标。同时构建人多巴胺D5受体突变基因(hD5F173L)和正常多巴胺D5受体基因(hD5WT)的大鼠心肌细胞(H9C2),检测两者在基础条件下ROS产量的变化。 结果 α-MHC-hD5F173L转基因小鼠的NADPH氧化酶的活性和NOX2蛋白的表达量均明显高于野生型α-MHC-hD5WT 小鼠,罗布麻宁能显著改善α-MHC-hD5F173L转基因小鼠的心脏功能。H9C2-hD5F173L大鼠细胞系NOX2的表达量及ROS产量高于H9C2- hD5WT对照细胞。 结论 多巴胺D5受体可能通过抑制氧化应激而防止扩张型心肌病的发生发展。
【关键词】扩张型心肌病;多巴胺D5受体;活性氧
扩张型心肌病(dilated cardiomyopathy,DCM)是一种以心腔扩大、心肌收缩功能障碍为主要特征的心肌疾病[1-2]。其发病的原因复杂,包括特发性、家族或遗传性、病毒感染和(或)免疫性、酒精性或中毒性等,但最终的临床表现相似,如出现神经激素的激活及心力衰竭等[3]。研究证明,许多不同的信号传导通路都和扩张型心肌病有关系[4-7],而其中的一些信号通路又和活性氧(ROS)的产生有着密切的联系。同时越来越多的研究表明,氧化应激在扩张型心肌病的发生发展中起着重要的作用[4-9]。
NADPH氧化酶是心血管系统ROS的主要来源[10]。NADPH氧化酶由6部分组成:细胞膜多肽p22phox、gp91phox,细胞浆多肽P40phox、p47phox和p67phox,小分子G蛋白rac1或rac2。多个亚型的Nox (NAD(P)H oxidase)被发现,包括Nox 1, Nox 2, Nox 3, Nox 4, Nox 5,其分子量类似gp91phox,为65×103[11]。NOX4主要在血管平滑肌和肾脏细胞内表达[12],NOX2主要在心脏内表达[13]。
多巴胺受体是一种G蛋白偶联受体,包括D1类和D2类受体。D1类受体包括D1受体和D5受体,该类受体增强腺苷酸环化酶(adenylyl cyclase,AC)活性,增加第二信使cAMP的产生。D2类受体包括D2、D3和D4,该类受体抑制AC活性[14]。前期的研究发现,D5受体基因敲除(D5-/-)小鼠血压明显升高,心脏重量增加、心肌肥厚[15-17]。全身表达hD5F173L (CMV-hD5F173L) 基因的转基因小鼠与CMV-hD5WT对照小鼠相比, CMV-hD5F173L小鼠肾脏的NADPH氧化酶的活性和ROS的产生量显著高于野生对照组,同时,3月龄开始血压升高,4月龄开始左心室肥厚[18]。因此,我们建立了心脏特异表达人多巴胺hD5F173L基因小鼠,发现该转基因小鼠出现典型扩张型心肌病的表型[19]。因此,在此基础上,我们对多巴胺D5受体通过氧化应激在心脏肥大发生、发展过程中的作用机制进行研究。
1材料和方法
1.1实验动物
SPF级C57BL/6J小鼠雌雄各15只,体重16~25 g,SPF级雄性ICR小鼠10只,雌性ICR小鼠20只,体重18~26 g,均购自北京华阜康生物科技股份有限公司【SCXK(京)2014-0004】;饲养在中国医学科学院医学实验动物研究所【SYXK(京)2014-0029】,实验中涉及动物的操作程序已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准【ILAS-PG-2014-005】。
1.2转基因小鼠构建及动物试验
将hD5FL173L或hD5WT基因插入心脏特异表达的α-MHC启动子下游,构建α-MHC-hD5FL173L或α-MHC-hD5WT转基因表达载体。用显微注射法将线性化的转基因表达载体注射到C57BL/6J小鼠的受精卵中,转入受体假孕ICR小鼠中,小鼠出生14 d提取基因组 DNA,用PCR鉴定α-MHC-hD5FL173L或α-MHC-hD5WT转基因小鼠的基因型。
为了验证NADPH氧化酶在转基因小鼠心肌扩张中的作用,我们用3月龄小鼠,通过皮下持续给ANDPH氧化酶的抑制剂Apocynin(SIGMA),同时给PBS作为对照组。连续皮下注射给药4周后(1 mmol/kg/day),对小鼠超声检查,最后处死小鼠,取心脏称重,并取同部分心肌组织用于ADPH氧化酶的活性和蛋白表达的测定。
1.3细胞培养和D5受体基因转染
将人D5受体正常基因hD5WT或突变基因hD5F173L 的全cDNA在EcoRI和Xbal之间插入到pcDNA6/V5-His质粒,然后用LT1转染试剂将人D5受体cDNA转染到H9C2细胞(H9C2-hD5WT和H9C2-hD5F173L)。用免疫印迹检测转染细胞内His/V5的表达确定转染是否成功。
1.4超声检查
使用VisualSonics,Vevo770(加拿大),高分辨率小动物超声系统,将3月龄的阳性转基因小鼠及同龄野生型对照小鼠腹腔注射三溴乙醇(0.18 mL/10 g体重,250 mg/kg)麻醉。待小鼠麻醉完成后,用脱毛膏涂于左胸,静待1 min,用卫生纸将毛擦去。毛脱不净影响超声的清晰度。固定小鼠仰卧位,用医用胶条将四肢固定于导电块上,在4个导电块涂上导电胶,用于分析心电图、心率及呼吸等参数。胸部涂上耦合剂,超声检测。
1.5NADPH氧化酶活性测定
用二氯荧光素醋酸盐(2′,7′- dichlorodihydrofluorescein diacetate,DCFDA)荧光法测定分别转染了人多巴胺D5受体突变基因F173L和正常人多巴胺D5受体基因的大鼠心肌细胞(H9C2)NADPH氧化酶的活性。将H9C2细胞培养于96孔板中,先使用NADPH氧化酶的抑制剂二苯基碘(DPI,10 mmol/L/30 min)(Sigma)处理,用Hanks平衡盐溶液洗涤一次,然后加入DCFDA(10 mmol/L), 37℃,孵育30 min;用酶标仪(Sigma)在激发光485 nm和射出光530 nm波长的情况记录荧光强度。小鼠心脏组织的NADPH 氧化酶的活性是利用光泽精化学发光法(lucigenin chemiluminescence)测定[17]。
1.6免疫印迹
提取小鼠心脏和转染人D5受体的大鼠心肌细胞(H9C2)全蛋白,通过免疫印迹的方法检测Nox2 (1:500,Epitomics)[20],并以GAPDH作为参照内参。
1.7统计学方法
数据用SPSS统计软件处理,计量数据以平均值±标准误(X±SE)的形式表示,二组样本间的比较用t 检验,3 组及以上样本的比较用One -Way ANOVA 统计分析方法,以P< 0.05为差异有统计学意义。
2结果
2.1α-MHC-hD5F173L和α-MHC-hD5WT转基因小鼠心脏内NADPH氧化酶活性和蛋白表达水平
分别利用光泽精化学发光法和免疫印迹方法检测转基因小鼠心脏内NADPH氧化酶的活性及其NOX2蛋白的表达,发现心脏特异表达人D5受体基因突变α-MHC-hD5F173L转基因小鼠的NADPH氧化酶的活性和NOX2蛋白的表达均明显高于野生型α-MHC-hD5WT 小鼠(图1A, 1B).

图1 α-MHC-hD5F173L和α-MHC-hD5WT转基因小鼠心脏NADPH氧化酶活性及NOX2蛋白的表达水平 (*P < 0.05 vs. α-MHC-hD5WT,n=12)Fig.1 NADPH oxidase activity and NOX2 expression in the heart of α-MHC-hD5F173L and α-MHC-hD5WT mice (*P < 0.05 vs. α-MHC-hD5WT,n=12)
2.2Apocynin作用于α-MHC-hD5FL173L转基因小鼠后心脏结构和功能的变化
我们以前的研究发现,α-MHC-hD5FL173L转基因小鼠心脏收缩期和舒张期左室内径均增加,收缩期和舒张期容积显著增大,射血分数及短轴缩短率减少。病理学观察显示心腔明显大于野生型,心室壁明显变薄,心肌细胞不均匀肥大,心肌间质纤维增多[19]。因此,我们使用NADPH氧化酶特异性抑制剂Apocynin (1 mmol/kg/day),通过皮下持续给以α-MHC-hD5FL173L转基因小鼠4周,发现Apocynin给药组小鼠心脏扩张明显改善(图2),心脏收缩期和舒张期容积减小(图3A),收缩期和舒张期左室内径减小(图3B),心脏体积相对减小(图3C),射血分数及短轴缩短率增加(图3D,3E),即心脏功能改善。

图2 α-MHC-hD5FL173L转基因小鼠分别注射生理盐水和罗布麻宁后心脏的M超声分析Fig.2 M-mode echocardiography of α-MHC-hD5FL173L mice heart injected with saline and Apocynin
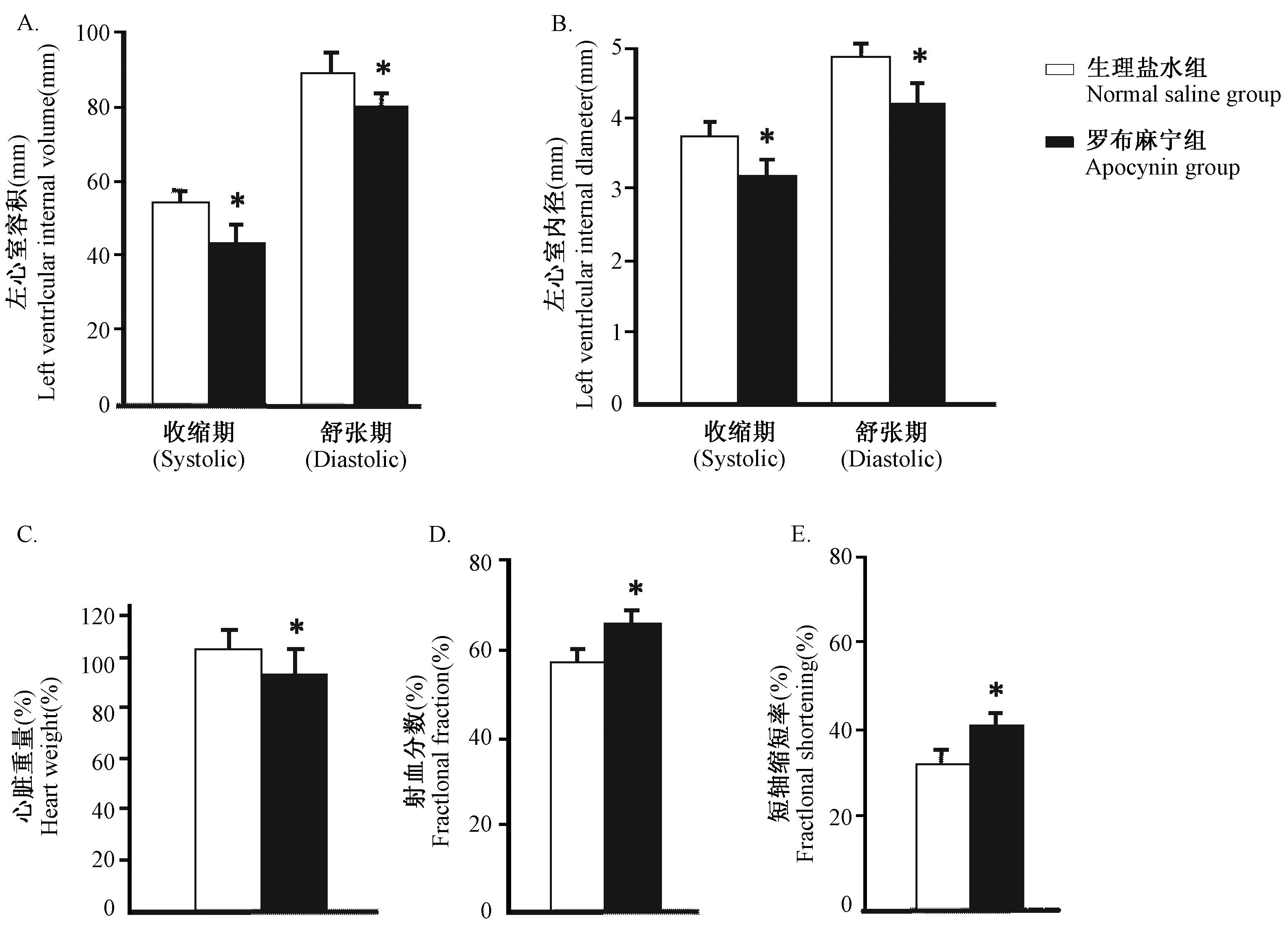
图3 A-E:α-MHC-hD5FL173L转基因小鼠心脏功能的超声心电图分析(*P < 0.05 vs. saline treatment,n=10)Fig.3 A-E: Echocardiographic analysis of α-MHC-hD5FL173L mice cardiac function(*P < 0.05 vs. saline treatment,n=10)

图4 H9C2-hD5F173L和H9C2-hD5WT细胞内NADPH氧化酶的活性和NOX2蛋白的表达(*P < 0.05 vs.H9C2-D5WT,n=5) Fig.4 NADPH oxidase activity and NOX2 expression in H9C2-hD5F173L and H9C2-hD5WT cells (*P < 0.05 vs.H9C2-D5WT,n=5)
2.3H9C2-hD5F173L和H9C2-hD5WT细胞内NADPH氧化酶的活性和蛋白的表达水平
为了进一步验证多巴胺D5受体在心脏内对氧化应激的调解作用,我们将hD5F173L和hD5WT转染到H9C2细胞内。因D5受体具有持续活性的特点,即D5受体在没有多巴胺或激动剂作用的情况下仍具有功能活性[17]。因此,我们检测了转染细胞基础条件下NADPH氧化酶的活性和蛋白表达。研究发现,H9C2-hD5F173L细胞内NADPH氧化酶的活性和NOX2蛋白的表达均高于H9C2-hD5WT细胞(图4A,4B)。
3讨论
研究发现,转人多巴胺D5受体突变基因hD5F175L心脏特异表达小鼠出现扩张型心肌病表型,心脏功能减弱,同时伴有心脏NADPH氧化酶活性和蛋白的表达增加。NADPH氧化酶抑制剂减轻了该疾病表型,改善了心脏功能。转染hD5F173L基因的心肌细胞,在基础状态下,其NADPH氧化酶活性和蛋白的表达均显著高于转染正常hD5WT基因的细胞。一些临床数据表明抗氧化剂对于扩张型心肌病的治疗是有效的,如辅酶Q10、洋地黄、卡维地洛等[21-24]。因此可证明多巴胺D5 受体通过调节NADPH氧化酶的活性及ROS的产生来影响心脏的结构和功能。
临床研究表明ROS的产生在许多心脏疾病的发生发展中起着重要作用[25-26]。ROS包括含氧自由基、氧的非自由基衍生物、对氧化物、氢过氧化物、脂质过氧化物等[27]。生理情况下,化学及代谢来源的ROS对机体起到有益作用,但在电离辐射、紫外线照射或抗氧化能力降低的情况下,机体内将产生大量的ROS自由基及脂质过氧化物等,使体内氧化和抗氧化平衡失调,导致ROS连锁反应,引起不同程度细胞毒性反应,并造成膜脂质、蛋白质和DNA的氧化损伤,进而引起心肌细胞的凋亡、衰老以致心力衰竭的发生。NADPH氧化酶家族是心血管系统ROS的主要来源,NOX2在小鼠和人的心脏衰竭进展中起到了一定的促进作用,减少NOX2的表达能防止氧化应激而保护心肌细胞[19]。
研究表明,心肌中的NADPH氧化酶是产生ROS的主要来源,ROS可激活一系列下游信号,对细胞外因子产生应答。其介导的信号通路包括:1)ROS-MAPKs信号通路。在哺乳类动物细胞内主要存在三条并行的MAPKs信号通路,即ERK(extracellularsignal-regulated kinase)、JNK/SAPK、p38MAPK。MAPK被双重特异性激酶激活后从胞浆移行至胞核,进而活化调控肥厚基因(ANP、BNP、α-SKA、ß-MHC)表达的转录因子[28]。研究发现,ROS是激活MAPKs重要的激活剂,心脏中ROS水平被抑制后,包括ERK1/2,JNK,P38在内的MAPKs磷酸化化水平明显下降,心肌肥厚减弱[29-30]。2)ROS-Ca2+信号通路。Ca2+是胞内重要的第二信使,参与下游多条信号通路,在细胞信号传导过程中起到重要的作用。ROS直接作用于钠钙交换蛋白,使得Ca2+大量内流,激活胞核基因进一步增加胞质蛋白的合成,导致心肌肥大[31-32]。但是,多巴胺D5受体并非是影响ROS产生的唯一通路,其调节心肌肥大的具体信号通路及作用机制还有待于进一步研究。
参考文献:
[1]Hughes SE, McKenna WJ. New insights into the pathology of inherited cardiomyopathy[J]. Heart 2005;91:257-264.
[2]Jefferies JL, Towbin JA. Dilated cardiomyopathy[J]. Lancet 2010;375:752-762.
[3]Houser SR, Margulies KB, Murphy AM,etal. Animal models of heart failure: a scientific statement from the American Heart Association[J]. Circ Res 2012;111:131-150.
[4]Baumgartner D, Scholl-Burgi S, Sass JO, et al.. 2007. Prolonged QTc intervals and decreased left ventricular contractility in patients with propionic acidemia[J]. J Pediatr. 150:192-197.
[5]Movahed MR, Saito Y. Lack of association between obesity and left ventricular systolic dysfunction[J]. Echocardiography. 2009. 26:128-132.
[6]Alameddine, F.M., Zafari, A.M. Genetic polymorphisms and oxidative stress in heart failure. Congest[J]. Heart Fail. 2002, 8, 157-164.
[7]Givertz, M.M. Colucci, W.S. New targets for heart-failure therapy: Endothelin, inflammatory cytokines, and oxidative stress[J]. Lancet 1998, 352, SI34-SI38.
[8]Kinugawa S, Tsutsui H, Hayashidani S,etal. Treatment with dimethylthiourea prevents left ventricular remodeling and failure after experimental myocardial infarction in mice: role of oxidative stress[J]. Circ Res. 2000;87:392-398.
[9]Engberding N, Spiekermann S, Schaefer A,etal. Allopurinol attenuates left ventricular remodeling and dysfunction after experimental myocardial infarction: a new action for an old drug[J]. Circulation. 2004;110:2175-2179.
[10]Cai H, Griendling KK, Harrison DG. The vascular NAD(P)H oxidases as therapeutic targets in cardiovascular diseases[J]. Trends Pharmacol Sci. 2003; 24(9): 471-418.
[11]Cheng G, Cao Z, Xu X,etal. Homologs of gp91phox: cloning and tissue expression of Nox3, Nox4, and Nox5[J]. Gene. 2001; 269: 131-140.
[12]Shiose A, Kuroda J, Tsuruya K,etal. A novel superoxide-producing NAD(P)H oxidase in kidney[J]. J Biol Chem. 2001; 276: 1417-1423.
[13]Piccoli C,Ria R,Scrima R,etal. Characterization of mitochondrial and extramitochondrial oxygen consuming reaction in human hematopoietic stem cells[J]. Novel evidence of the occurrence of NADPH oxidase activity[J]. J Biol Chen,2005,208(28):26467-26476.
[14]Yang Z, Sibley DR, Jose PA. D5 dopamine receptor knockout mice and hypertension[J]. J Recept Signal Transduct Res, 2004, 24: 149-164.
[15]Holmes A, Hollon TR, Gleason TC,etal. Behavioral characterization of dopamine D5 receptor null mutant mice[J]. Behav Neurosci. 2001, 115:1129-1144.
[16]Yang Z, Zheng S, Asico LD,etal. Increased PLD activity and elevated blood pressure in D5 receptor knockout mice[J]. Am J Physiol Heart Circ Physiol. 2005; 288(1): H55-61.
[17]Yang Z, Asico LD, Yu P,etal. D5 dopamine receptor regulation of reactive oxygen species production, NADPH oxidase, and blood pressure[J]. Am J Physiol Regul Integr Comp Physiol. 2006; 290(1): R96-R104.
18]张艳荣, 全雄志, 杨志伟, 等. 多巴胺D5受体转基因小鼠的建立[J]. 中国比较医学杂志. 2008; 18(5): 54-58.
19]胡永艳, 董伟,杨志伟,等. 多巴胺D5受体突变基因F173L在心脏过表达引起转基因小鼠扩张型心肌病[J]. 中华高血压杂志,2011,5(19):454-458.
[20]Nirmal PARAJULI, Vaibhav B. PATEL, Wang WANG, Ratnadeep BASUand Gavin Y. OUDIT. Loss of NOX2 (gp91phox) prevents oxidative stress and progression to advanced heart failure[J]. Clinical Science,2014, 127, 331-340.
[21]Turunen, M. Olsson, J. Dallner, G. Metabolism and function of coenzyme Q. Biochim. Biophys[J]. Acta,2004; 1660: 171-199.
[22]Packer M, Bristow MR, Cohn JN,etal. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure: US Carvedilol Heart Failure Study Group[J]. N Engl J Med 1996; 334: 1349- 1355.
[23]Yue TL, Cheng HY, Lysko PG.etal. Carvedilol, a new vasodilator and beta adrenoceptor antagonist, is an antioxidant and free radical scavenger[J]. J Pharmacol Exp Ther 1992; 263: 92- 98.
[24]Dandona, P. Karne, R. Ghanim,etal. Carvedilol inhibits reactive oxygen species generation by leukocytes and oxidative damage to amino acids. Circulation 2000;101: 122-124.
[25]Giordano FJ. Oxygen, oxidative stress, hypoxia, and heart failure[J]. J Clin Invest 2005; 115: 500 -508.
[26]Griendling KK, Sorescu D, Ushio-Fukai M. NAD(P)H oxidase: role in cardiovascular biology and disease.Circ Res. 2000;86:494-501.
[27]Beckman JS, Koppenol WH. Nitric oxide, superoxide, and peroxynitrite: the good, the bad, and ugly[J]. Am J Physiol, 1996, 271: C1424-C1437.
[28]Ghosh MC, Wang X, Li S,etal. Regulation of calcineurin by oxidative stress[J]. Methods Enzymol. 2003, 366: 289-304.
[29]G YB, Su B, Sah VP,etal. Cardiac Hypertrophy induced by mitogen-activated protein kinase kinase 7, a specific activator for c-Jun HN2-terminal kinase in ventricular cells[J]. J Biol Chem. 1998, 273(10): 5423.
[30]Ghosh MC, Wang X, Li S,etal. Regulation of calcineurin by oxidative stress[J]. Methods Enzymol. 2003, 366: 289-304.
[31]W, Zou Y, ShiojimaL,etal. Ca2+/calmodulin-dependentkinaseⅡand calcineurin playcriticaI rolesin endothelin-l-induced cardio myocyte hypertrophy[J]. J Biol Chem. 2000, 275.
[32]Rdano FJ,. Oxygen, oxidative stress, hypoxia, and heart failure[J]. J Clin Invest,.2005, 115(3): 500-508.
〔修回日期〕2015-04-08
研究报告
The regulation of dilated cardiomyopathy by dopamine D5
receptor through inhibiting oxidative stress
WANG Zi-hao,HU Yong-yan,WANG Wen-jie,DONG Wei,JIANG Xiao-liang,LIU Xing,YANG Zhi-wei
(Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences &
Peking Union Medical College, Beijing 100021,China)
【Abstract】ObjectiveTo determine whether dopamine D5 receptor (D5R) regulates the development of dilated cardiomyopathy (DCM) by inhibiting oxidative stress. Methods We developed heart-specific hD5 mutant (α-MHC-hD5F173L) and wild type (α-MHC-hD5WT) transgenic mice. The NOX2 expression and ROS production were tested in the transgenic mice at three month of age. The α-MHC-hD5F173L mice were treated with either NADPH oxidase inhibitor Apocynin (1mmol/kg/day) or phosphate-buffered saline (PBS) as control by intraperitoneal injection for 4 weeks. After then, the indexes of heart function were measured. The hD5WT and hD5F173L were transfected respectively in rat H9C2 cells, in which ROS production and NOX2 expression were detected at basal level. ResultsThe ROS production and NOX2 expression were higher in the heart of α-MHC-hD5F173L than α-MHC-hD5WT mice. Apocynin treatment improved the heart function of α-MHC-hD5F173L mice. NOX2 expression and ROS production were higher in hD5F173L than hD5WT transfected H9C2 cells. ConclusionsDopomine D5 receptor may prevent DCM development by inhibiting oxidative stress.
【Key words】Dilated cardiomyopathy;Dopamine D5 receptor(D5R);Reactive oxygen species(ROS)
doi:10.3969.j.issn.1671.7856. 2015.005.006
【中图分类号】R332
【文献标识码】A
【文章编号】1671-7856(2015) 05-0024-06
[通讯作者]杨志伟(1969-), 男,博士,研究员。 E-mail: yangzhiwei@cnilas.pumc.edu.cn。
[作者简介]王子皓(1988-),男,研究方向:高血压的发病机制。E-mail: simmons224@sina.com。
[基金项目]2009国家自然科学基金面上项目(30971186)。
