腹腔镜与开腹肝癌左外叶切除术对患者临床康复和机体免疫功能的影响
2016-01-28易永祥韩建波张郁峰
易永祥 王 建 王 翔 韩建波 赵 亮 张郁峰
(东南大学附属南京市第二医院普外科,江苏 南京 210003)
腹腔镜与开腹肝癌左外叶切除术对患者临床康复和机体免疫功能的影响
易永祥王建1王翔2韩建波赵亮张郁峰
(东南大学附属南京市第二医院普外科,江苏南京210003)
摘要〔〕目的对比腹腔镜与开腹肝癌左外叶切除术对患者康复和机体免疫功能的影响。方法选取在该院接受肝癌左外叶切除术的患者52例,接受腹腔镜手术的32例患者分为A组,将接受开腹手术的20例患者分为B组。对比两组患者的手术时间、术中出血量、术后使用镇痛药物的时间、首次进食时间、住院天数以及术后并发症的发生情况;同时对比两组患者手术前1 d和术后第5天的淋巴细胞亚群、C反应蛋白(CRP)、白细胞介素(IL)-1β、IL-8以及肿瘤坏死因子(TNF)-α水平的变化。结果A组术后镇痛药物使用时间、首次进食时间、住院天数均显著少于B组(均P<0.05);两组患者术后并发症发生率和死亡率对比均无统计学差异(均P>0.05);B组术后5 d的CD3、CD19、NK和CD4/CD8水平均显著低于术前1 d(均P<0.05);A组术后5 d的CD3、CD19、NK、CD4/CD8均显著高于B组(均P<0.05);B组术后5 d的CRP、IL-1β、IL-8、TNF-α水平均显著高于术前1 d(均P<0.05);A组术后5 d的CRP、IL-1β、IL-8、TNF-α均显著低于B组(均P<0.05)。结论相对于开腹手术,腹腔镜肝癌左外叶切除术可减轻患者的手术创伤,减少对其免疫功能的影响,降低术后的炎症反应,促进术后康复。
关键词〔〕腹腔镜;开腹;肝癌左外叶切除术;免疫功能
1徐州医学院第二附属医院外科2兴化市人民医院外科
第一作者:易永祥(1966-),男,硕士,主任医师,主要从事肝胆外科、肝脏移植研究。
局部肝切除术是治疗肝脏肿瘤的重要方法,其中肝左外叶切除术是开展较早、临床应用较为成熟的手术方式。然而,肝脏的血液循环十分丰富、结构复杂,手术过程中容易发生大出血等,风险较大,且术后并发症较多,这些均成为制约腹腔镜下肝左外叶切除术广泛开展的因素〔1〕。腹腔镜手术以其创伤小、患者术后恢复时间短、临床疗效良好等优势,逐渐取代开腹手术,成为临床医生和患者的首选〔2〕。目前临床关于腹腔镜下肝癌左外叶切除术对患者术后康复和机体免疫功能影响的研究较少。本研究拟对比腹腔镜和开腹肝癌左外叶切除术对患者术后康复和机体免疫功能的影响。
1资料与方法
1.1一般资料选取2012年1月到2015年1月在我院接受肝癌左外叶切除术的患者52例。接受腹腔镜手术的32例患者为A组,将接受开腹手术的20例患者为B组。A组中男21例,女11例;年龄43~62岁,平均(55.92±10.03)岁;身体质量指数(BMI)21~28 kg/m2,平均(24.51±4.28)kg/m2;肿瘤直径(4.47±2.03)cm;Child-Pugh分级A级23例,B级9例;美国麻醉医师协会(ASA)分级Ⅰ级11例,Ⅱ级16例,Ⅲ级5例;Edmondson-Steiner分级Ⅰ级9例,Ⅱ级18例,Ⅲ级5例。B组男14例,女6例;年龄41~61岁,平均(53.14±10.16)岁;BMI 22~27 kg/m2,平均(24.69±4.33)kg/m2;肿瘤直径(4.53±2.17)cm,Child-Pugh分级A级15例,B级5例;ASA分级Ⅰ级6例,Ⅱ级12例,Ⅲ级2例,Edmondson-Steiner分级Ⅰ级6例,Ⅱ级11例,Ⅲ级3例。两组患者的性别、年龄、BMI指数、肿瘤直径、ASA分级、Child-Pugh分级以及Edmondson-Steiner分级的对比差异均无统计学意义(均P>0.05),具有可比性。
1.2纳入标准参照中华人民共和国卫生部发布的《原发性肝癌诊疗规范》中的标准进行诊断〔3〕。所有患者术前均经过上腹部CT、磁共振成像(MRI)检查,结合甲胎蛋白等实验室检查指标,明确肝癌且肿瘤病灶位于左外叶。同时排除合并严重肝功能衰竭、心肝肾功能衰竭、凝血功能障碍等不宜接受手术治疗的患者;排除近期服用免疫抑制剂、糖皮质激素以及合并自身免疫性疾病、全身感染性疾病等影响本研究观察指标的患者;排除拒绝配合本研究治疗及相关指标检测的患者。
1.3手术方案采用气管内插管复合静脉全麻。A组采用腹腔镜下肝癌左外叶切除术进行治疗:建立人工二氧化碳气腹,维持12 mmHg的压力,沿脐部下缘切开一长约1 cm的切口,将腹腔镜置入,探查腹腔,了解肿瘤及其周围组织的情况;依次切开肝圆韧带、镰状韧带、冠状韧带以及三角韧带,将小网膜离断至静脉韧带根部;然后将肝实质和小管道离断,粗大的管道则需要以合成夹或者腔内切割缝合器夹闭后再行离断;切除后,仔细对创面进行电凝止血,缝扎胆漏处后,肝脏床面采用生物蛋白胶封闭,冲洗腹腔,退出腹腔镜,留置腹腔引流管后,缝合腹壁创口,手术结束。B组按照开腹肝癌左外叶切除术常规手术方案实施手术,取上腹正中切口。术后两组患者均给予加强补液支持治疗、应用抗菌药物预防感染、加强术口护理、镇痛等。
1.4观察指标记录并对比两组患者手术时间、术中出血量、术后使用镇痛药物的时间、首次进食时间以及住院天数;对比两组患者术后并发症(胆瘘、术区渗血、术口感染、术口种植)等并发症的发生率;对比两组患者住院期间发生死亡的情况。两组患者均在手术前1 d以及术后第5天空腹状态下采集外周静脉血行相关指标的检测。淋巴细胞亚群(CD3、CD19、NK、CD4/CD8)的检测采用流式细胞仪法,C反应蛋白(CRP)、白细胞介素(IL)-1β、-8、肿瘤坏死因子(TNF)-α的检测采用酶联免疫法。所有的检测方法和步骤均严格按照相关试剂和仪器的说明书进行操作。
1.5统计学分析采用SPSS17.0软件进行t检验、χ2检验。
2结果
2.1两组患者手术情况的对比两组患者的手术时间、术中出血量的对比均无统计学差异(均P>0.05);A组术后镇痛药物使用时间、首次进食时间、住院天数均显著少于B组(均P<0.05)。见表1。
2.2两组术后并发症发生情况的对比两组患者术后并发症发生率和死亡率对比均无统计学差异(均P>0.05)。见表2。
2.3两组淋巴细胞亚群检测结果的对比两组患者术前1 d的CD3、CD19、NK和CD4/CD8水平的对比,均无统计学意义(均P>0.05)。B组术后5 d的CD3、CD19、NK和CD4/CD8水平均显著低于术前1 d(均P<0.05);A组术后5 d的CD3、CD19、NK、CD4/CD8均显著高于B组(均P<0.05)。见表3。


组别n手术时间(min)术中出血量(ml)术后镇痛药物使用时间(d)首次进食时间(d)住院天数(d)A组3288.92±14.7380.37±14.151.16±0.731)2.16±0.471)6.29±1.251)B组20126.35±24.69138.73±22.582.53±0.854.61±1.1511.03±2.49
与B组比较:1)P<0.05
表2两组患者术后并发症发生情况的对比〔n(%)〕
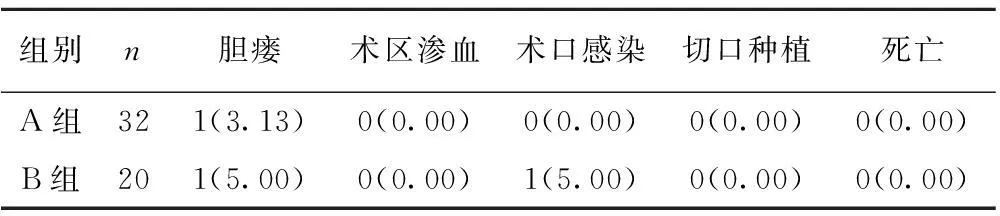
组别n胆瘘术区渗血术口感染切口种植死亡A组321(3.13)0(0.00)0(0.00)0(0.00)0(0.00)B组201(5.00)0(0.00)1(5.00)0(0.00)0(0.00)
2.4两组患者CRP、IL-1β、IL-8、TNF-α检测结果的对比两组患者术前1 d的CRP、IL-1β、IL-8、TNF-α水平对比均无统计学差异(均P>0.05);B组术后5 d的CRP、IL-1β、IL-8、TNF-α水平均显著高于术前1 d(均P<0.05);A组术后5 d的CRP、IL-1β、IL-8、TNF-α均显著低于B组(均P<0.05)。见表4。

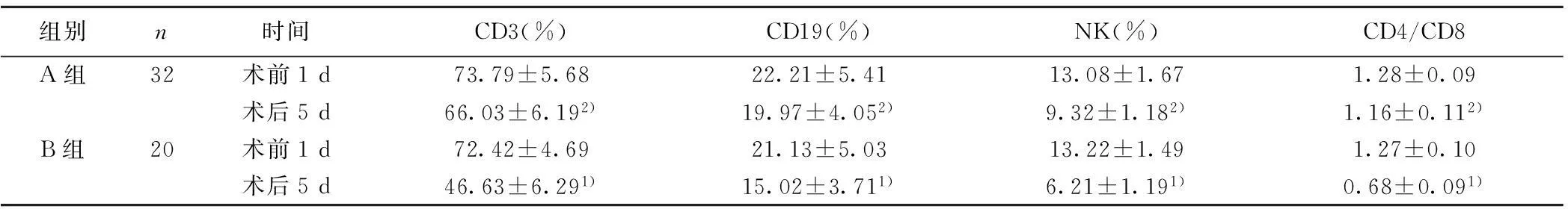
组别n时间CD3(%)CD19(%)NK(%)CD4/CD8A组32术前1d73.79±5.6822.21±5.4113.08±1.671.28±0.09术后5d66.03±6.192)19.97±4.052)9.32±1.182)1.16±0.112)B组20术前1d72.42±4.6921.13±5.0313.22±1.491.27±0.10术后5d46.63±6.291)15.02±3.711)6.21±1.191)0.68±0.091)
与术前1 d比较:1)P<0.05;与B组比较:2)P<0.05;下表同

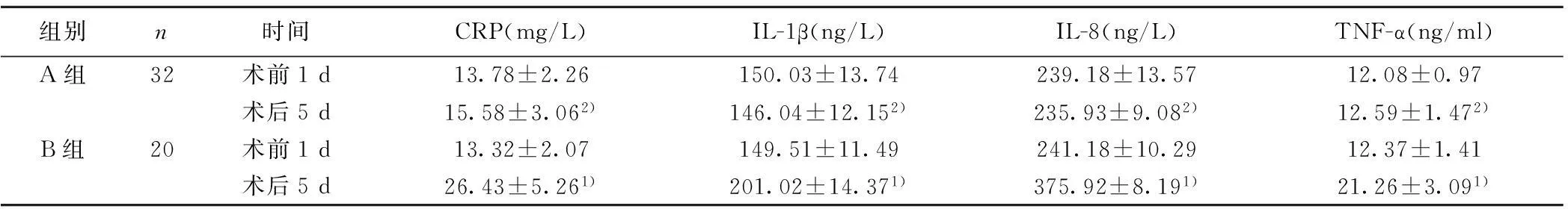
组别n时间CRP(mg/L)IL-1β(ng/L)IL-8(ng/L)TNF-α(ng/ml)A组32术前1d13.78±2.26150.03±13.74239.18±13.5712.08±0.97术后5d15.58±3.062)146.04±12.152)235.93±9.082)12.59±1.472)B组20术前1d13.32±2.07149.51±11.49241.18±10.2912.37±1.41术后5d26.43±5.261)201.02±14.371)375.92±8.191)21.26±3.091)
3讨论
腹腔镜下肝左外叶切除术是临床较早开展的局部肝组织切除术,目前的临床研究已经证实该术式的可行性和安全性〔4〕。随着腹腔镜技术在临床的普及应用,腹腔镜下肝左外叶切除术也逐渐成为治疗肝脏肿瘤的重要方法。然而,基于肝脏重要的生理功能,患者在接受肝癌左外叶切除术后的机体恢复情况及其对免疫功能的影响将直接影响到手术的临床疗效,进而影响患者的预后。
本研究结果说明腹腔镜手术有利于减少患者的手术创伤,减轻患者术后的痛苦,促进患者机体的康复,并具有较好的安全性。有研究表明,腹腔镜肝癌左外叶切除术显著减少患者的手术创伤,促进患者术后的康复〔5~7〕。但是,手术对于患者来说是一个强烈的应激事件,而机体的应激反应可影响患者的免疫功能〔8〕。在本研究中,两组患者术后的淋巴细胞亚群检测结果说明手术的应激可抑制患者的免疫功能。临床研究显示,肿瘤的发生、转移等均与患者的免疫功能有一定关系〔9〕,因此,尽量减少手术对患者免疫功能的影响有助于改善患者的预后。T淋巴细胞分为多个亚群,组成机体的免疫功能。CD3通过与T细胞抗原受体结合,活化T细胞,CD8和CD4细胞分别参与机体的初次和再次免疫反应,NK细胞则参与机体的非特异性免疫反应,对肿瘤细胞的增殖有抑制作用〔10~12〕。手术的创伤、机体过度的应激状态均可对免疫系统产生抑制作用,增加患者术后感染、肿瘤转移的风险〔13〕。腹腔镜手术由于手术创伤小,对患者机体各系统功能的影响小,从而减少了对免疫系统的干扰。本研究结果也证实A组患者的炎症反应明显轻于B组,这有助于减轻患者术后的炎症损伤,促进机体康复。IL-8由单核巨噬细胞产生,对炎症细胞有趋化作用,可调节机体的炎症反应。IL-1β、TNF-α均可促进IL-8的生成。上述炎症细胞因子水平升高可诱导机体产生炎症反应,释放蛋白酶等,造成局部组织的损伤〔14〕。CRP对机体的炎症反应有放大作用,对其浓度的检测有助于评估机体的炎症状态。A组患者术后的炎症反应较为轻微,减少了其对机体组织的损伤,这有利于患者术后的康复。
综上所述,相对于开腹手术,腹腔镜肝癌左外叶切除术可减轻患者的手术创伤,减少对其免疫功能的影响,降低术后的炎症反应,促进术后的康复。
参考文献4
1易永祥,胡亮,韩建波,等.切除肝癌联合定量微波消融治疗脾功能亢进患者术后并发症的相关因素分析〔J〕.中华老年医学杂志,2014;33(9):969-72.
2陈威,易永祥,张海斌,等.3种评分系统预测肝移植短期预后的效果评价〔J〕.中华肝胆外科杂志,2014;20(8):557-61.
3胡亮,易永祥,丁海,等.肝癌切除同时行脾切除加断流术术后并发症的相关因素分析〔J〕.山东大学学报:医学版,2013;6(1):64-6.
4柳己海,李明杰,郑直,等.腹腔镜肝癌切除术与开放式肝癌切除术的疗效比较研究〔J〕.现代生物医学进展,2011;11(18):3504-6.
5张跃伟.微创介入治疗肝癌对机体免疫功能影响的研究现状与展望〔J〕.实用肝脏病杂志,2014;17(3):231-3,234.
6中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)〔J〕.临床肿瘤学杂志,2011;16(10):929-46.
7韩亚飞,邰沁文,温浩,等.腹腔镜与开腹肝左外叶切除术的比较〔J〕.中国微创外科杂志,2013;13(5):403-5.
8刘天锡,方登华,关斌颖,等.腹腔镜肝切除治疗肝脏肿瘤的临床探讨〔J〕.中国普外基础与临床杂志,2012;19(5):526-9.
9谢敏.腹腔镜下胆管手术对机体的应激及体液免疫功能的影响〔J〕.中国医药导报,2013;10(1):44-5,48.
10张百红,岳红云.免疫微环境促进肿瘤发生发展的机制研究进展〔J〕.现代肿瘤医学,2015;23(6):862-4.
11严健,原永明,张舒,等.CD3+、CD4+、CD8+T淋巴细胞亚群在肿瘤患者外周血中检测的临床意义〔J〕.检验医学,2013;28(10):901-3.
12陆春伟,佟海侠,王秋实,等.恶性肿瘤患者外周血淋巴细胞亚群和调节性T细胞的检测及临床意义〔J〕.医学临床研究,2011;28(1):17-9.
13曹卫刚.创伤应激影响肿瘤发生发展的机制〔J〕.医学综述,2012;18(6):830-2.
14赵云刚.快速康复外科对胃癌手术效果及炎症介质释放的影响〔J〕.中国医药导刊,2014;16(5):798-9.
〔2015-10-10修回〕
(编辑曲莉)
中图分类号〔〕R65〔
文献标识码〕A〔
文章编号〕1005-9202(2015)23-6844-03;doi:10.3969/j.issn.1005-9202.2015.23.091
