大鼠CB1基因真核表达载体的构建及其对CaSki细胞凋亡的影响
2016-01-28严磊李晶赵婷婷王会娟王蕾赖国旗
严磊,李晶,赵婷婷,王会娟,王蕾,赖国旗,3*
(1. 重庆医科大学实验动物中心,重庆 400016;2. 重庆三峡医药高等专科学校,重庆 404120;
3.重庆市啮齿类实验动物工程技术研究中心,重庆 400016)
大鼠CB1基因真核表达载体的构建及其对CaSki细胞凋亡的影响
严磊1,李晶2,赵婷婷1,王会娟1,王蕾1,赖国旗1,3*
(1. 重庆医科大学实验动物中心,重庆400016;2. 重庆三峡医药高等专科学校,重庆404120;
3.重庆市啮齿类实验动物工程技术研究中心,重庆400016)
【摘要】目的构建大鼠CB1 (rCB1)基因真核表达载体,检测rCB1基因在细胞中的表达,研究rCB1对人宫颈癌CaSki细胞凋亡的影响。方法从大鼠脑组织中提取总RNA,RT-PCR扩增rCB1基因, 通过酶切、纯化、连接PCR纯化产物与pCDNA 3.1(+)质粒,构建pcDNA3.1(+)-rCB1。脂质体法将其转染到HEK293和CaSki细胞,Western blot及细胞免疫荧光联合激光扫描共聚焦方法检测rCB1的表达及定位,流式细胞仪检测细胞凋亡率,Western blot与实时荧光定量PCR检测rCB1、Bcl-2、Bax、Bad表达。结果酶切重组质粒获得5300 bp的载体片段和1500 bp的目的片段,测序结果和rCB1基因序列(NM012784.4)一致。转染HEK293细胞后, rCB1在HEK293细胞细胞膜和细胞质表达。转染CaSki细胞后, rCB1使细胞凋亡率增加(P<0.05);rCB1基因上调Bax、Bad的表达,同时抑制Bcl-2的表达,与空白组比较,其差异具有显著性(P<0.05)。结论成功构建了pcDNA3.1(+)-rCB1真核表达载体, rCB1表达于细胞膜和细胞质,rCB1可以明显促进宫颈癌CaSki细胞凋亡,其机制是上调Bax、Bad和抑制Bcl-2表达。
【关键词】CB1基因;HEK293细胞;CaSki细胞;细胞凋亡
大麻素是从印度大麻(Cannabissativa)里发现的一组萜酚类化合物,存在于动物神经系统和免疫系统里[1,2]。大麻类物质发挥生物作用的基础是大麻受体,现今已发现两个亚型: 1型大麻受体(cannabinoid receptor 1,CB1)[3]和2型大麻受体(cannabinoid receptor 2,CB2)[4],其中CB1受体主要分布于脑、脊髓与外周神经系统中,故又称中枢型大麻素受体。脑内的CB1受体主要分布于基底神经节(包括黑质、苍白球和外侧纹状体)、海马CA锥体细胞层,小脑和大脑皮质。通过激活CB1受体可以降低神经递质(如多巴胺和GABA)的释放,调节、参与记忆、认知、运动等活动的控制[5]。大鼠实验表明,大麻素受体在子宫组织中也有广泛分布[6]。
研究发现,大麻素对乳腺癌、前列腺癌、神经胶质瘤等具有抑制作用,在肿瘤组织中,增加大麻素受体在组织中的分泌可以选择性抑制细胞的恶性增殖[7]。我国宫颈癌的发病率位居女性恶性肿瘤第二,基因对比分析表明,人类CB1基因与大鼠的CB1基因序列存在很高的同源性。鉴于大鼠脑组织获取方便,本研究首先构建大鼠CB1真核表达载体,随后分别转染HEK293细胞与宫颈癌CaSki细胞,研究rCB1的细胞定位和rCB1对宫颈癌CaSki细胞凋亡的影响以及作用机制,其结果对大麻素治疗宫颈癌具有重要的理论意义。
1材料与方法
1.1材料
1.1.1实验动物
SPF级SD大鼠3只,雄性,体重 6.5 ~7.0 g,1日龄。购于重庆医科大学动物实验中心 [SCXK(渝)2012-0001]。大鼠的组织取材在重庆医科大学实验动物中心动物屏障设施内进行 [SYXK(渝)2012-0001]。
1.1.2材料和主要试剂
pcDNA3.1(+)真核表达载体、HEK293细胞、宫颈癌CaSki细胞由本实验室保存;总RNA提取试剂盒购自Promega公司; RT-PCR试剂盒、T载体连接试剂盒、T4DNA连接酶试剂盒、DH5α感受态细菌、DL2000 DNA maker、DL5000 DNA maker、DL1000 DNA maker、Taq DNA多聚酶、凝胶回收试剂盒、实时荧光定量PCR试剂盒购自Takara公司;限制性内切酶(EcoRI,BamHI)购自美国NEB公司;质粒提取试剂盒购自Qiagen公司;LipofectamineTM2000购自Invitrogen公司产品;兔抗大鼠CB1抗体购自武汉博士德生物技术公司;HRP标记的羊抗兔IgG购自北京中杉金桥公司;兔抗人Bcl-2多克隆抗体、兔抗人Bax多克隆抗体、兔抗人Bad多克隆抗体购自美国Abgent; DyLight 549标记的羊抗兔IgG购自美国Abbkine公司;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)、藻红蛋白标记的膜联素 (phycoerythrin conjugated annexin Ⅴ, annexin V-PE)/7-氨基放线菌素D(7-aminoactinomycin D,7-AAD)细胞凋亡检测试剂盒、ECL化学发光试剂盒、防荧光淬灭剂购自碧云天公司;流式细胞仪购自美国Coulter;GeneGnome5化学发光成像仪购自美国 Syngene;iQ5型荧光定量PCR仪购自美国Bio-Rad。
1.1.3引物设计
根据GenBank数据库中大鼠CB1基因NM_012784.4序列设计引物。其上游引物:5′-CG GGATCCGCCACCATGAAGTCGATCCTAGATG-3′;下游引物:5′-GGAATTCCTTTTTCTGTGCAGCCACAA-3′。其中,分别在上游和下游引物的5′端加上了EcoRI,BamHI酶切位点,引物由上海Invitrogen公司合成(见表1)。
表1qRT-PCR相关引物
Tab.1Primers applied in the quantitative RT-PCR analysis

基因Genes上游引物(5’-3’) Senseprimer 下游引物(3’-5’) Antisenseprimer rCB1CTACTGGTGCTGTGTGTCATCGCTGTCTTTACGGTGGAATACBcl-2ATGTGTGTGGAGAGCGTCAACCGCATCCCAGCCTCCGTTATCBaxGCTGTTGGGCTGGATCCAAGTCAGCCCATCTTCTTCCAGABadCCAGTGAGCAGGAAGACTCGGTAGGAGCTGTGGCGACTGAPDHGCCTCAAGATCATCAGCAATGCCATGGACTGTGGTCATGAGTCCT
1.2方法
1.2.1rCB1克隆和pcDNA3.1(+)-rCB1真核表达载体构建及鉴定
按试剂盒操作说明书从1日龄SD大鼠脑组织中提取大鼠总RNA。按RT-PCR试剂盒说明书逆转录为SD大鼠脑组织cDNA文库,以cDNA为模板,PCR扩增rCB1基因,条件为:50 μL体系;94℃ 5 min;94℃,30 s;56℃,30 s;72℃ 45 s,循环30次后72℃,7 min。PCR产物1 %琼脂糖凝胶电泳,按凝胶回收试剂盒说明书进行PCR产物回收纯化。
用限制性内切酶EcoRI和BamHI酶切rCB1片段和pcDNA3.1(+)质粒,凝胶电泳后按凝胶回收试剂盒说明书进行回收纯化。按T4DNA连接酶试剂盒将含rCB1片段连接到pcDNA3.1(+)酶切片段上,将连接产物转化DH5α感受态细菌,用含Amp的LB平板筛选阳性克隆,用含Amp的LB液体培养基,200 r/min,37℃,摇菌培养16 h。菌液按质粒提取试剂盒说明书提取质粒,酶切鉴定; 同时,质粒DNA送上海Invitrogen公司测序。
1.2.2HEK293细胞的pcDNA3.1(+)-rCB1转染
将HEK293细胞接种于35 mm含10%胎牛血清的RPMI 1640培养基的培养皿,在37℃、5% CO2环境下培养,待细胞的汇合率在50%~70%时,按LipofectamineTM2000转染说明书操作。转染时将质粒与转染试剂混合, 室温下静止 30 min后滴加在用无血清RPMI 1640培养基培养的细胞上,6 h 后更换含10%胎牛血清的RPMI 1640培养基。转染48 h后吸去培养基,收获细胞。以未转染的细胞为对照组。
1.2.3Western blot检测rCB1在HEK293细胞中的表达
取转染48 h后的HEK293细胞,裂解,提取蛋白。蛋白样品在100℃变性10 min,取5 μL蛋白样本上样,10% SDS-PAGE电泳分离后转膜,在含5%脱脂牛奶的TBST中封闭2 h,兔抗大鼠CB1抗体(1∶300)4℃孵育过夜,与HRP标记的羊抗兔IgG室温孵育2 h,化学发光。以未转染的细胞为对照组。
1.2.4细胞免疫荧光激光扫描共聚焦检测rCB1在293细胞中的定位
取转染48 h后的HEK293细胞爬片,冰甲醇处理15 min,加3% H2O2,20 min;5%胎牛血清封闭1 h,兔抗大鼠CB1抗体(1∶100)4℃孵育过夜,荧光标记的羊抗兔IgG (1∶50) 37℃孵育2 h,DAPI染色 5 min,防荧光淬灭剂封片,激光扫描。
1.2.5CaSki细胞凋亡的检测
pcDNA3.1(+)-rCB1质粒按1.2.2方法转染CaSki细胞,转染48 h后,经胰酶消化,PBS清洗,离心,PBS重悬后,按细胞凋亡检测试剂盒操作,流式细胞仪检测细胞凋亡。以未转染的细胞为对照组。
1.2.6rCB1及凋亡相关因子在CaSki细胞中表达的检测
pcDNA3.1(+)-rCB1质粒按1.2.2方法转染CaSki细胞,转染48 h后收取细胞。
(1)Western blot: 经超生裂解,100℃变性后于10% SDS-PAGE电泳90 min,转膜1 h,在5% BSA封闭液中封闭2 h。以兔抗大鼠CB1抗体(1∶500)、兔抗人Bcl-2抗体 (1∶1000)、兔抗人Bax抗体 (1∶1000)、兔抗人Bad抗体 (1∶1000) 4℃孵育过夜,加辣根酶过氧化物标记的羊抗兔IgG室温孵育2 h,ECL法显影。
(2)RT-PCR: 按RNA提取试剂盒提取总RNA,按RNA逆转录试剂盒说明书操作将RNA逆转录为cDNA。以所获cDNA为模板,按照实时荧光定量PCR试剂盒说明操作, PCR反应条件:25 μL体系,95℃,10 min; 94℃ 20 s, 60℃ 30 s, 72℃ 30 s,40 cycles。实验数据采用2-ΔΔCt分析,ΔΔCt=(Ct目的基因 - Ct内参)实验组 - (Ct目的基因 - Ct内参)空白组,相对定量 (relative quantification,RQ),以RQ实验组=2 - ΔΔCt,RQ对照组=1计算。以未转染的细胞为对照组。 实验重复三次。
1.2.7统计学方法
使用SPSS 17.0对数据进行统计学分析,数据采用均数±标准差表示,组间比较采用t检验或方差分析。以P<0.05表示差异有统计学意义。
2结果
2.1PCR扩增rCB1及载体构建
PCR扩增产物经琼脂糖凝胶电泳检测,结果如图1所示,条带大小在1.5 kb。用BamHI和EcoRI酶切pcDNA3.1(+)-rCB1重组质粒,切出1.5 kb的rCB1片段和5.3 kb的载体片段。结果如图2所示,结果与预期一致。

注:M:D2000;1:rCB1 PCR结果。 图1 rCB1 PCR产物琼脂糖凝胶电泳检测结果Note. M:D2000;1:The results of rCB1 by PCR. Fig.1 The results of rCB1 PCR products detected by agarose gel electrophoresis

注:M:D5000; 1:pcDNA3.1(+)-rCB1 BamHI、EcoRI酶切产物。 图2 pcDNA3.1(+)-rCB1双酶切鉴定结果M:D5000; 1:The products of pcDNA3.1(+) -rCB1 detected by double enzyme digestion with BamH I and EcoR I. Fig.2 The results of pCDNA3.1(+)-rCB1 by double enzyme digestion
2.2rCB1在HEK293细胞中的表达与定位
pcDNA3.1(+)-rCB1转染HEK293细胞后,Western blot检测rCB1在HEK293细胞中的表达,结果如图3示,rCB1转染组在50×103处出现一条蛋白带。细胞免疫荧光联合激光扫描共聚焦(549 nm波段)检测rCB1在HEK293细胞中的表达。如图4示,红色为rCB1蛋白表达且分布于细胞膜与细胞质。结果与预期一致。
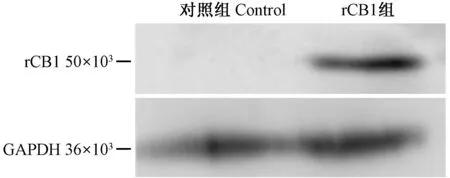
图3 rCB1 Western blot结果 Fig.3 The results of rCB1 detected by Western blot
2.3流式细胞仪检测细胞凋亡率
pcDNA3.1(+)-rCB1转染CaSki细胞后,流式细胞仪检测rCB1转染组和对照组的细胞凋亡率。结果如图5所示,与未转染组比较,rCB1转染组的细胞凋亡率(32.99±3.25)%大于对照组的细胞凋亡率(13.11±0.32)%,两组之间差异有显著性(P<0.05)。
2.4rCB1、Bcl-2、Bax、Bad在CaSki细胞的表达
pcDNA3.1(+)-rCB1转染CaSki细胞后,Western blot结果如图6所示,与对照组比较,rCB1组的Bax、Bad表达高于对照组(P<0.05),Bcl-2的表达低于对照组(P<0.05)。荧光定量PCR(qRT-PCR)检测结果如图7所示,与对照组比较,rCB1组中的Bax、Bad的mRNA表达高于空白组(P<0.05),Bcl-2 mRNA的表达低于空白组(P<0.05)。
3讨论
20世纪90年代初,人类发现大麻素CB1受体并对其结构进行了研究分析,发现CB1受体由473个氨基酸/7个跨膜结构域构成,属于G蛋白偶联受体。同时发现,CB1受体主要来源于神经细胞,CB1受体几乎都能与所有的大麻类物质结合,作为大麻素的作用受体,其生物作用是调节化学递质的释放[3]。
目前关于人CB1受体生理功能和药物活性的研究已有大量报道,CB1受体在神经退行性疾病、镇痛、精神性疾病、心血管疾病、糖尿病、眼科疾病、调节胃肠道系统等治疗中具有重要的作用[9-11]。大麻素与CB1受体结合后通过诱导细胞凋亡、影响细胞增殖、抑制细胞侵袭转移和抑制肿瘤血管生成等作用对包括乳腺癌、前列腺癌、神经胶质瘤、白血病、皮肤癌、甲状腺癌和胰腺癌等肿瘤产生明显的抑制作用[7]。

注:A: DAPI B: 红色荧光 D: 复合图。 图4 转染pcDNA3.1(+)-rCB1 后HEK293细胞的免疫荧光联合激光扫描共聚焦观察Note. A: DAPI; B: Red fluorescence; D: Composite diagram. Fig.4 Immunofluorescence and laser scanning confocal microscopic observation on HEK293 cells transfected with pcDNA3.1(+)-rCB1

图5 流式细胞仪检测结果 Fig.5 Apoptosis in CaSki cells determined by flow cytometry

注:与对照组比较,*P<0.05。Note. *P<0.05, compared with the control group. 图6 Western blot检测rCB1、Bcl-2、Bax、Bad蛋白表达结果 Fig.6 Expressions of rCB1, Bcl-2, Bax, and Bad proteins detected by Western blot

注:与对照组比较,*P<0.05。 图7 荧光定量PCR检测Bcl-2、Bax、Bad的mRNA表达结果Note. *P<0.05, compared with the control group. Fig.7 Expression levels of CB1, Bcl-2,Bax, and Bad mRNA measured by qRT-PCR
通过分析人类CB1基因和大鼠rCB1基因的核酸序列,发现基因序列相似性达99%。Sordelli 等[6]发现,CB1受体和CB2受体在大鼠子宫内有分布,影响胚胎的植入。Fonseca 等[12]研究发现,给予药物激动CB1受体,CB1可诱导大鼠子宫蜕膜细胞的凋亡,Sanchez[13]和Gentilini[14]的研究也发现CB1受体与人、小鼠子宫内膜异位及细胞凋亡存在关联。冯睿等[15]构建了rCB1-EGFP融合蛋白真核表达载体。然而,有关rCB1的生物活性报导还是很少。
宫颈癌是妇女最常见的恶性肿瘤之一,其发病率及死亡率仅次于乳腺癌,严重威胁着全球女性的健康,每年全世界约有 51 万新发病例。在中国每年有10 万新发病例, 约占世界宫颈癌新发病例的 1/5[16-18]。宫颈癌按病理学分为三种:鳞癌、腺癌和腺鳞癌。对宫颈癌组织标本的研究发现,99%以上的宫颈癌有人乳头瘤病毒(human papillomavirus, HPV)感染,HPV-16感染引起的宫颈鳞癌占50-60%[19-21]。在现有的宫颈癌细胞株中,CaSki细胞是HPV-16阳性宫颈癌细胞株,以CaSki细胞为模型,探索治疗宫颈癌的新基因药物,对临床应用具有重要意义。
本研究首先根据大鼠CB1受体的分布,取大鼠脑组织后剥离脑膜与脑血管,分离大鼠脑组织海马区,从海马区获取RNA可保障rCB1高拷贝,并构建鼠源CB1基因构建真核表达载体。将构建成功的rCB1真核表达载体转染宫颈癌CaSki细胞,研究rCB1对宫颈癌细胞凋亡的影响及其作用机制。
本研究发现,rCB1能够表达于HEK293细胞中且表达于细胞膜与细胞质中,这与Geiger等[22]研究人CB1在HEK293细胞中的表达位置一致。利用构建成功的rCB1真核表达载体转染宫颈癌CaSki细胞后结果发现,rCB1可以诱导宫颈癌CaSki细胞凋亡,同时发现CaSki细胞中bcl-2、bax、bad的表达发生变化,进而表明rCB1通过上调细胞凋亡因子bcl-2家族中bax、bad的表达和下调了bcl-2的表达,从而诱导宫颈癌细胞凋亡。
综上所述,本研究成功构建了rCB 1真核表达载体,并在国内首次发现rCB1能够诱导宫颈癌CaSki细胞凋亡,其作用机制是上调bax、bad和下调bcl-2的表达。研究结果提示rCB1对宫颈癌具有治疗作用,有望取代人的CB1功能。
参考文献
[1]Woelkart K, Salo-Ahen OM, Bauer R. CB receptor ligands from plants [J].Curr Top Med Chem, 2008, 8: 173-186.
[2]Selley DE, Welch SP, Sim-Selley LJ. Sphingosine lysolipids in the CNS: endogenous cannabinoid antagonists or a parallel pain modulatory system [J]. Life Sci, 2013, 93(5-6): 187-193.
[3]Matsuda LA, Lolait SJ, Brownstein MJ. Structure of a cannabinoid receptor and functional expression of the cloned cDNA [J]. Nature, 1990, 346(6284): 561-564.
[4]Munro S, Thomas KL, Abu-Shaar M, et al. Molecular characterization of a peripheral receptor for cannabinoids [J]. Nature, 1993, 365(6441): 61-65.
[5]吴永涛, 刘宏亮, 姚忠祥, 等. 大麻素CB1、CB2受体在脑组织中分布及其表达特性的研究 [J]. 中国康复医学杂志, 2009, 24(3): 197-199.
[6]Sordelli MS, Beltrame JS, Burdet J, et al. The effect of anandamide on uterine nitric oxide synthase activity depends on the presence of the blastocyst [J]. PLoS ONE, 2011, 6(4): e18368.
[7]吴敏,任瑞宝. 大麻素类化合物抗肿瘤研究新进展 [J]. 肿瘤, 2013, 33(5): 478-482.
[8]Schneider P, Hannusch C, Schmahl C, et al. Adolescent peer-rejection persistently alters pain perception and CB1 receptor expression in female rats [J]. Eur Neuropsychopharmacol, 2013, 24(2): 290-300.
[9]于海玲, 张凤, 全哲山. 内源性大麻素系统与抑郁症 [J]. 生理科学进展, 2012, 43(4): 257-262.
[10]Guabiraba R, Russo RC, Coelho AM, et al. Blockade of cannabinoid receptors reduces inflammation, leukocyte accumulation and neovascularization in a model of sponge-induced inflammatory angiogenesis [J]. Inflamm Res, 2013, 62(8): 811-821.
[11]王鹏飞, 何奔. 内源性大麻素系统与心肌缺血再灌注损伤 [J]. 中国动脉硬化杂志, 2010, 18(8): 669-672.
[12]Fonseca BM, Correia-da-Silva G, Teixeira NA, et al. The endocannabinoid anandamide induces apoptosis of rat decidual cells through a mechanism involving ceramide synthesis and p38 MAPK activation [J]. Apoptosis, 2013, 18(12): 1526-1535.
[13]Sanchez AM, Vigano P, Mugione A, et al. The molecular connections between the cannabinoid system and endometriosis [J]. Mol Human Reprod, 2012, 18(12): 563-571.
[14]Gentilini D, Besana A, Vigano P, et al. Endocannabinoid system regulates migration of endometrial stromal cells via cannabinoid receptor 1 through the activation of PI3K and ERK1/2 pathways [J]. Fertil Steril, 2010, 93(8): 2588-2593.
[15]冯睿, 范娟, 刘一辉, 等. 大鼠大麻素I型受体绿色荧光融合蛋白真核表达载体的构建与鉴定 [J]. 现代生物医学进展, 2014, 14(26): 5034-5037.
[16]梁东霞. 宫颈癌与HPV关系的研究进展 [J]. 实用癌症杂志, 2010, 25(2): 202-205.
[17]刘昱,曹来英,张蔚, 等。槲皮素抗宫颈癌的机制研究[J].微循环学杂志,2010,20(3):27-29.
[18]梁东霞.宫颈癌与hpv关系的研究进展[J].实用癌症杂志,2010,25(2):202-205.
[19]Kim MS, Bak Y, Park YS, et al. Wogonin induces apoptosis by suppressing E6 and E7 expressions and activating intrinsic signaling pathways in HPV-16 cervical cancer cells [J]. Cell Biol Toxicol, 2013, 29(4): 259-272.
[20]李华.H P V 与宫颈癌的研究进展[J].实用癌症杂志,2007,22(4):202-205.
[21]Sankaranarayanan R. Overview of cervical cancer in the developing world. FIGO 26thAnnual Report on the Results of Treatment in Gynecological Cancer [J]. Int J Gynaecol Obstet, 2006, 95 (1):S205-210.
[22]Geiger S, Nickl K, Schneider EH, et al. Establishment of recombinant cannabinoid receptor assays and characterization of several natural and synthetic ligands [J]. Naunyn Schmiedebergs Arch Pharmacol, 2010, 382(2): 177-191.
研究报告
Construction of expression vector containing rat rCB1 gene and
its influence on the apoptosis in human cervical cancer CaSki cell line
YAN Lei1, LI Jing2, ZHAO Ting-ting1, WANG Hui-juan1,WANG lei1, LAI Guo-qi1
(1. Laboratory of Animal Center of Chongqing Medical University, Chongqing 400016;
2. Chongqing Three Gorges Medical College, Chongqing 404120;
3. Chongqing Engineering Research Center on Rodent Laboratory Animals, Chongqing 400016)
【Abstract】ObjectiveTo construct rCB1 gene eukaryotic expression vector, detect its expression in the cell, and explore its influence on apoptosis in human cervical cancer CaSki cells. Methods The total RNA was extracted from rat brains. The rCB1gene was amplified by RT-PCR. The pcDNA3.1(+)-rCB1 was constructed by enzyme digestion, purification, bind the PCR purification products and pcDNA3.1 (+) DNA. The pcDNA3.1 (+)-rCB1 plasmid was transfected into HEK293 and CaSki cells by liposomes. The expression and localization of rCB1 were detected by Western blot and immunofluorescence combined with confocal laser scanning microscopy. The apoptosis rate of CaSki cells was detected by flow cytometry. The expression of rCB1, Bcl-2, Bax and Bad was detected by Western blot and real-time fluorescence quantitative RT-PCR (qRT-PCR). ResultsThe 5300 bp pcDNA3.1(+) and 1500 bp rCB1 were obtained after digesting the pcDNA3.1(+)-rCB1. The result of sequencing was in agreement with the sequence of rCB1 gene (NM012784.4). The rCB1 expressed in the membrane and cytoplasm when pcDNA3.1 (+)-rCB1 plasmid was transfected into HEK293 cells. The apoptosis rate of rCB1 group was increased compared with the blank group when pcDNA3.1 (+)-rCB1 plasmid was transfected into CaSki cells (P<0.05). Compared with the blank group, rCB1 gene upregulated the expression of Bax and Bad, and suppressed the expression of Bcl-2. The statistical difference was significant (P<0.05). ConclusionsThe pCDNA3.1(+)-rCB1 eukaryotic expression vector is constructed successfully. It is found that rCB1 is expressed in membrane and cytoplasm of HEK293 cells. rCB1 can significantly promote the apoptosis in cervical cancer CaSki cells by up-regulating the expression of Bax and Bad, and down-regulating the expression of Bcl-2 as well.
【Key words】rCB1; HEK293 cells; CaSki cells; Cell apoptosis
[收稿日期]2014-11-18
Doi:10.3969/j.issn.1005-4847.2015.02.010
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2015) 02-0153-06
[通讯作者]赖国旗(1964-),女,教授,博士。研究方向:实验动物学。E-mail: a68895078@21cn.com。
[作者简介]严磊(1985-),男,硕士研究生。研究方向:实验动物模型。E-mail: 985466685@qq.com。
[基金项目]重庆市教委自然科学基金项目(KJ111802);重庆市卫生局医学科研项目(2012-1-096);重庆市高等教育教学改革研究重点项目(132128、133309);重庆万州区科技计划项目(201203055);重庆市应用开发计划项目(cstc2013yykfC10005)。
