毛细管区带电泳检测抗EGFR抗体的电荷异质性
2016-01-27周冬梅孙文正
柯 志,周冬梅,徐 军,孙文正,杨 彬
(广东东阳光药业有限公司,广东 东莞 523867)
毛细管区带电泳检测抗EGFR抗体的电荷异质性
柯志,周冬梅,徐军,孙文正,杨彬*
(广东东阳光药业有限公司,广东东莞523867)
单克隆抗体凭借其高特异性和低副作用的优点成为生物药研究的热点[1]。抗体在生产和储存过程中,自身的翻译后修饰和储存条件会影响其电荷异质性[2],如琥珀酰亚胺修饰[3]、C末端赖氨酸修饰、酰胺化、氧化会产生碱性变体[4],脱酰胺、唾液酸化、焦谷氨酸环化[5]会产生酸性变体。除此之外,片段化会双向产生酸碱变体,异天冬氨酸化会影响表面电荷分布[6]。这些变体不仅可能影响抗体的生物活性,还可能影响抗体的稳定性。同时,电荷异质性作为生物药物的关键质量属性,是进行克隆筛选[7]、衡量生产工艺、工厂生产批次放行和稳定性实验的重要指标。因此,需要建立一种快速且稳定的方法对其进行分析。
单抗电荷异质性最常用的检测方法有等电聚焦(IEF)、离子交换色谱[8](IEC)、毛细管等电聚焦电泳[9](CIEF)、成像毛细管电泳(iCE)[10]及毛细管区带电泳[11](CZE)等。IEF是检测单抗电荷异质性的传统方法,该方法分辨率高,但耗时长且变异性高。目前较多用于单抗电荷异质性的检测方法为IEC和毛细管电泳法(CE,包括CIEF、iCE、CZE)。CE法因柱效高、进样量少、分离度好而成为单抗分析的常规手段[12]。CIEF分辨率高同时能精确测定PI值,但其两步分离耗时长[13];具有相似分离原理的iCE只需一步聚焦,能显著减少分析时间,但与CIEF一样,其涂层毛细管使用寿命短,且所用两性电解质以及分离液成本高,从而限制了这两种方法的使用。
CZE是毛细管电泳中最基本、应用最广泛的分离模式。2011年,He等[14]建立了一种新的CZE方法用于检测抗体电荷异质性。随后Shi等[15]采用醋酸盐作为分离液,聚环氧乙烯(PEO)和三亚乙基四胺(TETA)为添加剂,建立了另一种检测电荷异质性的方法。曹俊姿等[16]利用裸管,采用尿素为添加剂建立了相似的方法来检测单抗电荷异质性。随后,郭玮等[17]利用涂层毛细管,不使用添加剂建立了另一种分离方法。在CZE方法分离单抗的过程中,由于单抗吸附会使柱效降低,产生电渗流,使得重现性和分离度变差。因此一般选用中性毛细管,同时加入添加剂以抑制吸附和电渗流。
本文采用CZE方法,以未涂层毛细管进行检测,降低了成本,通过优化分离液的pH值、分离电压、分离温度以及添加剂的浓度,建立了快速、准确、特异的单抗产品毛细管区带电泳检测方法,并进行了方法学验证。
1实验部分
1.1试剂与仪器
6-氨基己酸(EACA,99%)、三亚乙基四胺(TETA,97%)、羟丙基甲基纤维素(HPMC)、甲基纤维素(MC)、尿素(Urea,99%)、冰乙酸(99.7%)均购于美国Sigma Aldrich公司;0.1 mol·L-1盐酸(美国Beckman Coulter公司);所有抗EGFR单抗原液均来自东阳光药业研究院;实验用水为超纯水。
PA800 Plus型毛细管电泳仪(美国Beckman Coulter公司);熔融石英毛细管(有效长度20 cm,内径50 μm,美国Beckman Coulter公司);SevenExcellence型pH计(美国Mettler Toledo公司)。
1.2实验条件及方法
新的毛细管使用前,依次用甲醇(20 psi,5 min)、0.1 mol·L-1HCl(20 psi,15 min)、超纯水(20 psi,5 min)冲洗活化。采用UV检测器,检测波长214 nm,样品盘温度10 ℃,毛细管温度20 ℃。分离缓冲液为380 mmol·L-1EACA、1.9 mmol·L-1TETA、0.1% HPMC的混合缓冲液(pH 6.0)。每次实验前用0.1 mol·L-1HCl冲洗3 min(50 psi)后,用水冲洗2 min(50 psi),再用分离缓冲液冲洗5 min(50 psi)。压力进样10 s(0.5 psi),分离电压为25 kV,分离时间8 min。实验结束后用0.1 mol·L-1HCl冲洗毛细管5 min(50 psi),毛细管两端置于超纯水中保存。
1.3样品及溶液制备
样品制备:将抗EGFR抗体溶液用超纯水稀释至1 mg·mL-1,取90 μL于进样小管中进样。
分离液储存液为400 mmol·L-1EACA, 2 mmol·L-1TETA,用冰乙酸调至pH 6.0。
分离缓冲液:取分离液储存液8.10 mL,加入900 μL 1%HPMC。涡旋混匀,临用新配。
2结果与讨论
2.1分离检测条件的优化


图1 EACA浓度对分离度(A)与迁移时间(B)的影响Fig.1 Effect of EACA concentration on resolution(A) and migration time(B)
2.1.1分离缓冲液浓度的影响区带电泳要求分离缓冲液提供稳定的背景信号和较低的电流。分离缓冲液浓度高,缓冲容量大,可以抑制毛细管内壁对蛋白的吸附,但同时缓冲液的离子强度增大,其相应的电流也增大,一方面会造成基线不稳,重复性差,产生的焦耳热降低柱效、影响柱的使用寿命;另一方面,离子强度增大还会压缩双电层,抑制电渗流,延长迁移时间。本实验考察了EACA浓度分别为300,350,380,450,500 mmol·L-1时对主峰与碱变体2之间分离度及主峰迁移时间的影响(见图1)。结果表明,缓冲液浓度为380 mmol·L-1时,主峰与碱变体2之间的分离度达到最大值,迁移时间随着缓冲液浓度的增加而增大,但相隔不超过1 min,所以最终选择EACA的浓度为380 mmol·L-1。
2.1.2分离缓冲液pH值的影响毛细管电泳中,分离缓冲液的pH值越小,电渗流越小;另一方面缓冲液pH值在小于抗体pI的前提下,pH值越小,抗体所带的正电荷则会越多,在正电压分离模式下,迁移时间显著减小,但分离度会降低。所以优化pH值要同时考虑分离度和分离时间。在此基础上,对不同分离缓冲液pH值( 4.0,5.0,5.4,5.7,6.0,6.2,7.0)进行优化,结果见图2。结果表明:分离缓冲液pH值在4.0~6.0时主峰与碱变体2的分离度逐渐增大,超过pH 6.2则分离度逐渐减小;迁移时间在pH 4.0时最快,超过pH 5.0变化不大。因此本文选择pH 6.0作为分离缓冲液的最佳pH值。
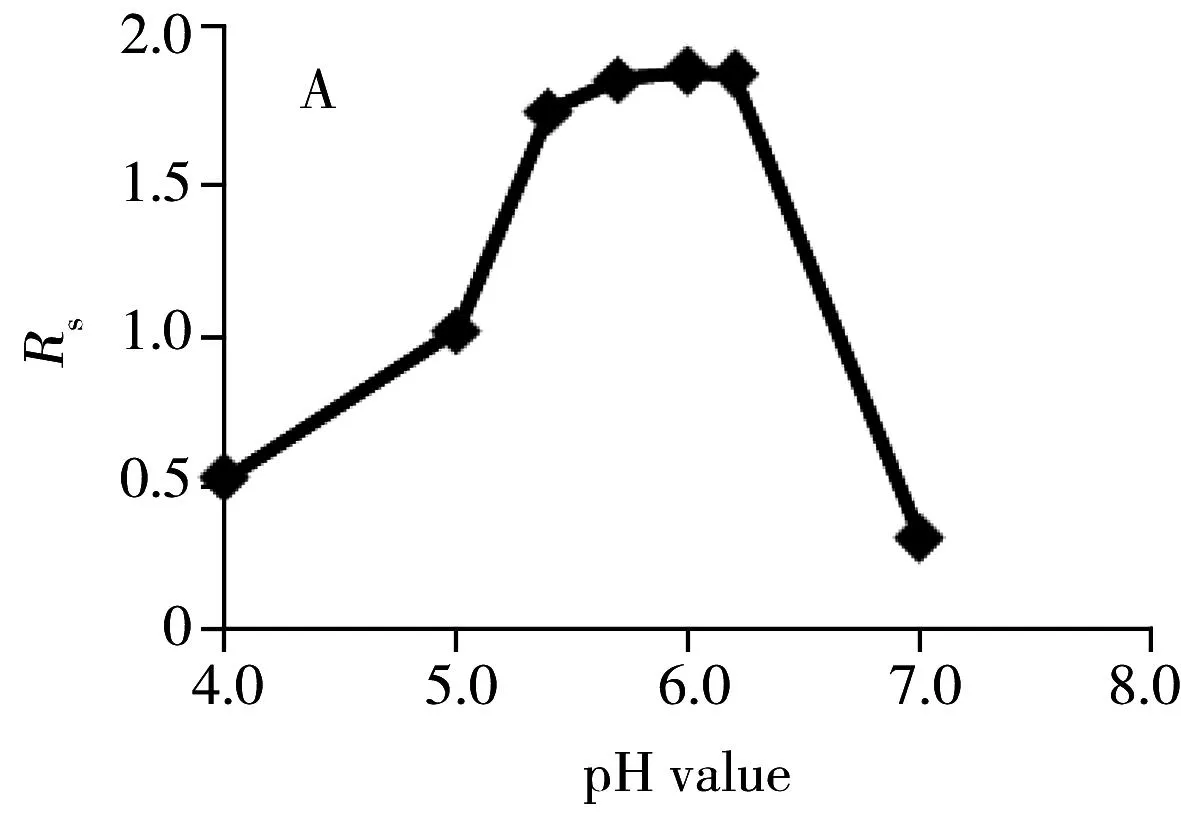
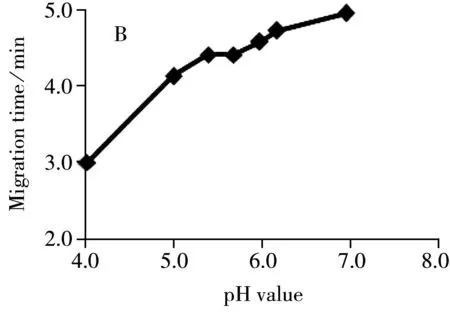
图2 pH值对分离度(A)与迁移时间(B)的影响Fig.2 Effect of pH value on resolution(A) and migration time(B)
2.1.3添加剂的影响区带电泳中,通常会在分离缓冲液中加入添加剂以抑制管壁对蛋白的吸附,提高分离度。一般选择表面活性剂或者中性高分子[18]。本实验通过加入线性高分子HPMC在毛细管内壁形成动态保护层,减少蛋白吸附,但过多的HPMC会使缓冲液粘度增加,分离时间延长,谱带展宽效应增加,分离度变低,同时引起进样量减少;加入的多胺TETA会竞争蛋白与毛细管内壁Si—OH基团结合,也可以抑制蛋白吸附,但过量的TETA会与单抗的羧基反应改变单抗电荷异质性。因此,本文对HPMC浓度(0.05%,0.1%,0.15%,0.2%,0.25%)和TETA浓度(1.5,1.9,3.5,4.0 mmol·L-1)进行优化。结果表明,HPMC浓度为0.1%时主峰与碱变体2的分离度最好,超过0.15%时则分离度显著变小;TETA浓度为1.9 mmol·L-1时主峰与碱变体2的分离度最高,超过1.9 mmol·L-1则逐渐降低。所以选择HPMC和TETA的浓度分别为0.1%和1.9 mmol·L-1。

图3 抗EGFR抗体的电泳图谱Fig.3 Electrophoretogram of anti-EGFR antibody1.basic variants 1 (碱变体1);2.basic variants 2 (碱变体2);3.main component(主成分);4. acidic variants ( 酸变体)
2.1.4电压与柱温的影响在一定范围内提高电压可以减少迁移时间,减小峰宽。但场强的增大会产生更大的焦耳热,使柱效降低,同时影响重复性。柱温升高可以增加毛细管壁Si—OH基团的解离,增加电渗流,提高分离效率,但高柱温产生的高焦耳热使柱效降低,影响分离度。本文分别考察了不同电压(20,25,30 kV)和柱温(15,20,25,30 ℃)下主峰与碱变体2的分离度,结果表明,电压25 kV,柱温20 ℃时,主峰与碱变体2的分离度最高。
确定优化的实验条件为:分离电压25 kV,柱温20 ℃,EACA,HPMC和TETA的浓度分别为380 mmol·L-1,0.1%和1.9 mmol·L-1,缓冲液pH 6.0。在该条件下分离抗EGFR抗体参比制剂的基线良好,主峰与碱变体2的分离度最高(图3)。
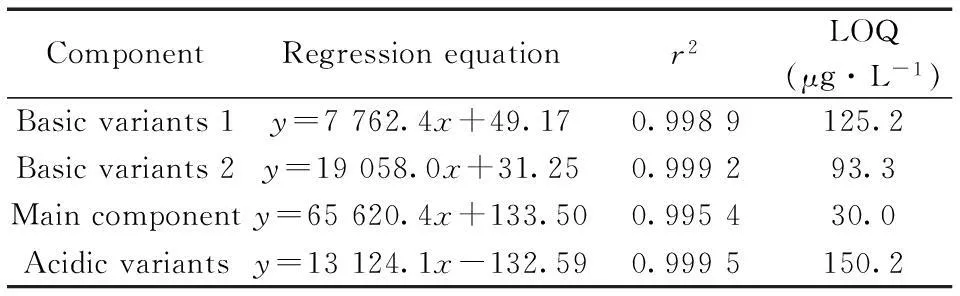
表1 线性和定量下限结果
2.2方法学考察
2.2.1线性与定量下限取抗EGFR抗体溶液,用超纯水稀释,配成1.0,0.75,0.5,0.25,0.1 mg·mL-1的系列浓度标准溶液进行线性考察,以浓度(x,mg·mL-1)为横坐标,峰面积为纵坐标(y)进行线性拟合,结果见表1。主成分及酸、碱变体的线性范围为0.1~1 mg·mL-1,相关系数均大于0.99。将抗EGFR抗体溶液继续稀释,以信噪比(S/N)为10时的抗体溶液浓度为定量下限,主成分、酸、碱变体1和碱变体2的定量下限(LOQ)分别为30.0,150.2,125.2,93.3 μg·L-1。
2.2.2重复性按“1.3”方法平行制备6份抗EGFR抗体溶液样品进行分析,考察6份样品的主峰、酸碱变体的迁移时间和相对百分含量(用面积归一化法计算)的平均值和相对标准偏差(RSD),结果见表2。6份样品的主峰、酸碱变体的迁移时间和相对百分含量的RSD均小于2%,重复性良好,可以满足电荷异质性的分析要求。
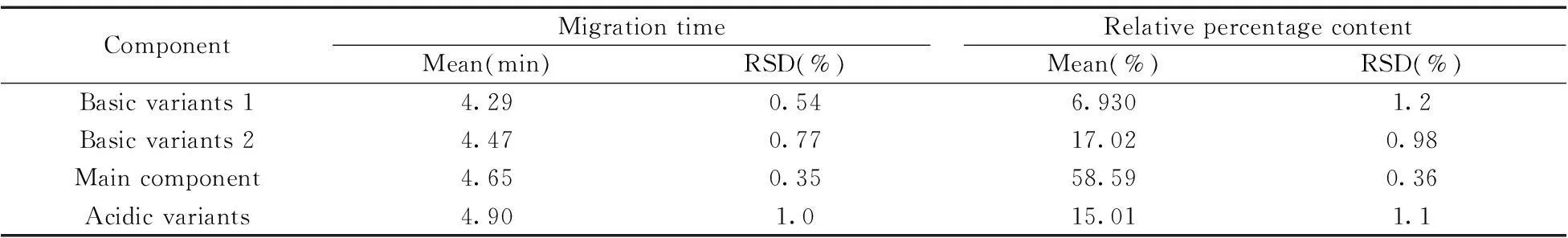
表2 重复性结果(n=6)
2.2.3中间精密度由另一分析人员按“1.3”方法平行制备6份抗EGFR抗体溶液样品进行分析,连同重复性考察的6份样品,分析此12份样品的主峰、酸碱变体的迁移时间和相对百分含量的平均值和RSD值,结果见表3。12份样品的主峰、酸碱变体的迁移时间和相对百分含量的RSD均小于2%,可见方法的中间精密度良好。
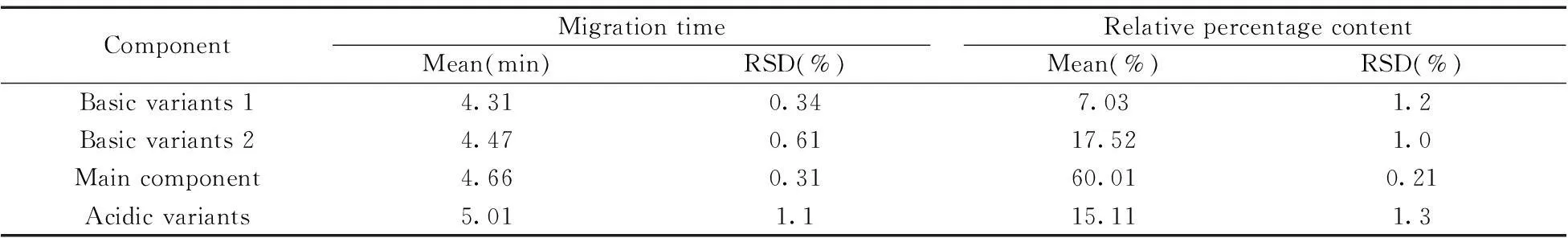
表3 中间精密度结果(n=12)
2.2.4准确度将EGFR抗体溶液稀释至1.0,0.75,0.5,0.25,0.1 mg·mL-1系列浓度,此浓度记为C0,每一浓度样品平行制备3份。进样分析得到各组分的峰面积对浓度的线性回归方程。将C0浓度下3份样品的峰面积平均值代入线性方程计算得到浓度Ce,则回收率R(recovery)%=Ce/C0×100%。各浓度的回收率见表4。结果显示各组分的回收率为95.4%~105.4%。
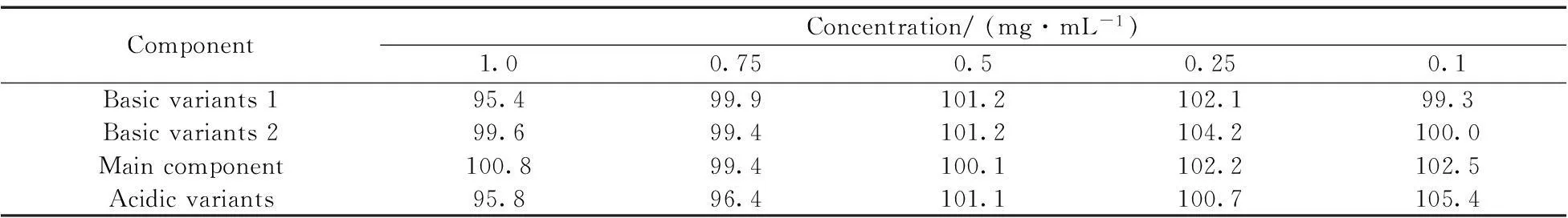
表4 不同浓度各组分的回收率
2.3样品测定及方法比较
按“1.3”方法平行制备3份抗EGFR抗体溶液样品,分别用本方法和文献方法[16]进行分析,结果如表5所示。结果显示,两种方法下,主峰的相对百分含量基本一致,RSD值小于1%;但文献所需的迁移时间长达19.433 min,而本文的出峰时间仅为4.846 min。可见本方法更快速,可以极大地提高检测效率。

表5 两种方法的比较
3结论
本文采用CZE模式,以EACA作为分离缓冲液,HPMC和TETA作为添加剂,建立了抗EGFR抗体电荷异质性的检测方法。该方法精密度和准确度良好,且不需要样品前处理、实验简单、快速、成本低,是一种理想的抗体电荷异质性检测方法。
参考文献:
[1]Ludwig D L,Pereira D S,Zhu Z P,Hicklin D J,Bohlen P.Oncogene,2003,22:9097-9106.
[2]Moritz B,Schnaible V,Kiessigl S,Heyne A,Wild M,Finkler C.J.Chromatogr.B,2015,983:101-110.
[3]Diepold K,Bomans K,Wiedmann M.PLoSOne,2012,7(1):e30295.
[4]Maeda E,Urakami K,Shimura K,Kinoshita M,Kakehi K.J.Chromatogr.A,2010,1217(45):7164-7171.
[5]Kumar M,Chatterjee A,Anand P K,Kusumanchi M,Adhikary L.J.Am.Soc.MassSpectrom.,2013,24(2):202-212.
[6]Sreedhara A,Cordoba A,Zhu Q,Kwong J,Liu J.PharmRes.,2012,29(1):187-197.
[7]Hopp J,Pritchett R,Darlucio M,Ma J F,Chou J H.Biotechnol.Prog.,2009,25(5):1427-1432.
[8]Feketea S,Beckb A,Guillarme D.J.Pharm.Biomed.Anal.,2015,111:169-176.
[9]Michels D A,Tu A W,McElroy W,Voehringer D,Salas-Solano O.Anal.Chem.,2012,84( 12):5380-5386.
[10]Li N,Kessler K,Bass L,Zeng D.J.Pharm.Biomed.Anal.,2007,43(3):963-972.
[11]Zhang L,Lawson K,Yeung B,Wypych J.Anal.Chem.,2015,87(1):470-476.
[12]Liu Q Q,Jia L.J.Instrum.Anal.(刘青青,贾丽.分析测试学报),2009,28(1):123-128.
[13]Cao J Z,Sun W,Gong F F,Liu W H.Electrophoresis,2014,35(10):1461-1468.
[14]He Y,Isele C,Hou W Y,Ruesch M.J.Sep.Sci.,2011,34:548-555.
[15]Shi Y,Li Z,Qiao Y B,Lin J.J.Chromatogr.B,2012,906:63-68.
[16]Cao J Z,Sun W,Gong F F,Liu W H.Chin.J.Pharm.Anal.(曹俊姿,孙雯,宫菲菲,刘万卉.药物分析杂志),2013,33(12):2092-2096.
[17]Guo W,Wang L,Wang W B,Zhang F,Yu C F,Li M,Liu C Y,Gao K.Chin.J.NewDrugs( 郭玮,王兰,王文波,张峰,于传飞,李萌,刘春雨,高凯.中国新药杂志),2014,23(20):2366-2381.
[18]Tamizi E,Jouyban A.Electrophoresis,2015,36:831-858.

摘要:建立了抗表皮生长因子受体(EGFR)抗体电荷异质性的检测方法。采用毛细管区带电泳(CZE)模式,考察了分离缓冲液浓度和pH值、添加剂、分离电压、毛细管温度对主峰与酸碱性变体分离度的影响。以380 mmol·L-16-氨基己酸(EACA,pH 6.0)为分离缓冲液,0.1%羟丙基甲基纤维素(HPMC)和1.9 mmol·L-1三亚乙基四胺(TETA)作为添加剂,分离电压25 kV,分离时间8 min,毛细管温度20 ℃条件下,电荷变体能够得到良好分离,且在0.1~1 mg·mL-1范围内线性关系良好,相关系数均大于0.99,主成分、酸、碱变体1和碱变体2的定量下限(LOQ)分别为30.0,150.2,125.2,93.3 μg·L-1,重复性和中间精密度RSD值小于2%,回收率为95.4%~105.4%。该方法简单、快速、成本低,可以满足抗EGFR抗体的电荷异质性检测要求。
关键词:毛细管区带电泳;电荷异质性;抗EGFR抗体;添加剂
Charge Variants Determination of Anti-EGFR Antibody by Capillary Zone ElectrophoresisKE Zhi,ZHOU Dong-mei,XU Jun,SUEN Wen-chen,YANG Bin*
(Sunshine Lake Pharma Co.,Ltd.,Dongguan523867,China)
Abstract:A simple and rapid capillary zone electrophoresis method was developed for charge variants determination of anti-epidermal growth factor receptor(EGFR) antibody.To obtain better resolution of antibody charge variants and less analysis time,a number of separation parameters were investigated,including concentration and pH value of separation buffer,concentration of additives,separation voltage and temperature of capillary.The optimized conditions were as follows: separation buffer:pH 6.0 380 mmol·L-16-aminocaproic acid(EACA) containing 0.1% hydroxypropyl methyl cellulose(HPMC) and 1.9 mmol·L-1triethylenetetramine(TETA);applied separation voltage:25 kV;capillary temperature: 20 ℃.Under the optimized conditions,the highest resolution was obtained among all the charge variants in 8 min.Meanwhile,all the components,including the main component,acidic variants,basic variants 1 and basic variants 2,were linear in the range of 0.1-1 mg·mL-1with correlation coefficients more than 0.99.The limit of quantitation for the four charge variants were 30.0,150.2,125.2 ,93.3 μg·L-1,respectively.The method showed a good repeatability and intermediate precision for all components with RSDs less than 2%,and the recoveries for all the antibody charge variants ranged from 95.4% to 105.4%.This method was simple,rapid and low cost,and could meet the requirement for the determination the charge variants of anti-EGFR antibody.
Key words:capillary zone electrophoresis;charge variants;anti-EGFR antibody;additives
中图分类号:O657.8;S852.43
文献标识码:A
文章编号:1004-4957(2015)12-1414-05
doi:10.3969/j.issn.1004-4957.2015.12.015
通讯作者:*杨彬,硕士,研究方向:单克隆抗体药物,Tel:0769-39005888-5717,E-mail:YangBin@hecpharm.com
基金项目:广东省引进创新科研团队计划项目(201101Y0104990178)
收稿日期:2015-05-12;修回日期:2015-05-26
