6-硫鸟嘌呤与邻氨基苯磺酸共聚物修饰电极的制备及其对抗坏血酸和多巴胺的同时测定
2016-01-27兰德香
兰德香,张 雷
(上海师范大学 生命与环境科学学院 化学系,上海 200234)
6-硫鸟嘌呤与邻氨基苯磺酸共聚物修饰电极的制备及其对抗坏血酸和多巴胺的同时测定
兰德香,张雷*
(上海师范大学生命与环境科学学院化学系,上海200234)
抗坏血酸(AA)是一种天然存在的具有抗氧化性质的有机化合物[1-2],是均衡饮食的重要成分,也是维持人体健康必需的一种水溶性维生素。在人体组织中,AA具有很强的生理活性:促进胶质的形成,参与神经介质的反应及类固醇、酪氨酸的代谢,蛋白质的转化及机体的氧化、还原等复杂代谢过程,促进生长和抗体的形成,增强对疾病的抵抗力,如普通感冒、神经性疾病、癌症和艾滋病等[1,3-4]。此外,AA常被作为食品添加剂用于腌肉、果蔬罐头以及啤酒饮料等食品中,起到促进呈色及抗氧化等作用[2,5]。人体若长期缺乏AA将会导致坏血病等疾病的发生,因此对AA的定量分析检测具有重要意义。
多巴胺(DA)是哺乳类动物中枢神经系统重要的神经递质,人体内DA含量失调会引发心脏病、帕金森氏症等疾病[1,3]。另外,DA类物质还是重要的拟肾上腺素药,可用于心原性及感染性休克的急救及神经紊乱、支气管哮喘、高血压和心肌梗塞等疾病的治疗[6]。因此,DA浓度的测定对于神经生理学研究、疾病诊断及相关药物的质量控制也尤为重要。目前,对于AA和DA等生物分子的检测主要采用光谱法[7]、高效液相色谱法[8]、电泳法[9]、酶法[10]及电化学法[1,3,11]等。但这些方法普遍存在易受其他还原性物质干扰和灵敏度低等缺点。虽然光谱法和高效液相色谱法能提高灵敏度和增强专一性,但复杂的样品前处理程序、漫长的分析时间及大型、昂贵的分析仪器导致其未能得到广泛应用;电泳法和酶法也因程序繁琐和价格昂贵[12-13]而受到了限制。
AA、DA的电活性[14]及电化学方法的快速、简便、高灵敏、低成本和高选择性等优点[12],使人们对二者的电化学分析方法越来越重视。但由于人体内AA的浓度通常为DA的10~100倍[15],且AA和DA在常规电极上具有较高的相互接近的氧化过电位、电子传递速率缓慢、其本身及其氧化产物易吸咐在电极表面而使电极“污染”等特点,从而极大地影响了分析效果[1,6,14]。为了提高测定的选择性和灵敏度,人们将多种材料覆盖在电极表面制备了各种各样的修饰电极,如石墨烯[16]、碳纳米管[1,17]、金属纳米粒子[18-19]、导电聚合物[3,20-22]等。聚合物修饰电极由于制备方法简单,使用寿命长,活性基团的浓度大,电化学响应信号强及选择性良好而被广泛应用于物质检测及分析,如聚噻吩[21]、聚噻唑[22]、聚谷氨酸[23]、聚苯胺[11,24]、聚吡咯[25]等已被大量报道;而对于嘌呤的聚合、在修饰电极上的应用及其与生物分子相互作用方面的研究鲜有报道。本文采用电聚合法将6-硫鸟嘌呤(6-TG)和邻氨基苯磺酸(ABSA)进行共聚制备了6-TG和ABSA二者共聚物修饰的玻碳电极(GCE),详细研究了该修饰电极的形貌及其电化学特性,并将其应用于尿样中AA和DA 的检测,结果满意。
1实验部分
1.1仪器与试剂
6-TG、ABSA(上海迈瑞尔化学技术有限公司),AA(上海曹杨二中化工厂),DA(Sigma公司),PBS(pH 4.0~9.0)由0.1 mol·L-1的NaH2PO4和Na2HPO4溶液配制,其他试剂均为分析纯,实验用水为二次去离子水(18.2 MΩ·cm)。
CHI660C电化学工作站(上海辰华有限公司);三电极系统:参比电极为饱和甘汞电极(SCE);辅助电极为铂电极(Pt);工作电极为GCE(Ф=3.0 mm)、聚6-TG修饰的GCE(P6-TG/GCE),聚ABSA修饰的GCE(PABSA/GCE)及聚(6-TG+ABSA)修饰的GCE(P6-TG-ABSA/GCE)。
S-4800场发射扫描电子显微镜(SEM,日本日立公司);DPV测试电位为-0.2~0.7 V,扫速为0.02 V·s-1,脉冲幅度为0.025 V·s-1,频率为0.5 s,脉冲宽度为0.06 s。在所有实验中,溶液和电极保持静止,均在室温(约20±3 ℃)下完成。
电化学阻抗(EIS)测量均在1 mmol·L-1K3Fe(CN)6、1 mmol·L-1K4Fe(CN)6及0.1 mol·L-1KNO3的混合液中进行。开路电位为0.21 V,频率范围为0.01~100 kHz。
1.2修饰电极的制备
将GCE依次用0.3 μm和0.05 μm的氧化铝粉抛光至镜面,用水冲洗后,再依次在无水乙醇和水中各超声清洗 2 min,高纯氮气吹干,室温保存备用。
将处理好的GCE置于含有1 mmol·L-16-TG和1 mmol·L-1ABSA的 0.1 mol·L-1H2SO4混合液中,用循环伏安法(CV)以0.05 V·s-1的扫速在-0.6~2.0 V范围内扫描15圈后,取出电极,再将修饰后的电极分别置于乙醇和水中各超声清洗 2 min,以除去表面未反应的6-TG和ABSA单体,从而制得聚(6-TG+ABSA)修饰的GCE(P6-TG-ABSA/GCE)。将修饰电极置于0.1 mol·L-1pH 5.0的PBS溶液中室温保存,备用。
1.3实验方法
在10 mL容量瓶中,加入一定量的AA和DA混合溶液,用pH 5.0的0.1 mol·L-1PBS稀释至刻度。移取3 mL该溶液于电解池中,以P6-TG-ABSA/GCE为工作电极,采用循环伏安法或差分脉冲伏安法,研究修饰电极对AA和DA的电催化氧化及同时测定。
2结果与讨论
2.1修饰电极的制备与表征
2.1.16-TG/ABSA在GCE上的电化学聚合图1为GCE在含有1 mmol·L-1ABSA、1 mmol·L-16-TG及含有1 mmol·L-1ABSA+1 mmol·L-16-TG混合物的H2SO4(0.1 mol·L-1)溶液中电聚合15圈的CV图。
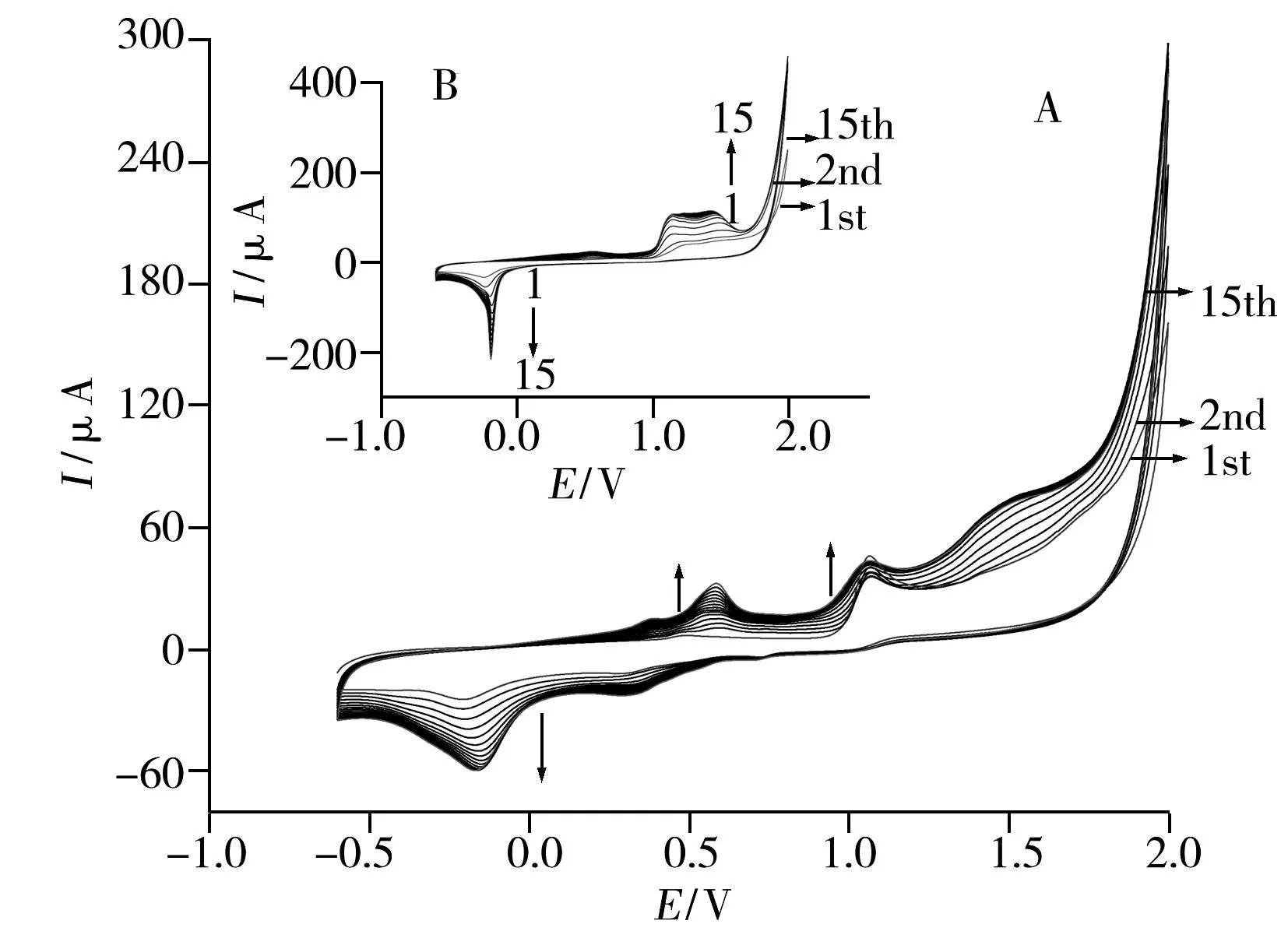
由图1可以看出,与ABSA(图1A)和6-TG(图1B)的单独电聚合行为相比,ABSA和6-TG混合物的电化学行为(图1C)具有显著的不同,这表明ABSA和6-TG确实发生了共聚反应而生成了新的聚合物。基于ABSA(图1A)和6-TG(图1B)的电化学行为,在二者共聚的CV图(图1C)中,CV扫描的第1圈,出现了2个峰电位分别位于0.75 V和1.07 V的氧化峰和1个峰电位位于-0.19 V的还原峰。其中,位于0.75 V的氧化峰归因于6-TG分子中巯基的氧化而生成6-TG阳离子自由基(6-TG+);位于1.07 V的氧化峰则是由于ABSA单体中的氨基被氧化[26]而生成ABSA阳离子自由基(ABSA+);位于-0.19 V的还原峰应是6-TG+和ABSA+发生阳离子交联反应(Cross-reaction)生成的6-TG和ABSA的二聚物/低聚物的电还原所致。从第2圈开始,位于0.75 V和1.07 V的2个氧化峰逐渐减弱并消失;从第4圈开始,出现了4个峰电位分别位于0.60,0.73,1.20,1.58 V的新氧化峰。这是由于在第1圈中,当6-TG和ABSA分别被氧化生成其相应的阳离子自由基后,其阳离子自由基6-TG+和ABSA+即发生交联反应生成二者的二聚物/低聚物,这些二聚物/低聚物在第2圈扫描中即发生各自的电氧化反应而形成了相应的氧化峰;随着交联反应的持续进行,电极表面6-TG+和ABSA+的量逐渐减少,最终全部转化为聚合物,从而导致第1圈中的两个氧化峰逐渐减弱并消失。随着CV扫描的持续进行,新出现的4个氧化峰和位于-0.19 V的还原峰不仅稳定存在,而且其峰电流均随着扫描圈数(4→15)的增加而增大。这表明通过6-TG+和ABSA+交联反应生成的聚合物不仅成功地修饰在电极表面,而且随着扫描的持续进行,电极表面共聚物的量增多,直至15圈为止。此外,值得注意的是,从第2圈开始,共聚物的起始氧化电位(Onset potential)随着扫描的持续进行呈逐渐负移的趋势,这表明共聚物的骨架链逐渐增长,聚合物的共轭度逐渐增大,从而使其越来越易被氧化[27]。最后,在电极表面观察到一层光滑、均匀的深蓝色薄膜。
聚合结束(15圈)后,用水仔细冲洗电极表面聚合物薄膜中未发生聚合反应的单体,并再次将其置于0.1 mol·L-1H2SO4的空白溶液中,在-0.6~2.0 V范围内以0.05 V·s-1扫速继续扫描15圈,使电极表面未反应的6-TG和ABSA单体继续氧化聚合,并使电极表面的共聚物进行深度的“重排”,使其更加有序化(图2)。
2.1.2修饰电极的表面形貌 图2为P6-TG/GCE,PABSA/GCE及P6-TG-ABSA/GCE的SEM图。由图2可知,固载在电极表面的这3种聚合物膜分别呈现出不同的结构形貌。其中,P6-TG膜呈“棒-块”状交替的非均匀结构(图2A),聚合物棒的直径约为30~60 nm,块状物的直径约为50~200 nm;PABSA呈较为均匀的一层膜(图2B),其间分布着一维的直径约为50~80 nm、长度约为1~5 μm的线状聚合物;共聚物P6-TG-ABSA膜呈均匀光滑的有序纳米粒子结构,纳米粒子的直径约为2~50 nm(图2C)。这不仅表明共聚物膜P6-TG-ABSA成功地修饰到电极表面,而且也显示该共聚物膜在电极表面的有序生成。这种均匀、有序的纳米结构为生物分子的负载及其电催化氧化提供了更好的活性平台。

图2 P6-TG/GCE(A),PABSA/GCE(B) 及P6-TG-ABSA/GCE(C)的扫描电镜图
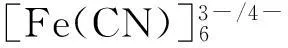
由图3可知,GCE的电荷交换电阻约为40 Ω;当在其表面修饰上PABSA膜时,其Rct值增至400 Ω;当在其表面修饰上P6-TG膜时,Rct值增至1 250 Ω;当在其表面修饰上P6-TG-ABSA膜时,电极的Rct值显著增加到2 300 Ω。EIS结果不仅表明P6-TG膜、PABSA膜和P6-TG-ABSA膜对电荷的传递具有阻碍作用,而且也表明共聚物P6-TG-ABSA膜已修饰在电极表面。
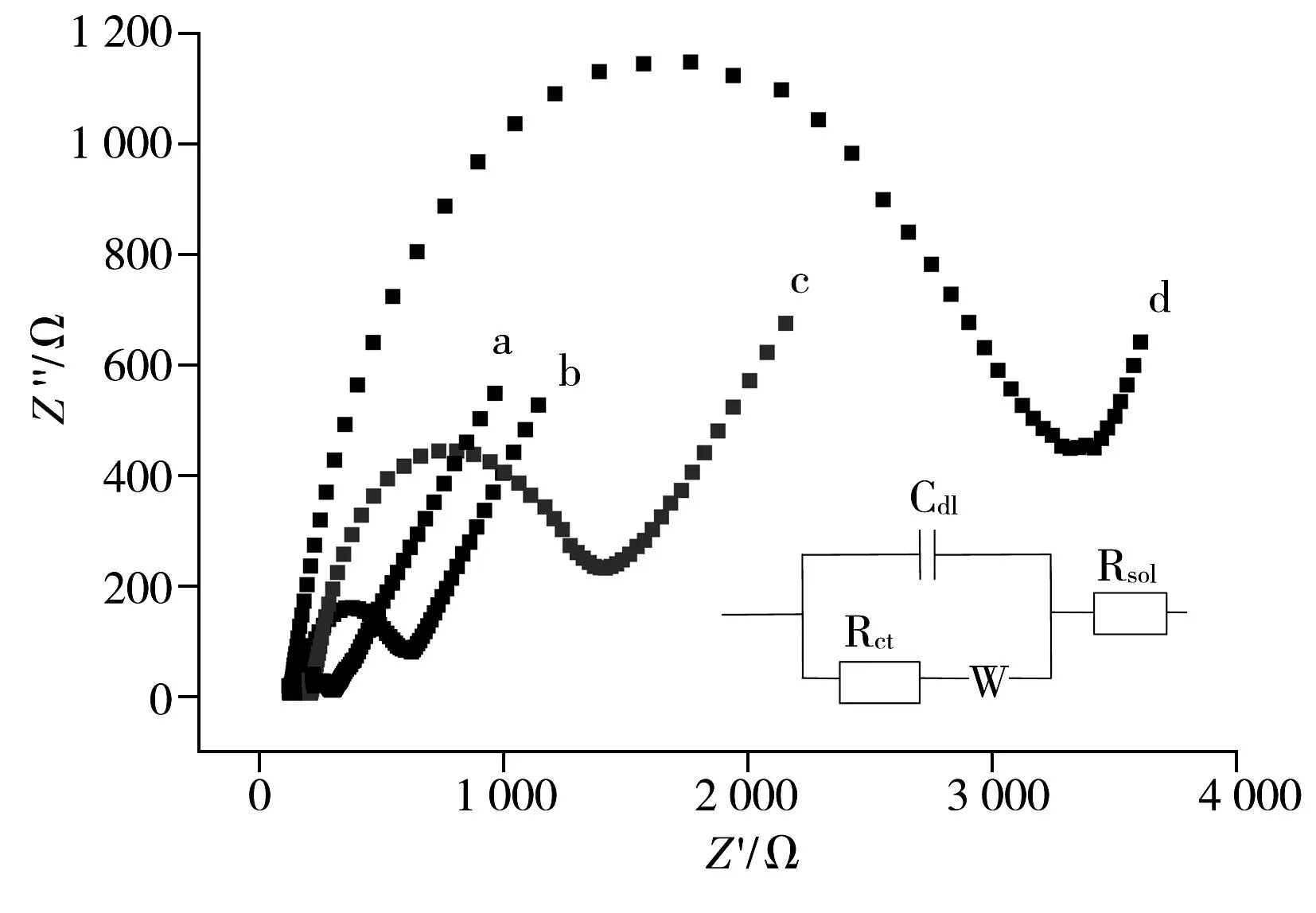
图3 GCE(a),PABSA/GCE(b),P6-TG/GCE(c)和P6-TG-ABSA/GCE(d)的EIS图Fig.3 EIS plots of GCE(a),PABSA/GCE(b),P6-TG/GCE(c) and P6-TG-ABSA/GCE(d) in the presence of equimolar 1 insert:the Randles equivalent circuit;electrolyte:0.1 mol·L-1 KNO3
2.2AA和DA在修饰电极上的电化学氧化
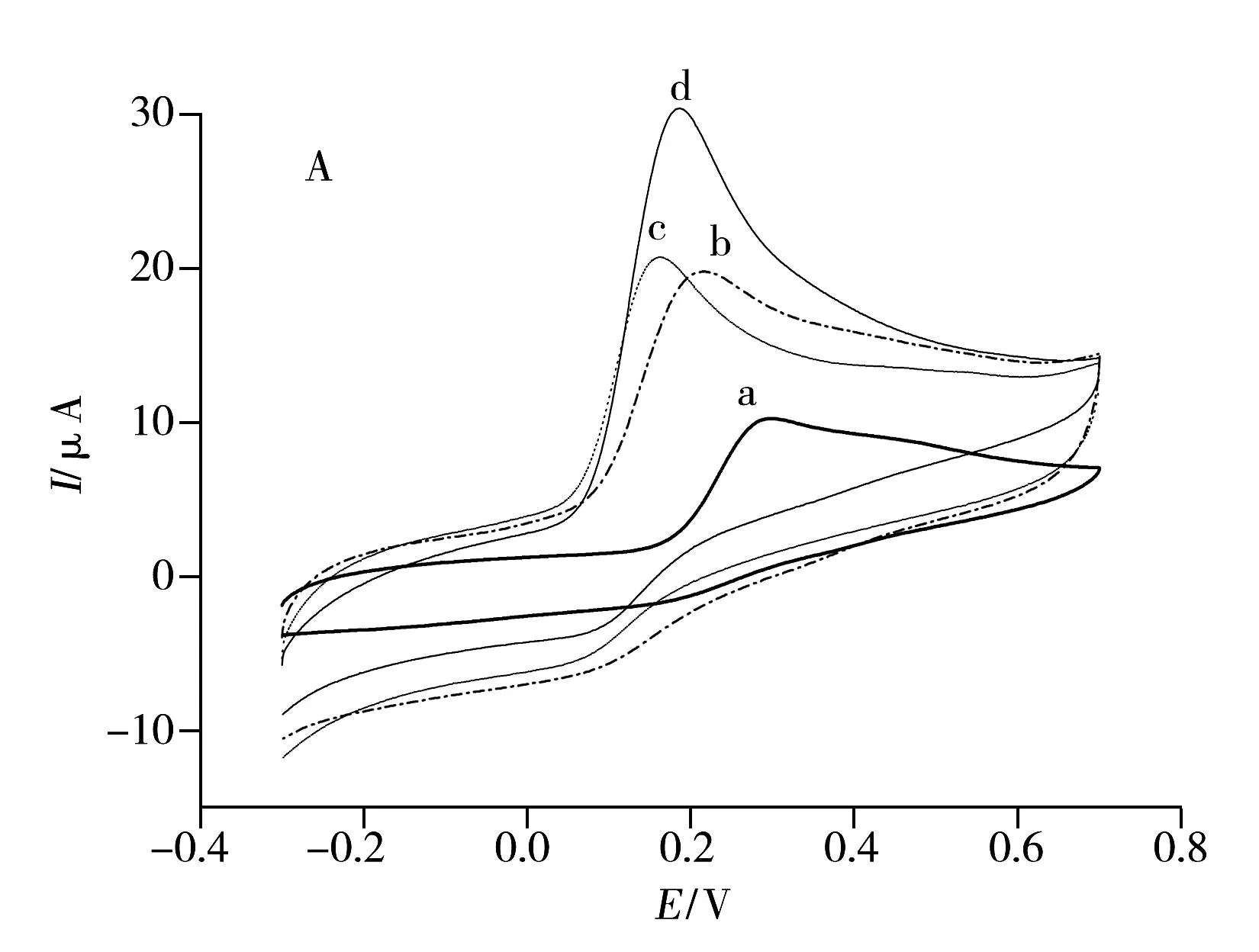
为研究AA和DA在修饰电极上的电化学行为,分别考察了AA和DA在GCE,PABSA/GCE,P6-TG/GCE和P6-TG-ABSA/GCE上的伏安响应(见图4)。从图4A可以看出,在GCE(曲线a)上,AA呈现出1个位于0.30 V处宽的弱氧化峰;在PABSA/GCE(曲线b)上,AA的氧化峰电位为0.22 V。与裸GCE相比,AA在PABSA/GCE上不仅具有较低的氧化过电位,而且其氧化峰电流也大幅增加,为其在GCE上峰电流的1.7倍;在P6-TG/GCE(曲线c)上,AA具有比在PABSA/GCE上更低的氧化峰电位(0.16 V)和更强的峰电流响应(为其在GCE上峰电流值的1.8倍);在P6-TG-ABSA/GCE(曲线d)上,AA的氧化峰电位为0.18 V。与裸GCE相比,AA在P6-TG-ABSA/GCE上不仅具有较低的氧化过电位,而且氧化峰电流也大大增加,为其在裸GCE上峰电流值的3.1倍。由此可见,与裸GCE相比,AA在PABSA/GCE、P6-TG/GCE和P6-TG-ABSA/GCE上均有较低的氧化过电位和较强的峰电流响应,表明此3种修饰电极对AA的电化学氧化具有催化作用,而P6-TG-ABSA/GCE电极的催化作用最为显著。
从图4B可以看出,在GCE(曲线a)上,DA在0.37 V处呈现1个很宽的弱氧化峰,而在PABSA/GCE(曲线b)、P6-TG/GCE(曲线c)和P6-TG-ABSA/GCE(曲线d)上,DA的氧化过电位均负移,分别为0.31,0.30,0.30 V;且峰电流均增大,分别为DA在GCE上峰电流的2.0,2.9及7.3倍,以P6-TG-ABSA/GCE的表现最为突出。在该共聚物修饰的GCE上,DA的氧化峰负移到0.30 V处,较GCE减小了0.07 V,且峰电流为GCE,PABSA/GCE及P6-TG/GCE的7.3,3.7和2.5倍,这表明P6-TG-ABSA/GCE对DA有较好的催化氧化作用。
2.3P6-TG-ABSA/GCE对混合液中AA和DA的电化学区分
为了考察P6-TG-ABSA/GCE的实用性,分别采用CV法和DPV法研究了AA和DA的混合液在GCE,PABSA/GCE,P6-TG/GCE和P6-TG-ABSA/GCE上的电化学行为(图5)。
图5A为2 500 μmol·L-1AA和85 μmol·L-1DA的混合溶液在裸GCE(曲线a),PABSA/GCE(曲线b),P6-TG/GCE(曲线c)和P6-TG-ABSA/GCE(曲线d)上的CV图。由图中曲线a、b可知,AA和DA在GCE和PABSA/GCE上的氧化峰几乎重叠,不能将二者区分开;而从曲线c、d可以看出,AA和DA的混合液在P6-TG/GCE和P6-TG-ABSA/GCE上呈现出两个分开的氧化峰。另外,与AA和DA在P6-TG/GCE上的氧化峰相比,其在P6-TG-ABSA/GCE上具有更强的峰电流响应。值得注意的是,PABSA膜对DA有较好的催化氧化作用,而P6-TG膜对AA和DA的重叠氧化峰有较好的区分作用,二者的协同作用使得P6-TG-ABSA/GCE不仅能很好地区分AA和DA的氧化峰,而且能使其氧化电流大大增加。在P6-TG-ABSA/GCE(曲线d)上,AA和DA的氧化峰电位分别位于0.18 V和0.35 V,峰间距为0.17 V。以上结果表明,该修饰电极不仅能有效改善AA和DA的电化学行为,而且能将AA和DA在GCE上的重叠氧化峰完全分开成两个灵敏的氧化峰。因此,该修饰电极可用于混合液中AA和DA的选择性测定和同时测定。
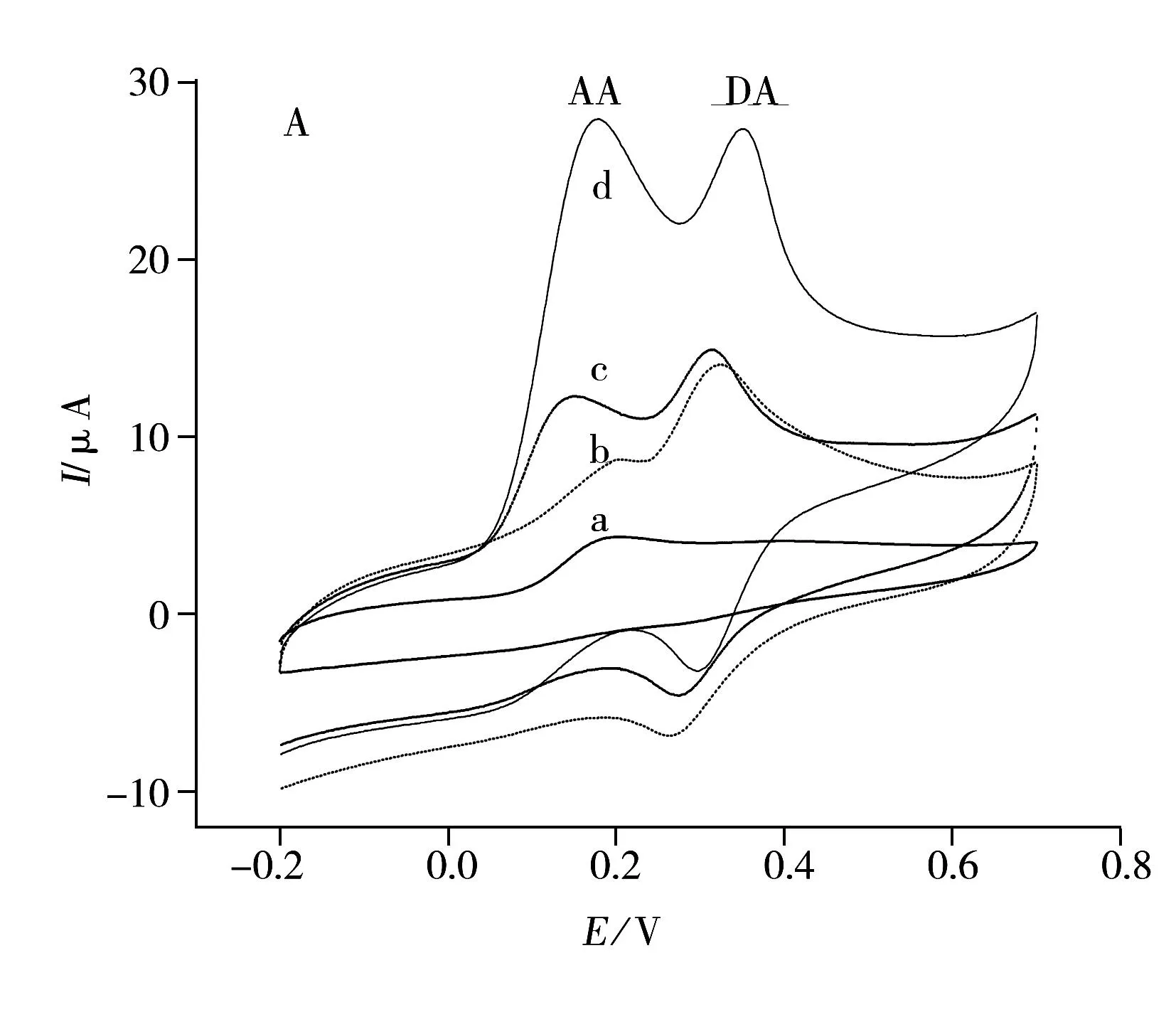
图5B为2 500 μmol·L-1AA和85 μmol·L-1DA的混合溶液分别在裸GCE(曲线a)、PABSA/GCE(曲线b)、P6-TG/GCE(曲线c)和P6-TG-ABSA/GCE(曲线d)上的DPV图。由图可知,AA和DA的混合液在GCE上分别于0.14 V和0.31 V处出现两个宽的弱氧化峰,在PABSA/GCE和P6-TG/GCE上分别于0.12 V/0.28 V和0.14 V/0.31 V处出现两个氧化峰,在P6-TG-ABSA/GCE上分别于0.10 V和0.30 V处出现两个氧化峰。以上结果表明,P6-TG-ABSA/GCE不仅能对AA和DA的氧化峰电位进行有效区分(AA与DA的峰间距为0.20 V),而且能有效地改善AA和DA的峰电流响应:AA在该共聚物修饰电极上的峰电流值分别为其在GCE,PABSA/GCE及P6-TG/GCE上的8.9,9.1及3.1倍;DA在该修饰电极上的峰电流值分别为其在GCE,PABSA/GCE及P6-TG/GCE上的12.2,1.6及2.0倍。这表明该电极可以用于混合液中AA和DA的选择性测定和同时测定。
2.4介质酸度的选择
介质的酸度对AA和DA的电化学行为有较大影响。考察了不同酸度介质下AA和DA的电化学行为。图6为P6-TG-ABSA/GCE在不同酸度(pH 4.0~9.0)的0.1 mol·L-1PBS介质中对AA和DA的电化学响应。由图6可知,AA和DA的氧化峰电位均随着介质pH值的增加而逐渐负移,说明质子参与了电极反应。另外,从图6A可以看出,当介质pH值从4.0增至5.0时,AA的峰电流值逐渐增加,并达到最大值,此后随着溶液pH值的继续增大,AA的氧化峰电流又逐渐减弱。从图6B可以看出,随着介质的pH值从4.0增至7.0,DA的峰电流逐渐增加;当溶液pH值为7.0时,DA的氧化峰电流达到最大值,此后随着溶液pH值的继续增大,DA 的氧化峰电流又逐渐减弱。基于此,为了获得高区分度和高灵敏度,本实验选用pH 5.0的0.1 mol·L-1PBS作为测定介质。
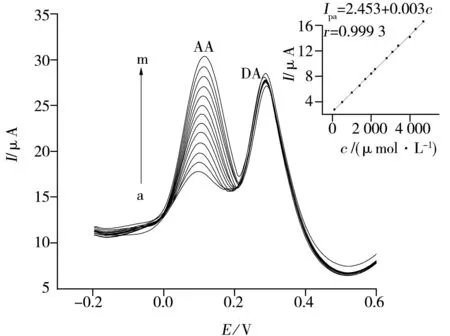
图7 DA存在下,不同浓度的AA在P6-TG-ABSA/GCE上的DPV图Fig.7 DPV curves of AA at P6-TG-ABSA/GCE in the presence of DAcAA(a→m):100,500,1 000,1 400,1 700,2 000,2 200,2 800,3 100,3 400,4 000,4 300,4 700 μmol·L-1;cDA:110 μmol·L-1;buffer: pH 5.0 0.1 mol·L-1 PBS
2.5AA与DA在P6-TG-ABSA/GCE上的选择性测定
为了考察共存于同一混合液中的AA和DA在电化学选择性测定时相互之间的影响,分别在保持溶液中一种待测物浓度不变的情况下,研究不同浓度的另一种物质在修饰电极上的电化学行为。结果显示,若保持DA的浓度不变,在一定范围内增加AA的浓度,AA的峰电流随其浓度的增加而线性增加,而DA的峰电流几乎保持不变(图7)。AA的峰电流在100~4 700 μmol·L-1浓度范围内,其线性方程为Ipa(AA)=2.453+0.003cAA(r=0.999 3)。同样,若保持AA的浓度不变,在一定范围内增加DA的浓度,DA的峰电流也随其浓度的增加而线性增加,而AA的峰电流几乎保持不变,在10~320 μmol·L-1浓度范围内,DA的峰电流与其浓度的线性方程为Ipa(DA)=7.189+0.062 4cDA(r=0.999 8)。这表明在AA和DA共存的混合溶液中,一种物质的存在不会干扰另外一种物质的响应。因此,P6-TG-ABSA/GCE可用于混合溶液中AA或DA的选择性测定。
2.6AA与DA在P6-TG-ABSA/GCE上的同时测定
采用DPV法,将P6-TG-ABSA/GCE用于混合溶液中AA和DA的同时测定。结果显示,AA和DA的氧化峰电流在一定范围内均随其浓度的增加而线性增大,线性范围分别为2~5 000 μmol·L-1和2~180 μmol·L-1,回归方程分别为Ipa(AA)=2.45+0.003cAA(r=0.999 8)和Ipa(DA)=7.12+0.063cDA(r=0.999 7)。AA和DA的检出限(S/N=3)分别为0.06 μmol·L-1和 0.05 μmol·L-1。相比于表1中列出的同时测定AA和DA的其他研究,本方法具有较好的选择性和较宽的检测范围。
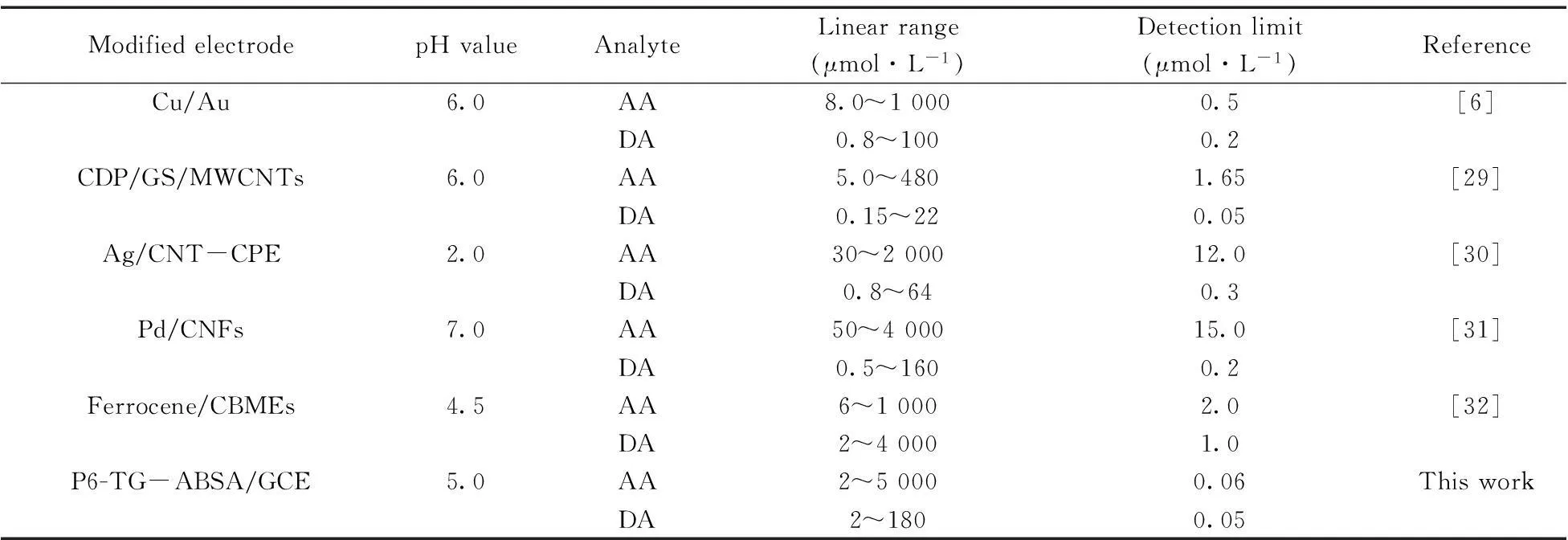
表1 本法与其它同时测定AA和DA的电化学方法的比较
2.7AA与DA在不同扫速下的电化学行为
考察了不同扫速下AA和DA在P6-TG-ABSA/GCE上的CV图。结果显示,当扫速(v)在30~220 mV·s-1范围时,AA的氧化峰电流随扫速平方根的增大而线性增加,线性方程为Ipa(AA)=0.66v1/2+2.05(r=0.998 4),表明AA在P6-TG-ABSA/GCE上的电极反应为扩散控制过程。当扫速(v)在30~290 mV·s-1范围时,DA的氧化峰电流随扫速的增大而线性增大,线性方程为Ipa(DA)=0.11v+1.67(r=0.998 7),表明DA在P6-TG-ABSA/GCE上的电极反应受吸附过程控制。
2.8干扰研究
2.9电极的重现性与稳定性
采用重复测定含有120 μmol·L-1AA和60 μmol·L-1DA混合液的方法考察了P6-TG-ABSA/GCE的重现性和稳定性。15次连续测定AA和DA结果的相对标准偏差(RSD)分别为2.7%和2.3%;另外,用5根采用相同方法制备的修饰电极对含有120 μmol·L-1AA和60 μmol·L-1DA的混合液进行测量,AA和DA的RSD分别为2.9%和2.5%,表明该修饰电极有较好的重现性。测定完毕后,将修饰电极在室温下保存于0.1 mol·L-1PBS(pH 5.0)中,其峰电流在1周内基本不变,2周后下降约3.8%,30 d后下降约5.7%,表明修饰电极具有较好的稳定性。
2.10样品分析
采用该电极对人体尿液样本中的AA和DA进行分析。尿液样本在检测前用0.1 mol·L-1pH 5.0的PBS进行稀释。为了验证该方法的有效性,采用标准加入法在尿样中加入一定量的AA和DA标准溶液,然后测定AA和DA的浓度,结果见表2。由表2可知,AA和DA的回收率分别为97.1%~103.7%和94.5%~101.4%,表明P6-TG-ABSA/GCE能有效地应用于实际样品中AA和DA的同时测定。
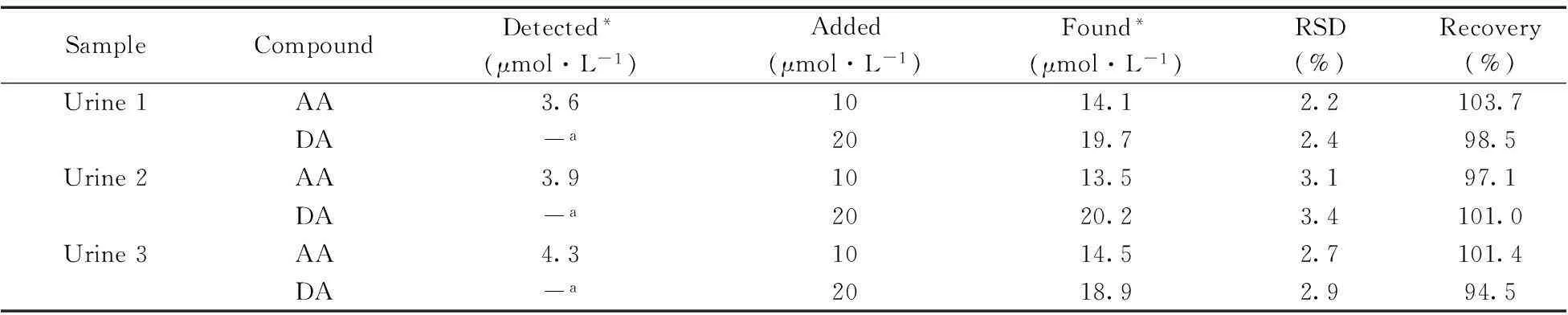
表2 尿样中AA和DA的同时测定(n=5)
*mean value(n=5);a.no detected
3结论
本文采用简单的两步电化学法将6-TG和ABSA共聚在GCE表面,制备了均匀的聚6-TG-ABSA纳米颗粒修饰的玻碳电极(P6-TG-ABSA/GCE),并采用CV法和DPV法研究了AA和DA在该修饰电极上的电化学行为。结果表明,纳米态的共聚物颗粒不仅大大改善了AA和DA的氧化还原行为,而且还将两者在裸电极上重叠的氧化波分成两个明显的强氧化峰。因此,P6-TG-ABSA/GCE可用于混合液中AA和DA的同时测定。该法具有修饰简单、灵敏度高、选择性好和检测范围宽等优点,已成功用于尿样中AA和DA的同时测定。
参考文献:
[1]Wang C,Yuan R,Chai Y Q,Chen S H,Zhang Y,Hu F X,Zhang M H.Electrochim.Acta,2012,62:109-115.
[2]Zhang W,Zhao X J,Huang D D,Chen H G,Hou X X.J.Instrum.Anal.(张威,赵晓娟,黄丹丹,陈海光,侯向昶.分析测试学报),2013,32(12):1438-1442.
[3]Kalimuthu P,John S A.Talanta,2010,80:1686-1691.
[4]Wei X P,Li J P,Cui G P,Yang W Q.J.Instrum.Anal.(魏小平,李建平,崔桂平,阳文琼.分析测试学报),2009,28(4):428-431.
[5]Xiao M J.ChinaFoodAddit.(肖明均.中国食品添加剂),1997,(1):34-35.
[6]Zhang Y,Ren W.Chem.Res.Appl.(张英,任旺.化学研究与应用),2008,20(4):382-385.
[7]GB/T5009.159-2003.Determination of Reductive-form Ascorbic Acid in Food.National Standards of the Peoples Republic of China(食品中还原型抗坏血酸的测定.中华人民共和国国家标准),2004.
[8]Martin A,Petra P,Andrea C,Petra B,Karel V.FoodChem.,2012,135:1613-1618.
[9]Niu Y,Sun X M,Sun J L,Zhao C Z.J.QingdaoUniv.Sci.Technol.(牛燕,孙雪梅,孙久龙,赵常志.青岛科技大学学报),2008,29(3):206-209.
[10]Chen Z L,Hayashi K,Iwasaki Y,Kurita R,Niwa O,Sunaawa K.Electroanalysis,2005,17(3):231-238.
[11]Zhao X J,Zhang W,Chen H G,Chen Y J,Huang G Y.FoodAnal.Methods,2014,7:1557-1563.
[12]Wang Y,Tong L L.Sens.ActuatorB,2010,150:43-49.
[13]Ojani R,Alinezhad A,Abedi Z.Sens.ActuatorB,2013,188:621-630.
[14]Zhang Y,Ren W,Li M J.J.Electrochem.(张英,任旺,李敏娇.电化学),2012,18(1):79-83.
[15]Qiu P.J.Instrum.Anal.(邱萍.分析测试学报),2011,30(8):933-936.
[16]Yang J,Liu Z M,Zhan H J,Wang Z L.J.Instrum.Anal.(杨君,刘志敏,展海军,王珍玲.分析测试学报),2014,33(4):403-408.
[17]Zhang W,Yuan R,Chai Y Q,Zhang Y,Chen S H.Sens.ActuatorB,2012,166/167:601-607.
[18]Wang C,Yuan R,Chai Y Q,Zhang Y,Hu F X,Zhang M H.Biosen.Bioelectron.,2011,30:315-319.
[19]Zhang L,Yuan W J,Hou B Q.J.Electroanal.Chem.,2013,689:135-141.
[20]Zhang L,Yang D,Wang L L.Electrochim.Acta,2013,111:9-17.
[21]Kumar S S,Mathiyarasu J,Phani K L N,Yegnaraman V.J.SolidStateElectrochem.,2006,10:905-913.
[22]Revin S B,John S A.Electrochim.Acta,2011,56:8934-8940.
[23]Lin X Q,Jin G P,Cui H.Chin.J.Anal.Chem.(林祥钦,晋冠平,崔华.分析化学),2002,30(3):271-275.
[24]Prathap M U A,Srivastava R.Sens.ActuatorB,2013,177:239-250.
[25]Ghanbari K,Hajheidari N.Anal.Biochem.,2015,473:53-62.
[26]Randall S D,Mankit H,James W A,Marc D P.Langmuir,1994,10:1306-1313.
[27]Liu X Q,Huang F X,Zeng D M,Huang F J,Liu Z X.Electroplating&Finishing(刘小勤,黄凤祥,曾冬铭,黄发军,刘中兴.电镀与涂饰),2015,34(1):1-7.
[28]Qiu D F,Bao X Y,Feng Y Q,Liu K C,Wang H W,Shi H Z,Guo Y C,Huang Q Z,Zeng J L,Zhou J,Xing Z C.Electrochim.Acta,2012,6:339-346.
[29]Zhang Y,Yuan R,Chai Y Q,Li W J,Zhong X,Zhong H A.Biosen.Bioelectron.,2011,26:3977-3980.
[30]Tashkhourian J,Hormozi N M R,Khodavesi J,Javadi S.J.Electroanal.Chem.,2009,633:85-91.
[31]Huang J S,Liu Y,Hou H Q,You T Y.Biosen.Bioelectron.,2008,24:632-637.
[32]Zhang J,Deng P H,Kuang Y F,Li J N.Chin.J.Anal.Lab.(张军,邓培红,匡云飞,黎拒难.分析试验室),2004,23(8):67-69.

摘要:采用电化学法将6-硫鸟嘌呤(6-TG)和邻氨基苯磺酸(ABSA)共聚在玻碳电极(GCE)表面,制备了6-TG和ABSA的共聚物(P6-TG-ABSA)修饰的GCE(P6-TG-ABSA/GCE),并采用扫描电镜(SEM)及电化学方法对修饰电极的形貌和电化学特性进行表征。SEM图片显示6-TG和ABSA的共聚物呈规则、均匀的颗粒状结构,这有利于其对分析物的电催化作用;循环伏安和差分脉冲伏安分析结果表明,该修饰电极在0.1 mol·L-1的磷酸盐缓冲溶液(PBS,pH 5.0)中,对抗坏血酸(AA)和多巴胺(DA)具有良好的电催化响应,与其在聚6-硫鸟嘌呤和聚邻氨基苯磺酸单聚物修饰电极上的电化学行为相比,二者的氧化峰电流明显增加,峰电位差(ΔEpa)为0.20 V,可对二者进行同时测定。在优化实验条件下,AA和DA的线性范围分别为2~5 000 μmol·L-1和2~180 μmol·L-1,相关系数分别为0.999 8和0.999 7,检出限(S/N=3)分别为0.06,0.05 μmol·L-1。AA和DA在不同扫速下的电化学行为表明,AA在P6-TG-ABSA/GCE上的电极过程受扩散过程控制,而DA的电极过程受吸附过程控制。将该修饰电极应用于尿样中AA和DA 的同时测定,结果满意。
关键词:6-硫鸟嘌呤;邻氨基苯磺酸;抗坏血酸;多巴胺;修饰电极;电化学
Fabrication of Poly(6-Thioguanine-co-o-Aminobenzene Sulfonic Acid) Modified Glassy Carbon Electrode and Its Application in Simultaneous Determinationof Ascorbic Acid and DopamineLAN De-xiang,ZHANG Lei*
(Department of Chemistry,College of Life and Environmental Sciences,Shanghai Normal University,Shanghai200234,China)
Abstract:A poly(6-thioguanine-co-o-aminobenzene sulfonic acid)(P6-TG-ABSA) film modified glassy carbon electrode(GCE)(P6-TG-ABSA/GCE) was fabricated by electrochemical copolymerization of 6-thioguanine(TG) and o-aminobenzene sulfonic acid(ABSA).The surface morphology and electrochemical activity of the modified electrode were investigated by scanning electron microscopy(SEM) and electrochemical methods.The SEM images show that the copolymer film exhibits a granular surface structure with regular and homogeneous particles,which is helpful to the electro-catalytic oxidation of the analytes.The results of cyclic voltammetry(CV) and differential pulse voltammetry(DPV) show that the modified electrode exhibits strong electro-catalytic activities toward the oxidation of ascorbic acid(AA) and dopamine(DA) in 0.1 mol·L-1phosphate buffer solution(PBS,pH 5.0).Compared with those at P6-TG/GCE and PABSA/GCE,the current responses in anodic peak signal remarkably increase and the peak potential separation is 0.20 V at P6-TG-ABSA/GCE,which could be used for the simultaneous determination of AA and DA mixture with high sensitivity.Under the optimum conditions,the linear dependences of DPV current responses for AA and DA are observed in the concentration ranges of 2-5 000 μmol·L-1and 2-180 μmol·L-1,with correlation coefficients of 0.999 8 and 0.999 7,respectively.The detection limits(S/N=3) of AA and DA are 0.06 μmol·L-1and 0.05 μmol·L-1,respectively.The different electrochemical behaviors of AA and DA at P6-TG-ABSA/GCE at various scan rates indicate that the electrode reaction of AA is a diffusion-controlled process,and that of DA is an adsorption-controlled process.The P6-TG-ABSA/GCE is applied in the simultaneous determination of AA and DA concentrations in human urine samples with satisfactory results.
Key words:6-thioguanine;o-aminobenzene sulfonic acid;ascorbic acid;dopamine;modified electrode;electrochemistry
中图分类号:O657.1;Q564
文献标识码:A
文章编号:1004-4957(2015)12-1339-09
doi:10.3969/j.issn.1004-4957.2015.12.002
通讯作者:*张雷,博士,副教授,研究方向:导电高聚物、生物传感器及光谱电化学,Tel:021-64321701,E-mail:chemzl@shnu.edu.cn
基金项目:上海市教育科学研究项目(B-13034)
收稿日期:2015-05-18;修回日期:2015-06-20
