燕麦隐性核不育cSSR标记的开发及其验证
2016-01-27张丽君刘龙龙畅志坚郭彬崔林
张丽君,刘龙龙,畅志坚,郭彬,崔林*
(1.山西省农业科学院农作物品种资源研究所,农业部黄土高原作物基因资源与种质创制重点实验室,山西 太原 030031; 2.山西省
农业科学院作物研究所,山西 太原 030031;3.山西省晋中市寿阳县乡镇农产品质量安全监管站,山西 寿阳 045400)
燕麦隐性核不育cSSR标记的开发及其验证
张丽君1,刘龙龙1,畅志坚2,郭彬3,崔林1*
(1.山西省农业科学院农作物品种资源研究所,农业部黄土高原作物基因资源与种质创制重点实验室,山西 太原 030031; 2.山西省
农业科学院作物研究所,山西 太原 030031;3.山西省晋中市寿阳县乡镇农产品质量安全监管站,山西 寿阳 045400)
摘要:构建燕麦隐性核不育转录组数据库,开发cSSR标记,丰富燕麦分子标记数据库,并对隐性核不育相关cSSR标记进行验证,为充分利用燕麦种质资源及深入研究隐性核不育奠定基础。对燕麦雄性不育近等基因系CAMS1进行转录组测序,利用软件对得到的EST序列进行SSR位点查找和分析,开发cSSR 引物。并用CAMS1×品燕2号F2代群体对所开发的雄性不育相关的cSSR引物进行验证。通过转录组测序获得的EST序列中6409条存在SSR位点,736条序列中有2个及2个以上SSR位点;在所有SSR位点中三核苷酸、二核苷酸重复序列最多,分别为4340(56.66%)和1768(24.30%)个。三核苷酸重复中,CCG/CGG(26.68%)、AGG/CTT(21.29%)、AGC/CTG(18.48%)出现的频率较多,二核苷酸重复中,以AG/CT(60.63%)和AC/GT(26.24%)出现的频率较高;根据开发的cSSR设计了13344对cSSR引物,选择与雄性不育相关且能设计引物的21条序列合成45对SSR引物。PCR检测表明,32对引物(71%)有扩增产物,其中11对cSSR引物在亲本间的扩增产物具有多态性,7对引物在可育和不育性状池间存在差异。本研究对燕麦雄性不育近等基因系CAMS1进行了转录组测序,根据得到的EST序列开发了13344对cSSR 引物,并利用CAMS1×品燕2号F2代群体进行有效性检测,32对引物有扩增产物,7个标记可用于燕麦雄性不育材料的分子检测。
关键词:燕麦;cSSR;SSR标记
DOI:10.11686/cyxb2014232
Zhang L J, Liu L L, Chang Z J, Guo B, Cui L. Development and functional verification of cSSR markers for recessive genetic male sterility in oats. Acta Prataculturae Sinica, 2015, 24(7): 146-154.
张丽君,刘龙龙,畅志坚,郭彬,崔林. 燕麦隐性核不育cSSR标记的开发及其验证. 草业学报, 2015, 24(7): 146-154.
http://cyxb.lzu.edu.cn
收稿日期:2014-05-08;改回日期:2015-01-07
基金项目:山西省农科院博士基金项目(YBSJJ209),山西省自然基金项目(2014011030-1),山西省国际合作项目(2014081032-1)和国家燕麦荞麦产业技术体系(CARS-08-A-1)项目资助。
作者简介:张丽君(1981-),女,河北行唐人,助理研究员,博士。E-mail:lijun.zhang911@163.com
通讯作者*Corresponding author. E-mail: sxcuilin@163.com
Abstract:The objective of this study was to develop new cSSR markers from an oat (Anena sativa) recessive genes male sterile transcriptome database. EST sequences obtained from a RNA-Seq of oat male sterile near-isogenic line CAMS9 were used to search for SSRs using software. cSSR primers were developed and functional verification for those related to male sterility was determined with a F2population of hybridized CAMS9 and Pinyan 2.6409 EST sequences obtained from the transcriptome sequencing had SSR loci and 736 of these sequences had 2 or more loci. Most of the sequence motifs were dinucleotides (56.66%) and trinucleotides (24.30%). For trinucleotides, CCG/CGG (26.68%), AGG/CTT (21.29%), AGC/CTG (18.48%), AAG/CTT (8.18%) and ACC/GGT (8.11%) were the most frequent repeats. For dinucleotides, AG/CT (60.63%) and AC/GT (26.24%) were the most frequent. Based on these cSSRs, 13344 pairs of cSSR primers were designed. 45 pairs of the primers were synthesized based on male sterile-related cSSRs, and 32 (71.1%) of the pairs led to amplified products. Using the F2population, the polymorphism of 11 pairs between parents and the differences of 7 pairs between fertile and sterile trait pools were detected. In total, 13344 pairs of cSSR primers have been developed from the RNA-Seq database. 32 pairs were related to fertility and 7 can be used for molecular detection of oat male sterility. These new cSSR markers are beneficial for the further use of oat germplasm and for the study of male sterility.
Development and functional verification of cSSR markers for recessive genetic male sterility in oats
ZHANG Li-Jun1, LIU Long-Long1, CHANG Zhi-Jian2, GUO Bin3, CUI Lin1*
1.CropGermplasmResourcesResearchInstitute,ShanxiAcademyofAgriculturalSciences;KeyLaboratoryofCropGeneResourcesandGermplasmEnhancementonLoessPlateau,MinistryofAgriculture,Taiyuan030031,China; 2.InstituteofCropScience,ShanxiAcademyofAgriculturalSciences,Taiyuan030031,China; 3.QualityandSafetySupervisionofTownshipAgriculturalStation,Shouyang045400,China
Key words: oat (Avenasativa); cSSR; SSR
燕麦(Avenasativa)为禾本科燕麦属(Avena)单子叶植物,具有降低血清胆固醇、甘油三脂和血糖的功效,是国际适销的营养和医用保健食品[1-3]。雄性不育既是研究植物生殖生物学重要的植物学性状,也是研究作物杂种优势利用的重要农艺性状,因此在遗传和分子生物学中具有重要地位。目前我国发现了两种燕麦不育类型:皮燕麦隐性核不育[4]和裸燕麦显性核不育[5]。
燕麦雄性不育材料不仅是宝贵的种质资源,而且对改进育种方法、提高育种效率具有非常重要的作用。但目前燕麦雄性不育植株的鉴别只能在抽穗后进行。通过对燕麦雄性不育相关分子标记的研究,促使不育植株的鉴别工作在苗期提前进行,有利于杂交种子的大量获得,对于更为有效地实现燕麦轮回选择育种具有重要的应用前景。
目前SSR(simple sequence repeats, SSR)、AFLP(amplified fragments length polymorphism, AFLP)、RFLP(restriction fragment length polymorphism, RFLP)、RAPD(polymerase chain reaction, RAPD)和DarT(dynamic advertising reporting targeting, DarT)等分子标记广泛应用于基因组分析[6]、遗传多样性分析[7]、分子育种[8]等方面,其中SSR分子标记因具有共显性遗传、多态性高、多等位性以及技术简单等优点[9]而应用最广。随着测序技术的发展,cSSR标记除保留了SSR标记的优势外,还具有其他的应用特点:针对性强,若发现某个cSSR在某一性状连锁的基因或EST序列上,则该cSSR 就可能与此性状相关;通用性好,由于EST 来自转录区,其保守性较高,具有较好的通用性,因而在亲缘物种之间校正基因组连锁图谱方面及在比较作图方面均有很高的利用价值[10]。现在cSSR标记已在小麦(Triticumaestivum)[11]、大麦(Hordeumvulgare)[12]、水稻(Oryzasativa)[13]、高粱(Sorghumvulgare)[14]等物种中应用于遗传图谱构建、遗传多样性分析、品种鉴定、基因诊断等多种方面。
本研究利用Illumina HiSeqTM2000二代测序技术对皮燕麦隐性核不育植株的近等基因系进行转录组测序,分析了燕麦基因组中基因转录本所含微卫星重复序列的组成和特征,后基于EST开发cSSR引物,并对其中的隐性核不育cSSR标记进行验证,发掘可用于苗期鉴别燕麦雄性不育株与可育株的分子标记,为燕麦育性研究以及育种方法的改进奠定基础。
1材料与方法
1.1 试验材料
燕麦雄性不育近等基因系CAMS1用于转录组测序;亲本CAMS1和品燕2号,及其F2、F2:3群体用于对隐性核不育SSR标记的验证。上述材料均由山西省农业科学院农作物品种资源研究所提供。
1.2 转录组测序文库构建及测序
2011年冬天将燕麦雄性不育近等基因系CAMS1在温室种植,室温20℃左右,相对湿度(65±20)%,光照12 h/d,光强4000 lx。当可育和不育植株在抽穗0~5 cm时,选择不同发育阶段雄蕊混合提取总RNA。用带有Oligo(dT)的磁珠富集mRNA。加入fragmentation buffer将mRNA打断成短片段,以mRNA为模板,用random hexamers合成第1条cDNA链,然后加入缓冲液、dNTPs、RNase H和DNA polymerase I合成第2条cDNA链,在经过QiaQuick PCR试剂盒纯化并加EB缓冲液洗脱之后做末端修复、加A并连接测序接头,然后用琼脂糖凝胶电泳进行片段大小选择,最后进行PCR扩增,建好的测序文库用Illumina HiSeqTM2000进行测序。
1.3 SSR的开发
利用Illumina HiSeqTM2000对供试材料进行转录组测序,将获得的序列应用MISA(MicroSAtellite)和SSRfinder软件开发SSR。将可循环的序列及其互补序列进行分类:如 AAC基序代表所有AAC、 ACA、 CAA、GTT、TGT 和 TTG 的SSR[15]。据此,将单核苷酸重复序列归为 A/T,C/G 两类,二核苷酸重复序列归为AC/GT、AG/CT、AT/AT、CG/CG 4类,三核苷酸重复序列归为10类,四核苷酸重复序列归为 33类,五核苷酸重复序列归为102类,六核苷酸重复序列归为350类。
1.4 SSR-EST的功能分析
从NCBI(National Center for Biotechnology Information)数据库中下载7599条雄性不育相关序列(截止2013年6月),与燕麦转录组EST序列进行比对预测其功能。通过Blastx程序对包含SSR位点的EST序列进行同源性比较,筛选同源蛋白质的标准为:最大评分(maxscore)≥80,最大一致性(maxidentity)≥35%,Evalue<10-5;通过GO(Gene Ontology)注释系统将获得的SSR的EST序列进行功能注释和分类。
1.5 cSSR引物设计
基于燕麦EST-SSR重复单元前后的序列,应用软件Primer 3设计cSSR引物,每条SSR产生5对引物。引物筛选条件:引物不能存在SSR;将获得的引物比对到EST序列,引物的5′端允许有3个碱基的错配,3′端允许有1个碱基的错配;去掉比对到不同EST上的引物,筛选得到唯一匹配的引物;使用SSR finder软件和产物序列分析来校验SSR检验结果是否与MISA软件分析结果相同。通过评估的cSSR引物由北京六合华大科技有限公司进行引物合成。
1.6 cSSR引物的筛选
2012年夏天取CAMS1×品燕2号F2群体五叶期的嫩绿叶片,以CTAB(hexadecyltrimethy ammonium bromide, CTAB)法提取基因组DNA。结合CAMS1×品燕2号F2:3群体的表现型,从F2群体中分别选取10份纯合可育单株和10 株纯合不可育单株的DNA进行混合,建立可育池和不育池。利用亲本和育性池验证和筛选引物。引物筛选分2个环节进行:前期筛选以获得初步认为与育性相关基因的引物对育性池进行扩增。在前期引物筛选(即初筛)环节,每次扩增电泳同时检测若干对引物,扩增反应体系为13 μL 10×Premix Taq(TaKaRa),上游和下游引物各1 μL(10 μmol/L),1 μL DNA(50 ng/μL)和4 μL超纯水。扩增程序为:94℃ 5 min (1个循环);94℃ 30 s,55~65℃ 40 s,72℃ 30 s (35个循环),72℃ 10 min(1个循环)。 根据扩增结果和已有经验,在可育池和不育池完全无带的引物都舍弃,认为该引物无效。2012年11-12月完成45对cSSR引物的前期筛选,筛选时使用的退火温度通常为56℃,少量引物使用60℃。然后,进一步应用初步认为有效的引物对可育池和不育池进行扩增,扩增反应体系和程序同前期筛选所应用的,但已根据初筛的扩增情况来适当调整了退火温度。进一步挑选在可育池和不育池之间存在差异的引物,然后利用亲本和育性池进一步验证和筛选引物。试验重复3次,扩增产物分别用1.0%的琼脂糖电泳和6%变性聚丙烯酰胺凝胶电泳检测,每样品点样2 μL,电泳时间90 min。胶板在0.15% AgNO3溶液中银染15 min,取出后蒸馏水速漂5 s,放入含有3%NaOH和0.5%甲醛的溶液中显色10 min,视条带清晰后转入固定液终止反应,蒸馏水清洗2 min后晾干、扫描。
2结果与分析
2.1 转录组得到的EST序列长度分布
采用Illumina HiSeqTM2000转录组测序组装获得100169条cDNA序列、总长为66580832 nt,其中300 nt的EST序列共30970条(30.92%),400 nt的EST序列共18480条(18.45%),500 nt的EST序列共10267条(10.25%)(图1)。
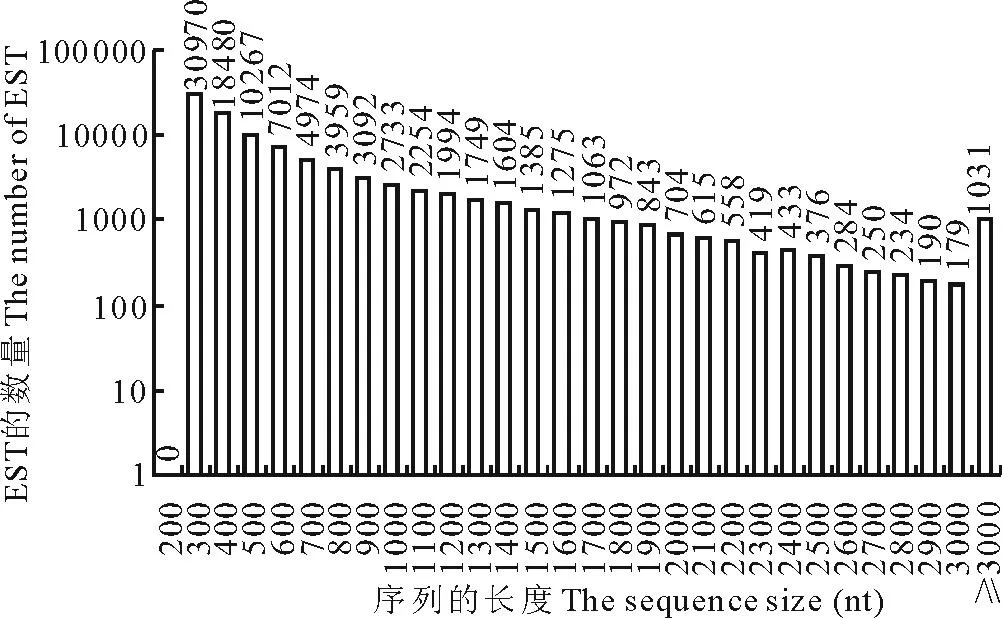
图1 EST序列长度分布Fig.1 EST sequence length distribution
2.2 燕麦EST序列中不同类型SSR的频率
燕麦EST序列中有6409条EST序列包含1~6核苷酸重复的SSR位点,7275个SSR位点被找到,平均每9152.004 nt 的EST序列(66580832/7275)出现一个SSR,且每100条EST中出现7.26(7275/100169)个SSR,说明燕麦EST中SSR数量较为丰富。736个序列含2个及2个以上SSR位点,5673个(88.52%)EST只含有1个SSR位点。cSSR位点的总长度变化在12~197 nt之间,其中15 nt的最多,占35.74%;18,12和20 nt 的分别占14.28%,13.13%和7.16%。单、二、三、四、五、六核苷酸重复基序最小,长度分别达到12,12,15,20,20,24 bp。在这些SSR位点中,三核苷酸重复的数量最多,共4340个(56.66%),其次是二核苷酸(24.30%)、单核苷酸(6.10%)、四核苷酸(3.95%)、五核苷酸(3.53%)及六核苷酸(2.46%)(图2)。其中约347个(4.77%)SSR为复合SSR。对于重复次数而言,六核苷酸和五核苷酸重复4次出现频率最高,分别达到87.71%和89.88%;四核苷酸和三核苷酸基序的SSR中,5次重复频率最高,分别为85.02%和47.09%(图3)。
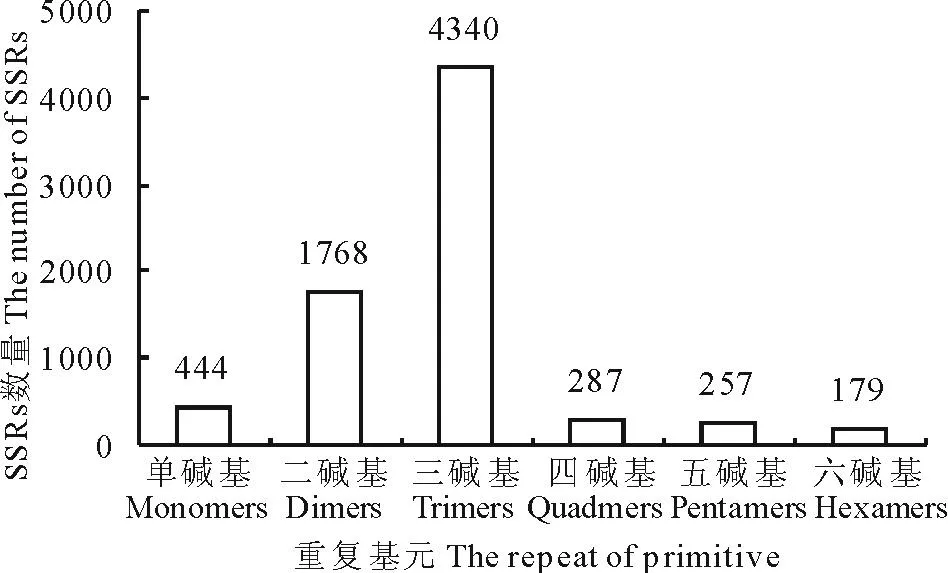
图2 cSSR中不同SSR重复基元分布频率Fig.2 Frequency distribution of cSSR motifs of A. sativa
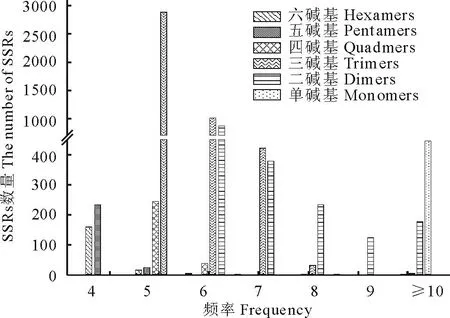
图3 SSR基元重复次数在燕麦EST序列中的分布频率Fig.3 Frequency distribution of the number of cSSR repeats of A. sativa
2.3 燕麦EST-SSR中不同类型基序的分布频率
在单碱基(444)重复的SSR中,A/T出现频率最高(87.84%),其次是C/G(12.16%);二碱基(1768)重复的SSR序列中共搜索到AC/GT、AG/CT、AT/AT、CG/CG四类SSR基序,其中AG/CT出现频率最高(60.63%),其次是AC/GT(26.24%)和AT/AT(8.20%);在三碱基(4340)重复的SSR序列中出现频率最高的是CCG/CGG(26.68%),而AGG/CTT(21.29%)、AGC/CTG(18.48%)、AAG/CTT(8.18%)及ACC/GGT(8.11%)次之,这5类基序所组成的SSR占三碱基SSR总数的82.74%,数量最少的三碱基基数为AAT/ATT,仅有29个(图4)。同时在燕麦的EST中搜索四、五和六碱基重复的SSR分别有27,69,101种,其中AAAG/CTTT(10.45%)和AAGG/CCTT(9.41%)在四碱基重复SSR中(287)出现的频率较高;AGAGG/CCTCT(11.28%)和AAAAG/CTTTT(5.45%)在五碱基重复SSR 中(257)出现频率较高;ACGAGG/CCTCGT(2.79%)在六碱基重复SSR中(179)出现频率较高。

图4 二核苷酸和三核苷酸重复中不同重复基序的比例Fig.4 Percentage of different motifs in dinucleotide (A) and trinucleotide (B) repeats
分析燕麦EST数据库中的SSR得出,在燕麦EST中最丰富的微卫星类型是三碱基重复,其次为二碱基重复,主要的优势重复序列分别是GGC、GCG以及GA、CT类。
2.4 cSSR引物筛选和功能推测
按照引物设计要求设置基本检索条件,共得到燕麦cSSR引物13344对。以“雄性不育”为检索词在NCBI 数据库中进行搜索,再将结果与转录组基因集进行同源性比对,最终得到424条相关序列。用TBLASTX将设计引物的7275条燕麦EST序列与上述424条序列进行同源性比对,筛选出96条燕麦EST序列,去除含有SSR位点但是长度不支持设计SSR引物的EST序列,得到21条与雄性不育相关的候选基因序列。
BLAST比对发现,21条燕麦育性候选基因中与短柄草(Brachypodiumdistachyon)同源的有9条,与大麦同源的有8条。这些基因涉及的通路主要为次生代谢产物合成(biosynthesis of secondary metabolites)、代谢通路(metabolic pathways)、淀粉和蔗糖合成(starch and sucrose metabolism)。
2.5 燕麦中与雄性不育相关基因的GO注释分析
GO功能注释分析结果表明,21条燕麦育性候选基因分布在分子功能、细胞组分和生物学过程3大类,以及更详细的27个子类(图5)。其中生物学过程功能类型中的细胞过程(cellular process GO:0009987)和代谢过程(metabolic process GO:0008152)所占比例最高,分别为68.2%和63.6%;细胞组分功能类型中,细胞(cell GO:0005623)、细胞部分(cell part GO:0044464)涉及的基因最多(cell GO:0005623为15条,cell part GO:0044464为15条);分子功能类型中的催化活性(catalytic activity GO:0003824)和蛋白结合(binding GO:0005488)所含比例最高,为77.3%和63.6%。
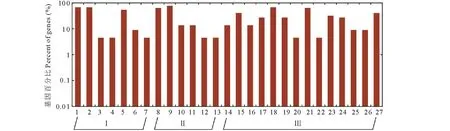
图5 21条候选基因 GO功能分类Fig.5 Gene ontology functional classification of 21 candidate genes Ⅰ: 细胞组分Cellular component; Ⅱ: 分子功能Molecular function; Ⅲ: 生物过程Biological process. 1: 细胞Cell; 2: 细胞部分Cell part; 3: 外膜Envelope; 4: 胞外区Extracellular region; 5: 细胞器Organelle; 6: 细胞器部分Organelle part; 7: 合胞体Symplast; 8: 结合Binding; 9: 催化Catalytic; 10: 电子载体Electron carrier; 11: 酶的调节器Enzyme regulator; 12: 分子转导Molecular transducer; 13: 转运Transporter; 14: 组织结构的形成Anatomical structure formation; 15: 生物调节Biological regulation; 16: 细胞成分的生物合成Cellular component biogenesis; 17: 细胞成分的组织Cellular component organization; 18: 细胞过程Cellular process; 19: 发育过程Developmental process; 20: 生长Growth; 21: 代谢过程Metabolic process; 22: 多生物体过程Multi-organism process; 23: 多细胞生物过程Multicellular organismal process; 24: 着色Pigmentation; 25: 生殖Reproduction; 26: 生殖过程Reproductive process; 27: 响应刺激Response to stimulus.
2.6 cSSR引物的验证
利用建立的可育池和不育池DNA为模板,对21个雄性不育候选基因对应的45对cSSR引物进行验证和筛选。对45对引物进行初步筛选发现有32对引物(表1)能在燕麦中成功扩增出条带,初步认为这些引物是有效引物。利用这些引物对亲本和育性池进行进一步筛选发现其中11对引物在亲本间具有多态性(表1中编号2~12),7对引物在可育和不育性状池间存在差异(表1中编号1~7),引物CL1163_134_1、CL2383_248_2和nigene22206_2260_1 (表中编号1~3)只在不育池中有条带,可育池中没有条带(图6),可用于苗期鉴别燕麦雄性不育株与可育株。
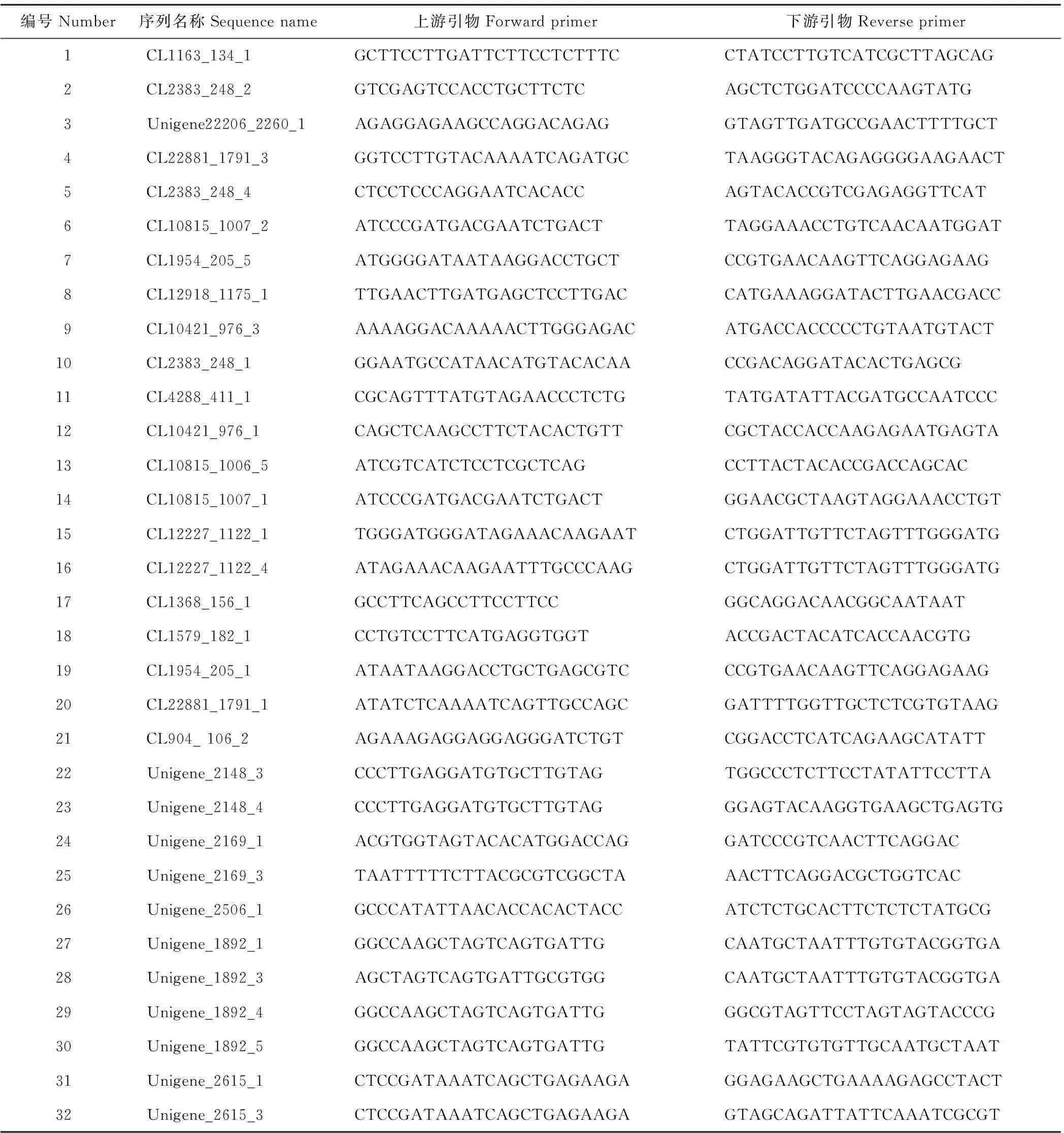
表1 32对cSSR引物
3讨论
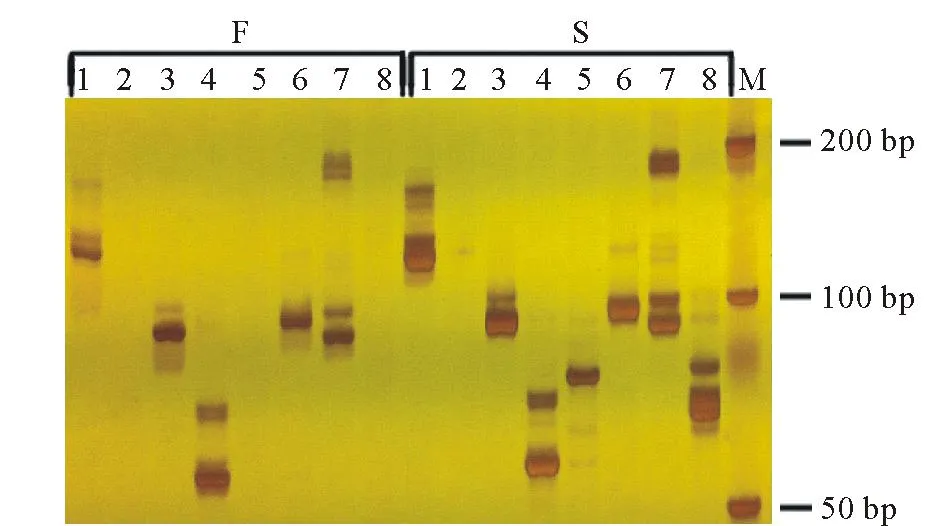
图6 部分引物在两个性状池间的多态性 Fig.6 Polymorphisms of some primers in oat two traits pools F:可育材料Fertile materials;S:不育材料Sterile materials;1:CL10421_976_3;2:CL1163_134_1;3:CL22881_1791_3;4:CL2383_248_1;5:CL2383_248_2;6:CL2383_248_4;7:CL4288_411_1;8:Unigene22206_2260_1;M:DNA marker DL500.
3.1 皮燕麦隐性核不育相关SSR标记的开发
EST序列来源于保守型较高的编码DNA,可直接反映相关基因的功能,在分子生物学研究领域中已被作为一个重要的使用工具。截止2014年4月NCBI数据库中公布的燕麦EST序列为79657条,与小麦(1358140条)、大麦(537546条)、水稻(1369506条)等禾本科作物相比燕麦EST序列数据明显不足。在利用EST进行燕麦的cSSR标记开发方面,Bräutigam等[16]利用测序技术对不同温度条件下生长的燕麦进行转录组分析,发现9792条EST序列,确定了2800个与冷诱导相关的基因,其中51条基因是以前报道过与冷诱导相关的基因,并证明CBF转录因子在调节冷驯化中有重要作用,并开发400对与冷诱导相关cSSR标记。本研究在国内首次利用皮燕麦隐性核不育材料进行SSR开发,根据获得的燕麦隐形核不育EST序列,开发了13344对引物。经过生物信息学同源比对分析和实验验证发现,7对SSR引物可作为燕麦可育和不育性状的评价引物,为燕麦的育性分子标记研究以及育种方法的改进奠定基础。
3.2 EST中简单重复序列(cSSR)的分布特点
SSRs 分布于基因间隔区和基因编码区。对大麦、小麦、燕麦和玉米(Zeamays)等禾谷类作物EST中cSSR的含量、出现频率、重复类型等的研究表明,7%~10%的EST序列含有cSSR,其中3%可用于cSSR引物设计。cSSR在大麦、小麦、燕麦、黑麦(Secalecereale)、玉米、高粱和水稻中出现的频率分别为7.5,6.2,5.5,7.5,5.5 和3.9 kb,平均6.0 kb 就出现一个cSSR。其中三核苷酸重复出现次数最多(54%~78%),其次为二核苷酸重复类型(17%~40%),而四核苷酸以上重复类型较少[17]。
Gao等[18]发现,许多三核苷酸与具有重要功能的基因相关,如CCG重复涉及许多基因的功能,如胁迫抗性、转录调控、信号传导等许多基因的功能。二核苷酸重复单元AG/CT在mRNA 中根据不同的阅读起始位点可以分别读为:GAG、AGA、UCU 和CUC,从而分别翻译为Arg、Glu、Ala 和Leu,而Ala 和Leu在蛋白质中出现的频率高达8%和10%[19]。在本研究中,三核苷酸重复基元的SSR类型最多(4340个,56.66%), 其中CCG/CGG(26.68%)和AGG/CTT(21.29%)出现频率最高,这两类重复类型占了三核苷酸重复类型总量的50%以上,而其他重复类型则相对较少。二核苷酸重复中(1768个,24.30%),含AG/CT 重复单元的最多,而含CG/CG重复单元的数量最少。这些和大麦[20]、小麦[21]、水稻[22]以及玉米[23]4种禾本科作物EST序列SSR的分布规律相似[24]。
Temnykh等[25]按照SSR长度将微卫星分为两大类:长度≥20 bp的SSR和长度>12 bp但<20 bp的SSR。与第2类SSR相比,第1类SSR序列长度更长,具有更高的突变率,因而更不稳定。SSR一般被认为是由于DNA复制过程中聚合酶瞬时脱离、碱基错配引起的,cSSR的多态性主要是由于重复长度和重复次数造成的[26], 菊花(Chrysanthemum)EST序列中SSR重复基元的重复次数为1~13次,最大的重复次数出现在三核苷酸中,詹少华等[27]统计了SSR基元重复次数变异范围,推测SSR基元重复次数变异范围越大,分子标记的多态性就越高,认为SSR重复基元重复次数变异的发生与SSR形成有关。本试验对7275个微卫星长度进行分析发现,燕麦EST序列所含的微卫星在长度上存在显著变异,微卫星长度为12~197 bp,平均19 bp。长度大于20 bp的有1066条,这些较长的序列变异较大,其多态性较丰富,有利于cSSR标记的开发[28]。在燕麦cSSR位点中重复最长的出现在二核苷酸中,为197 bp。7对在可育和不育性状池间存在差异的引物涉及6条序列,分布在二核苷酸GC、TG和三核苷酸GCT、CAG和TCG,大小为12~18 bp,重复次数为5~8次。在可育和不育性状间存在差异分子标记的开发,有利于不育植株的鉴别工作提前开展,获得大量的杂交种子。
4结论
本研究利用生物信息学软件对燕麦雄蕊发育EST库中的cSSR位点分布特征进行了分析,了解了燕麦育性材料转录组中基因转录序列所含微卫星重复序列的特征和组成情况,后根据发现的微卫星位点设计了cSSR引物,在此基础上开发了燕麦育性相关的SSR标记,并对这些标记在燕麦育性鉴别上进行了初步验证。通过燕麦SSR标记开发,将其用于燕麦遗传多样性检测,有助于燕麦属植物分子水平的研究,对中国燕麦种质资源多样性的分析、连锁图谱构建、比较基因组学等研究也具有重要的现实意义。
References:
[1]Wu N, Hu Y G, Ren C Z,etal. Effects of super absorbent polymer application rate on soil nitrogen of spring-sown naked oat in two irrigation systems. Acta Prataculturae Sinica, 2014, 23(2): 346-351.
[2]Xie Z L, Zhang T F, Chen X Z,etal. A study on the nutrient value of oat and its influences on soil fertility of winter fallow fields. Acta Prataculturae Sinica, 2013, 22(2): 47-53.
[3]Guo X, Jie X L, Hu H F,etal. Effects of basal Se fertilizers on nutrition values of naked oats. Acta Prataculturae Sinica, 2013, 22(1): 53-59.
[4]Cui L, Fan Y Y, Xu H Y,etal. Discovery and genetic identification of male-sterile oat in China. Acta Agronomica Sinica, 1999, 25(3): 296-301.
[5]Yang C, Zhou H T, Zhang X J,etal. New high protein oat variety “Ji-Zhang-Yan No.1” breeded with naked oat genetic male sterile gene ZY. Journal of Hebei North University: Natural Science Edition, 2009, 25(1): 39-41.
[6]Wu L, Wang D, Su W Y,etal. Developing InDel markers fromAegilopsgenusbased on comparative genomics. Acta Agronomica Sinica, 2012, 38(7): 1334-1338.
[7]Lai Y, Wang P X, Fan G Q,etal. Genetic diversity and association analysis using SSR markers in Barley. Scientia Agricultura Sinica, 2013, 46(2): 233-242.
[8]Ren Y, Li S R, Li J,etal. Genetic analysis and molecular mapping of stripe rust resistance gene in a restore line of Thermo-Photo sensitive hybrid wheat MR168. Hereditas, 2011, 33(11): 1263-1270.
[9]Yu Y, Wang Z W, Feng C H,etal. Genetic evaluation of EST-SSRs derived fromGossypiumherbaceum. Acta Agronomica Sinica, 2008, 34(12): 2085-2091.
[10]Lu Y F, Jiang J X, Yi Z L. Study on the transferability of maize SSR and sugarcane EST-SSR markers toMiscanthus(Poaceae). Acta Prataculturae Sinica, 2012, 21(5): 86-95.
[11]Gupta P K, Rustgi S, Sharma,etal. Transferable CSSR markers for the study of polymorphism and genetic diversity in bread wheat. Molecular Genetics and Genomics, 2003, 270: 315-323.
[12]Nandha P S, Singh J. Comparative assessment of genetic diversity between wild and cultivated barley using gSSR and CSSR markers. Plant Breeding, 2013, doi: 10.1111/pbr.12118.
[13]Sripathy K V, Ganesh M, Keshavulu K,etal. Assessment of genetic purity using informative EST-SSR markers in rice (OryzasativaL.) hybrids. A Quarterly Journal of Life Sciences, 2012, 9: 128-133.
[14]Ramu P, Billot C, Rami J F,etal. Assessment of genetic diversity in the sorghum reference set using CSSR markers. Theoretical and Applied Genetics, 2013, 126: 2051-2064.
[15]Liu L, Sun L L, Lan M Q,etal. Analysis and exploitation of EST-SSTs in theTriticumaestivum. Journal of Yunnan Agricultural University, 2012, 27(5): 623-630.
[16]Bräutigam M, Lindlöf A, Zakhrabekova1 S,etal. Generation and analysis of 9792 EST sequences from cold acclimated oat,Avenasativa. BMC Plant Biology, 2005, 5: 18.
[17]Varshney R K, Thiel T, Stein N,etal. In silico analysis on frequency and distribution of microsatellites in ESTs of some cereal species 1. Celluar Molecular Biology Letters, 2002, 7: 537-546.
[18]Gao L F, Tang J F, Li H W,etal. Analysis of microsatellites in major crops assessed by computational and experimental approaches. Molecular Breeding, 2003, 12: 245-261.
[19]Lewin B. Genes V[M]. New York: Oxford University Press, 1994.
[20]Kota R, Varshney R K, Thiel T,etal. Generation and comparison of EST-derived SSRs and SNPs in barley (HordeumvulgareL.). Hereditas, 2001, 135: 145-151.
[21]Varshney R K, Graner A, Sorrells M E. Genic microsatellite marers in plants: features and applications. Trends Biotechnology, 2005, 23: 48-55.
[22]Rota L R, Kantety R V, Yu J K. Nonrandom distribution and frequencies of genomic and EST-derived microsatellite markers in rice, wheat and barley. BMC Genomics, 2005, 6: 23.
[23]Tang J F, Gao L F, Cao Y S,etal. Homologous analysis of SSR-ESTs and transferability of wheat SSR-EST marers across barley, rice and maize. Euphytica, 2006, 151: 87-93.
[24]Kantety R V, Rota M L, Matthews D E,etal. Data mining for simple sequence repeats in expressed sequence tags from barley, maize, rice, sorghum and wheat1. Plant Molecular Biology, 2002, 48: 501-510.
[25]Temnykh S, Declerk G, Lukashover A,etal. Computational and experimental analysis of microsatellites in rice (OryzasativaL.): frequency, length variation, transposon associations, and genetic marker potential. Genome Research, 2001, 11: 1441-1452.
[26]Feng J M, Guo S G, Lu G Y,etal. Analysis of EST-SSR information related toFusariumwilt resistance in watermelon. Acta Agriculturae Boreali-Sinica, 2009, 24(3): 87-91.
[27]Zhan S H, Sheng X Y, Fan H H,etal. Relationship between length of soybean ESTs sequence and characters of EST-SSR. Soybean Science, 2009, 28(2): 204-209.
[28]Wan Z B, Chen Y, Yan Y Y,etal. EST-SSR analysis and marker development forChrysanthemummorifolium. Journal of Southwest Forestry University, 2013, 33(1): 39-44.
参考文献:
[1]吴娜, 胡跃高, 任长忠, 等. 两种灌溉方式下保水剂用量对春播裸燕麦土壤氮素的影响. 草业学报, 2014, 23(2): 346-351.
[2]谢昭良, 张腾飞, 陈鑫珠, 等. 冬闲田种植2种燕麦的营养价值及土壤肥力研究. 草业学报, 2013, 22(2): 47-53.
[3]郭孝, 介晓磊, 胡华锋, 等. 基施硒肥对裸燕麦营养水平的影响. 草业学报, 2013, 22(1): 53-59.
[4]崔林, 范银燕, 徐惠云, 等. 中国首例燕麦雄性不育的发现及遗传鉴定. 作物学报, 1999, 25(3): 296-301.
[5]杨才, 周海涛, 张新军, 等. 利用核不育莜麦ZY基因育成优质高蛋白燕麦新品种“冀张燕1号” . 河北北方学院学报(自然科学版), 2009, 25(1): 39-41.
[6]吴磊, 王丹, 苏文悦, 等. 利用比较基因组学开发山羊草属InDel分子标记. 作物学报, 2012, 38(7): 1334-1338.
[7]赖勇, 王鹏喜, 范贵强, 等. 大麦SSR标记遗传多样性及其与农艺性状关联分析. 中国农业科学, 2013, 46(2): 233-242.
[8]任勇, 李生荣, 李俊, 等. 两系杂交小麦恢复系MR168抗条锈病基因遗传分析及分子标记定位. 遗传, 2011, 33(11): 1263-1270.
[9]余渝, 王志伟, 冯常辉, 等. 草棉CSSRs的遗传评价. 作物学报, 2008, 34(12): 2085-2091.
[10]卢玉飞, 蒋建雄, 易自力. 玉米SSR引物和甘蔗EST-SSR引物在芒属中的通用性研究.草业学报, 2012, 21(5): 86-95.
[15]刘林, 孙来亮, 兰茗清, 等. 小麦EST-SSR的分析及其引物的开发.云南农业大学学报, 2012, 27(5): 623-630.
[26]冯建明, 郭绍贵, 吕桂云, 等. 西瓜抗枯萎病相关CSSR的信息分析.华北农学报, 2009, 24(3): 87-91.
[27]詹少华, 盛新颖, 樊洪泓, 等. 大豆EST序列长度与SSR特性的关系.大豆科学, 2009, 28(2): 204-209.
[28]万志兵, 陈燕, 闫莹莹, 等. 菊花EST-SSR分析及标记开发.西南林业大学学报, 2013, 33(1): 39-44.
