Cu(Ⅱ)对海胆免疫相关酶活性的影响及其在壳中蓄积量的研究
2016-01-26丁文君丁君孟凌峰
丁文君,丁君,孟凌峰
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
Cu(Ⅱ)对海胆免疫相关酶活性的影响及其在壳中蓄积量的研究
丁文君,丁君,孟凌峰
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
摘要:为研究环境中Cu(Ⅱ)对经济棘皮动物的生理影响,以5月龄和15月龄中间球海胆Strongylocentrotus intermdius为试验材料,根据国家海水水质标准(GB3097—1997)中对Cu(Ⅱ)浓度的限定值设置试验浓度,测定中间球海胆的24 h半致死浓度(24 h LC50)、体腔液中免疫相关酶活性、丙二醛(MDA)含量和壳中Cu(Ⅱ)蓄积量。结果表明:随着Cu(Ⅱ)浓度的升高海胆死亡率明显增加,Cu(Ⅱ)对中间球海胆的24 h LC50为0.247 mg/L;0.012 mg/L浓度组Cu(Ⅱ)对海胆体腔液中超氧化物歧化酶(SOD)活性表现为诱导—抑制效应,其他浓度组Cu(Ⅱ)对SOD活性均表现为抑制效应,随着Cu(Ⅱ)浓度的升高SOD活性呈先升高再下降的趋势;Cu(Ⅱ)对各浓度组内CAT活性表现为诱导—抑制效应,30 d时各浓度组CAT活性均降到最低且显著低于对照组(P<0.05);随着Cu(Ⅱ)浓度的升高海胆体腔液中过氧化物酶(POD)活性表现为升高趋势,30 d时各浓度组POD活性均达到最高且显著高于对照组(P<0.05);0.012 mg/L浓度组Cu(Ⅱ)对海胆体腔液中溶菌酶(LZM)活性表现为诱导—抑制效应,其他浓度组内Cu(Ⅱ) 对LZM活性表现为诱导效应;各浓度组内Cu(Ⅱ)对海胆体腔液中丙二醛(MDA)含量均表现为诱导—抑制效应;中间球海胆壳对Cu(Ⅱ)的蓄积量随着处理时间的延长逐渐升高。本研究结果可为环境中Cu(Ⅱ)对海胆的生理影响研究及利用海洋生物方法检测海洋中Cu(Ⅱ)污染的情况提供参考。
关键词:海胆;Cu(Ⅱ);免疫相关酶;半致死浓度;丙二醛;蓄积量
Cu(Ⅱ)是海洋重金属污染的重要成分之一。近年来,Cu(Ⅱ)随着工业废水的排放大量流入海洋,导致局部海域Cu(Ⅱ)浓度超标,Cu(Ⅱ)严重影响海洋生物的生长,对海洋经济动物的生存影响显著[1-3]。国内外研究表明:Cu(Ⅱ)能够破坏扇贝机体的免疫系统,使扇贝幼苗抗病力下降、种质退化[2];Cu(Ⅱ)慢性胁迫对仿刺参幼参的生长和生存产生严重影响[4];高浓度Cu(Ⅱ)影响对虾的血细胞数量、酚氧化酶活性等,使对虾更易受弧菌感染[5];过量的Cu(Ⅱ)在鲟鱼体内富集,对机体蛋白质和酶产生毒害作用,甚至导致其死亡[6]。
海胆是海洋底栖环境中比较常见的经济棘皮动物,是早期胚胎发育的模式生物,具有个体相对小、适应性广、生命力强、在实验室控制条件下容易饲养、繁殖周期短、能分批产卵或连续产卵等特点[7-10]。国内外已有研究表明,可采用海胆胚胎或幼体来检测重金属的毒性以及监测海洋环境的污染状况[11-13]。国内关于Cu(Ⅱ)对海胆成体毒性方面的研究尚不多见。本研究中,以5月龄、15月龄中间球海胆Strongylocentrotusintermdius为试验材料,进行了Cu(Ⅱ)对海胆半致死浓度、体腔液中免疫相关酶活性、丙二醛(MDA)含量和壳中Cu(Ⅱ)蓄积量的研究,以期为环境中Cu(Ⅱ)对海胆的生理影响及采用生物方法来检测海洋中Cu(Ⅱ)污染状况提供参考。
1材料与方法
1.1材料
试验用中间球海胆为农业部北方海水增养殖重点实验室培育的5月龄壳径为(0.5±0.1)mm和15月龄壳径为(27.5±7.0)mm的健康中间球海胆, 在实验室内暂养一周,暂养期间不投饵。养殖用海水为沙滤海水。试验前将CuSO4·5H2O配制成浓度为1 mg/mL和0.1 mg/mL的贮备液待用。
1.2方法
1.2.124 h 半致死浓度 (24 h LC50)的测定根据预试验所得Cu(Ⅱ)质量浓度范围(96 h全部存活的质量浓度上限、24 h全部死亡的质量浓度下限),在室温条件下,采用静水停食法[14],设置0.30、0.21、0.12、0.03 mg/L 4个Cu(Ⅱ)浓度组,以实验室沙滤海水为对照(Cu(Ⅱ)浓度为0.001 3 mg/L),每组设3个重复,在10 L塑料桶中进行试验,每桶放20枚5月龄中间球海胆。测定中间球海胆的24 h LC50。每隔12 h收集死亡个体,计算死亡率,试验时间为48 h。
1.2.2免疫酶活性及MDA含量的测定试验设置0.005、0.010、0.050、0.012 mg/L[4]4个Cu(Ⅱ)浓度,以实验室沙滤海水为对照,每组设3个重复。在10 L塑料桶中进行试验,每桶放20枚15月龄中间球海胆。每天更换相同Cu(Ⅱ)浓度的海水,每隔10 d取样1次,试验时间为30 d。
每次从每组随机取5枚海胆,抽取体腔液,将体腔液在4 ℃下以6000 r/min离心15 min,取上清于超低温冰箱(-80 ℃)中保存备用[15-17]。利用Epoch酶标仪(美国Biotek公司生产)测定体腔液中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、溶菌酶(LZM)、过氧化物酶(POD)活性和MDA含量(酶活测定试剂盒均购自南京建成生物工程研究所)。
1.2.315月龄中间球海胆壳中Cu(Ⅱ)蓄积量的测定将0.050 mg/LCu(Ⅱ)浓度组中间球海胆的壳用超纯水冲洗干净,放入烘箱中烘干,磨碎,于国家海洋环境监测中心测定海胆壳中Cu(Ⅱ)蓄积量。
1.3数据处理
试验数据用SPSS 19.0软件进行单因素方差分析和多重比较,显著性水平设为0.05。
2结果与分析
2.1中间球海胆的24 h LC50
不同时段Cu(Ⅱ)对中间球海胆的累计死亡率如表1所示。在24、36 h时,随着Cu(Ⅱ)浓度的升高,海胆死亡率明显增加,通过直线内插法得到海胆24 h Cu(Ⅱ)浓度与海胆累计死亡率的线性回归方程为Y=0.5553X+1.4885(R2=0.9033),换算得到海胆24 h LC50为0.247 mg/L。
表1不同Cu(Ⅱ)浓度下中间球海胆的累计死亡率
Tab.1Cumulative mortality of sea urchinStrongylocentrotusintermediusat variousCu(Ⅱ) concentrations
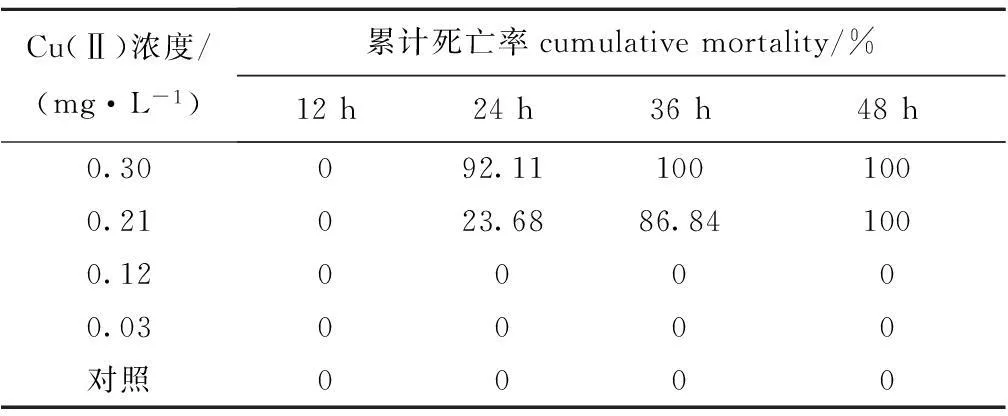
Cu(Ⅱ)浓度/(mg·L-1)累计死亡率cumulativemortality/%12h24h36h48h0.30092.111001000.21023.6886.841000.1200000.030000对照0000
2.2不同Cu(Ⅱ)浓度下中间球海胆免疫相关酶活性及MDA含量
2.2.1SOD活性从表2可见:随着Cu(Ⅱ)处理时间的持续,0.005、0.010、0.012 mg/L浓度组SOD活性呈下降趋势,0.050 mg/L浓度组SOD活性呈上升趋势,相同浓度组内均无显著性差异(P>0.05);试验过程中,与对照组相比,Cu(Ⅱ)对0.012 mg/L浓度组SOD活性表现为诱导—抑制效应,对0.005、0.010、0.050 mg/L浓度组SOD活性表现为抑制效应。同一时间下,随着Cu(Ⅱ)浓度的升高,SOD活性均呈先升高再下降的趋势;第10天时,0.012 mg/L浓度组SOD活性最高,为(4.65±0.25)U/mL,显著高于其他浓度组(P<0.05);第20天时,0.050 mg/L浓度组SOD活性最低,为(2.39±0.37)U/mL,但与其他浓度组无显著性差异(P>0.05)。
2.2.2CAT活性从表2可见:随着Cu(Ⅱ)处理时间的持续,0.005、0.010、0.012 mg/L浓度组CAT活性呈下降趋势,各浓度组内均有显著性差异(P<0.05);0.050 mg/L浓度组内CAT活力活性呈先下降后上升的趋势,浓度组内无显著性差异(P>0.05);试验过程中,与对照组相比,Cu(Ⅱ)对各浓度组CAT活性均表现为诱导—抑制效应。同一时间下,随着Cu(Ⅱ)浓度升高,CAT活性在第10、20 天时呈先升高后下降的趋势;第10天时,0.012 mg/L浓度组CAT活性最高,各浓度组间无显著性差异(P>0.05);第30 天时,各浓度组CAT活性均低于对照组。
2.2.3POD活性从表2 可见:随着Cu(Ⅱ)处理时间的持续,各浓度组内POD活性均表现为升高的趋势;试验过程中,与对照组相比,Cu(Ⅱ)对0.050 mg/L浓度组POD活性表现为诱导效应,对0.010、0.012 mg/L浓度组POD活性表现为抑制—诱导效应,对0.005 mg/L浓度组POD活性表现为抑制效应。同一时间下,随着Cu(Ⅱ)浓度的升高,POD活性呈缓慢升高的趋势;第10天时,0.005 mg/L浓度组POD活性为(1.88±0.40) U/mL,显著低于除0.010 mg/L组外的其他组(P<0.05);第30天时,各浓度组POD活性均达到最高,均与对照有显著性差异(P<0.05)。
2.2.4LZM活性从表2 可见:随着Cu(Ⅱ)处理时间的持续,0.005、0.010、0.012 mg/L浓度组内呈现先升高后降低的趋势,各浓度组内有显著性差异(P<0.05);0.050 mg/L浓度组则呈现下降的变化趋势,浓度组内有显著性差异(P<0.05);试验过程中,与对照组相比,Cu(Ⅱ) 对0.010、0.005 mg/L浓度组LZM活性表现为诱导效应,对0.012 mg/L浓度组LZM活性表现为诱导—抑制效应,对0.050 mg/L浓度组LZM活性表现为抑制效应。同一时间下,随着Cu(Ⅱ)浓度的升高,LZM活性均呈先升高后下降的趋势;第10天时,0.010、0.012 mg/L浓度组LZM活性分别显著高于对照组(P<0.05);第20天时,0.010、0.012 mg/L浓度组LZM活性达到最高,显著高于其他组(P<0.05)。
2.2.5MDA含量从表2 可见:随着Cu(Ⅱ)处理时间的持续,各浓度组内MDA含量均表现为先降低后升高的趋势,各浓度组内有显著性差异(P<0.05);各浓度组内Cu(Ⅱ)对MDA含量均表现为诱导—抑制效应。第10天时,0.010 mg/L浓度组MDA含量最高,为(22.98±1.06) nmol/mL,显著高于其他组(P<0.05);第20天时,各浓度组MDA含量降到最低且显著低于对照组(P<0.05)。
2.3中间球海胆壳中Cu(Ⅱ)的蓄积量
当水环境中Cu(Ⅱ)浓度为0.050 mg/L时,各处理组中间球海胆壳中Cu(Ⅱ)的蓄积均表现出随处理时间的持续而逐渐升高的趋势,对照组与处理组在第10、20、30 天时海胆壳中Cu(Ⅱ)的蓄积量分别为0.5×10-3、0.7×10-3、0.8×10-3、1.7×10-3μg/g。处理时间与中间球海胆壳中Cu(Ⅱ)蓄积量呈线性相关,Cu(Ⅱ)蓄积量与时间的线性方程为y=0.5x+0.0667(R2=0.89)。各取样点中间球海胆壳中Cu(Ⅱ)的蓄积量均明显高于对照组。
表2Cu(Ⅱ) 对中间球海胆体腔液中免疫相关酶活性、丙二醛含量的影响
Tab.2Effects of Cu(Ⅱ) on activities of immune-related enzymes and the content of MDA in coelomic fluid of sea urchinStrongylocentrotusintermedius
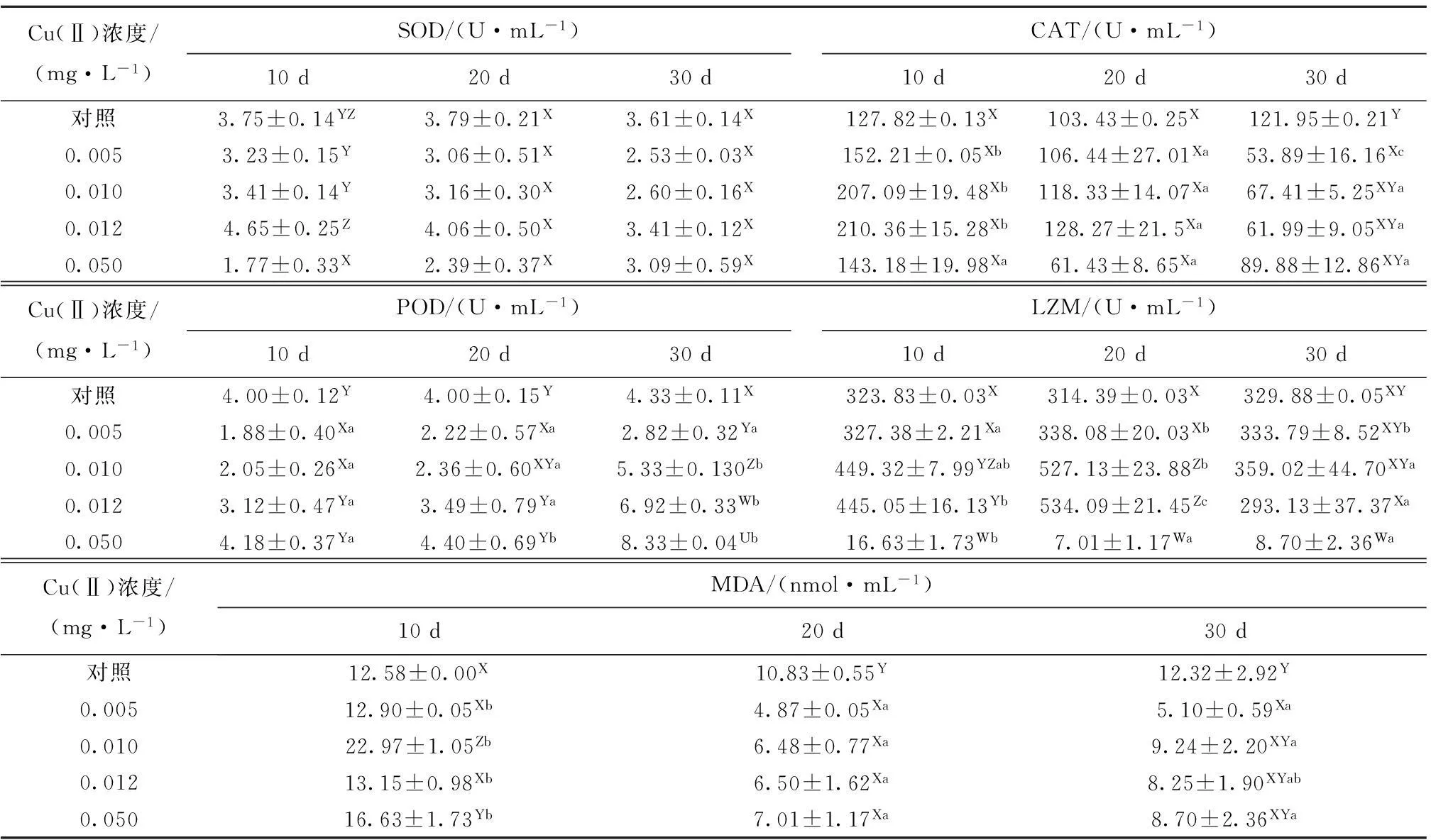
Cu(Ⅱ)浓度/(mg·L-1)SOD/(U·mL-1)10d20d30dCAT/(U·mL-1)10d20d30d对照3.75±0.14YZ3.79±0.21X3.61±0.14X127.82±0.13X103.43±0.25X121.95±0.21Y0.0053.23±0.15Y3.06±0.51X2.53±0.03X152.21±0.05Xb106.44±27.01Xa53.89±16.16Xc0.0103.41±0.14Y3.16±0.30X2.60±0.16X207.09±19.48Xb118.33±14.07Xa67.41±5.25XYa0.0124.65±0.25Z4.06±0.50X3.41±0.12X210.36±15.28Xb128.27±21.5Xa61.99±9.05XYa0.0501.77±0.33X2.39±0.37X3.09±0.59X143.18±19.98Xa61.43±8.65Xa89.88±12.86XYaCu(Ⅱ)浓度/(mg·L-1)POD/(U·mL-1)10d20d30dLZM/(U·mL-1)10d20d30d对照4.00±0.12Y4.00±0.15Y4.33±0.11X323.83±0.03X314.39±0.03X329.88±0.05XY0.0051.88±0.40Xa2.22±0.57Xa2.82±0.32Ya327.38±2.21Xa338.08±20.03Xb333.79±8.52XYb0.0102.05±0.26Xa2.36±0.60XYa5.33±0.130Zb449.32±7.99YZab527.13±23.88Zb359.02±44.70XYa0.0123.12±0.47Ya3.49±0.79Ya6.92±0.33Wb445.05±16.13Yb534.09±21.45Zc293.13±37.37Xa0.0504.18±0.37Ya4.40±0.69Yb8.33±0.04Ub16.63±1.73Wb7.01±1.17Wa8.70±2.36WaCu(Ⅱ)浓度/(mg·L-1)MDA/(nmol·mL-1)10d20d30d对照12.58±0.00X10.83±0.55Y12.32±2.92Y0.00512.90±0.05Xb4.87±0.05Xa5.10±0.59Xa0.01022.97±1.05Zb6.48±0.77Xa9.24±2.20XYa0.01213.15±0.98Xb6.50±1.62Xa8.25±1.90XYab0.05016.63±1.73Yb7.01±1.17Xa8.70±2.36XYa
注:同行中标有不同小写字母者表示相同浓度组内不同时间组间有显著性差异(P<0.05),同列中标有不同大写字母者表示相同时间下不同浓度组间有显著性差异(P<0.05),标有相同字母表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same line are significant differences at the 0.05 probability level in different time at the same concentration, the means with different capital letters within the same column are significant differences at the 0.05 probability level in same time at the different concentration, and the means with the same letters within the same column are not significant differences
3讨论
3.1Cu(Ⅱ)对中间球海胆24 h LC50的影响
本研究中,Cu(Ⅱ)对中间球海胆的24 h LC50为0.247 mg/L。张宜奎等[18]研究表明,Cu(Ⅱ)对文蛤的24 h LC50为1.66 mg/L。刘天红等[19]研究表明,Cu(Ⅱ)对栉孔扇贝的24 h LC50为0.32 mg/L。推测中间球海胆对Cu(Ⅱ)敏感度较高。
3.2Cu(Ⅱ)对中间球海胆免疫相关酶活性及MDA含量的影响
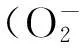
LZM能够水解细菌的破坏和消除侵入体内的异物,从而起到防御作用[23]。本试验中,随着Cu(Ⅱ)处理时间的延长,0.005、0.010、0.012 mg/L浓度组LZM活性表现为先升高后降低的趋势,0.050 mg/L浓度组表现为下降的趋势,与赵婷[24]对克氏原螯虾的研究结果类似。推测可能是由于Cu(Ⅱ)在海胆体内积累导致LZM活性降低。
POD是抗氧化防御系统中的关键酶,能够清除生物体内的自由基。本试验中,随着Cu(Ⅱ)处理时间的延长及Cu(Ⅱ)浓度的升高,POD活性均表现为升高的趋势,与宋志慧等[25]对斑马鱼的研究结果类似。推测海胆体腔液中免疫酶的作用也有一定的次序,随着Cu(Ⅱ)浓度升高机体内SOD、CAT和LZM活性降低后,POD活性升高,以保护机体免受损伤。
MDA是脂质过氧化作用的最终产物,其含量的高低可以反映出机体的过氧化程度[26]。本试验中,随着Cu(Ⅱ)处理时间的延长,各浓度组MDA含量均表现为诱导—抑制效应,且各浓度组MDA含量均表现为先降低后升高的趋势,与Geret等[27]对文蛤的研究结果类似。分析认为,在试验初期海胆体内抗氧化系统发挥作用,有效地清除了体内多余的活性氧自由基,进而减少了对生物体的氧化损伤。随着处理时间的延长,Cu(Ⅱ)在生物体内逐渐积累,使得生物体脂质过氧化物增加,MDA含量也必然随之增加。
3.3Cu(Ⅱ)在中间球海胆壳中蓄积量的分析
程波等[28]对凡纳滨对虾的研究表明,Cu(Ⅱ)可能向甲壳中转移,通过蜕皮排出体外。赵元凤等[29]研究表明,Cu(Ⅱ)在牙鲆体内的蓄积随着处理时间的延长而增加。李君丰等[4]研究表明,幼参随暴露时间的延长,Cu(Ⅱ)在体内的蓄积量持续增加。本研究中,海胆壳中Cu(Ⅱ)的蓄积量与以上研究结果一致。本研究结果可为利用海胆壳中Cu(Ⅱ)蓄积量检测海水中Cu(Ⅱ)的污染状况提供参考。
参考文献:
[1]江天久,牛涛.重金属 Cu2+、Pb2+和Zn2+胁迫对近江牡蛎(Crassostrearivularis)SOD活性影响研究[J].生态环境,2006,15(2):289-294.
[2]李华,李磊.铜离子对栉孔扇贝幼贝几种免疫因子的影响[J].生命科学仪器,2009,10:29-32.
[3]王维娜,王安利,孙儒泳.水环境中的铜锌铁钴离子对日本沼虾消化酶和碱性磷酸酶的影响[J].动物学报,2001,47:72-77.
[4]李君丰,张从尧,王华,等.仿刺参幼参对Cu2+的蓄积及Cu2+慢性胁迫对其生长的影响[J].海洋环境科学,2011,30(5):609-613.
[5]Yeh S T,Liu C H,Chen J C.Effect of copper sulfate on the immune response and susceptibility toVibrioalginolyticusin the white shrimpLitopenaneusvannamei[J].Fish and Shellfish Immunology,2004,17:437-446.
[6]宋波澜,张华.Cu离子浓度对杂交鲟幼鱼行为、血液指标和抗氧化酶的影响[J].大连海洋大学学报,2014,29(3):241-245.
[7]李娇,王姮,丁君,等.8种常见农药对海胆胚胎各发育时期的急性毒性[J].生态毒理学报,2010,5(2):255-261.
[8]孙雪峰,丁君,张辉,等.12种常见农药对海胆胚胎发育的毒性影响[J].生态毒理学报,2009,4(1):147-151.
[9]Semenova M N,Kiselyov A,Semenov V V.Sea urchin embryo as a model organism for the rapid functional screening of tubulin modulators[J].Bio Techniques,2006,40(6):765-774.
[10]Manzo S,Buono S,Cremisini C.Toxic effects of irgarol and diuron on sea urchinParacentrotuslividusearly development,fertilization,and offspring quanlity[J].Archives of Environmental Contamination and Toxicology,2006,51:61-68.
[11]Hamdoum A M,Griffin F J,Cherr G N.Tolerance to biodegraded crude in marine invertebrate embryos and larvae is associated with expression of a multixenobiotic resistance transporter[J].Aquatic Toxicology,2002,61(1/2):127-140.
[12]Kobayashi N,Okamura H.Effect of heavy metals on sea urchin embryo development:part 2.interactive toxic effects of heavy metals in synthetic mine effluents[J].Chemosphere,2005,61(8):1198-1203.
[13]Coteur G,Gosselin P,Wantier P,et al.Echinoderms as bioindicators,bioassays,and impact assessment tools of sediment-associated metals and PCBs in the North Sea[J].Archives of Environmental Contamination and Toxicology,2003,45:190-202.
[14]周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989:75-156.
[15]刘伟,常亚青,丁君.温度缓降和骤降对刺参“水院1号”和大连养殖群体非特异性免疫影响的初步研究[J].水产学报,2013,37(9):1342-1348.
[16]贲月,郝振林,丁君,等.高温对虾夷扇贝体腔液免疫酶活力的影响[J].水产学报,2013,37(6):858-863.
[17]于庆云,王悠,徐彦,等.镉和铅对菲律宾蛤仔脂质过氧化和抗氧化酶活性的影响[J].生态毒理学报,2013,8(4):504-512.
[18]张宜奎,宋秀凯,刘爱英,等.重金属Cd2+、Cu2+对文蛤的急性毒性[J].海洋湖沼通报,2011(3):51-56.
[19]刘天红,孙福新,王颖,等.硫酸铜对栉孔扇贝急性毒性胁迫研究[J].水产科学,2011,30(6):317-320.
[20]Song L S,Ji Y B,Cai Z H,et al.The immunochemical variation of mitten hand crabEriocheirsinensisafter the increment of temperature[J].Oceanologia Et Limnologia Sinica,2004,35(1):74-77.
[21]孟晓林.镉、铜分别胁迫虾夷扇贝的毒性作用机制研究[D].北京:中国科学院大学,2013.
[22]赖廷和,何斌源,范航清,等.重金属Cd胁迫对红树蚬的抗氧化酶、消化酶活性和MDA 含量的影响[J].生态学报,2011,31(11):3044-3053.
[23]刘云孔,伟丽,姜国良,等.2种免疫多糖对刺参组织主要免疫酶活性的影响[J].中国水产科学,2008,15(5):787-793.
[24]赵婷.克氏原螯虾(Procambarusclarkii)对铜胁迫的免疫响应研究[D].太原:山西大学,2011.
[25]宋志慧,王庆伟.Cu2+、Cd2+、Cr2+胁迫对斑马鱼抗氧化酶活性的影响[J].安徽农业科学,2011,39(8):4739-4741.
[26]张喆,马胜伟,王贺威,等.十溴联苯醚(BDE-209)对菲律宾蛤仔外套膜抗氧化酶活性的影响[J].生态学杂志,2013,32(1):122-128.
[27]Geret F,Serafim A,Barreira L,et al.Response of antioxidant system to copper in the gills of the clamRuditapesdecussates[J].Marine Environmental Research,2002,54(3/5):413-417.
[28]程波,刘鹰,杨红生,等.Cu2+在凡纳滨对虾组织中的积累及其对蜕皮率、死亡率的影响[J].农业环境科学学报,2008,27(5):2091-2095.
[29]赵元凤,吕景才,宋晓阳,等.铜在牙鲆Paralichthysoilvaceus组织蓄积、分配及排放的研究[J].海洋与湖沼,2005,36(2):139-145.
Bioaccumulation and effect of Cu(Ⅱ) on serum immune-related
enzyme activities in sea urchinStrongylocentrotusintermedius
DING Wen-jun, DING Jun, MENG Ling-feng
(Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China)
Abstract:The activities of immune-related enzymes, content of malonaldehyde (MDA) in coelomic fluid and accumulation of Cu(Ⅱ)in shell were determined in sea urchin Strongylocentrotus intermedius exposed to the various Cu(Ⅱ) concentrations designed by marine water quality standard to focus on physiological effects of Cu(Ⅱ) on echinoderms. The results showed that the mortality in the sea urchin was significantly increased with the elevated concentration of Cu(Ⅱ), with 24 h LC50of 0.247 mg/L. The superoxide dismutase (SOD) was induced in the sea urchin in 0.012 mg/L group, but inhibited in other groups in which the SOD activity was increased firstly and then decreased. In all treatment groups, the activity of catalase(CAT) was induced once but inhibited, the minimum on 30 d and, significantly lower than that in the control group (P<0.05). The activity of peroxidase(POD) was found to be increased with the rise of the concentrations of Cu(Ⅱ), the maximum on 30 d, and significantly higher than that in the control group (P<0.05). In 0.012 mg/L group, lysozyme (LZM) was induced first but inhibited, and the activity of LZM was induced in other treatment groups. In all treatment groups, the content of MDA was induced once but inhibited. The accumulation of copper ions was found to be increased with copper ion exposure elapse. The findings provided a new sight on the physiological effects of Cu(Ⅱ)and on monitoring of Cu(Ⅱ)levels in marine with bio-detection.
Key words:Strongylocentrotus intermedius; copper ion; immune-related enzyme; median lethal concentration; malondaldehyde; bioaccumulation
通信作者:丁君(1973—),女,博士,研究员。E-mail:dingjun1119@dlou.edu.cn
作者简介:丁文君(1989—),女,硕士研究生。E-mail:mengnvsuibian@163.com
基金项目:辽宁省农业攻关计划(2007203004);辽宁省海洋与渔业厅科研计划项目(200916)
收稿日期:2014-07-01
中图分类号:S917.4
文献标志码:A
文章编号:2095-1388(2015)02-0165-05
DOI:10.3969/J.ISSN.2095-1388.2015.02.010
