牛蛙与斑马鱼中维生素D受体的免疫印迹体系的建立
2016-01-25李游山张婷婷
李游山, 张婷婷, 朱 瑞
(1.陕西理工学院 维生素D生理与应用研究所, 陕西 汉中 723000;
2.陕西理工学院 管理学院, 陕西 汉中 723000)
牛蛙与斑马鱼中维生素D受体的免疫印迹体系的建立
李游山1,张婷婷1,朱瑞2
(1.陕西理工学院 维生素D生理与应用研究所, 陕西 汉中 723000;
2.陕西理工学院 管理学院, 陕西 汉中 723000)
[摘要]选用牛蛙与斑马鱼作为两栖类和鱼类的代表,以牛蛙十二指肠、牛蛙肾、斑马鱼肠作为VDR检测的潜在组织器官,通过对选择的组织进行蛋白质提取,应用免疫印迹技术检测了VDR的组织分布,并在实验过程中对实验条件进行了优化。实验结果为两栖类、鱼类中的VDR研究提供技术支撑并推动相关领域的研究。
[关键词]牛蛙;斑马鱼;维生素D受体;免疫印迹
维生素D3是复杂的固醇类衍生物,动物体内的维生素D3必须经过两步羟基化,转化成其活性形式1α,25(OH)2D3才能发挥其最佳生物活性[1]。1α,25(OH)2D3与核内的维生素D受体(vitamin D receptor,VDR)结合,并招募多种转录调节因子,形成转录机器,调节靶基因的转录表达,从而发挥生物学作用[2]。VDR在维持机体钙、磷代谢平衡,调节骨的形成、机体免疫活性、细胞增殖和分化等方面起重要作用[3]。
VDR最早发现于鸡的肠中[4],但VDR的分布并不只是局限于禽类的肠道当中。研究表明,VDR广泛分布于鸟类(鸡)[5]、哺乳类(人、小鼠、大鼠等)[6-8]和鱼类(斑马鱼、海七鳃鳗、大西洋鲑等)[9-11]的各种组织细胞中。在过去的30年内,至少从50种靶组织或细胞中鉴定出VDR的存在[12-13]。除了传统的靶器官肠道[14]、肾脏[15]、骨骼[16]外,VDR还存在于血液淋巴系统(如T淋巴细胞、B淋巴细胞、单核细胞和巨噬细胞等)[17-20]、泌尿生殖系统(如子宫、卵巢和前列腺等)[21]、内分泌系统(如甲状旁腺、脑垂体和胰腺等)[22]以及神经系统[23]等。
组织和细胞中是否存在VDR决定着其能否对维生素D反应,VDR含量多少决定其对维生素D反应强弱或者灵敏性高低。因此,探究VDR在组织和细胞的分布情况,有助于深入理解维生素D内分泌系统的生理功能。目前,维生素受体的研究主要集中于哺乳类和鸟类中,对高等脊椎动物中的VDR研究越来越多,但是在较低等脊椎动物(例如两栖类和鱼类)中的VDR作用机理尚不清楚,需要进一步探索。而要在低等脊椎动物开展VDR的研究,首要任务就是要建立维生素D受体的免疫印迹体系作为技术支撑。本研究选用牛蛙(Ranacatesbeiana)与斑马鱼(Daniorerio)作为两栖类和鱼类的代表,以期建立针对低等脊椎动物VDR的免疫印迹体系。
1材料和方法
1.1供试材料和试剂耗材
C57BL/6小鼠购自西安交通大学医学院实验动物中心,成年牛蛙与斑马鱼购自汉中市水产品批发市场。取成年小鼠(2月龄)十二指肠、小鼠肾、牛蛙十二指肠、牛蛙肾和斑马鱼肠等组织样品液氮速冻后于-80 ℃保存。蛋白酶抑制剂cocktail购自Sigma公司;BSA购自Genview公司;罗氏ECL超强显色试剂盒购自Thermo Scientlfic公司;小鼠抗人VDR单克隆抗体D-6和兔抗大鼠VDR多克隆抗体C-20购自Santa Cruz Biotechnology公司;辣根过氧化物酶(HRP)标记山羊抗小鼠IgG(L)购自Jackson Immuno Research Laboratories公司;HRP标记山羊抗兔IgG(H+L)、NC膜和脱脂奶粉购自碧云天生物技术有限公司。
1.2蛋白质的提取
蛋白质提取参照先前已报道的方法,并略作调整[24]。将采集的组织清洗后切成小块,迅速置于组织裂解液(20 mM HEPES,1 mM EDTA,4% SDS,0.01 mg/mL蛋白酶抑制剂cocktail,pH 7.4)中煮沸10 min。充分超声破碎组织样品,并煮沸5 min。在室温12 000 g离心15 min后,将上清液转移至新的离心管,弃去含有少量或无VDR的沉淀部分。蛋白质样品经BCA法定量、12%的SDS-PAGE分离后,考马斯亮蓝染色观察。
1.3抗体的选择
50 μg蛋白样品经12% SDS-PAGE分离后,采用湿转法(恒流200 mA,42 min),印记至NC膜上。加入6% BSA,室温孵育2 h。用TBST(20 mM Tris-HCl,0.88% NaCl,0.05% Tween 20,pH 7.6)清洗3次,每次5 min。加入TBST稀释的一抗(小鼠抗人VDR单克隆抗体D-6,0.2 μg/mL;或兔抗大鼠VDR多克隆抗体C-20,0.4 μg/mL),4 ℃孵育过夜。用TBST洗膜5次,每次5 min。加入VDR一抗对应的二抗(HRP标记山羊抗小鼠IgG(L),1∶10 000;或HRP标记山羊抗兔IgG(H+L),1∶10 000),45 rpm,37 ℃孵育1.5 h。用TBST洗膜5次,每次5 min。最后,利用罗氏ECL超强显色试剂盒显色5 min,压片曝光(曝光时间根据信号强弱而有所调整)、显影、定影、观察。对照组以等体积TBST溶液替代一抗,加入等量的HRP标记山羊抗小鼠IgG(L)作为二抗,其余条件同实验组。
1.4不同封闭条件对VDR检测的影响
分别采用5%脱脂奶粉和6% BSA作为封闭液,其余条件同1.3。
1.5VDR免疫印迹条件的优化
优化后的VDR免疫印迹体系采用6% BSA作为封闭液,D-6作为一抗(抗体浓度为1 μg/mL),HRP标记山羊抗小鼠IgG(L)作为二抗(1∶10 000稀释),其余条件同1.3。该实验体系可用于建立牛蛙和斑马鱼中VDR的免疫印迹体系。
2结果与分析
2.1蛋白质样品的SDS-PAGE电泳分离

图1 蛋白质样品的还原型SDS-PAGE电泳分析
十二指肠和肾是VDR高表达的组织,也是维生素D的主要靶组织,在维持机体钙、磷平衡中发挥着重要作用。因此,实验选取牛蛙十二指肠、牛蛙肾、斑马鱼肠作为VDR检测的潜在组织器官,建立针对牛蛙与斑马鱼VDR的免疫印迹体系。VDR本质上是一种配体依赖的顺式激活转录调控因子,主要定位于细胞核内。为了有效提取核内VDR蛋白,参照先前已报道的方法[24],略作调整后,提取组织蛋白质。利用12%的还原型SDS-PAGE对提取的蛋白质进行分离检测。如图1所示,其中Marker为蛋白质分子量标准,m-Duodenum表示小鼠十二指肠,b-Duodenum和b-Kidney分别表示牛蛙十二指肠和牛蛙肾,z-Intestine表示斑马鱼肠。结果显示蛋白质提取效果良好,可以用于后续实验。
2.2抗体的选择
要在低等脊椎动物中建立VDR的免疫印迹体系,必须选择一种能够与其VDR高效、特异反应的抗体。目前,有十几种市售VDR抗体,其中应用最广泛的是大鼠单克隆抗体9A7、兔多克隆抗体C-20、小鼠单克隆抗体IVG8C11、小鼠单克隆抗体D-6。前人的研究结果表明,VDR抗体D-6和C-20具有很高的灵敏性和多功能性,能够和人、大鼠、小鼠、猴、猪、鸡的VDR抗原反应[24]。因此,本研究选择D-6和C-20作为建立低等动物VDR的免疫印迹体系的候选抗体。为了进一步比较以上两种VDR抗体的特异性和灵敏性,实验选取已知能够响应维生素D反应的组织——小鼠十二指肠,进行免疫印迹实验。
由于小鼠内源性IgG重链的免疫印迹条带与VDR条带位置一致,为了避免IgG重链对免疫印迹的潜在干扰,实验选用了一种只识别IgG轻链的特殊二抗(HRP标记山羊抗小鼠IgG(L))。如图2所示,m-Duodenum和m-Kidney分别表示小鼠十二指肠和小鼠肾,VDR和Endo-IgG(L)分别表示小鼠VDR和内源性IgG轻链,Ns band表示非特异性信号条带。HRP标记山羊抗小鼠IgG(L)除了与小鼠内源性IgG轻链反应,还非特异性的识别几种未知蛋白,但不与内源性IgG重链反应(图2(b)),与预期结果基本一致。与对照组相比,D-6为一抗的免疫印迹体系中,能够检测到明显的VDR信号条带(图2(a))。以C-20作为一抗的免疫印迹体系中,只检测到微弱的VDR信号条带,而且在VDR上下都出现了多个较强的非特异蛋白条带(图2(c))。以上结果表明,在当前的实验条件下,D-6的特异性和灵敏性都要优于C-20抗体。因此,选取D-6抗体作为一抗进行后续实验。
(a)以D-6作为一抗 (b)以TBST替代一抗 (c)以C-20作为一抗 图2 采用不同一抗的VDR免疫印迹
2.3不同封闭条件对VDR检测的影响
为了进一步优化VDR检测的封闭条件,实验选择了两种较为常用且效果较好的封闭液(5%脱脂奶粉或6%BSA)应用于VDR的免疫印迹体系中,如图3所示。结果表明,以5%脱脂奶粉或6%BSA作为封闭液的免疫印迹体系都能检测到较强的VDR的信号条带。相较于5%脱脂奶粉组,6%BSA组的VDR条带信号更强、特异性更高。因此,选用6%BSA作为封闭液应用于后续实验。

(a)以5%脱脂奶粉作为封闭液的VDR免疫印迹 (b)以6%BSA作为封闭液的VDR免疫印迹图3 不同封闭条件对VDR检测的影响
2.4VDR免疫印迹条件的优化
基于上述实验,对免疫印迹体系进行了进一步优化,以期提高VDR检测的特异性和灵敏性。优化后的免疫印迹体系采用6% BSA作为封闭液,D-6作为一抗(抗体浓度为1 μg/mL),HRP标记山羊抗小鼠IgG(L)作为二抗(1∶10 000稀释),其余条件同1.3。如图4所示,其中“D-6”和“Control”分别表示以D-6作为一抗或等体积的TBST溶液替代一抗的VDR免疫印迹;与对照组(Control)相比,实验组(D-6)出现信号较强、特异性较高的VDR条带。该免疫印迹体系将用于牛蛙和斑马鱼VDR的蛋白检测。
2.5牛蛙与斑马鱼中VDR的免疫印迹体系建立
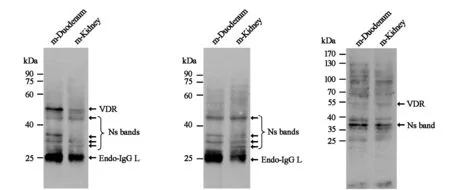
为了在牛蛙与斑马鱼中建立VDR的免疫印迹体系,实验选取牛蛙十二指肠、牛蛙肾、斑马鱼肠作为VDR检测的潜在靶组织、器官,以小鼠十二指肠作为阳性对照,进行免疫印迹实验(图5)。图5中mVDR、bVDR和zVDR分别表示小鼠VDR、牛蛙VDR和斑马鱼VDR。D-6抗体能够和小鼠、牛蛙、斑马鱼的VDR反应。在牛蛙十二指肠和肾中特异地检测到两种形式的VDR条带,上面的条带信号较强(VDR亚型I),下面的条带信号较弱(VDR亚型II),它们的表观分子量分别约为60 kDa和55 kDa。在斑马鱼的肠中也检测到两条信号带,其中表观分子量约为56 kDa的条带对应于VDR蛋白,约为30 kDa的条带推测为非特异性信号带。牛蛙、斑马鱼、小鼠VDR的大小略有差异,其中斑马鱼VDR大于小鼠VDR,略大于牛蛙VDR亚型II,但小于牛蛙VDR亚型I。以上结果表明,牛蛙十二指肠、牛蛙肾、斑马鱼肠中存在VDR,本研究建立的免疫印迹体系能够成功应用于牛蛙和斑马鱼VDR的蛋白质检测。

图4 小鼠VDR检测条件的优化 图5 牛蛙与斑马鱼中VDR的免疫印迹体系建立
3讨论
VDR广泛分布于各种组织细胞中,几乎所有细胞都能够和维生素D响应;大约3%的人类或小鼠基因组是受维生素D内分泌系统直接或间接调控的,这表明维生素D具有除调节钙磷平衡之外更为广泛的功能[25]。维生素D是通过与VDR结合来发挥其生理功能,因此测定组织细胞中的VDR水平至关重要。近年来,国内外对哺乳动物和鸟类VDR的研究越来越多,但对两栖类和鱼类等较低等脊椎动物中的VDR功能知之甚少,有必要进行深入研究。要在这些低等脊椎动物中开展VDR的研究,首先要建立一套高效的VDR免疫印迹体系作为技术支撑。本研究选用牛蛙(Ranacatesbeiana)与斑马鱼(Daniorerio)作为两栖类和鱼类的代表,在这两个物种中成功建立了一套VDR免疫印迹体系。
两栖动物在动物进化中占据着举足轻重的地位,是第一个从水生向陆生过渡的动物,代表着脊椎动物发育的原始模式。水生到陆生环境的改变,伴随着新器官的形成和原有器官机能的转变。水生动物(鱼和蝌蚪)是通过鳃和皮肤从溶有矿物离子的水中获取钙,而陆生动物从食物中摄取钙,两栖动物从水生向陆生的转变会增加对膳食钙的依赖[26]。为了从进化的角度更好的理解维生素D内分泌系统在两栖动物中的功能,有必要对其VDR的分布和功能进行研究。研究者从非洲爪蟾(Xenopuslaevis)肠道总RNA中克隆出VDR的cDNA,并在成年爪蟾的肾、肠、皮肤、骨等组织中检测到VDR mRNA[27]。本研究利用免疫印迹技术在牛蛙组织中检测到VDR蛋白,这在两栖类中尚属首次。有研究显示非洲爪蟾中存在两种VDR mRNA,其大小分别为2.2 kb和1.8 kb[27]。本研究在牛蛙十二指肠和肾中检测两种形式的VDR蛋白条带,其表观分子量分别约为60 kDa和55 kDa大小。
斑马鱼具有完善的基因组数据库和吗啉代基因敲低的技术优势,是研究离子调控和相关内分泌控制的较好动物模型。前人研究表明,斑马鱼中存在两种的VDR亚型,即VDRa和VDRb,且维生素D-VDRa信号通路能够通过上调上皮钙通道基因(EcaC)来刺激斑马鱼的钙吸收[9,28]。目前,Real time-PCR和免疫组织化学技术是检测斑马鱼VDR的主要技术手段[9,29],尚缺乏高效特异的免疫印迹体系对VDR蛋白进行分析。尽管基于VDRa 和VDRb的多克隆抗体和NBT(5-bromo-4-chloro-3-indolylphosphate/nitro-blue tetrazolium)显色液的免疫印迹体系已被尝试用于斑马鱼中VDR的检测,但该方法的特异性和灵敏性都有待提高[9]。本研究中基于小鼠D-6抗体和ECL超强显色试剂盒建立的免疫印迹体系,一定程度上提高了VDR检测的灵敏性。
牛蛙肾、牛蛙十二指肠、斑马鱼肠中检测到VDR蛋白,暗示维生素D内分泌系统可能在低等脊椎动物的肠和肾中发挥重要作用。牛蛙与斑马鱼中VDR的免疫印迹体系的建立将为两栖类、鱼类中VDR研究提供技术支撑,推动相关领域的研究。
[参考文献]
[1]DELUCA H F. Vitamin D: the vitamin and the hormone[J]. Fed Proc,1974,33(11):2211-2219.
[2]HAUSSLER M R, WHITFIELD G K, HAUSSLER C A, et al. The nuclear vitamin D receptor: biological and molecular regulatory properties revealed[J].J Bone Miner Res,1998,13(3):325-349.
[3]GOLTZMAN D, MIAO D, PANDA D K, et al. Effects of calcium and of the Vitamin D system on skeletal and calcium homeostasis: lessons from genetic models[J]. J Steroid Biochem Mol Biol,2004,89-90(1-5):485-489.
[4]BRUMBAUGH P F, HAUSSLER M R. Specific binding of 1alpha,25-dihydroxycholecalciferol to nuclear components of chick intestine[J]. J Biol Chem,1975,250(4):1588-1594.
[5]PRASLICKOVA D, SHARIF S, SARSON A, et al. Association of a marker in the vitamin D receptor gene with Marek’s disease resistance in poultry[J]. Poult Sci,2008,87(6):1112-1119.
[6]BAKER A R, MCDONNELL D P, HUGHES M, et al. Cloning and expression of full-length cDNA encoding human vitamin D receptor[J]. Proc Natl Acad Sci U S A,1988,85(10):3294-3298.
[7]CUI X, PELEKANOS M, LIU P Y, et al. The vitamin D receptor in dopamine neurons; its presence in human substantia nigra and its ontogenesis in rat midbrain[J]. Neuroscience,2013,236:77-87.
[8]WANG Yong-ji, ZHU Jin-ge, DELUCA H F. Identification of the vitamin D receptor in osteoblasts and chondrocytes but not osteoclasts in mouse bone[J]. J Bone Miner Res,2014,29(3):685-692.
[9]LIN C H, SU C H, TSENG D Y, et al. Action of vitamin D and the receptor, VDRa, in calcium handling in zebrafish (Danio rerio)[J]. PLoS One,2012,7(9):e45650.
[10]WHITFIELD G K, DANG H T, SCHLUTER S F, et al. Cloning of a functional vitamin D receptor from the lamprey (Petromyzon marinus), an ancient vertebrate lacking a calcified skeleton and teeth[J]. Endocrinology,2003,144(6):2704-2716.
[11]LOCK E J, ORNSRUD R, AKSNES L, et al. The vitamin D receptor and its ligand 1alpha,25-dihydroxyvitamin D3 in Atlantic salmon (Salmo salar)[J]. J Endocrinol,2007,193(3):459-471.
[12]DELUCA H F. Overview of general physiologic features and functions of vitamin D[J]. Am J Clin Nutr,2004,80(6 Suppl):1689S-1696S.
[13]KOIKE N, HAYAKAWA N, KUMAKI K, et al. In vivo dose-related receptor binding of the vitamin D analogue [3H]-1,25-dihydroxy-22-oxavitamin D3 (OCT) in rat parathyroid, kidney distal and proximal tubules, duodenum, and skin, studied by quantitative receptor autoradiography[J]. J Histochem Cytochem,1998,46(12):1351-1358.
[14]KAUNE R, SCHROEDER B, HARMEYER J. Binding properties of plasma vitamin D-binding protein and intestinal 1,25-dihydroxyvitamin D3 receptor in piglets with pseudo-vitamin D-deficiency rickets, type I: treatment effects with pharmacological doses of vitamin D3[J]. Arch Biochem Biophys,1990,282(2):326-332.
[15]HEALY K D, ZELLA J B, PRAHL J M, et al. Regulation of the murine renal vitamin D receptor by 1,25-dihydroxyvitamin D3 and calcium[J]. Proc Natl Acad Sci U S A,2003,100(17):9733-9737.
[16]BELLIDO T, GIRASOLE G, PASSERI G, et al. Demonstration of estrogen and vitamin D receptors in bone marrow-derived stromal cells: up-regulation of the estrogen receptor by 1,25-dihydroxyvitamin-D3[J]. Endocrinology,1993,133(2):553-562.
[17]MAYNE C G, SPANIER J A, RELLAND L M, et al. 1,25-Dihydroxyvitamin D3 acts directly on the T lymphocyte vitamin D receptor to inhibit experimental autoimmune encephalomyelitis[J]. Eur J Immunol,2011,41(3):822-832.
[18]KOEFFLER H P, BISHOP J E, REICHEL H, et al. Lymphocyte cell lines from vitamin D-dependent rickets type II show functional defects in the 1 alpha,25-dihydroxyvitamin D3 receptor[J]. Mol Cell Endocrinol,1990,70(1):1-11.
[19]MATSUNAWA M, AMANO Y, ENDO K, et al. The aryl hydrocarbon receptor activator benzo[a]pyrene enhances vitamin D3 catabolism in macrophages[J]. Toxicol Sci,2009,109(1):50-58.
[20]PROVVEDINI D M, TSOUKAS C D, DEFTOS L J, et al. 1,25-dihydroxyvitamin D3 receptors in human leukocytes[J]. Science,1983,221(4616):1181-1183.
[21]CHEN Li-na, DAVEY SMITH G, EVANS D M, et al. Genetic variants in the vitamin d receptor are associated with advanced prostate cancer at diagnosis: findings from the prostate testing for cancer and treatment study and a systematic review[J]. Cancer Epidemiol Biomarkers Prev,2009,18(11):2874-2881.
[22]GARFIA B, CANADILLAS S, CANALEJO A, et al. Regulation of parathyroid vitamin D receptor expression by extracellular calcium[J]. J Am Soc Nephrol,2002,13(12):2945-2952.
[23]LAI S C, NAKAYAMA Y, SEQUEIRA J M, et al. The transcobalamin receptor knockout mouse: a model for vitamin B12 deficiency in the central nervous system[J]. FASEB J,2013,27(6):2468-2475.
[24]WANG Yong-ji, BECKLUND B R, DELUCA H F. Identification of a highly specific and versatile vitamin D receptor antibody[J]. Arch Biochem Biophys,2010,494(2):166-177.
[25]BOUILLON R, CARMELIET G, VERLINDEN L, et al. Vitamin D and human health: lessons from vitamin D receptor null mice[J]. Endocr Rev,2008,29(6):726-776.
[26]BALDWIN G F, BENTLEY P J. Calcium metabolism in bullfrog tadpoles (Rana catesbeiana)[J]. J Exp Biol,1980,88:357-365.
[27]LI Yan-chun, BERGWITZ C, JUPPNER H, et al. Cloning and characterization of the vitamin D receptor from Xenopus laevis[J]. Endocrinology,1997,138(6):2347-2353.
[28]LAFONT A G, WANG Y F, CHEN G D, et al. Involvement of calcitonin and its receptor in the control of calcium-regulating genes and calcium homeostasis in zebrafish (Danio rerio)[J]. J Bone Miner Res,2011,26(5):1072-1083.
[29]CRAIG T A, SOMMER S, SUSSMAN C R, et al. Expression and regulation of the vitamin D receptor in the zebrafish, Danio rerio[J]. J Bone Miner Res,2008,23(9):1486-1496.
[责任编辑:李 莉]
Establishment of immunoblotting system for vitamin D receptors
in bullfrog and zebrafish
LI You-shan1, ZHANG Ting-ting1,ZHU Rui2
(1.Vitamin D Research Institute, Shaanxi University of Technology, Hanzhong 723000, China;
2.School of Management, Shaanxi University of Technology, Hanzhong 723000, China)
Abstract:To date, vitamin D receptors (VDRs) from mammalian and avian have been studied extensively, but little is known about VDR in lower vertebrate species such as amphibians and fishes. In this study, bullfrog and zebrafish were chosen as the representatives of amphibians and fishes, the bullfrog duodenum, bullfrog kidney and zebrafish intestine were collected as potential target tissues for VDR detection. After protein extraction from the selected tissues, the tissue distribution of VDR was detected by immunoblotting, and the experimental conditions were optimized in the experiment. This study will provide the valuable technical support for VDR studies of amphibians and fishes, and promote advances in research of the related fields.
Key words:bullfrog;zebrafish;vitamin D receptor;immunoblotting
作者简介:李游山(1985—),男,河北省隆尧县人,陕西理工学院讲师,博士,主要研究方向为维生素D及其受体的功能。
基金项目:汉中市科技发展计划项目(2013hzzx-32);陕西理工学院科研基金资助项目(SLGQD13(2)-23)
收稿日期:2015-07-06
[中图分类号]Q565
[文献标识码]A
[文章编号]1673-2944(2015)06-0039-07
