木尔坦棉花曲叶病毒SYBR Green I实时荧光定量PCR检测方法
2016-01-25吕利华何自福何余容华南农业大学农学院广东广州5064广东省农业科学院植物保护研究所广东省植物保护新技术重点实验室广东广州50640
赵 蕊,吕利华,陈 婷,何自福,何余容(华南农业大学农学院,广东广州5064; 广东省农业科学院植物保护研究所/广东省植物保护新技术重点实验室,广东广州50640)
木尔坦棉花曲叶病毒SYBR Green I实时荧光定量PCR检测方法
赵蕊1,2,吕利华2,陈婷2,何自福2,何余容1
(1华南农业大学农学院,广东广州510642; 2广东省农业科学院植物保护研究所/广东省植物保护新技术重点实验室,广东广州510640)
摘要:【目的】木尔坦棉花曲叶病毒Cotton Leaf Curl Multan Virus(CLCuMV)是为害锦葵科植物的重要双生病毒之一,本研究的目的是建立CLCuMV定量检测方法,为进一步研究其在寄主植物内的增殖动态、在介体昆虫内循环和其与寄主、介体间互作机制提供技术手段.【方法】以纯化的含CLCuMV基因组的质粒为模板,利用SYBR Green I荧光定量PCR对不同浓度的质粒样品进行CLCuMV扩增,制作标准曲线.依照建立的标准曲线,计算烟粉虱Bemisia tabaci及朱槿Hibiscus rosa-sinensis中CLCuMV的含量.【结果和结论】该定量检测法可检测到低浓度(5.2×101μL-1)的CLCuMV,其灵敏度是常规PCR的10倍,可被用于在寄主植物和介体昆虫体内CLCuMV的定量检测.
关键词:木尔坦棉花曲叶病毒;锦葵科; SYBR Green I;实时荧光定量PCR;检测方法
赵蕊,吕利华,陈婷,等.木尔坦棉花曲叶病毒SYBR Green I实时荧光定量PCR检测方法[J].华南农业大学学报,2015,36(6):87-90.
优先出版时间:2015-10-16
优先出版网址: http: / /www.cnki.net/kcms/detail/44.1110.s.20151016.1630.026.html
木尔坦棉花曲叶病毒Cotton Leaf Curl Multan Virus(CLCuMV)属双生病毒科菜豆金黄花叶病毒属,含DNA-A组分,并伴随有卫星DNA β分子,该病毒是引起棉花曲叶病的主要病原之一[1-2].该病毒通过烟粉虱Bemisia tabaci进行传播和扩散,危害严重[3-6].已在我国广东、广西、海南及云南的棉花Gossypium hirsutum L.[2]、朱槿Hibiscus rosa-sinensis Linn.[7-9]、黄秋葵Abelmoschus esculentu L.[10]、垂花悬铃木Malvaviscus arboreus Cav.var.penduliflocus (DC.) Schery[11]和红麻Hibiscus cannabinus[8]等锦葵科植物检测到该病毒.已有利用测序比对CLCuMV在不同寄主间的变异程度的研究[12].
实时荧光定量PCR (Real time fluorescence quantitative PCR,RT-PCR)是在PCR定性技术基础上发展起来的核酸定量技术[12],被广泛用于医学病理学及分子生物学等领域[13],主要包括荧光染料法和探针法.利用RT-PCR探针法定量检测了发病番茄叶片和介体昆虫烟粉虱的番茄黄化曲叶病毒含量[14]、发病番茄植株中番茄黄化曲叶病毒和番茄黄化皱叶病毒的含量[15],也检测了蓟马虫体内番茄斑点枯萎病毒的含量[16],为解释病毒共同侵染、预测病毒传播提供了有效的依据.目前鲜见利用荧光染料法对CLCuMV定量检测的报道.
本文基于SYBR Green I检测技术,构建CLCuMV实时荧光定量PCR定量检测体系,并比较其与常规PCR定量检测该病毒的灵敏度差异;定量测定寄主植物朱槿的健康及显症植株及介体昆虫烟粉虱虫体内的CLCuMV含量,为深入研究木尔坦棉花曲叶病的发病过程、致病机理以及该病毒与寄主植物、介体昆虫的互作提供有效的定量检测技术.
1 材料与方法
1.1材料
2014年7月在广东省广州市南沙区蒲园的绿化地朱槿病株上采集供试感病叶片.病株表现为叶脉膨大且颜色加深,叶片边缘上卷,有脉突和耳突等木尔坦棉花曲叶病的典型症状.对照叶片是在未显症状的健康朱槿植株上采集的.
介体昆虫为室内饲养于朱槿植株上的MEAM1隐种(B型)烟粉虱试验种群.
质粒标准品为含有CLCuMV基因组的质粒pBin PLUS-1. 85A,由广东省农业科学院植物保护研究所蔬菜病害防控研究室提供.
高纯度质粒小量快速提取试剂盒(北京天根生化科技有限公司) ;血液组织细胞基因组提取试剂盒(北京天根生化科技有限公司) ;植物基因组提取试剂盒EasyPureTMPlant Genomic DNA Kit(北京全式金生物技术有限公司) ; 2XGoTaqTMGreen Master Mix(普洛麦格生物技术有限公司) ; 2×SYBR Green PCR Master Mix(北京天根生化科技有限公司) ; Alpha1506微量分光光度计(上海谱元仪器有限公司).
1.2方法
1.2.1质粒提取与引物设计取出保存于-80℃并含有pBin PLUS-1. 85A的农杆菌菌株(GV3101)培养后,用试剂盒提取质粒pBin PLUS-1. 85A,再将其转化到大肠埃希菌感受态细胞(DH5α),继续培养.取D600 nm为0. 6~0. 8的适量菌液,用试剂盒提取质粒,微量分光光度计测定质粒浓度,将该质粒作为标准样品母液,-20℃保存备用.
质粒中病毒基因组拷贝数= N×10-9×ρ/Mr,式中,N为阿伏伽德罗常数,ρ为核酸质量浓度(ng·μL-1),Mr为相对分子质量.由该公式计算出母液质粒浓度为5. 02×109μL-1.
基于CLCuMV的DNA-A基因组序列(GenBank登录号为: EF465535. 1[17]),用Primer 5. 0软件设计并合成检测引物CLCMuV 492-F: 5'-TCCAGATGTCCGCACAAATA-3',CLCMuV 492-R: 5'-AACCAGGTCAGCACATTTCC-3'.
1.2.2 PCR反应体系及条件常规PCR反应体系(25 μL):2XGoTaqTMGreen Master Mix 12. 5 μL,CLCMuV 492-F和CLCMuV 492-R各1 μL,样本DNA 1 μL,用ddH2O补足25 μL.阴性对照不加DNA,加1 μL DEPC(焦磷酸二乙酯)水.反应条件: 94℃7 min;94℃35 s,49℃35 s,72℃45 s,35个循环; 72℃10 min,4℃保存.在10 g·L-1琼脂糖凝胶电泳检测PCR产物.
荧光定量PCR反应体系(20 μL):2×SYBR Green PCR Master Mix 10 μL、10 μmol·L-1CLCMuV 492-F和CLCMuV 492-R各0. 5 μL、样本DNA 1 μL、用ddH2O补至20 μL.阴性对照不加DNA,加1 μL DEPC水.反应条件: 94℃,7 min; 94℃,35 s,49℃,35 s,72℃,45 s,35个循环; 95℃,10 s,95℃,5 s.1.2.3 CLCuMV实时荧光定量PCR用DEPC水以10倍梯度稀释质粒标准样品母液,获得8个供试的质粒浓度: 5. 2×108、5. 2×107、5. 2×106、5. 2×105、5. 2×104、5. 2×103、5. 2×102和5. 2×101μL-1,进行实时荧光定量PCR,获得质粒浓度与其循环阈值(Ct值)之间关系,建立其检测标准曲线.
CLCuMV以5. 2×109、5. 2×108、5. 2×107、5. 2× 106、5. 2×105、5. 2×104、5. 2×103、5. 2×102、5. 2× 101和5. 2 μL-1为供试浓度,对其进行常规PCR和实时荧光定量PCR,比较其检测的灵敏度.以不加DNA模板作为阴性对照.1.2.4朱槿显症叶片DNA提取及CLCuMV定量检测选取5株朱槿发病植株,分别采集显症的嫩叶、成熟叶片,分开标记编号,每袋1片样叶,带回实验室并保存于-80℃冰箱中.试验时,试剂盒提取朱槿DNA,用健康朱槿上的叶片作对照.微量分光光度计测定各样本的总DNA质量浓度,再将其稀释为100 ng·μL-1,备用.
1.2.4烟粉虱饲毒处理及CLCuMV定量检测以显症的朱槿作为病毒来源,在放置病株的养虫笼(50 cm×50 cm×50 cm)中释放B型烟粉虱300头.接虫24、48 h后分别从接虫朱槿植株的上、中、下部叶片上随机吸取饲毒成虫,共10头,并放于φ为95%的乙醇溶液保存,待测.从健康朱槿植株上饲养的供试成虫中吸取10头,作为对照.试剂盒提取介体昆虫DNA,微量分光光度计测定各样本的总DNA质量浓度,将其稀释为10 ng·μL-1,备用.
1.3数据处理
采用t检验对已显症状朱槿嫩叶与成熟叶片处理的CLCuMV含量、饲毒24与48 h烟粉虱虫体CLCuMV含量进行显著性检验.采用SPSS 19. 0进行统计分析.
2 结果与分析
2.1 CLCuMV实时荧光定量PCR标准曲线的建立
用DEPC水以10倍梯度稀释质粒母液获得8个浓度,并对其进行荧光定量PCR,获得8个标准样品的浓度与Ct值之间的关系,其标准曲线关系式为y =-3. 75x + 40. 56 (朱槿)、y =-4. 13x + 41. 43(烟粉虱),其中y为循环阈值(Ct值)、x为质粒标准品的初始浓度拷贝数的对数值.
2.2实时荧光定量PCR与常规PCR检测CLCuMV的灵敏度
将5. 2~5. 2×109μL-110个浓度的质粒标准样品分别进行实时荧光定量PCR和常规PCR.实时荧光定量PCR扩增曲线表明,空白对照无DNA模板,Ct值高于35,当质粒标准样品为5. 2×109,5. 2× 108、5. 2×107、5. 2×106、5. 2×105、5. 2×104、5. 2× 103、5. 2×102、5. 2×101和5. 2×100μL-1,其Ct值分别为4. 72、8. 56、12. 89、16. 31、20. 05、23. 23、26. 66、29. 65、32. 87和35. 22,其中5. 2 μl-1的Ct值高于35,其余的均小于35,说明利用实时荧光定量PCR可定量检测出质粒标准样品的最低浓度为5. 2 ×101μL-1.利用常规PCR检测上述10个浓度质粒标准样品时,5. 2×109、5. 2×108、5. 2×107、5. 2× 106、5. 2×105、5. 2×104、5. 2×103和5. 2×102μL-1的质粒标准样品可扩增出清晰的492 bp的目的条带(图1),判定该方法检测最低浓度为5. 2×102μL-1.分析表明,利用实时荧光定量PCR检测CLCuMV的灵敏度约是常规PCR的10倍.
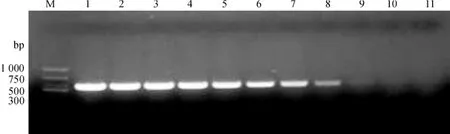
图1 10个浓度质粒标准样品的常规PCR扩增Fig.1 PCR amplification of 10 concentrations of plasmid standard samples
2.3朱槿病株的CLCuMV定量检测
利用上述实时荧光定量PCR技术,对供试的朱槿上显症的嫩叶、成熟叶及对照进行CLCuMV定量检测.结果表明,显症的嫩叶和老熟叶片的Ct平均值分别为20. 66±0. 89和22. 70±0. 32,均可检测到病毒,但所有健康叶片样本的Ct值均大于35,未检测到病毒.根据试验所建立的检测朱槿的标准曲线,获得显症嫩叶和显症老熟叶片的CLCuMV浓度分别为(9. 00±3. 80)×105和(1. 60±0. 25)×105μL-1,虽然后者小于前者,但两者间无显著性差异(t =-2. 173,P = 0. 095).
2.4烟粉虱虫体CLCuMV定量检测
利用实时荧光定量PCR对未饲毒和饲毒的单头烟粉虱虫体进行检测,结果表明对未经饲毒烟粉虱扩增的Ct值均大于35,说明对照中的烟粉虱不带毒;饲毒后24和48 h烟粉虱的扩增Ct值为32. 44 ±0. 24和31. 92±0. 73,说明饲毒24和48 h的烟粉虱均能检测到病毒,根据建立的检测烟粉虱标准曲线,推算出饲毒24和48 h的烟粉虱含有CLCuMV (4. 0±1. 6)×102和(1. 3±0. 2)×102μL-1,前者显著性地大于后者(t = 2. 445,P = 0. 04).结果分析表明,利用实时荧光定量PCR可对介体内的CLCuMV进行定量检测.
3 讨论与结论
本试验建立了一种用实时荧光定量PCR检测木尔坦棉花曲叶病毒的方法,本方法的灵敏度约是常规PCR的10倍,检测最低浓度达到5. 2×101μL-1.王洪星等[18]应用RT-PCR检测甘蔗黄叶病毒和高粱花叶病毒,检出水平分别为5×102和2. 5×102μL-1.李金磊等[19]建立的RT-PCR检测猪传染性胃肠炎病毒灵敏度可达5×101μL-1,与本试验灵敏度类似.
本研究利用实时荧光定量PCR检测寄主植物及介体昆虫的CLCuMV带毒量,检测的显症嫩叶与显症老熟叶片的CLCuMV含量并无显著差异.笔者还发现将烟粉虱转移到非番茄黄化曲叶病毒寄主植物上时,随着时间延长,昆虫体内番茄黄化曲叶病毒含量递减.本试验结果表明,饲毒24 h烟粉虱获毒量显著性地高于饲毒48 h烟粉虱获毒量,但CLCuMV在昆虫介体烟粉虱中的增殖情况还需要进一步的试验验证.
建立并完善CLCuMV的检测体系,将有助于比较CLCuMV在不同寄主植物中的传播情况,也可以监测CLCuMV在昆虫介体中的繁殖动态,最终有效预防木尔坦棉花曲叶病的传播.
参考文献:
[1]HARRISON B D,LIU Y L,KHALID S,et al.Detection and relationships of cotton leaf curl virus and allied whitefly-transmitted geminiviruses occurring in Pakistan[J].Ann Appl Biol,1997,130(1):61-75.
[2]CAI J H,XIE K,LIN L,et al.Cotton leaf curl Multan virus newly reported to be associated with cotton leaf curl disease in China[J].Plant Pathol,2010,59(4):794-795.
[3]BRIDDON R W.Cotton leaf curl disease,a multi-component begomovirus complex[J].Mol Plant Pathol,2003,4 (6):427-434.
[4]BRIDDON R W,MARKHAM P.Cotton leaf curl virus disease[J].Virus Res,2000,71(1/2):151-159.
[5]MANSOOR S,AMIN I,IRAM S,et al.Breakdown of resistance in cotton to cotton leaf curl disease in Pakistan [J].Plant Pathol,2003,52(6):784.
[6]何自福,佘小漫,汤亚飞.入侵我国的木尔坦棉花曲叶病毒及其为害[J].生物安全学报,2012,21(2):87-92.
[7]章松柏,夏宣喜,张洁,等.福州市发生由木尔坦棉花曲叶病毒引起的朱槿曲叶病[J].植物保护,2013,39 (2):196-200.
[8]林林,蔡健和,罗恩波,等.南宁市朱槿曲叶病毒病病原分子鉴定和寄主范围研究[J].植物保护,2011,37 (4):44-47.
[9]唐远,陆永跃.广东地区引起朱槿黄化曲叶病的病毒种类确定[J].广东农业科学,2013,40(10):80-82.
[10]董迪,何自福,柴兆祥.广东黄秋葵黄脉曲叶病样中检测到烟粉虱传双生病毒[J].植物保护,2010,36(1):65-68.
[11]汤亚飞,何自福,杜振国,等.侵染垂花悬铃花的木尔坦棉花曲叶病毒分子特征研究[J].植物病理学,2013,43(2):120-127.
[12]董迪,朱艳华,何自福,等.侵染广东黄秋葵的木尔坦棉花曲叶病毒及伴随卫星DNA的分子特征[J].华南农业大学学报,2012,33(1):33-39.
[13]WALKER N J.Real-time and quantitative PCR: Applications to mechanism-based toxicology[J].J Biochem Mol Toxic,2001,15 (3):121-127.
[14]MASON G,CACIAGLI P,ACCOTTO G P,et al.Real-time PCR for the quantitation of Tomato yellow leaf curl Sardinia virus in tomato plants and in Bemisia tabaci[J].J Virol Methods,2008,147(2):282-289.
[15]MORILLA G,KRENZ B,JESKE H,et al.Tête à Tête of tomato yellow leaf curl virus and tomato yellow leaf curl sardinia virus in single nuclei[J].J Virol,2004,78 (19):10715-10723.
[16]BOONHAM N,SMITH P,WALSH K,et al.The detection of tomato spotted wilt virus (TSWV) in individual thrips using real-time fluorescent RT-PCR (TaqMan)[J].J Virol Methods,2002,101(1/2):37-48.
[17]毛明杰,何自福,虞皓,等.侵染朱槿的木尔坦棉花曲叶病毒及其卫星DNA全基因组结构特征[J].病毒学报,2008,24(1):64-68.
[18]王洪星,张雨良,王健华,等.应用多重SYBR Green-I实时荧光定量PCR检测甘蔗黄叶病毒和高粱花叶病毒[J].热带农业科学,2012,32(7):52-56.
[19]李金磊,王亚宾,崔保安,等.猪传染性胃肠炎病毒SYBR-Green I荧光定量PCR检测方法的建立[J].河南农业大学学报,2011,45(3):313-317.
【责任编辑霍欢】
A SYBR Green I real-time fluorescence quantitative PCR detection method for Cotton leaf curl virus
ZHAO Rui1,2,LÜLihua2,CHEN Ting2,HE Zifu2,HE Yuyong1
(1 College of Agriculture,South China Agricultural University,Guangzhou 510642,China;
2 Guangdong Provincial Key Laboratory of High Technology for Plant Protection/Plant ProtectionResearch Institute,Guangdong Academy of Agricultural Sciences,Guangzhou 510640,China)
Abstract:【Objective】Cotton Leaf Curl Multan Virus (CLCuMV) is one of the most important viral pathogens of Malvaceae plants.The purpose of this study is to establish an accurate detection method for CLCuMV,which can provide a technological means to study propagation dynamics of viruse in host plants,virus generation cycle inside vector insect,and interaction mechanisms among virus,plant and vector.【Method】The SYBR Green I real-time fluorescence quantitative PCR was adopted using CLCuMV-plasmid as template and the standard curve was established.In accordance with the standard curve,the CLCuMV contents in leaves of Hibiscus rose-sinensis and vector bodies of Benisia tabaci were calculated.【Result and conclusion】The detection sensitivity was as low as 5. 2×101μL-1of CLCuMV,which was 10 times as sensitive as conventional PCR.It can be applied to quantitatively detect CLCuMV in host plants and vector insects.
Key words:CLCuMV; Malvaceae; SYBR Green I; real-time fluorescence quantitative PCR; detection method
基金项目:广东省科技计划项目(2010B050300014,2011B031500020)
作者简介:赵蕊(1990—),女,硕士研究生,E-mail: 335908457@ qq.com;通信作者:何余容(1963—),女,教授,博士,E-mail: yrhe@ scau.edu.cn
收稿日期:2015-01-11
文章编号:1001-411X(2015) 06-0087-04
文献标志码:A
中图分类号:S435.79
