不同有机酸对断奶仔猪肠道厌氧培养微生物菌群的影响
2016-01-25王丽娜朱晓彤王松波江青艳习欠云张永亮吴仕林华南农业大学动物科学学院广东广州5064广州智特奇生物科技股份有限公司广东广州50663
王丽娜,高 飞,朱晓彤,高 萍,王松波,江青艳,习欠云,张永亮,吴仕林,束 刚(华南农业大学动物科学学院,广东广州5064;广州智特奇生物科技股份有限公司,广东广州50663)
不同有机酸对断奶仔猪肠道厌氧培养微生物菌群的影响
王丽娜1,高飞1,朱晓彤1,高萍1,王松波1,江青艳1,习欠云1,张永亮1,吴仕林2,束刚1
(1华南农业大学动物科学学院,广东广州510642;2广州智特奇生物科技股份有限公司,广东广州510663)
摘要:【目的】建立仔猪肠道微生物菌群调控的离体模型,并研究有机酸对断奶仔猪肠道微生物菌群的影响.【方法】每次试验选取2头40日龄杜×(长×大)仔猪,屠宰后取其空肠和回肠混合食糜,按照每管300 μL分装于2 mL离心管,分别添加30 mmol·L-1不同有机酸(甲酸、乙酸、丙酸、丁酸、乳酸、富马酸、柠檬酸、苯甲酸、苹果酸和山梨酸),置于厌氧工作站中,厌氧培养4 h后提取食糜中基因组DNA,应用绝对定量PCR技术测定食糜中乳杆菌属Lactobacillus、双歧杆菌属Bifidobacterium、沙门菌属Salmonella和大肠埃希菌Escherichia coli的数量变化.随后进一步选择抑菌活性较强的甲酸、乙酸、丁酸、乳酸、柠檬酸研究其抑菌活性的浓度梯度效应.【结果和结论】成功建立了体外全食糜厌氧培养体系,研究结果发现,甲酸、丁酸和柠檬酸能呈剂量依赖性地抑制细菌增殖,而乙酸对总菌数量影响不大;对益生菌而言,柠檬酸能显著抑制乳杆菌属和双歧杆菌属的增殖,但低剂量的乳酸(10 mmol·L-1)能显著促进乳杆菌属和双歧杆菌属的增殖,且低剂量的乙酸(15 mmol·L-1)也能促进双歧杆菌属的增殖;所选择的有机酸在浓度达到10~15 mmol·L-1时,均能有效抑制病原菌(沙门菌和大肠埃希菌)的增殖.
关键词:有机酸;断奶仔猪;肠道微生物;厌氧培养
王丽娜,高飞,朱晓彤,等.不同有机酸对断奶仔猪肠道厌氧培养微生物菌群的影响[J].华南农业大学学报,2015,36(6):9-14.
优先出版时间:2015-10-16
优先出版网址: http: / /www.cnki.net/kcms/detail/44.1110.s.20151016.1446.010.html
动物肠道存在数量众多和种类各异的微生物,既包括乳酸杆菌和双歧杆菌等有益菌,也存在沙门菌和大肠埃希菌等致病菌或条件致病菌[1].肠道内正常微生物菌群不仅是肠道内抵抗外来病原菌以及内源条件致病菌的第一道防线,而且也是影响动物肠道发育和消化吸收功能的重要因素[2-3].仔猪,尤其是从出生到断奶前后的仔猪,由于肠道发育尚不成熟,其肠道微生态的平衡容易受到气候、断奶应激和饲料等因素的影响,从而造成微生物菌群失调,病原微生物感染,进而出现腹泻甚至导致仔猪死亡[4].因此,如何调节仔猪肠道微生物区系,改变有益菌和病原菌的比例,对养猪生产具有重要意义.
长期以来,抗生素一直被认为是抑制猪肠道病原微生物的首选添加剂.但抗生素滥用所造成的药物残留和细菌耐药性等问题也日益凸显.近年来的大量动物试验研究表明,酸制剂在降低肠道pH、提高饲料蛋白消化率和抑制有害微生物生长等方面均发挥着重要的作用[5],因而被认为是能有效替代抗生素的饲料添加剂之一[6].目前养殖生产中常用的酸制剂的种类和组合多样,既包括各种单一有机酸及其盐和无机酸,又包括各种复合酸[7].由于动物活体试验存在干扰因素多,动物个体差异大和试验重复性差等限制,导致不同酸制剂以及不同酸制剂组合之间的效果往往难以进行客观的评价和系统性地比较.
为快速便捷地测定有机酸对有害微生物的抑菌效应,研究人员多选择标准菌株进行药敏试验[8-9].但标准菌株既不能完全代表肠道野生菌株,同时又忽略了肠道内多种微生物之间的互作效应,其研究结果往往也很难在活体动物试验中得到重复验证.因此,本试验利用体外厌氧共培养技术,分离培养仔猪小肠内微生物,并利用16S rRNA定量分析食糜内微生物菌群的数量.研究结果不仅可以为有机酸的效价分析提供有效的体外模型,而且对于养猪生产中有机酸种类和剂量的选择同样具有指导意义.
1 材料与方法
1.1试验材料
有机酸:甲酸、乙酸、丙酸、丁酸、乳酸、富马酸、柠檬酸、苯甲酸、苹果酸和山梨酸,均为广州吉祥生物科技有限公司产品,为分析纯.
1.2试验动物和厌氧培养
每次选择2头35日龄健康断奶仔猪(华南农业大学原种猪场),于代谢笼中饲养(饲粮配方见表1) 5 d后,屠宰取其空肠和回肠内食糜,放入冰浴的烧杯中,用保鲜膜封口后置于厌氧工作站(试验开始前用氮气和二氧化碳混合气体将厌氧工作站内氧气排尽,温度调节至39℃)中,并搅拌混匀,按照每管300 μL食糜分装于40个2 mL离心管中.40个离心管随机分成4组,即未培养组、空白培养组、5 mg·mL-1氨苄青霉素组(5 mg·mL-1AMP)和10 mg·mL-1氨苄青霉素组(10 mg·mL-1AMP).其中,未培养组和空白培养组添加100 μL无菌生理盐水,抗生素组添加不同剂量氨苄青霉素.除未培养组外,其余3组均厌氧培养4 h后立即置于-20℃保存备用.采用定量PCR检测微生物菌群,每个处理设10个重复.
1.3有机酸对全食糜厌氧培养体系微生物菌群的影响
按照“1.2”方法制备仔猪肠道食糜,分别采用30 mmol·L-1的甲酸、乙酸、丙酸、丁酸、乳酸、富马酸、柠檬酸、苯甲酸、苹果酸和山梨酸培养食糜4 h.采用定量PCR检测有机酸对食糜内微生物菌群的影响.随后选择抑菌活性较强的甲酸、乙酸、丁酸、乳酸、柠檬酸,每种有机酸分别设置5、10、15、20、25和30 mmol·L-1浓度梯度,研究这些有机酸抑菌活性的浓度梯度效应.有机酸与食糜厌氧条件下共培养4 h后立即置于-20℃保存备用.每个处理设10个重复.
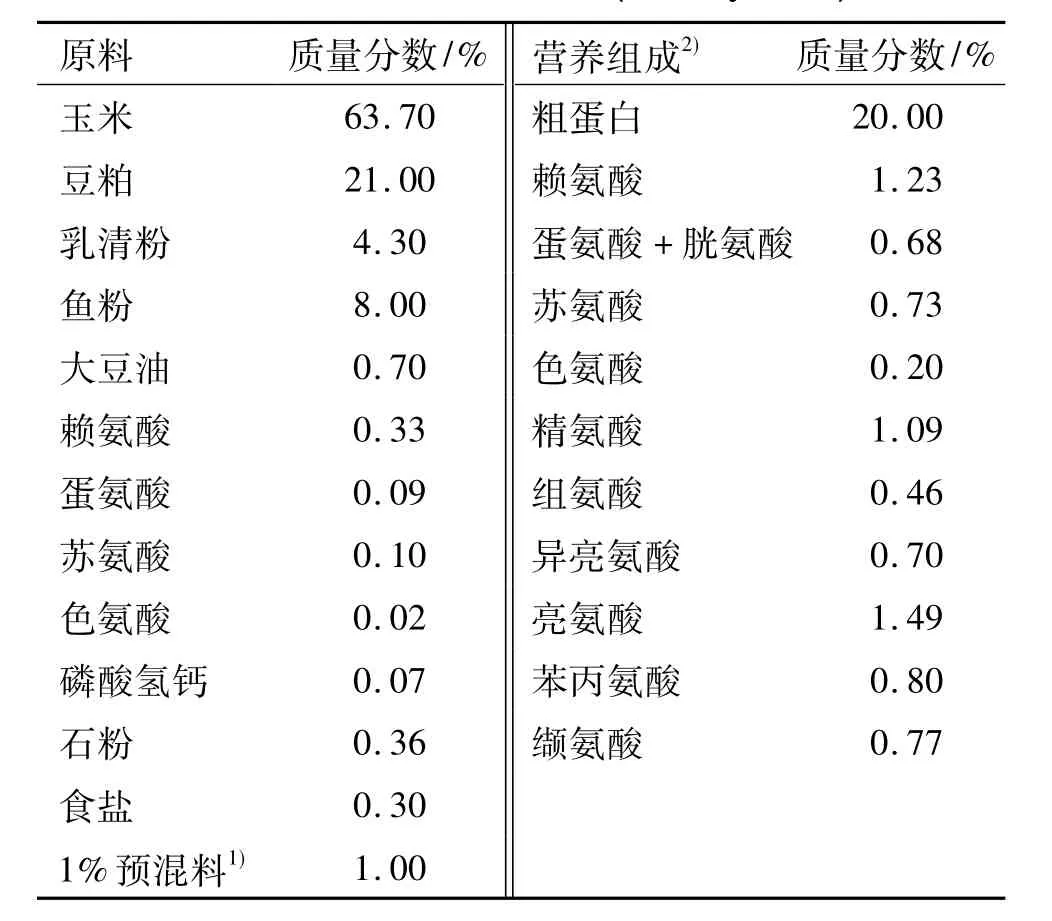
表1 饲粮配方表(风干基础)Tab.1 Diet formulations (air dry basis)
1.4引物设计
根据NCBI中GenBank发表的基因序列,用Primer Premier 5. 0软件设计不同菌属16S rRNA的上、下游引物(表2),引物由北京奥科鼎盛生物科技有限公司合成.
1.5细菌DNA的提取
食糜解冻后,定量称取300 mg于离心管中,加入50 μL溶菌酶,轻轻振荡混匀,于37℃水浴放置30 min,随后加入40 μL的0. 1 g·mL-1SDS和10 μL蛋白酶K,65℃水浴20 min后加入5 mol·L-1NaCl 100 μL于65℃水浴10 min.采用酚/三氯甲烷/异戊醇法提取DNA.所得DNA用体积分数为75%的预冷乙醇洗涤沉淀并干燥,最后用含有终质量浓度为20 μg·μL-1RNAase的灭菌TE Buffer溶解沉淀,于37℃水浴中孵育30 min.所得DNA样品置于-20℃保存备用.

表2 荧光定量PCR引物一览表Tab.2 Primer sequences used in real-time PCR analyses
1.6 16S rRNA定量分析
采用Mx3005P型实时荧光定量PCR仪进行扩增与分析,20 μL反应体系包括基因组DNA 1 μL,上、下游引物(10 μmol·L-1) 1 μL,RealtimePCR Master Mix(含荧光染料SYBR green) 10 μL,ddH2O 8 μL.反应程序为: 95℃预变性1 min; 95℃变性15 s,58~61℃退火15 s,72℃延伸30 s,共40个循环后结束.PCR产物胶回收后制作标准曲线.扩增结果用Mx3005P型实时荧光定量PCR仪进行分析并制作标准曲线.细菌数量(以拷贝数计)采用下列公式计算:
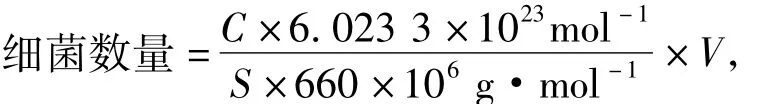
式中,C表示各样品根据标准曲线计算得到的DNA浓度,单位μg·μL-1; S表示待测细菌基因组DNA的定量PCR产物的碱基数; V表示从单位质量食糜中获取的DNA溶液体积,单位μL.
1.7数据统计
数据采用SPSS19. 0软件进行统计分析,检验试验数据的正态分布性,对不同处理组间的数值进行单因素方差分析(Analysis of variance,ANOVA)和独立t检验(Independent samples t test).数值用平均值±标准误表示.
2 结果与分析
2.1断奶仔猪肠道食糜厌氧培养效果鉴定
经过4 h厌氧培养后,食糜中总菌和各菌属的数量均急剧增加,添加5和10 mg·mL-1氨苄青霉素可极显著抑制总菌、沙门菌属和大肠埃希菌的数量(表3).氨苄青霉素对乳杆菌属和双歧杆菌属也有显著抑制作用,但抑菌活性相对较弱.上述结果表明该体外培养模型可用于后续试验.
2.2不同种类有机酸对仔猪全食糜培养体系微生物菌群的影响
试验选取的10种有机酸对微生物菌群的影响如表4所示.结果发现:与对照组相比,30 mmol·L-1甲酸、乙酸、丙酸、丁酸、乳酸和山梨酸能提高乳杆菌属数量2倍以上,而丁酸、乳酸和山梨酸能显著提高双歧杆菌属数量1. 4~2. 0倍.对于病原菌,柠檬酸、甲酸、乙酸和苹果酸表现出对大肠埃希菌和沙门菌属较强的抑菌效应.与对照组相比,柠檬酸、甲酸、乙酸、苹果酸、丁酸和乳酸处理组沙门菌数仅分别为对照组的5. 2%、7. 8%、10. 0%、10. 1%、12. 6%和17. 4%,大肠埃希菌数仅分别为对照组的5. 5%、11. 2%、12. 7%、 16. 1%、20. 2%和40. 0%.因此,30 mmol·L-1情况下综合各种有机酸对有益菌和有害菌的效应,甲酸和乙酸可以有效提高乳杆菌的数量,抑制有害菌的繁殖,但对双歧杆菌没有显著的促进作用;柠檬酸对有害菌具有最强的抑制作用,但是对有益菌也表现出抑制作用;只有丁酸和乳酸既能够有效促进有益菌的繁殖,又能较有效地抑制有害菌.
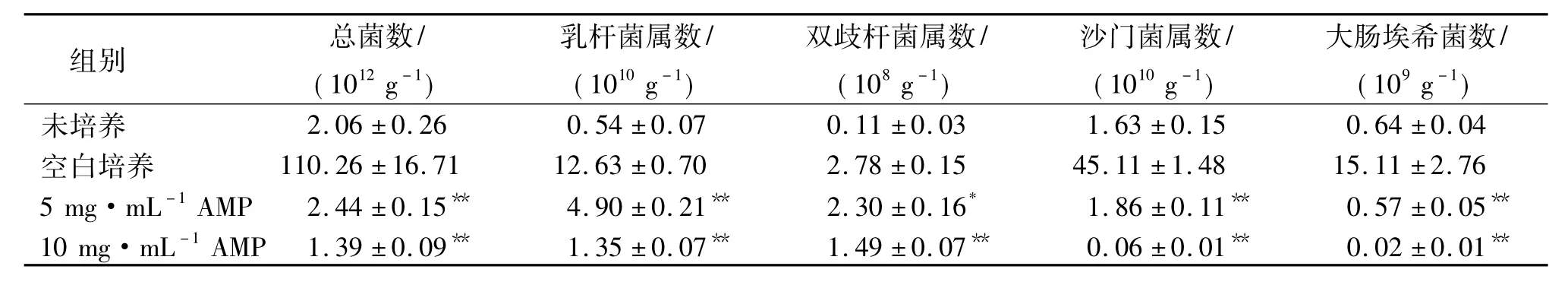
表3 断奶仔猪肠道食糜体外厌氧培养效果1)Tab.3 The construction of in vitro anaerobic culture system for total chyme from the small intestine of weaned piglets
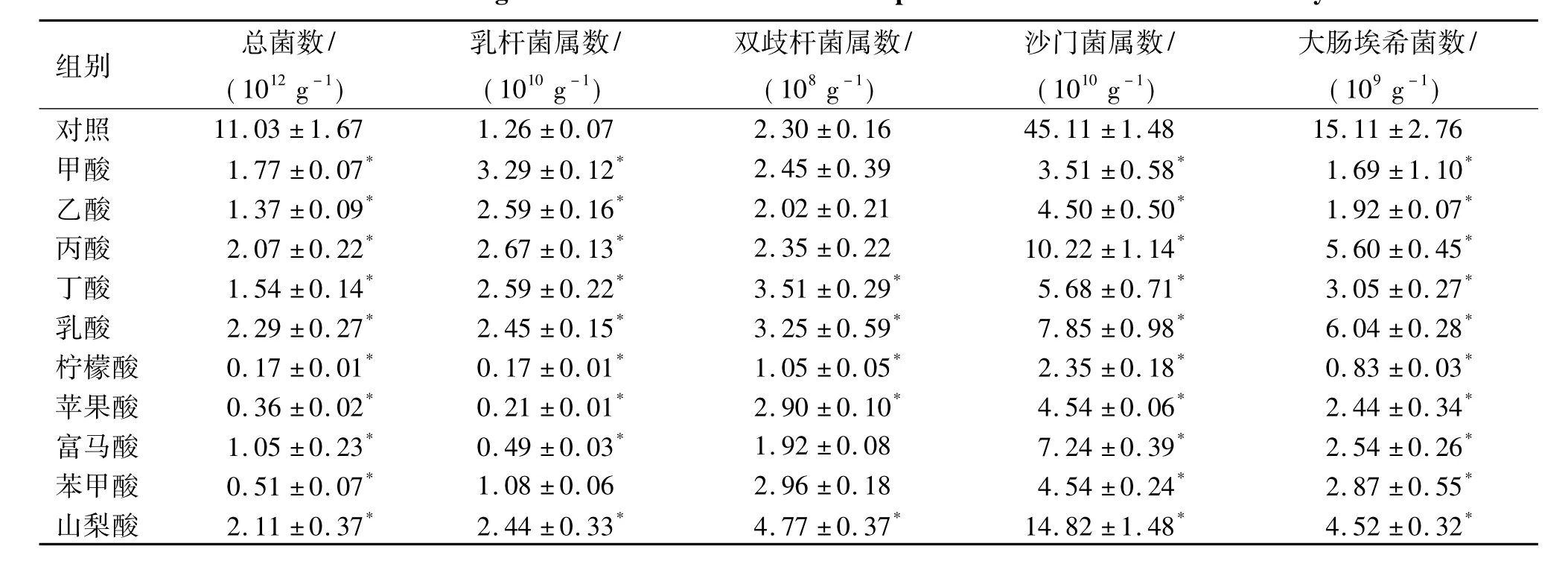
表4 不同种类有机酸对仔猪空肠和回肠中厌氧培养微生物菌群的影响1)Tab.4 The effects of organic acids on intestinal bacteria profiles in vitro anaerobic culture system
2.3有机酸调控仔猪全食糜培养体系微生物菌群的剂量效应
为进一步研究有机酸调控猪肠道微生物菌群的剂量效应,试验选择甲酸、乙酸、丁酸、乳酸和柠檬酸,分别设置6个浓度梯度进行试验.试验结果如图1所示,甲酸、丁酸和柠檬酸能呈现剂量依赖性地抑制细菌增殖,而乙酸对总菌数量影响不大(图1A).对益生菌而言,柠檬酸能显著抑制乳杆菌属和双歧杆菌属的增殖,但低剂量的乳酸(10 mmol·L-1)能显著促进乳杆菌属和双歧杆菌属的增殖(图1B、1C),且低剂量的乙酸(15~20 mmol·L-1)也能促进双歧杆菌属的增殖(图1C).所选择的5种有机酸在浓度达到10~15 mmol·L-1时,均能有效抑制病原菌(沙门菌和大肠埃希菌)的增殖(图1D、1E).因此,体外厌氧培养条件下使用单一有机酸时:乙酸应使用约15 mmol·L-1,丁酸约15 mmol·L-1,乳酸约10~15 mmol·L-1,柠檬酸只能使用约5 mmol·L-1.
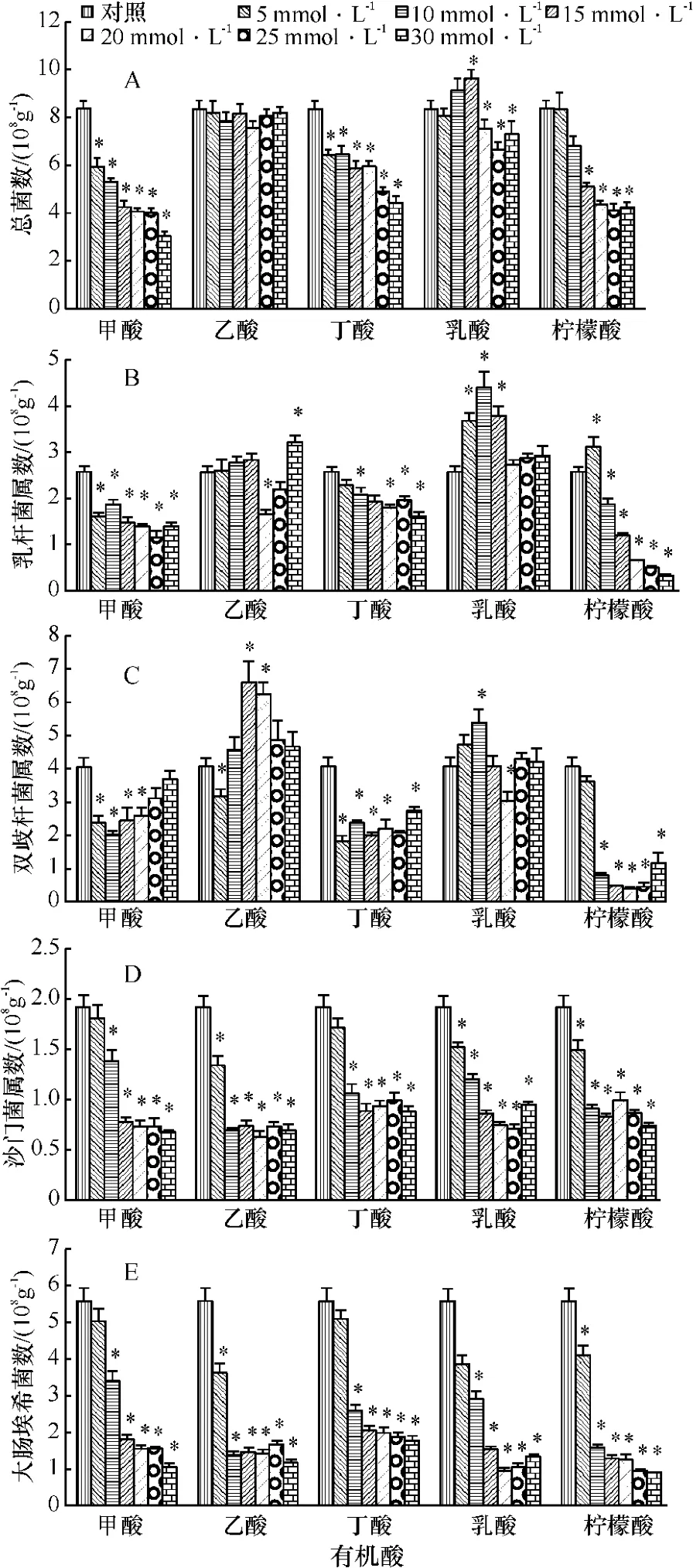
图1 不同浓度有机酸对断奶仔猪全食糜培养体系微生物菌群的影响Fig.1 The effects of different levels of concentration on organic acids on intestinal bacteria profiles in vitro total chyme anaerobic culture system
综上所述,体外厌氧培养条件下使用单一有机酸调节微生物菌群,15 mmol·L-1乙酸和10~15 mmol·L-1乳酸是较好的选择.
3 讨论与结论
3.1不同有机酸对肠道有害菌的影响
多数研究显示,有机酸在抑制肠道病原菌(大肠埃希菌、沙门菌)方面作用显著[10-12],本研究待筛选的10种酸所用浓度为30 mmol·L-1,换算成质量分数后结果与部分文献的结果也基本一致[6,13],但关于有机酸作用效果的报道仍存在差异,主要原因包括有机酸种类的不同、添加剂量存在差异.有学者认为有机酸抑制病原菌的机制主要有2个方面,首先是有机酸电离产生的氢离子,可以通过降低消化道pH间接减少细菌数量;其次,有机酸在某些复杂的酶作用下直接进入细菌的细胞从而抑制革兰阴性菌[14-15].现有的有机酸中,已有研究表明富马酸、柠檬酸、苹果酸和乳酸主要通过改变pH来抑菌,而甲酸、乙酸、丙酸和山梨酸等则可以进入细菌内,从而杀灭或抑制细菌[16].本文中的甲酸和乙酸等对大肠埃希菌和沙门菌的抑菌活性明显高于乳酸和富马酸等,说明甲酸和乙酸等直接添加在体外培养食糜中,可能同时通过两方面不同的机制发挥抑菌作用,因而表现出更强的抑菌活性.此外,有机酸电离氢离子的部位对其抑菌活性也有不同的影响.Gauthier等[17]则将肠道细菌分为pH敏感型(大肠埃希菌等) 和pH不敏感型(乳酸杆菌和双歧杆菌).研究表明,未解离状态的有机酸能够穿透某些细菌的细胞膜,在细菌体内发生解离,释放出氢离子和阴离子.细胞内pH降低,无法耐受细胞内外pH变化的pH敏感型细菌则会由于消耗大量能量用来维持正常pH而被杀灭[18].由此可以推测,由于柠檬酸的pKa值较低,将保留更多的未解离状态,从而可能产生更强的抑菌活性.
3.2不同有机酸对仔猪肠道有益菌的影响
本文研究结果发现,短链脂肪酸和乳酸能显著提高乳杆菌属数量,而丁酸、乳酸和山梨酸则对双歧杆菌属增殖有明显的促进效应.陈宝江等[19]通过试验也发现,添加酸化剂后,回肠中乳酸杆菌、厌氧菌数量呈上升趋势,且随着添加剂量增加,乳酸杆菌随之上升.而且多数报道也指出,添加单一有机酸或者复合酸化剂后,肠道内乳酸杆菌数量呈上升趋势[20-21],这主要是由于肠道pH降低,抑制有害微生物的活动和繁殖,从而促使有益菌繁殖[22],由此可见,不同种类和配比的酸化剂对仔猪肠道微生物区系的影响也不尽相同.
目前对有机酸的研究大多是通过动物试验的方式来进行,添加的有机酸也都通过不同的工艺方式进行加工处理,常用的酸化剂的加工工艺有吸附混合、流化床包衣和脂埋等技术,而随着工艺的改进,酸化剂的使用效果将不受饲料因素影响,且缓释性能得到极大的提高,从而导致不同研究中的添加剂量差异很大[23].本文通过体外研究模型,筛选出每种酸的最佳处理浓度,以期为生产实践中添加剂量的选择提供参考.而生产实践中,通过合理设置酸化剂的组合是增加肠道有益菌,降低病原菌,改善肠道健康的有效途径.
3.3结论
综上所述,本试验采用仔猪食糜离体厌氧培养体系,研究各种有机酸对肠道微生物菌群的影响,并初步筛选确定了体外厌氧培养条件下使用单一有机酸调节微生物菌群,15 mmol·L-1乙酸和10~15 mmol·L-1乳酸是较好的选择.研究结果为进一步优化仔猪用有机酸制剂的配比提供了直接的试验依据.
参考文献:
[1]VONDRUSKOVA H,SLAMOVA R,TRCKOVA M,et al.Alternatives to antibiotic growth promoters in prevention of diarrhoea in weaned piglets: A review[J].Vet Med,2010,55(5):199-224.
[2]BERNET M F,BRASSART D,NEESER J R,et al.Lactobacillus acidophilus LA 1 binds to cultured human intestinal cell lines and inhibits cell attachment and cell invasion by enterovirulent bacteria[J].Gut,1994,35 (4):483-489.
[3]高权新,吴天星,王进波.肠道微生物与寄主的共生关系研究进展[J].动物营养学报,2010,22(3):519-526.
[4]谢倩,姚明,黄晓慧,等.某猪场腹泻仔猪沙门氏菌分离鉴定与药敏试验[J].猪业科学,2014,31(1):94-96.
[5]KASPROWICZ-POTOCKA M,FRANKIEWICZ A,SELWET M,et al.Effect of salts and organic acids on metabolite production and microbial parameters of piglets'digestive tract[J].Livest Sci,2009,126(1):310-313.
[6]CANIBE N,HøJBERG O,HøJSGAARD S,et al.Feed physical form and formic acid addition to the feed affect the gastrointestinal ecology and growth performance of growing pigs[J].J Anim Sci,2005,83(6):1287-1302.
[7]王杰.复合酸化剂的筛选及其对断奶仔猪的应用研究[D].杨凌:西北农林科技大学,2004.
[8]SKRIVANOVA E,MAROUNEK M,BENDA V,et al.Susceptibility of Escherichia coli,Salmonella sp.and Clostridium perfringens to organic acids and monolaurin[J].Vet Med,2006,51(3):81.
[9]马鑫,马秋刚,计成,等.蛋氨酸羟基类似物和有机酸
化剂对主要肠道病原菌体外抑菌效果的比较[J].动物营养学报,2008,20(2):238-241.
[10]CREUS E,PéREZ J F,PERALTA B,et al.Effect of A-cidified feed on the prevalence of Salmonella in market-age pigs[J].Zoonoses Public Hlth,2007,54(8):314-319.
[11]PIVA A,GRILLI E.Role of benzoic,lactic and sorbic acid in in vitro swine cecal fermentation[J].Vet Res Commun,2007,31(Suppl 1):401-404.
[12]KNARREBORG A,MIQUEL N,GRANLI T,et al.Establishment and application of an in vitro methodology to study the effects of organic acids on coliform and lactic acid bacteria in the proximal part of the gastrointestinal tract of piglets[J].Anim Feed Sci Tech,2002,99(1):131-140.
[13]TSILOYIANNIS V K,KYRIAKIS S C,VLEMMAS J,et al.The effect of organic acids on the control of porcine post-weaning diarrhoea[J].Res Vet Sci,2001,70(3):287-293.
[14]PAPATSIROS V,TASSIS P,TZIKA E,et al.Effect of benzoic acid and combination of benzoic acid with a probiotic containing Bacillus cereus var.toyoi in weaned pig nutrition[J].Pol J Vet Sci,2011,14(1):117-125.
[15]PIVA A,CASADEI G,BIAGI G.An organic acid blend can modulate swine intestinal fermentation and reduce microbial proteolysis[J].Can J Anim Sci,2002,82(4):527-532.
[16]CASTRO M.Use of additives on the feeding of monogastric animals[J].Cuban J Agr Sci,2005,39: 439-445.
[17]GAUTHIER R.Intestinal health,the key to productivity: The case of organic acids[C]/ / Anon.XXVII Convencion ANECA-WPDC.Jal.,Mexico: Puerto Vallarta,2002: 1-14.
[18]LAMBERT R J,STRATFORD M.Weak-acid preservatives: Modelling microbial inhibition and response[J].J Appl Microbiol,1999,86(1):157-164.
[19]陈宝江,景翠,于会民,等.酸化剂对早期断奶仔猪肠黏膜形态、微生物区系及挥发性脂肪酸产生的影响[J].中国畜牧兽医,2011,38(10):23-26.
[20]冷向军,王康宁,杨凤,等.酸化剂对早期断奶仔猪胃酸分泌、消化酶活性和肠道微生物的影响[J].动物营养学报,2002,14(4):44-48.
[21]林映才,陈建新,蒋宗勇,等.复合酸化剂对早期断奶仔猪生产性能、血清生化指标、肠道形态和微生物区系的影响[J].养猪,2001(1):13-16.
[22]BARROW P A.The attachment of bacteria to the gastric epithelium of pig and its importance in the microecology of the intestine[J].J Appl Bacteriol,1980,48(1):147-154.
[23]刘庚寿.不同剂型的酸化剂对乳猪生产性能的影响[J].饲料广角,2012(19):37-40.
【责任编辑柴焰】
Effects of different organic acids on anaerobically cultured intestinal microflora in weaned piglets
WANG Lina1,GAO Fei1,ZHU Xiaotong1,GAO Ping1,WANG Songbo1,JIANG Qingyan1,XI Qianyun1,ZHANG Yongliang1,WU Shilin2,SHU Gang1
(1 College of Animal Science,South China Agricultural University,Guangzhou 510642,China; 2 Guangzhou Wisdom Bio-Technology Co.,Ltd.,Guangzhou 510663,China)
Abstract:【Objective】A research model of piglet intestinal microbial flora regulation was established in vitro.The effect of organic acids on intestinal microflora of piglets was studied.【Method】In this study,for each experiment,two 40-day-old Duroc×(Landrace×large) weaned piglets were slaughtered,and the mixed chyme of jejunum and ileum was aliquoted as 300 μL every tube to 2 mL centrifuge tube,then anaerobically cultured without or with 30 mmol·L-1organic acid (including formic acid,acetic acid,propionic acid,butyric acid,lactic acid,fumaric acid,citric acid,benzoic acid,malic acid and sorbic acid,respectively).Genome DNA in chyme was extracted after 4 h anaerobic culture,and the numbers of the genus Lactobacillus,Bifidobacterium,Salmonella and Escherichia coli in the chyme were detected using the method of absolute quantitative PCR.Then five organic acids (formic acid,acetic acid,butyric acid,lactic acid and citric acid) which had a stronger antibacterial activity were selected for further studybook=10,ebook=282of its concentration gradient effects on antibacterial activities.【Result and conclusion】The total chyme anaerobic culture system was successfully established in vitro.As a result,formic acid,butyric acid,and citric acid present dose dependently inhibited the proliferation of bacteria,but acetic acid had no obvious effects on the number of total bacteria.As for probiotics,citric acid could significantly inhibit the proliferation of Lactobacillus and Bifidobacterium.However,the low dose of lactic acid (10 mmol·L-1) could significantly promote the proliferation of Lactobacillus and Bifidobacterium,and the low dose of acetic acid (15 mmol·L-1) could also promote Bifidobacterium proliferation.At the concentration levels of 10-15 mmol·L-1,all of the organic acids tested in this study effectively inhibited the proliferation of pathogenic bacteria (Salmonella and E.coli).The results of this study provide a simple and effective model for optimizing the species and optimal dose of acidifier used in pig production,and when microflora is regulated with single organic acid under the anaerobic condition,15 mmol·L-1acetic acid and 10-15 mmol·L-1lactic acids are good choices.
Key words:organic acid; weaned piglet; intestinal microflora; anaerobic culture
基金项目:国家自然科学基金(31272447) ;企业委托课题:猪用抗生素替代品——新型高效有机酸制剂的研发
作者简介:王丽娜(1982—),女,讲师,博士,E-mail: wanglina@ scau.edu.cn;通信作者:束刚(1979—),男,副教授,博士,E-mail: shugang@ scau.edu.cn
收稿日期:2014-12-09
文章编号:1001-411X(2015) 06-0009-06
文献标志码:A
中图分类号:S811.2
