荧光原位杂交技术可早期有效的预测慢性粒细胞性白血病的预后
2016-01-20彭友帆张朝霞
彭友帆, 刘 洋, 张朝霞
(新疆医科大学,新疆 乌鲁木齐 830054)
荧光原位杂交技术可早期有效的预测慢性粒细胞性白血病的预后
彭友帆,刘洋,张朝霞
(新疆医科大学,新疆 乌鲁木齐 830054)
摘要:目的本研究探讨荧光原位杂交技术(FISH)在甲磺酸伊马替尼(IM)治疗慢性粒细胞性白血病(CML)长期预后中的早期预测价值。方法选取60例IM治疗阶段的CML患者骨髓标本,运用骨髓细胞形态学(BM)、FISH、逆转录-聚合酶链反应(RT-PCR)以及常规染色体分析方法(CC)对入组的CML患者每3~6个月进行48个月疗效观察。结果运用FISH技术在第3个月、第6个月以及第12个月检测融合基因Bcr-abl阳性细胞<10%的病例,其在第12个月具有较高的细胞遗传学完全缓解(CCR),同时,在第36个月和第48个月所观察的大多数患者均获得了无事件生存,与Bcr-abl阳性细胞百分数>10%的患者组比较,差异具有统计学意义(P<0.05)。相似的,运用RT-PCR和CC在第3个月和第6个月检测Bcr-Abl mRNA以及阳性分裂相百分数,两组病例在第36个月和第48个月的无事件生存率(EFS)差异无统计学意义(P>0.05),仅在第12个月差异具有统计学意义(P<0.05)。结论FISH分析技术可以为CML的长期预后提供早期有效的预测。
关键词:慢性粒细胞性白血病;荧光原位杂交技术;无事件生存率;早期预测价值
中图分类号:
文章编号:1673-8640(2015)02-0167-06Q503
文献标志码:码:A
DOI:10.3969/j.issn.1673-8640.2015.02.016
Abstract:ObjectiveTo investigate the early predictive significance of fluorescence in-situ hybridization (FISH) in the long-term prognosis of treating chronic myeloid leukemia(CML) by imatinib(IM). MethodsA total of 60 patients with CML undergoing IM treatment were enrolled, their bone marrow specimens were collected, and they were observed per 3-6 months for 48 months for treatment efficiency by bone marrow cell morphology(BM), FISH, reverse transcription polymerase chain reaction (RT-PCR) and karyotyping(CC). ResultsApplying FISH to detect the patients showed that BCR-ABL positive cell <10% in the 3rd month, the 6th month and the 12th month, which there was high CCR in the 12th month, and the most patients got free-event survival in the 36th and 48th months. Comparing with those whose BCR-ABL positive cell >10%, there was statistical significance (P<0.05). Similarly, applying RT-PCR and CC to detect Bcr-Abl mRNA and positive mitosis phase, there was no statistical difference in the 36th and 48th months(P>0.05), and there was statistical significance only in the 12th month (P<0.05). ConclusionsFISH is able to provide the early and effective prediction for the long-term prognosis of CML.
作者简介:彭友帆,男,1988年生,硕士,主要从事血液病实验室诊断工作。
收稿日期:(2014-04-15)
Fluorescence in-situ hybridization can provide the early and effective prediction for the prognosis of chronic myeloid leukemiaPENGYoufan,LIUYang,ZHANGZhaoxia.(XinjiangMedicalUniversity,XinjiangUrumqi830054,China)
Key words: Chronic myeloid leukemia; Fluorescence in-situ hybridization; Free-event survival rate; Early predictive significance

慢性粒细胞性白血病(chronic myeloid leu-kemia,CML)为一种源于骨髓干细胞的恶性增殖性疾病,是临床上较为多见的白血病类型之一,可以发生于任何年龄的人群,以中老年人群最常见[1]。其发病机制由于t(9;22)(q34;q11)易位而形成的费城染色体和相应的Bcr-Abl融合基因,进一步生成具有异常活性的络氨酸激酶被普遍认为是CML发生、发展的原因[2]。因此,在治疗方面,据研究报道表明,对于甲磺酸伊马替尼(imatinib mesylate, IM)在慢性期CML患者的治疗上,虽然运用IM对于慢性期治疗的临床缓解率(clinical remission rate,CR)可达75%~90%,但少部分患者IM治疗效果不佳[3],且据临床观察,有部分患者由于经济问题中断IM的治疗,使CR和无事件生存率(event free survival,EFS)降低。显然,对于IM治疗没有良好反应和长期IM治疗中预后较差的CML患者需要运用适当的技术手段对其治疗效果和预后进行早期的预测,以便临床早期采取干预措施提高患者的长期生存率和生活质量。
材料和方法
一、研究对象
本研究收集了新疆医科大学第一附属医院2007年至2013年60例经骨髓细胞形态学、组织化学、细胞及分子遗传学确诊的初诊CML并接受IM作为一线治疗患者的临床资料,男40例,女20例,年龄21~87岁,中位年龄54岁。本研究经过新疆医科大学第一临床医学院伦理委员会审核批准,并且获得每位参与者的知情同意。
二、治疗方法
入组患者第一次使用IM治疗且后续长期口服,治疗剂量根据患者的临床疗效和不良反应进行动态调整。其中8例在IM治疗前使用2~6周的羟基脲(hydroxyurea,HU)治疗。
三、疗效监测
人组患者治疗期间每3~6个月例行一次骨髓细胞形态学(bone marrow cell morphology ,BM)、常规染色体分析(karyotyping,CC)、荧光原位杂交技术(fluorescence in situ hybridization, FISH)以及逆转录-聚合酶链反应(quantitative real-time pcr,RT-PCR)进行病情监测。
四、疗效标准
参考张之南《血液病诊断及疗效标准》[4]。血液学完全缓解(complete hematologic response, CHR)标准:外周血白细胞<10×109/L,中性粒细胞≥1.5×109/L,白细胞分类正常,血小板(100~350)×109/L,骨髓中原始粒细胞+早幼粒细胞比例<5%,无髓外浸润。细胞遗传学完全缓解(complete cytogenetic response, CCR):细胞分裂中期可检测到的Ph染色体阳性细胞消失。分子生物学效应:(1) “完全”分子学缓解(complete molecular response, CMR):定量PCR未测出Bcr-AblmRNA;(2)主要分子学缓解(major molecular response, MMR):定量PCR≤0.10(或较治疗前下降≥3 log)。
五、试剂和仪器
1.CC骨髓细胞培养基(青岛莱福),染色体增长剂,秋水仙碱,0.075 mol/L KCL低渗溶液,NAPCO孵育箱。
2.FISHBcr-Abl序列探针(英国cytocell), SCC液,吐温20液,4,6-二-2苯吲哚(DAPI)抗荧光衰减剂。加热平板,杂交仪(英国THERRMO),荧光显微镜(LEICA公司DM-6000)。
3 .RT-PCRBcr-Abl荧光定量试剂(北京思尔成), 淋巴细胞分离液,生理盐水,RPMI1640, RBC裂解液, Trizol ,氯仿,异丙醇,70%乙醇溶液,焦碳酸二乙酯(DEPC)水,RT-PCR( ABI PRISM系列)。
六、检测方法
1.CC检测分析采用直接培养法和短期培养法制备骨髓细胞染色体,R带显带技术分析细胞染色体核型,异常核型按国际细胞遗传学命名体制(ISCN,1995)进行核型分析。油镜下选择带纹清晰、分布适中的中期分裂细胞,每例标本分析中期细胞至少20 个中期分裂相,见图1和图2,计数阳性细胞分裂相占总细胞分裂相的百分数。
2.FISH检测分析将收获的细胞滴片、室温洗涤、脱水,杂交仪变性,杂交后标本置于72 ℃ 0.4×SCC(pH值7.0)中洗涤2 min,经 2×SCC中冲洗后,放入0.05%的吐温20液30 s后,冲洗标本,复染,封片,应用荧光显微镜在DAPI/异硫氰酸荧光素(FITC)/TexasRed三色滤色镜激发下, 计数边界清晰、无重叠 、结构完整的细胞核,使用染色体自动分析系统进行图像采集和分析,每例标本至少分析500个间期细胞核,见图3。
3.RT-PCR检测方法(1)骨髓单个核细胞(marrow mononuclear cells,MNC)分离以及细胞总RNA的提取:使用淋巴细胞分离液分离单个核细胞,细胞总RNA的提取严格按照试剂说明书进行操作;(2)Bcr-Abl基因检测:取RNA进行逆转录反应得到cDNA备用,标准品10倍稀释,测控管与参控管的应体系为cDNA模板或定量标准品5 μL、 反应混合液44.0 μL、Taq聚合酶1.0 μL,反应终体积为50 μL,各反应管置RT-PCR仪中进行扩增,循环参数为93 ℃预变性2 min,93 ℃ 30 s, 55 ℃ 60 s共40个循环,最后于33 ℃保温反应过程中实时检测扩增过程,根据激发荧光强度变化计算机作出定量结果及定量曲线,最终获得的Bcr-Abl基因的拷贝数,计Bcr-Abl基因的拷贝数计为百分数。
七、统计学方法
采用SPSS 16.0软件进行统计分析,生存资料采用Kaplan-Meier统计方法进行分析,计数资料采用检验进行统计学分析,以P<0.05为差异有统计学意义。
结果
一、CML经IM治疗期间的血液学、细胞遗传学以及分子生物学缓解率
所有入组患者分别在第3个月、第6个月、第9个月、第12个月、第24个月、第36个月以及第48个月的血液学完全缓解(CHR)、细胞遗传学完全缓解(CCR)和主要分子学缓解(MMR)结果见表1。
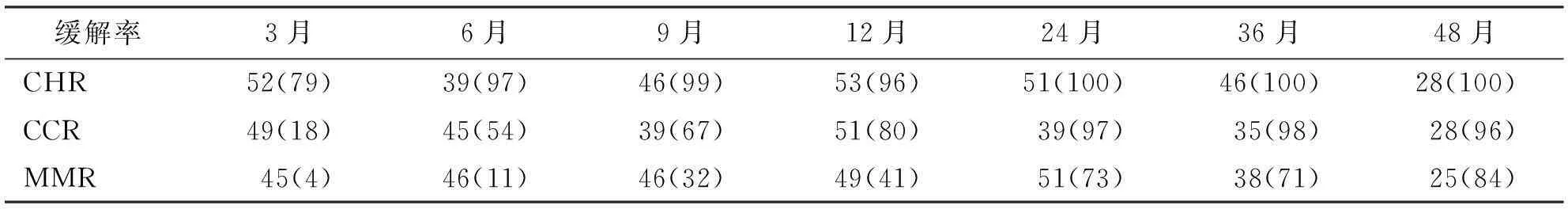
表1 血液学、细胞遗传学以及分子生物学缓解率缓解率 [例(%)]

图1 常规染色体分析模式图

图2 常规染色图分析t(9;22)异位
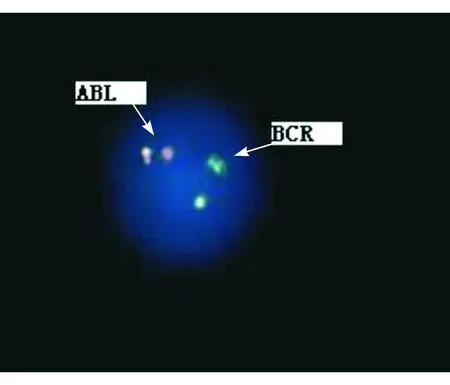
图3 BCR/ABL双色双融合探针见双融合细胞
二、CML患者生存分析结果
临床随访过程中,在36个月持续治疗期间,3例发生毒副反应,1例进行了骨髓移植手术。7例出现CML加速期,其中5例第二次络氨酸激酶关键性阻断药物治疗后重新获得缓解,另2例加速期患者死亡。1例在第17个月出现急变,后续行骨髓移植后死亡。无事件生存率(event free survival,EFS)曲线见图4。
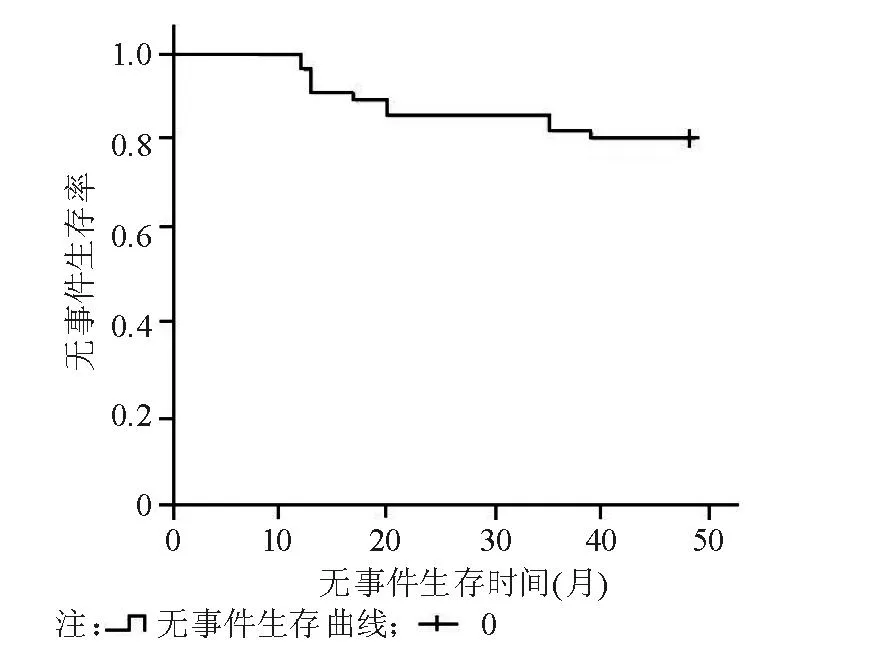
图4 CML患者IM治疗48个月期间无事件
三、3种检测方法针对12个月的CCR监测以及CML患者长期预后分析结果。见表2。
运用FISH在第3和第6个月以及第12个月检测融合基因Bcr-abl阳性细胞, FISH检测Bcr-abl阳性细胞百分数<10%的病例组在第12个月具有较高的CCR,并且,在第36个月以及第48个月的EFS明显高于Bcr-abl阳性细胞百分数>10%的病例组,两组差异具有统计学意义(P<0.05),相似的,运用RT-PCR和CC在第3个月和第6个月检测其Bcr-Abl融合基因和费城染色体,两病例组在第36个月以及第48个月的EFS差异无统计学意义(P>0.05),RT-PCR和CC在第12个月检测,差异具有统计学意义(P<0.05)。

表2 CC、FISH以及RT-PCR对于CCR和长期预后预测分析结果
讨论
IM作为治疗CML的一线药物,据国外研究报道,在第3个月出现首次CCR的患者,5年生存率的人数比例达95%[5]。可见CCR可以作为IM治疗CML后期预后评价一个可靠的指标,CML患者获得持续的CCR对于提高患者长期生存率具有重要的意义,TAKAHASHI等[6]研究发现,FISH可以有效的对IM治疗期间的CCR进行判断,对于长期服用IM的CML患者,在第3个月应用FISH技术对Bcr-abl融合基因进行检测,有利于监控IM的疗效。据TAKAKASHI等[7]研究表明,FISH对IM治疗CML初期阶段的临床预后具有一定的预测价值。但在上述研究中,FISH对于CML患者长期预后的早期判断并没有得到进一步的阐述和研究,本研究运用CC、FISH以及RT-PCR对60例经IM治疗的CML患者长达48个月的跟踪监测发现,运用FISH技术在第3个月和第6个月检测Bcr-abl阳性细胞百分数<10%的病例,其在第12个月具有较高的CCR,同时,所观察的患者在第36个月和第48个月大多数获得了无事件生存,具有良好的预后,差异具有统计学意义,进一步观察可发现,FISH在第12个月检测结果也能对第36个月和第48个月的无事件生存率提供预测,与OHM等[8]研究结果相符合。观察RT-PCR和CC的检查结果,其不能在第3个月和第6个月为36个月以后的预后情况提供早期预测,仅在第12个月可发现RT-PCR和CC在第36个月和第48个月的预测价值,并不能与FISH相似地在CML治疗期间的早期做出预后判断。
临床对于CML诊断和疗效评价的应用上,以往CC作为临床诊断CML的“金标准”,甚至作为络氨酸激酶阻断药物治疗CML的疗效判断和CML预后评估的指标之一[9],但由于CC只能分析骨髓标本,每例骨髓细胞培养标本不可能均可获得满意的细胞分裂相[10],且CC一般分析20~50个细胞分裂相的变化,因而对染色体异位筛查存在一定的漏检率。再者,FISH分析外周血细胞能和骨髓细胞能达到一样的效果,不但能分析非分裂相细胞的Bcr-Abl融合基因的表达,而且FISH一次性能观察大量的细胞,并且运用特异性荧光探针对异常基因位点进行标记并杂交,进而具有高度的敏感性[11],同时,据王小青等[12]研究报道,FISH技术对CML的诊断与CC相比,具有快速、可靠、成功率高的特点,可用于病情监测。显然,FISH对于CML患者预后判断具有明显的优势。
在目前,由于RT-PCR具有高度敏感性,其对于CML患者预后判断和IM的疗效观察明显优于CC[13],且能监测CML患者IM期间的疗效反应或移植术后的微小残留量病变[14-15],因此,RT-PCR技术在CML的监测上得到了广泛的运用,据HANFSTEIN和HUGHES等[5,16]研究表明,在第3个月检测BCR-ABL的mRNA转录水平,Bcr-Abl mRNA比例<10%的群体与比例>10%的群体相比具有较高的EFS,在长期IM治疗期间获得了良好的预后,但在第6个月和第12个月检测BCR-ABL的mRNA转录水平并不能为CML患者的EFS和长期预后提供有效的判断,可见RT-PCR仅在第3个月可以为CML的预后提供早期预测。最近,据KLAMOVA等[17]针对458例IM治疗期间的CML患者长达5年随访研究表明,在第6个月和第12个月检测BCR-ABL的mRNA转录水平,比例小于10%的群体获得了良好的EFS,即RT-PCR在第6个月和第12个月能为CML的预后提供预测。但本次研究仅发现RT-PCR在第12个月的预测价值,与KLAMOVA等[17]的研究结果相符,显然,在不同地区的不同实验室,对于Bcr-abl的mRNA转录水平的检测结果有所差异,其原因由于目前RT-PCR对于Bcr-abl融合基因mRNA转录水平的检测,在不同的实验室从标本的采集到室内质量控制以及定量报告的结果存在较大的差异,从而减低了不同实验室结果的可比性,更重要的是缺乏标准化,主要包括内部控制基因和外部参考基因的标准化。尤其在美国,由于很多分子学实验室并没有根据IS标准评价试验的影响因素,从而很难通过单个Bcr-abl的mRNA转录水平的测定评价CML患者的疗效和预后,因此,不同地区的不同实验室对于Bcr-abl融合基因检测的结果存在一定的差异,有待通过标准化规则进一步提高[18], BRANFORD等[19]研究也证实了这点,即RT-PCR的检测结果是不稳定的,在不同的实验室的结果有一定的差异。为此,国内首个白血病领域分子检测室间比对项目“中国CML患者PCR检测标准化项目”启动,通过比对获得有效的转换系数(CF),相信在以后Bcr-ablmRNA的检测将有一个统一的国际标准[20]。另外,本次研究属于小标本,且部分患者来至偏远的南疆地区,由于条件限制而缺乏一定的依从性,可能对研究结果也存在一定的影响,有待提高标本量进一步探讨和研究。但本研究检测Bcr-abl融合基因mRNA转录水平的分子生物学实验室为ISO15189认证实验室,并且使用ABL参考基因,从而一定程度上减少了单个实验室检测mRNA转录水平的差异。
在临床上,对于初诊为CML患者,往往使用络氨酸激酶阻断药物治疗作为CML治疗的一线药物,而有些患者在长期治疗过程中,可能由于耐药等原因没获得良好的预后。因此,需要一种早期的监测手段预测IM治疗过程中的预后,以便临床早期实施干预措施,尽管RT-PCR在CML疗效的监测方面得到了广泛的运用,且在国内已经开展的比较成熟,其在CML的诊断和临床疗效监测上已经作为了一种常规检查,但本次研究表明,FISH分析技术可以为CML的预后提供早期有效的预测。
参考文献
[1]熊树民,余润泉.临床血液细胞学图谱与应用[M].上海:上海交通大学出版社,2009: 65.
[2]HEHLMANN R, HOCHHAUS A, BACCARANI M. Chronic myeloid leukaemia[J]. Lancet, 2007, 370(9584): 342-350.
[3]HOCHHAUS A, KANTARJIAN HM, BACEARANI M, et al. Dasatinib induces notable hematologic and cytogenetic responses in chronic-phase chronic myeloid leukemia after failure of imatinib therapy[J].Blood, 2007, 109(6): 2303-2309.
[4]张之南,沈悌. 血液病诊断及疗效标准[M].3版.北京:科学出版社,2007: 134-138.
[5]HANFSTEIN B, MÜLLER MC, HEHLMANN R, et al. Early molecular and cytogenetic response is predictive for long-term progression-free and overall survival in chronic myeloid leukemia (CML)[J].Leukemia, 2012, 26(9): 2096-2102.
[6]TAKAHASHI N, KAMEOKA Y, TAGAWA H, et al. Early prediction of a long-term outcome by neutrophil-FISH in patients with CML receiving imatinib mesylate[J]. Int J Hematol, 2010, 92(3): 559-561.
[7]TAKAHASHI N, MIURA I, KOBAYASHI Y, et al. Fluorescence in situ hybridization monitoring of BCR-ABL-positive neutrophils in chronic-phase chronic myeloid leukemia patients during the primary stage of imatinib mesylate therapy[J]. Int J Hematol, 2005, 81(3): 235-241.
[8]OHM L, ARVIDSSON I, BARBANY G, et at. Early landmark analysis of imatinib treatment in CML chronic phase: less than 10% BCR-ABL by FISH at 3 months associated with improved long-term clinical outcome[J]. Am J Hematol, 2012, 87(8): 760-765.
[9]The Italian Cooperative Study Group on Chronic Myeloid Leukemia. Long-term follow-up of the Italian trial of interferon-alpha versus conventional chemotherapy in chronic myeloid leukemia[J]. Blood, 1998, 92(5):1541-1548.
[10]CUNEO A, BIGONI R, EMMANUEL B, et al.Fluorescence in situ hybridization for the detection and monitoring of the Ph-positive clone in chronic myelogenous leukemia: comparison with metaphase banding analysis[J]. Leukemia, 1998,12(11):1718-1723.
[11]GRJMWADE D, BIONDI A, MOZZICONACCI M, et al. Characterization of acute promyelocytic leukemia cases lacking the classic t(15;17):results of the European Working Party [J].Blood,2000, 96(4):1297-1308.
[12]王小青,唐少华,裘晓乐.荧光原位杂交技术检测BCR/ABL融合基因[J].检验医学, 2006,21(2):152-154.
[13]KANTARJIAN HM, TALPAZ M, CORTES J, et al. Quantitative polymerase chain reaction monitoring of BCR-ABL during therapy with imatinib mesylate (STI571; gleevec) in chronic-phase chronic myelogenous leukemia[J]. Clin Cancer Res, 2003, 9(1):160-166.
[14]BRANFORD S, HUGHES TP, RUDZKI Z. Monitoring chronic myeloid leukaemia therapy by real-time quantitative PCR in blood is a reliable alternative to bone marrow cytogenetics[J]. Br J Haematol, 1999,107(3):587-599.
[15]HOCHHAUS A, REITER A, SAUSSELE S, et al.Molecular heterogeneity in complete cytogenetic responders after interferon-alpha therapy for chronic myelogenous leukemia: low levels of minimal residual disease are associated with continuing remission. German CML Study Group and the UK MRC CML Study Group[J]. Blood, 2000, 95(1):62-66.
[16]HUGHES TP, HOCHHAUS A, BRANFORD S, et al.Long-term prognostic significance of early molecular response to imatinib in newly diagnosed chronic myeloid leukemia: an analysis from the International Randomized Study of Interferon and STI571 (IRIS) [J]. Blood, 2010,116(19):3758-3765.
[18]ZHEN C, WANG YL. Molecular monitoring of chronic myeloid leukemia international standardization of BCR-ABL 1 quantitation[J]. J Mol Diagn, 2013,15(5):556-564.
[19]BRANFORD S, FLETCHER L, CROSS NC, et al. Desirable performance characteristics for BCR-ABL measurement on an international reporting scale to allow consistent interpretation of individual patient response and comparison of response rates between clinical trials[J]. Blood,2008,112(8):3330-3338.
[20]秦亚溱,主鸿鸽.慢性髓性白血病分子监测手册[M].北京:人民卫生出版社,2013:62-66.
(本文编辑:范基农)
