婴幼儿血管瘤源性血管内皮细胞系XPTS-1中p-Akt及Bcl-xL的表达及意义
2016-01-20陆宇刘硕硕泰州市第二人民医院江苏泰州225599
陆宇,刘硕硕(泰州市第二人民医院,江苏泰州225599)
婴幼儿血管瘤源性血管内皮细胞系XPTS-1中p-Akt及Bcl-xL的表达及意义
陆宇,刘硕硕
(泰州市第二人民医院,江苏泰州225599)
摘要:目的观察活化的蛋白激酶B(p-Akt)及B细胞淋巴瘤/白血病-x基因长片段(Bcl-xL)在婴幼儿血管瘤源性血管内皮细胞系(HemEC)XPTS-1中的表达变化并探讨其意义。方法取处于对数生长期的XPTS-1细胞,经特异性PI3K/Akt信号通路抑制剂LY294002处理的XPTS-1作为实验组,未经处理的XPTS-1作为对照组,采用流式细胞仪检测两组细胞周期分布和凋亡率,应用Western blotting法检测p-Akt和Bcl-xL在各组中的表达。结果
实验组G0/G1期细胞比例明显增加(P<0.01),S期和G2/M期细胞明显减少(P<0.05);实验组细胞凋亡率高于对照组(P<0.01);实验组p-Akt和Bcl-xL表达均比对照组明显降低(P均<0.01)。结论p-Akt及Bcl-xL在婴幼儿血管瘤细胞中的表达明显降低,二者可能在XPTS-1细胞凋亡中发挥重要作用。
关键词:血管瘤;磷脂酰肌醇3激酶;磷酸化丝/苏氨酸激酶; B细胞淋巴瘤/白血病-x基因长片段doi: 10.3969/j.issn.1002-266X.2015.33.009
婴幼儿血管瘤(IH)是婴幼儿较常见的良性肿瘤,根据血管瘤内皮细胞的生物学特点及临床表现,血管瘤的病程可分为增生期、消退期和消退完成期[1,2],关于其增生、消退的机制目前尚未阐明。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)通路是细胞内重要的信号转导通路,在诸多生物过程中发挥作用,包括细胞凋亡、新陈代谢、细胞的生长及增殖[3],有研究[4]证实PI3K/Akt信号通路参与血管生成。LY294002是PI3K/Akt通路的特异性抑制剂,通过特异性抑制PIK3 p110亚单位的催化活性,可阻止PI3K的磷酸化过程,进而阻止通路的激活。B细胞淋巴瘤/白血病-x基因长片段(Bcl-xL)是公
认的抗凋亡蛋白,在恶性肿瘤中研究较多,血管瘤中研究较少,有文献[5,6]报道,Bcl-xL可能参与血管形成。本研究中,我们通过阻断PI3K/Akt信号通路后检测婴幼儿血管瘤源性血管内皮细胞系XPTS-1[7]细胞周期分布和凋亡率的变化及活化的Akt(p-Akt)、Bcl-xL表达,初步探讨p-Akt及Bcl-xL蛋白在婴幼儿血管瘤中的表达及意义。
1 材料与方法
1.1主要材料及试剂胎牛血清购于杭州四季青生物工程材料有限公司,DMEM培养基和RPMI1640培养基购于美国GIBCO公司,胰蛋白酶购于华美生物工程有限公司,DMSO购于天津永大化学试剂开发中心,LY294002购于美国Sigma公司,兔抗人p-Akt多克隆抗体购于美国NEOMARKERS公司,兔抗人Bcl-xL多克隆抗体购于美国NEOMARKERS公司,流式细胞仪试剂盒购于北京四正柏生物科技有限公司。
1.2婴幼儿血管瘤内皮细胞的培养、鉴定及分组采用组织块加酶消化法培养血管瘤内皮细胞。去除新鲜血管瘤标本上残留的皮肤和脂肪组织,将瘤体剪成1~2 cm3的组织块,0.25%胰蛋白酶37℃消化10~20min,将消化后的组织块修剪成1mm3大小,接种于无菌培养瓶内,加入3mL含20%胎牛血清、70 μg/L VEGF、100mg/L肝素的DMEM培养基,37℃、5% CO2培养箱中孵育,4~5d后更换培养液。待组织块周围爬出内皮细胞较多时去除组织块,更换培养液后继续培养。细胞铺满瓶底后1∶2传代培养。传至16代时,换用RPMI1640培养基,继续培养,建立婴幼儿血管瘤XPTS-1细胞系[7]。细胞鉴定采用免疫组化法对Ⅷ因子相关抗原进行检测。结果显示血管瘤内皮细胞Ⅷ因子表达阳性。取处于对数生长期的XPTS-1细胞,分为实验组、对照组。
1.3细胞周期检测取培养的已传代并贴壁的细胞,先用血清饥饿24 h,使细胞生长周期同步化;对照组XPTS-1细胞常规培养,实验组参照文献[8]加入50 μmol/L LY294002处理,继续培养24 h,收集细胞,PBS洗2次,加入碘化丙啶(PI),避光,4℃作用30min,用流式细胞仪检测细胞周期。
1.4细胞凋亡率测算将LY294002处理24 h后的2组细胞,调整细胞浓度为1×106/mL,分别取1mL,PBS洗涤2次,弃上清,加入预冷的结合缓冲液100 μL重悬细胞,加入AnnexinV-FITC 5 μL和PI(20g/L)10 μL,混匀后于室温避光孵育15min,在反应管中加入400 μL结合缓冲液,流式细胞仪分析细胞凋亡情况。
1.5 p-Akt和Bcl-xL表达检测将LY294002处理24 h后的两组细胞吸出培养液,PBS洗涤后每孔加入细胞裂解液50 μL提取总蛋白。以牛血清蛋白做标准品,测蛋白浓度。取50 μg总蛋白经10%聚丙烯酞胺凝胶电泳分离后,转至硝酸纤维素膜上,5%脱脂牛奶(含0.1% Tween20)封闭1 h,加一抗(p-Akt 1∶1 000; Bcl-xL 1∶1 000),室温孵育过夜,洗膜,加辣根过氧化物酶标记的二抗室温孵育2 h,洗膜,ECL显色,暗室中曝光,显影,定影,保存胶片,扫描分析p-Akt和Bcl-xL表达情况。
1.6统计学方法采用SPSS13.0统计软件。计量资料以珋x±s表示,组间比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1两组细胞周期分布比较G0/G1期细胞比例明显增加(P<0.01),S期和G2/M期细胞明显减少(P<0.05),细胞生长被阻滞于G0/G1期,见表1。
表1 两组处理24 h后XPTS-1细胞周期分布(%,)
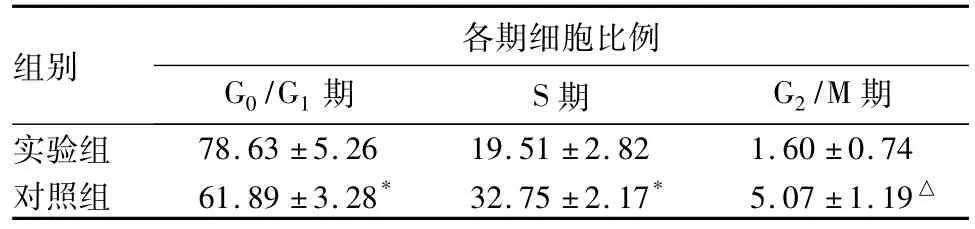
表1 两组处理24 h后XPTS-1细胞周期分布(%,)
注:与对照组比较,△P<0.05,*P<0.01。
组别 各期细胞比例G0/G1期 S期 G2/M期实验组78.63±5.26 19.51±2.82 1.60±0.74对照组 61.89±3.28* 32.75±2.17* 5.07±1.19△
2.2两组细胞凋亡率比较对照组和实验组的细胞凋亡率分别为(0.27±0.14)%、(34.72± 0.51)%,两组比较,P<0.01。
2.3两组p-Akt和Bcl-xL表达比较对照组和实验组中p-Akt的表达强度分别为0.97±0.22、0.21 ±0.07,Bcl-xL的表达强度分别为0.59±0.11、0.12 ±0.03,实验组与对照组两种蛋白表达强度差异均有统计学意义(P均<0.01)。
3 讨论
IH是婴儿期常见的良性肿瘤,其特点为异常血管的迅速增长。直至目前其增生和退化的细胞及分子机制尚未完全阐明。目前IH的治疗方法主要有口服或局部注射糖皮质激素、放疗、激光[9]、口服α-干扰素、硬化剂局部注射[10]及手术等,但均有不同程度不良反应,寻求新的治疗方法成为目前研究的热点。
Akt又名蛋白激酶B,是一种丝氨酸/苏氨酸激酶,位于PI3K/Akt信号传导通路的中心环节,Akt的活化依赖PI3K对磷脂酰肌醇环上3位羟基的特异磷酸化,p-Akt通过磷酸化下游的靶蛋白发挥促进细胞增殖、抑制细胞凋亡、化疗耐受等作用[11]。
p-Akt能调节细胞周期G1/S时相转换,其机制是通过使失活,增加cyclin-D1转录,磷酸化p21、p27等实现[12]。本实验结果发现,阻断PI3K/Akt信号通路后G0/G1期细胞比例比对照组明显增加,p-Akt表达明显降低,表明通路阻断后,活化的Akt减少,调节细胞G1/S期的作用不能发挥,细胞被阻滞于G0/G1期。
Bcl-2家族在细胞凋亡过程中发挥重要的调控作用,其成员包括抗凋亡因子和促凋亡因子,调节多细胞机体的发展及组织的动态平衡[13]。Bcl-x是Bcl-2家族的成员,是1993年Boise等[14]以鼠Bcl-2 的cDNA为探针从鸡淋巴细胞cDNA文库中筛选到的一个克隆,激活后有双重调节作用,因其mRNA的第一个外显子5'端剪接位点不同而存在两种大小不同的片段,即表达长片段的Bcl-xL及短片段的Bcl-xS,Bcl-xL在细胞质中通过与Bax形成异源二聚体抑制细胞凋亡。近年来,Bcl-xL在肿瘤发生发展中的作用受到较多关注,如前列腺癌[15]、肺癌[16]等。本研究结果发现,阻断PI3K/Akt信号通路后,XPTS-1细胞的凋亡率明显增加,p-Akt和Bcl-xL表达均降低。表明PI3K/Akt信号通路与IH细胞的增生、凋亡可能存在某种关系,且抗凋亡因子Bcl-xL亦在其中发挥重要作用。根据国内外研究结果提示,p-Akt可能是通过磷酸化NF-κB,激活其转录功能,促进Bcl-xL表达[17],一旦p-Akt的活性被抑制,Bcl-xL表达亦会下降,从而其抗凋亡作用受到抑制。
综上所述,PI3K/Akt信号通路及其下游的BclxL在婴幼儿血管瘤细胞的凋亡中发挥重要作用,据此推测婴幼儿血管瘤的增生、消退很可能与PI3K/ Akt通路的激活与抑制及Bcl-xL的表达高低有关系。本研究为以PI3K/Akt信号通路为靶点的治疗方法提供了实验依据,亦为今后婴幼儿血管瘤增生、消退机制更进一步的研究提供了新思路,但细胞内的信号转导通路错综复杂,涉及因子很多,婴幼儿血管瘤的发病机制仍需更深入地研究去完善。
参考文献:
[1]Jinninm,Ishihara T,Boye E,et al.Recent progress in studies of infantile hemangioma[J].Jdermatol,2010,37(4): 283-298.
[2]Boye E,Olsen BR.Signalingmechanisms in infantile hemangioma [J].Curr Opin Hematol,2009,16(3): 202-208.
[3]Wu B,Wang X,Chi ZF,et al.Ursolic acid-induced apoptosis in K562 cells involving upregulation of PTEN gene expression and inactivation of the PI3K/Akt pathway[J].Arch Pharm Res,2012, 35(3): 543-548.
[4]Jiang BH,Zheng JZ,Aokim,et al.Phosphatidylinositol 3-kinase signalingmediates angiogenesis and expression of vascular endothelial growth factor in endothelial cells[J].Proc Natl Acad Sci USA,2000,97(4): 1749-1753.
[5]Fernandez-Flores A,Valerdiz S.Study of the immuno expression of Bcl-2 by a cutaneous granular cell tumor[J].Actadermatovenerol Alp Panonica Adriat,2010,19(3): 11-18.
[6]Boise LH,Minn AJ,Noel PJ,et al.CD28costimulation can promote T cell survival by enhancing the expression of Bcl-xL[J].J Immunol,2010,185(7): 3788-3799.
[7]Li P,Xiao XE,Xu Q,et al.Establishment of human infancy hemangioma-derived endothelial cell line XPTS-1 and animalmodel of human infancy hemangioma[J].Zhonghua Kou Qiang Yi Xue Za Zhi,2011,46(3): 129-133.
[8]石丹,范德生,甄蕾,等,PI3K/Akt信号通路抑制剂在舌鳞癌细胞系增殖和凋亡中的作用[J].口腔颌面外科杂志,2010,20(5): 324-326.
[9]Yan X,Zhou J.The application progress of treat of oral andmaxillofacial cancer by laser[J].Stomatolmed Sci,2006,26(6): 2246-2469.
[10]Yang YW,SunmY,Shang LF,et al.Contral treatment with smalldose of PYM treat infantile parotid gland area hemangioma[J].Stomatolmed Sci,2008,28(2): 75-77.
[11]Martelli AM,Evangelisti C,Chiarini F,et al.The phosphatidylinositol 3-kinase/Akt/mTOR signaling network as a therapeutic target in acutemyelogenous leukemia patients[J].Oncotarget,2010,1(2): 89-103.
[12]沈磊,杨鸣良,孙长伏.LY294002对唾液腺腺样囊性癌SACC-83细胞周期和细胞凋亡的影响[J].中国口腔颌面外科杂志,2006,4(2): 132-135.
[13]VauxdL,Korsmeyer SJ.Celldeath indevelopment[J].Cell,1999,96(2): 245-254.
[14]Boise LH,González-Garcíam,Postema CE,et al.Bcl-x,a bcl-2 related gene that functions as adominant regulator of apoptotic celldeath[J].Cell,1993,74(4): 597-608.
[15]Hwang JJ,Kim YS,Kim T,et al.A novel histonedeacetylase inhibitor,CG200745,potentiates anticancer effect ofdocetaxel in prostate cancer viadecreasingmcl-1 and Bcl-xL[J].Invest Newdrugs,2012,30(4): 1434-1442.
[16]Li X,Wang J,Chen XJ,et al.Effect of chitooligosaccharides on cyclind1,bcl-xl and bcl-2mRNA expression in A549 cells using quantitative PCR[J].Chinese Science Bulletin,2011,56(15): 1629-1632.
[17]Go HS,Seo JE,Kim KC,et al.Valproic acid inhibits neural progenitor celldeath by activation of NF-κB signaling pathway and upregulation of Bcl-xL[J].J Biomed Sci,2011,18(1): 48.
收稿日期:( 2015-04-10)
文章编号:1002-266X(2015)33-0027-03
文献标志码:A
中图分类号:R732.2
