四氢普伐他汀钠对高血脂模型新西兰兔脂质代谢的影响
2016-01-19周淑芳
周淑芳,李 晶,关 溯,张 雷*
(1.华南理工大学生物科学与工程学院,广州 510006;2.丽珠医药集团股份有限公司,珠海 519020)
四氢普伐他汀钠对高血脂模型新西兰兔脂质代谢的影响
周淑芳1,2,李晶1,关溯1,张雷1*
(1.华南理工大学生物科学与工程学院,广州510006;2.丽珠医药集团股份有限公司,珠海519020)
摘要:目的通过高脂饮食兔高血脂模型考察四氢普伐他汀钠(H4PV-Na)的降血脂和调节脂质代谢的作用。方法新西兰白兔,雄性,100只, 适应性饲养2周后, 随机分为空白对照组、高脂模型组、阳性对照组P(普伐他汀钠组2.5 mg·kg-1)、阳性对照组A(阿托伐他汀钙组2.5 mg·kg-1)和给药组(低剂量1.25 mg·kg-1、中剂量2.5 mg·kg-1、高剂量5 mg·kg-1)。高脂饲料喂饲2周形成高脂模型后,阳性药物和供试药物强制经口灌胃给药,10 mL·kg-1,每天上午给药1次,每周给药6 d,连续10周。最后1次给药后24 h,禁食过夜,取血和肝脏组织,进行血脂和肝脂相关指标检测:血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、全血超氧化物歧化酶(SOD)活力和血清丙二醛(MDA)含量。横纹肌溶解毒性检测指标:测定血清磷酸肌酸激酶(CK)含量。取心脏、肝脏、脾脏、肺脏、肾脏、肾上腺等器官经HE染色检测脂肪组织的病理学变化。结果新西兰兔用高脂饲料喂养10周后, TC, TG和LDL-C水平升高, HDL-C水平降低, 给予H4PV-Na后,TC、TG 和LDL-C 水平降低, HDL-C 水平升高。结论H4PV-Na具有明确的降血脂和胆固醇作用,在肝脏组织中降低胆固醇能力高于在血液中,无横纹肌溶解毒性,但在同等剂量下,H4PV-Na降脂效果稍弱于普伐他汀钠和阿托伐他汀钙。
关键词:四氢普伐他汀钠; 血清磷酸肌酸激酶; 高脂血症;超氧化物歧化酶;脂肪组织
他汀类药物作为HMG-CoA 还原酶抑制剂, 能有效降低低密度脂蛋白(LDL-C) 和胆固醇(TC)水平, 从而大大减少了致命性和非致命性心血管疾病事件的发生[1-3]。他汀类降脂药为细胞内胆固醇合成限速酶, 即3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶的抑制剂, 是目前临床上应用最广泛的一类降脂药物, 常用的有辛伐他汀、洛伐他汀、普伐他汀、阿托伐他汀、匹伐他汀和氟伐他汀等。他汀类药物不仅具有调脂功能,还具有改善血管内皮功能、抑制血栓形成、稳定粥样硬化斑块、减少中风等其他多效性[4-6]。但是,他汀类药物也与肌损害有关[7]。近年来,他汀类药物可以与其他药物联合使用治疗高血脂和高血压患者,表现出良好的效果[8-9]。普伐他汀是临床表现较好的调脂药物之一,具有很好的耐受性。四氢普伐他汀最初是从普伐他汀发酵液中分离得到的氢化产物,目前对其产生的途径还不清楚。笔者课题组在前期的研究中证明了其结构和生物活性[10]。本文采用高脂饲料法建立新西兰兔高脂血症模型研究了四氢普伐他汀钠(H4PV-Na)对高脂血症的调节作用, 为H4PV-Na应用于预防和治疗高脂血症提供依据。
1仪器与材料
1.1仪器BS210S 精密电子天平 ( 北京赛多利斯天平有限公司) ; TDL80-2B台式离心机 (上海安亭科学仪器厂) ; T25型高速组织分散机(德国IKA公司);Safire2测读仪(瑞士TECAN公司);2030型组织切片机(德国莱卡公司);E600生物显微镜(日本尼康公司);SYSMEX XE-2100血球自动分析仪(日本东亚公司);OLYMPUS AUS400全自动生化分析仪(日本奥林巴斯公司)。
1.2试药四氢普伐他汀钠(H4PV-Na),质量分数98.9%,课题组合成;普伐他汀钠,质量分数99.0%,新北江制药股份有限公司生产;阿托伐他汀钙,质量分数98.2%,江苏恒瑞医药股份有限公司生产。超氧化物歧化酶(SOD)检测试剂盒,购自同仁化学研究所;丙二醛(MDA)测定试剂盒,购自南京建成生物工程研究所;血液生化检测试剂盒为OLYMPUS AUS400血液生化学检测专用试剂,由南京威尔曼公司生产;血液细胞学检测专用试剂为SYSMEX XE-2100配套试剂;其余化学试剂均为分析纯。
1.3实验动物新西兰白兔,普通级,体质量约2 kg,4月龄,雄性,100只,购自江苏省农业科学院,实验前适应性饲养2周。
1.4高脂饲料配方按质量分数配制:2%胆固醇,5%猪油,10%蛋黄粉,83%普通颗粒饲料。供应量:每只每天150~200 g。
2实验方法
2.1饲养和生化检测方法100只新西兰兔,实验前适应性饲养2周,排除饮食异常者。动物单笼饲养,按照体质量、性别随机分为7组:空白对照组、高脂模型组、阳性对照组P(普伐他汀钠组2.5 mg·kg-1)、阳性对照组A(阿托伐他汀钙组2.5 mg·kg-1)和给药组(低剂量1.25 mg·kg-1、中剂量 2.5 mg·kg-1、高剂量5 mg·kg-1)。高脂饲料喂饲之日起,阳性药物和供试药物强制经口灌胃给药,10 mL·kg-1,每天上午给药1次,每周给药6 d,连续10周。定期称量体质量,观察动物的一般行为表现。最后1次给药后24 h,禁食过夜,眼眶静脉取血,常规制备血清,进行血清生化测定,观察血脂相关指标:血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、全血超氧化物歧化酶(SOD)活力和血清丙二醛(MDA)含量。同时取肝组织,制备肝匀浆,测定肝脂相关指标:TC、TG、LDL-C、HDL-C、SOD和MDA的含量。横纹肌溶解毒性检测指标:测定血清肌肉酶类之一的血清磷酸肌酸激酶(CK)含量。
2.2组织病理学检查动物放血脱颈椎处死,进行详细地系统尸检,观察实质性脏器的色泽、质地、肿块等及空腔脏器的黏膜完整性和色泽等。心脏、肝脏、脾脏、肺脏、肾脏、肾上腺等器官去血液后称质量,按下式计算其脏器系数。
脏器系数(%)=器官(湿)质量/体质量×100%
取肝脏和兔主动脉全长标本,用生理盐水洗净,吸干水分后,常规固定于10 mL·L-1的中性甲醛固定液,经梯度乙醇脱水、二甲苯透明、石蜡包埋、切片(厚4~5 μm)、苏木素-伊红(HE)染色,进行病理形态学观察。
3结果
3.1H4PV-Na连续灌胃10周对高脂模型新西兰兔主要脏器质量及其系数的影响结果见表1。从表1可以看出,该实验持续4周时间内,正常对照组动物体质量增长无明显异常;模型组动物的体质量高于正常对照组,但动物的被毛清洁度和光泽度下降,阳性对照组和给药组动物的体质量也高于正常饮食组,动物的被毛清洁度和光泽度有不同程度的下降。与正常对照组相比,给药高剂量与阳性对照组均表现出统计学差异。由表1可以看出,与正常对照组相比,高脂饮食模型组动物肝重系数有明显升高,但无统计学差异;与高脂饮食模型组相比,各给药组动物肝重系数有明显下降趋势,但也无统计学差异。
3.2H4PV-Na对高脂血症新西兰兔的TC、TG、HDL-C和LDL-C的影响见表2~3。由表2~3可以看出,与正常对照组相比,高脂模型组动物血脂(TC,TG)及肝脂(TC,TG)水平均有显著升高(P<0.01,P<0.05),高脂模型组动物血清和肝组织中HDL-C显著降低,LDL-C显著升高(P<0.01,P<0.05)。
给药治疗10周,与模型组相比,四氢普伐他汀钠高、中剂量组、普伐他汀钠和阿托伐他汀钙组血清TC水平有显著降低(P<0.05,P<0.01);四氢普伐他汀钠高剂量组、普伐他汀钠和阿托伐他汀钙组血清TG水平有显著降低(P<0.05,P<0.01)。与模型组相比,四氢普伐他汀钠所有剂量组、普伐他汀钠和阿托伐他汀钙组肝组织TC水平有显著降低(P<0.05,P<0.01);四氢普伐他汀钠所有剂量组肝组织TG水平未见有显著降低,而普伐他汀钠和阿托伐他汀钙组肝组织TG水平有显著降低(P<0.05,P<0.01)。
给药治疗10周,与模型组相比,四氢普伐他汀钠高、中剂量组及普伐他汀钠和阿托伐他汀钙组血清HDL-C水平有显著升高(P<0.05,P<0.01);四氢普伐他汀钠高剂量组、普伐他汀钠和阿托伐他汀钙组肝组织HDL-C水平有显著升高(P<0.01)。四氢普伐他汀钠所有剂量组血清LDL-C水平未见有显著降低(P<0.05);四氢普伐他汀钠高、中剂量组、普伐他汀钠和阿托伐他汀钙组肝组织LDL-C水平有显著降低(P<0.01)。
3.3H4PV-Na对高脂血症新西兰兔的MDA和SOD的影响结果见表2~3。由表2~3可以看出,与正常对照组相比,高脂模型组动物血清和肝组织MDA有显著升高,血清和肝组织SOD水平有显著下降(P<0.01)。给药治疗10周,与模型组相比,四氢普伐他汀钠所有剂量组血清SOD水平未见有显著升高(P<0.05);四氢普伐他汀钠高剂量组、普伐他汀钠和阿托伐他汀钙组肝组织SOD水平有显著升高(P<0.01);四氢普伐他汀钠高剂量组、普伐他汀钠和阿托伐他汀钙组血清MDA水平有显著降低(P<0.05,P<0.01);四氢普伐他汀钠高剂量组、普伐他汀钠和阿托伐他汀钙组肝组织MDA水平有显著降低(P<0.01)。
3.4H4PV-Na对高脂血症新西兰兔血清CK的影响结果见表2。由表2可以看出,与正常对照组相比,高脂模型组动物血清CK有显著升高,(P<0.01),四氢普伐他汀钠中剂量组CK升高(P<0.05)。给药治疗10周,与模型组相比,四氢普伐他汀钠各剂量组、普伐他汀钠和阿托伐他汀钙组血清CK水平未见显著升高,其均数均明显低于模型组。
3.5组织病理学检查切片结果见表4和图1。结果表明,正常组肝小叶结构存在,肝板排列整齐,以中央静脉为中心向周围放射状排列,肝细胞多边形,浆丰富,核大而圆,少见双核。模型组肝小叶结构存在,肝板排列尚整齐,肝细胞呈放射状排列,大量肝细胞(>60%)明显脂肪变性,肝高脂细胞内见较多脂肪空泡。四氢普伐他汀钠高、中剂量组、普伐他汀钠和阿托伐他汀钙组形态学改变较模型对照组有改善(P<0.05)。
表1H4PV-Na连续灌胃10周对高脂模型新西兰兔主要脏器质量及其系数的影响
Tab.1 The influence of H4PV-Na on the mass of major visceral organs and coefficient after oral administration for 10 weeks in hyperlipidemia New Zealand male rabbits
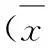

组别(n)剂量/mg·kg-1脏器质量/g;脏器质量系数/%(每组别第二排表示脏器质量系数)心脏肝脏脾脏肾脏肾上腺正常组(9)-6.792±1.355 63.477±30.8331.350±0.609 12.273±3.3600.856±0.8210.395±0.0781 3.668±1.7320.078±0.035 0.713±0.1930.049±0.048模型组(10)-6.905±0.666 96.233±11.361▲1.839±0.493 14.691±2.9071.186±0.3890.385±0.084 5.063±2.0240.119±0.034▲ 0.840±0.3180.070±0.034低剂量组(6)1.256.723±1.765 106.444±31.933▲2.679±0.657**▲▲16.183±6.9121.247±0.5250.367±0.123 5.663±1.7780.146±0.045▲▲0.840±0.2470.069±0.030中剂量组(7)2.55.470±1.108** 65.698±13.265*1.485±0.400 10.644±1.880**1.170±0.5400.330±0.126 3.805±0.7670.086±0.029 0.627±0.1640.067±0.027高剂量组(8)55.590±1.064 89.121±45.3491.811±0.842 12.071±5.4991.057±0.3480.252±0.055*▲▲ 3.820±1.0520.078±0.022 0.523±0.1360.050±0.024阿托伐他汀钙(6)2.55.458±0.679**▲▲78.775±30.6972.106±0.311 10.708±2.393*1.034±0.2730.273±0.073*▲▲3.854±1.5240.104±0.023▲ 0.523±0.112*▲0.050±0.011普伐他汀钠(7)2.56.120±1.328 86.970±23.4381.871±0.617 12.944±3.2890.974±0.4310.296±0.091▲ 4.191±1.4190.088±0.026 0.627±0.2180.048±0.026
注:与模型组比较*P<0.05,**P<0.01;与正常组相比▲P<0.05,▲▲P<0.01。
表2H4PV-Na连续灌胃给药10周对高脂模型新西兰兔血液生化指标的影响
Tab.2 The influence of H4PV-Na on TC, TG, HDL, LDL, CK, SOD and MDA in serum after oral administration for 10 weeks in hyperlipidemia New Zealand male rabbits

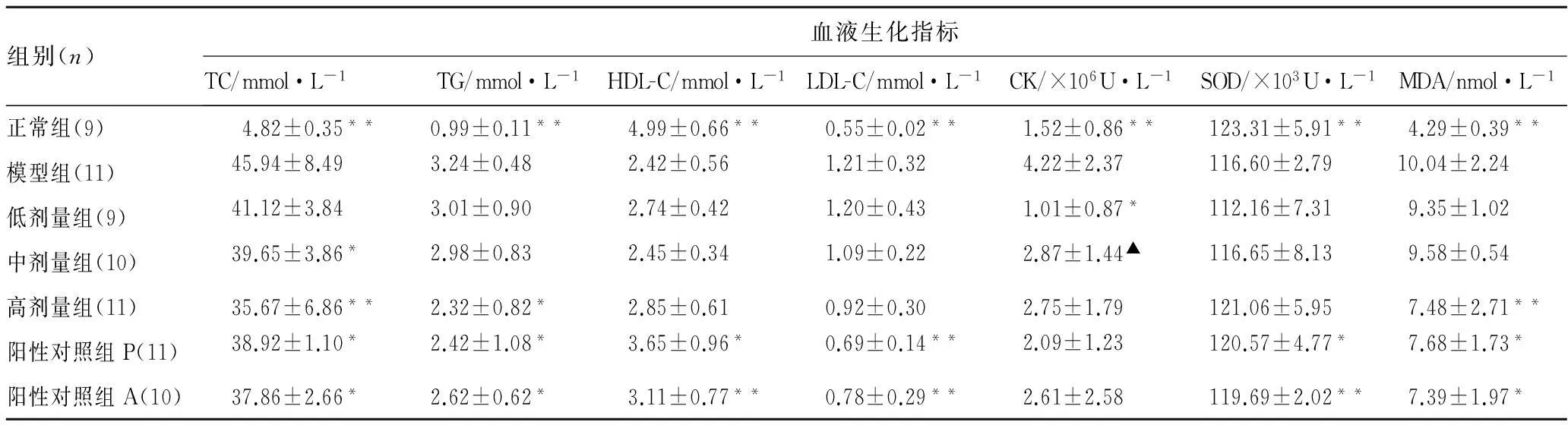
组别(n)血液生化指标TC/mmol·L-1TG/mmol·L-1HDL-C/mmol·L-1LDL-C/mmol·L-1CK/×106U·L-1SOD/×103U·L-1MDA/nmol·L-1正常组(9)4.82±0.35**0.99±0.11**4.99±0.66**0.55±0.02**1.52±0.86**123.31±5.91**4.29±0.39**模型组(11)45.94±8.493.24±0.482.42±0.561.21±0.324.22±2.37116.60±2.7910.04±2.24低剂量组(9)41.12±3.843.01±0.902.74±0.421.20±0.431.01±0.87*112.16±7.319.35±1.02中剂量组(10)39.65±3.86*2.98±0.832.45±0.341.09±0.222.87±1.44▲116.65±8.139.58±0.54高剂量组(11)35.67±6.86**2.32±0.82*2.85±0.610.92±0.302.75±1.79121.06±5.957.48±2.71**阳性对照组P(11)38.92±1.10*2.42±1.08*3.65±0.96*0.69±0.14**2.09±1.23120.57±4.77*7.68±1.73*阳性对照组A(10)37.86±2.66*2.62±0.62*3.11±0.77**0.78±0.29**2.61±2.58119.69±2.02**7.39±1.97*
注: 与高脂模型组比较*P<0.05,**P<0.01;与正常组相比▲P<0.05。
表3H4PV-Na连续灌胃给药10周对高脂模型新西兰兔肝脏生化指标的影响
Tab.3 The influence of H4PV-Na on TC, TG, HDL, LDL, SOD and MDA in liver after oral administration for 10 weeks in hyperlipidemia New Zealand male rabbits

±s)
注:与同期模型组比较*P<0.05,**P<0.01。
表4四氢普伐他汀钠对高脂模型新西兰兔肝脏病理的影响
Tab.4 The influence of H4PV-Na on hepatic histopathology in hyperlipidemia New Zealand male rabbits
±s,n=6)
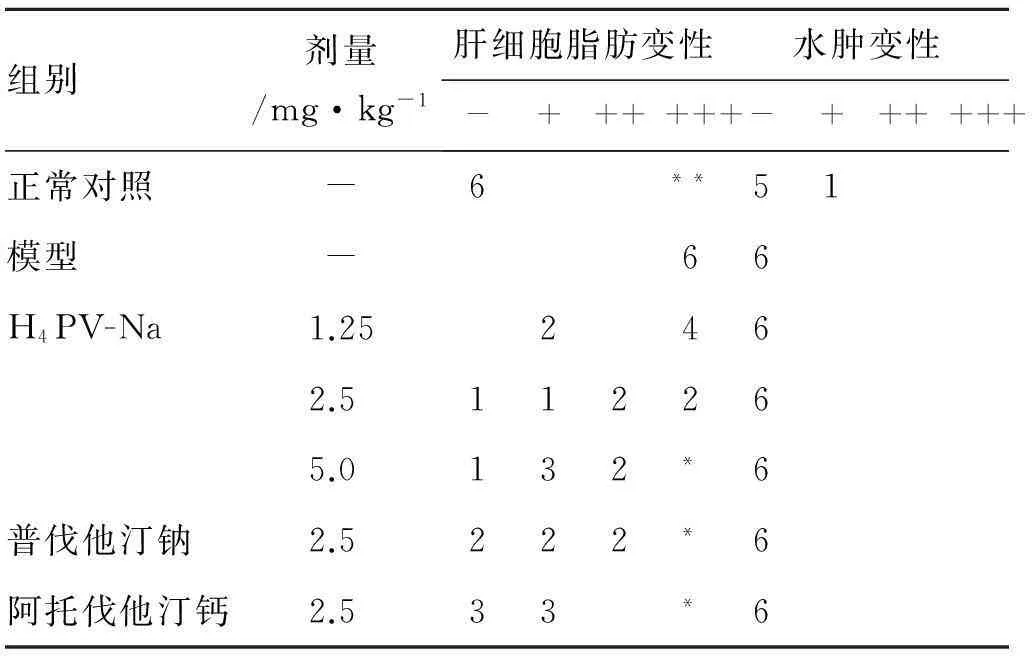
组别剂量/mg·kg-1肝细胞脂肪变性水肿变性-+++ +++-+++ +++正常对照-6**51模型-66H4PV-Na1.252462.5112265.0132*6普伐他汀钠2.5222*6阿托伐他汀钙2.533*6
注:*P<0.05,**P<0.01,与模型组相比。脂肪变性评分标准:-为<5%肝细胞脂肪变性,+为5%~30%肝细胞脂肪变性,++为30%~60%肝细胞脂肪变性,+++为>60%肝细胞脂肪变性。
胸主动脉病理切片结果见表5和图2。结果表明,正常对照组主动脉管腔无异常改变,内皮细胞完整, 单层紧贴内弹力板, 中层平滑肌细胞排列整齐,动脉内膜无脂纹、斑块;高脂饮食模型组内膜显著增厚,内皮细胞缺损,脂质增加,斑块内含大量泡沫细胞;普伐他汀钠和阿托伐他汀钙组内膜亦有增厚,只是增厚程度较高脂模型组轻,斑块内脂质和泡沫细胞数量亦较高脂饮食模型组减少;四氢普伐他汀钠高、中剂量组形态学改变较高脂饮食模型对照组有改善,内膜增厚较高脂组明显减轻,泡沫细胞减少;与高脂模型组比较,四氢普伐他汀钠高、中剂量组、普伐他汀钠和阿托伐他汀钙组的内-中膜厚度比均有显著性差异(P<0.05,P<0.01)。
表5四氢普伐他汀钠对高脂模型新西兰兔胸主动脉脂质厚度变化的影响
Tab.5 The influence of H4PV-Na on thoracic aortic lipid in hyperlipidemia New Zealand male rabbits
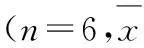

组别剂量内膜-中层厚度比正常对照-0.38±0.10**模型-1.70±0.33H4PV-Na1.251.33±0.472.50.89±0.18**5.00.67±0.22**普伐他汀钠2.50.77±0.15**阿托伐他汀钙2.50.86±0.33**
注:*P<0.05,**P<0.01,与模型组相比。
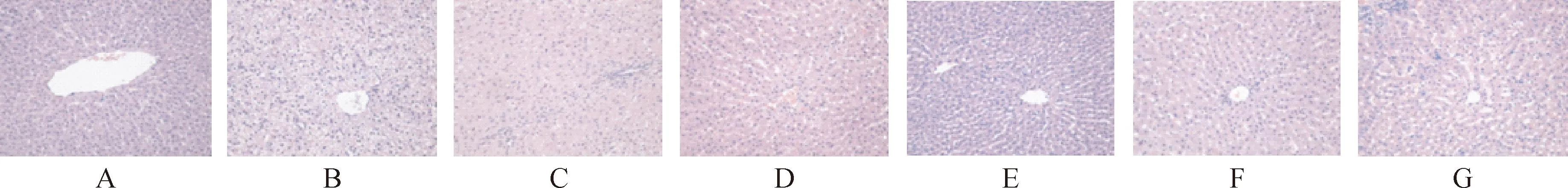
图14PV-Na对新西兰兔高血脂模型肝脏病理组织学的影响(10周)
A.正常对照组;B.高脂模型组;C.普伐他汀钠组2.5 mg·kg-1;D.阿托伐他汀钙组2.5 mg·kg-1;E.四氢普伐他汀钠高剂量组5.0 mg·kg-1;F.四氢普伐他汀钠中剂量组2.5 mg·kg-1;G.四氢普伐他汀钠低剂量组1.25 mg·kg-1。
Fig.1 The influence of H4PV-Na on hepatic histopathology in hyperlipidemia New Zealand male rabbits after 10 weeks
A.control group;B.model group;C.pravastatin sodium 2.5 mg·kg-1;D.atorvastatin calcium 2.5 mg·kg-1;E.H4PV-Na 5.0 mg·kg-1; F. H4PV-Na 2.5 mg·kg-1; G. H4PV-Na 1.25 mg·kg-1.
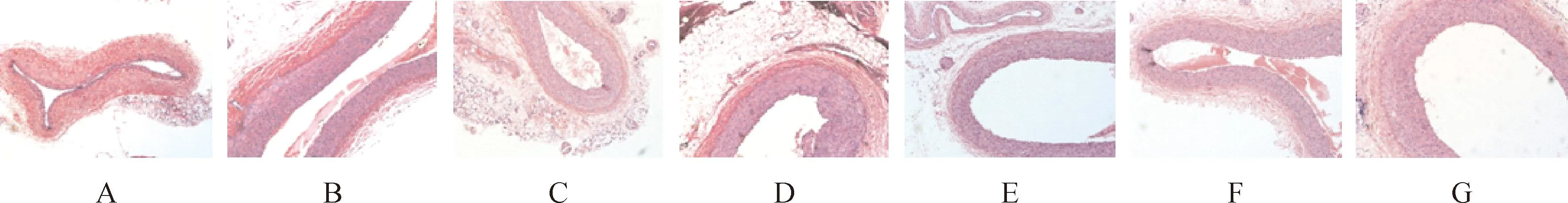
图2H4PV-Na对新西兰兔高血脂模型主动脉病理组织学的影响(10周)
A.正常对照组;B.高脂模型组;C.普伐他汀钠组;D.阿托伐他汀钙组;E.四氢普伐他汀钠高剂量组5.0 mg·kg-1;F.四氢普伐他汀钠中剂量组2.5 mg·kg-1;G.四氢普伐他汀钠低剂量组1.25 mg·kg-1。
Fig.2 The influence of H4PV-Na on thoracic aortic histopathology in hyperlipidemia New Zealand male rabbits after 10 weeks
A.control group; B.model group; C.pravastatin sodium 2.5 mg·kg-1; D.atorvastatin calcium 2.5 mg·kg-1;E.H4PV-Na 5.0 mg·kg-1; F. H4PV-Na 2.5 mg·kg-1; G.H4PV-Na1.25 mg·kg-1.
4讨论
高脂血症是指各种原因导致的血浆中胆固醇和或三酰甘油水平升高, 是诱发动脉粥样硬化的主要原因。大量研究资料表明,高脂血症也是脑中风、冠心病、心肌梗死等疾病的重要危险因素。随着人们生活水平的提高, 高脂血症的发病率逐年升高。本研究采用高脂饲料法建立新西兰兔高脂血症模型, 饲喂高脂饲料10周后的新西兰兔TC、TG 和LDL-C水平显著高于正常对照组, HDL-C 水平显著低于正常对照组, 表明造模成功。H4PV-Na给药后,与高脂饮食模型组兔相比,四氢普伐他汀钠中、高剂量(2.5,和5.0 mg·kg-1)组血清和肝组织TC、TG、LDL-C水平有显著降低, HDL-C和SOD有显著升高;MDA含量有显著降低。四氢普伐他汀钠各剂量组肝组织和血管的病理形态学改变与模型组比较有改善,长期给药不导致家兔CK的异常升高。这些结果证实H4PV-Na具有很好的降低总胆固醇和低密度脂蛋白,升高高密度脂蛋白的能力,且无横纹肌溶解毒性。实验结果也证实,H4PV-Na降低总胆固醇的能力明显强于三酰甘油,且呈现剂量依赖性。H4PV-Na与阳性对照组(普伐他汀和阿托伐他汀)相比,在同等剂量下,其降低血液和肝脏中TC、TG、LDL-C水平的效果低于普伐他汀钠和阿托伐他汀钙,对升高HDL-C的能力也低于2个阳性对照药品,这说明H4PV-Na的总体降脂效果还是稍弱于普伐他汀和阿托伐他汀钙(尽管在数值上处于同一个数量级)。从H4PV-Na与普伐他汀钠的结构上分析,在普伐他汀钠的母环结构上催化氢化,增加了母环的椅式构象和环的稳定性,但其降脂能力降低。
参考文献:
[1]Grundy S M. HMG-CoA reductase inhibitors for treatment of hypercholesterolemia [J]. New Engl J Med, 1988, 319: 24-33.
[2]Fu Z J, You Q D, Tang W F, et al. The progress of the action mode and SARs of statins [J]. Chin Pharm J, 2003, 38: 404-407.
[3]Bocan T M, Mazur M J, Mueller S B, et al. Antiatherosclerotic activity of inhibitors of 3-hydroxy-3-methyl-glutaryl coenzyme A reductase in cholesterol-fed rabbits: a biochemical and morphological evaluation [J]. Atherosclerosis, 1994, 111 (1): 127-142.
[4]曲莉,刘宗武,赵学忠.他汀类药物多效性研究进展[J].中国老年学杂志,2010, 30(2): 280-283.
[5]郭佳,田金徽,杨克虎,等.他汀类药物预防卒中再发的系统评价[J].中国循证医学杂志,2009, 9(5): 565-569.
[6]Ovbiagele B, Schwamm L H, Smith E E, et al. Recent nationwide trends in discharge statin treatment of hospitalized patients with stroke [J]. Stroke, 2010, 41(7): 1508-1513.
[7]Moride Y,Hegele R A,Langer A,et al. Clinical and public health assessment of benefits and risks of statins in primary prevention of coronary events: resolved and unresolved issues [J]. Can J Cardiol, 2008, 24(4): 293-300.
[8]尹若熙,薛光辉,李树民,等.沙棘黄酮与阿托伐他汀联用对实验性高脂金黄地鼠高血脂相关指标及肝脏形态的影响[J].西北药学杂志, 2013, 28(6): 599-602.
[9]郭永辉, 张小民.阿托伐他汀联合普罗布考对糖尿病合并高血压患者的影响[J].西北药学杂志, 2015, 30(2): 191-192.
[10]Li J, Li H, Zhang L.Synthesis, crystal structure and biological evaluation of 4, 5, 6, 7-tetrahydropravastatin as HMG-CoA reductase inhibitor [J]. Lett Drug Design Discov, 2011, 8: 884-888.
·药理·
Effect of tetrahydropravastatin sodium on lipid metabolism in hyperlipidemic New Zealand rabbits
ZHOU Shufang1,2,LI Jing1,GUAN Su1,ZHANG Lei1*(1.School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006, China;2. Livzon Pharmaceutical Group Limited Company,Zhuhai 519020, China)
Abstract:Objective To explore the effect of tetrahydropravastatin sodium (H4PV-Na) on blood lipid and lipid metabolism in experimental hyperlipidemic New Zealand rabbits. Methods 100 New Zealand white rabbits (male) were randomly divided into normal control group, fat control group, positive control group P (pravastatin sodium, 2.5 mg·kg-1), positive control group A (atorvastatin calcium, 2.5 mg·kg-1) and the treatment groups with low, medium and high dose (1.25, 2.5 and 5.0 mg·kg-1) after adaptive feeding for 2 weeks. TC, TG, HDL-C, LDL-C, MDA, SOD and CK levels in serum and liver were determined after giving high fat diet and corresponding reagents orally for 10 weeks. The histopathological changes of the adipose tissues were detected with HE staining. Results After high fat diet for 10 weeks, TC, TG and LDL-C levels went up, while HDL-C levels went down. H4PV-Na could significantly lower the levels of TC, TG, LDL-C, and MDA in serum as well as in liver, and increase HDL-C levels and SOD activity after oral administration of H4PV-Na for 10 weeks. Conclusion H4PV-Na had a specific role in lowering serum lipid and cholesterol with the higher capacity in liver. The results also suggested that H4PV-Na could increase HDL-C levels and the SOD activity in hyperlipidemic rabbits without rhabdomyolysis toxicity, but the potential to lower the blood lipid is weaker than pravastatin sodium and atorvastatin calcium at the same dose.
Key words:tetrahydropravastatin sodium; serum creatine kinase; hyperlipidemia; superoxide dismutase; adipose tissue
收稿日期:(2015-05-06)
通信作者:*张雷,男,教授,博士生导师
作者简介:周淑芳,女,执业药师
基金项目:广东省自然科学 (编号:S2013010012018); 广州市科技计划项目(编号:2014J4100015)
中图分类号:R965
文献标志码:
文章编号:1004-2407(2016)01-0051-06
doi:10.3969/j.issn.1004-2407.2016.01.017
