小球藻与褐潮原因种
——抑食金球藻间的相互作用研究*
2016-01-15毕相东张兴华胡顺鑫唐学玺
毕相东 张兴华 宋 伦 胡顺鑫 唐学玺① 闫 冉
(1. 天津农学院水产学院 天津市水产生态及养殖重点实验室 天津 300384; 2. 中国海洋大学海洋生命学院 青岛 266003;3. 辽宁省海洋水产科学研究院 大连 116023; 4. 南开大学环境科学与工程学院 天津 300350)
自2009年起已连续5年在河北省秦皇岛近岸海域定期(5—8月)暴发“褐色赤潮”(国家海洋局,2010—2014), 2011年起山东半岛威海海域亦有“褐色赤潮”暴发(刘爱英等, 2013)。秦皇岛近岸海域乃至我国北方其它沿海暴发如此大范围的“褐色赤潮”对我国贝类养殖业造成极大的损失。渤海秦皇岛近岸海域是我国最大的海湾扇贝养殖区, 2009年褐色赤潮暴发期间当地近2/3的海湾扇贝养殖区约1733 hm2养殖贝类受到影响, 扇贝出现了生长停滞和死亡的现象(廖洋等, 2012)。根据国家海洋局海洋灾害公报报道,2010年河北沿海“赤潮”(现已证实为主要为褐潮)面积达3350 km2, 直接经济损失2.05亿元(国家海洋局,2010-2014)。该褐色赤潮每年5月中下旬至6月上旬在渤海海域定期出现, 海水透明度降低常呈黄褐色,形成的藻华一般到8月中下旬才会慢慢消去, 主要原因种是细胞直径只有2—3 μm的微微型藻, 藻华发生时该藻细胞密度最高可达到 109cell/L (Kong et al,2012)。中国科学院海洋研究所于仁成研究团队采用光合色素分析和特异性抗体检测等手段研究表明,渤海近岸海域有害藻华的主要原因种为海金藻类的抑食金球藻(Aureococcus anophagefferens) (Kong et al,2012)。抑食金球藻能产生一种类似多巴胺的生物活性物质(Sieburth et al, 1988; Zhang et al, 2012), 能抑制贝类侧纤毛的活动, 从而对滤食性贝类产生负面影响, 具体表现为抑制贝类的摄食、生长、甚至导致死亡(Bricelj et al, 1997; Bricelj et al, 2001)。因藻华期间细胞密度极高、能特异性地抑制贝类摄食、藻华水体呈黄褐色而被称作“褐潮”, 该命名已被国际有害藻华研究界所接受。至此, 我国是继美国(Cosper et al,1987)及南非(Probyn et al, 2001)后第三个发生褐潮的国家。
目前, 褐潮的危害在我国近岸海域不断地扩大发展, 亟需建立有效的褐潮应急处置技术, 以期大幅降低其对近岸贝类养殖的危害。研究人员尝试采用粘土吸附藻细胞等物理方式(张雅琪等, 2013)及H2O2抑杀藻细胞等化学方法进行消除(Randhawa et al,2012)。但终因耗费高、生态安全性低等诸多局限, 均未规模化地应用于贝类养殖海域的褐潮应急处置中。最近兴起的利用植物间竞争作用或化感作用抑制有害藻类生长的生物控藻技术颇受关注, 被认为是高效、生态安全性好的新型控藻技术(杨小茹等, 2008)。毕相东等(2016)研发出一种饵料微藻浓缩液缓释仪,使用筛选出的既能强烈抑制抑食金球藻生长又能为养殖微环境中贝类提供饵料的微藻, 并将其浓缩液缓释于贝类养殖的微环境中。该技术将能够有效降低对褐潮对贝类养殖的危害, 提高养殖经济效益, 具有广阔的实用推广前景。
小球藻(Chlorella vulgaris)是最为常见的贝类饵料微藻, 具有生长快、细胞活性高、竞争力强等特点。研究发现共培养体系中的小球藻对赤潮异湾藻(Heterosigma akashiwo)的生长具有强烈的抑制作用(王金凤, 2007)。本研究采用抑食金球藻的荧光定量PCR监测技术(宋林生等, 2013), 详细分析了共培养体系中小球藻与抑食金球藻的相互作用, 并在此基础上通过分析小球藻培养滤液对抑食金球藻生长和叶绿素荧光参数的影响, 探讨小球藻与抑食金球藻间的相互作用机理。
1 材料与方法
1.1 实验藻种
抑食金球藻(Aureococcus anophagefferens CCMP1984)来自美国国家海洋浮游植物藻种中心(National Center for Marine Algae and Microbiota, NCMA), 小球藻(Chlorella vulgaris)来自中国海洋大学生态学实验室藻种库。
1.2 培养条件
实验用三角瓶预先用1mol/L的HCl浸泡24h, 蒸馏水反复冲洗干净后, 于121°C灭菌20min。培养用的海水均为取自青岛市鲁迅公园的自然海水, 经沉淀、脱脂棉过滤、0.22μm微孔滤膜抽滤后, 于121°C灭菌 20min。本实验均采用一次性培养的方法, 在250mL的三角瓶中进行, 培养液体积为150mL。所有实验藻种均用f/2营养盐配方培养, 温度(20±1)°C, 光照 60μmol/(m2·s), 光暗周期 12h : 12h, 每天摇动藻液3—4次, 防止藻细胞附壁下沉。
1.3 藻细胞的计数方法
小球藻和单养培养体系中抑食金球藻的计数方法: 取摇晃均匀的微藻培养液 0.5mL, 用 Lugol碘液固定后血球计数板计数。
共培养体系中抑食金球藻的计数方法: 由于抑食金球藻细胞微小直径只有 2—3μm, 在共同培养体系中显微计数易受其它藻种和杂质的影响而导致计数失准。因此, 本实验中共同培养体系中抑食金球藻采用宋林生等(2013)研发的荧光定量 PCR技术进行计数。该方法原理为利用抑食金球藻基因组中具有较高特异性的单拷贝基因脲基甲酸酯水解酶基因, 以该基因的序列设计特异性的引物和探针, 利用荧光定量 PCR技术建立一种快速检测抑食金球藻细胞密度的方法。本研究参照该方法, 绘制藻细胞数量与Ct值的标准曲线和方程。然后, 实验中每 2天取 1mL藻液, 经 0.45μm 的纤维素滤膜过滤来获取藻细胞,收集藻液的 0.45μm的滤膜作为提取 DNA的介质。将提取的 DNA样品进行荧光定量 PCR, 获得 Ct值,将其代入已建立的标准曲线方程中并换算出藻细胞数量。每个样品设3个平行, 计算平均值。
1.4 叶绿素荧光参数的测定
用德国Walz公司产Phyto-PAM进行各叶绿素荧光参数的测定。取2 mL藻液经15 min暗适应后, 打开测量光, 待Ft荧光稳定后, 施加200 ms 的饱和脉冲, 得到F0、Fm及Fv/Fm的值。另取2mL藻液, 施加164 μmol/(m2s)的光化光 2 min 后, 施加 200 ms的饱和脉冲, 得到F′、Fm′及 ΦPSII的值。
另取2 mL藻液, 测定快速光曲线(RLC)(Ralph et al, 2005)。光强梯度设置为: 1, 16, 32, 64, 164, 264,364, 464, 664, 864, 1064, 1264, 1464, 1664, 1864和2064 μmol/(m2s), 通过软件内置公式拟合, 得到alpha(到达光饱和之前RLC的初始斜率)、rETRmax(最大相对电子传递速率)和Ik(半饱和光强)的估计值。
1.5 实验内容
1.5.1 抑食金球藻荧光定量PCR监测技术的建立
(1) 藻细胞的收集及基因组 DNA提取: 在光学显微镜下记录稳定期藻细胞密度后稀释, 使藻细胞密度最终分别达到为 8, 8×101, 8×102, 8×103, 8×104,8×105, 8×106cell/ mL, 经 0.45 μm 微孔滤膜过滤来获取微藻细胞, 收集藻液的 0.45 μm 滤膜作为基因组DNA提取介质。藻细胞基因组DNA提取所用的试剂盒为TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0。提取流程按照试剂盒说明进行。
(2) 特异性荧光探针定量 PCR反应(宋林生等,2013)
上游引物 5′-GCGGAGGTCGTGGAGAGG-3′
下游引物 5′-GGGTGCGTCCGTAGACTTGA-3′
探针 5′-CTCGGCTTCACGGGCGGCTTCC-3′
反应体系: 基因组DNA模板约4 µL、2×Premix EX Taq BufferMix (TaKaRa) 5 µL、探针 0.4 µL(10 μmol/L)、引物各 0.2 µL(10 μmol/L), 最后加灭菌去离子水至 10 µL。
反应条件: 95°C 预变性10 min, 95 °C变性15 s,60 °C退火/延伸1 min, 40个循环。
藻细胞基因组DNA样品在ABI 7500荧光定量PCR仪上进行扩增和数据分析。
(3) 绘制标准曲线
将特异性荧光探针定量PCR反应所得的Ct值与细胞的对数值通过线性回归拟合形成标准曲线, 并得到标准曲线方程。
1.5.2 抑食金球藻的单培养实验 将处于指数增长期的抑食金球藻接进行接种, 使其起始密度分别达到(1, 2, 4)×104cell/mL, 在藻种室培养。每实验设3个平行组, 每d取出藻液按1.3中所述方法对藻细胞进行计数。
1.5.3 小球藻和抑食金球藻的共培养实验 小球藻(C. vulgaris)简称C、抑食金球藻(A. anophagefferens)简称 A, 具体设置如下: 处理①: 共培养体系中小球藻的起始密度为1×104cell/mL、抑食金球藻的起始密度为4×104cell/mL, 初始密度比C︰A = 1︰4。处理②: 共培养体系中小球藻的起始密度为2×104cell/mL、抑食金球藻的起始密度为2×104cell/mL, 初始密度比C︰A = 1︰1。处理③: 共培养体系中小球藻的起始密度为 4×104cell/mL, 抑食金球藻的起始密度为 1×104cell/mL、初始密度比C︰A = 4︰1。
将处于指数增长期的抑食金球藻和小球藻按上述接种比例共同培养(小球藻的比例逐渐增加), 实验以相同条件下单培养实验中的抑食金球藻作为对照,每实验设3个平行。自接种之后起, 每2 d取出藻液按1.3中所述方法对两种藻细胞进行计数。
1.5.4 小球藻培养滤液对抑食金球藻生长及叶绿素荧光参数的影响实验 为初步研究小球藻对抑食金球藻生长抑制的作用机理, 开展了小球藻培养滤液对抑食金球藻生长及叶绿素荧光参数的影响研究。将处于对数增长期、起始密度为5×104cell/mL的小球藻进行培养, 使其达到最大环境容量; 溶液经0.22μm 的醋酸纤维素滤膜抽滤, 该溶液即为小球藻的培养液滤液。实验分6组, 每组加入不同量的小球藻培养滤液, 具体设置为: 组① 140mL海水+0mL小球藻培养滤液; 组② 135mL海水+5mL小球藻培养滤液; 组③ 130mL海水+10mL小球藻培养滤液; 组④120mL 海水+20mL小球藻培养滤液; 组 ⑤ 1 05mL 海水+35mL小球藻培养滤液; 组 ⑥ 9 0mL 海水+50mL小球藻培养滤液。以组①为空白对照, 每组设3个平行,按比例加入 f/2营养盐后, 接入 10mL处于指数增长期的抑食金球藻, 最后的实验总体积均为150mL。自接种之后起, 每天同一时间取出藻液, 按 1.3中所述方法对抑食金球藻细胞进行计数, 按1.4中所描述的方法进行叶绿素荧光参数的测定。
1.6 数据分析
1.6.1 种群瞬时增长率、环境容量和生长曲线进入拐点时间的计算 利用Logistic方程对微藻种群的增长进行拟合, 并根据其积分形式N=K/(1+e(a-rt))用统计软件 SigmaPlot 12.5进行非线性回归分析, 计算环境容量(K)和种群瞬时增长率(r), 式中 a表示曲线对原点的相对位置, 其值取决于N0, N0=K/(1+ea), t表示时间。根据公式Tp=a/r计算藻类生长曲线到达拐点的时间。
1.6.2 统计分析 采用Excel 2010作图。采用SPSS 17.0进行单因子方差分析和多重比较。P<0.05被认为是在α=0.05水平上差异显著。
2 结果与分析
2.1 荧光定量PCR标准曲线结果
从图1可以看出, 荧光定量PCR扩增曲线平滑,扩增效果较好。根据藻细胞DNA模板PCR扩增后所得的Ct值与藻细胞数目的对数值通过线性回归拟合形成如下标准曲线见图 2, 线性回归方程为y=–2.6711x+ 42.134, 相关系数(R2)为0.9519, 显示出良好的线性关系, 且有较宽藻细胞数目检测范围, 完全可适用于本实验中抑食金球藻细胞数目的定量分析。
2.2 单培养体系中抑食金球藻的生长情况
单培养体系中不同起始密度抑食金球藻的生长情况见图3。从图3可以看出, 不同起始密度抑食金球藻的生长曲线均呈现出典型的Logistic “S”型增长模式。以逻辑斯谛方程进行拟合, 各参数的估计值以及生长曲线达到拐点的时间见表 1。结果表明随着起始密度的增加, 抑食金球藻种群K值逐渐减小, 进入指数生长期和静止期的时间亦逐渐缩短, 而种群瞬时增长率(r)、进入拐点时间(Tp)及稳定期细胞密度均较为接近。

图1 PCR检测出荧光定量样品ΔRn和循环数的扩增曲线Fig.1 Amplification of standards from qPCR run on ABI7500 of ΔRn versus the number of cycles

图2 抑食金球藻密度对数值与Ct值的标准曲线Fig.2 Standard curve of threshold cycle (Ct) versus the abundance of A. anophagefferens (cells/mL) in log scale

图3 不同起始密度下抑食金球藻的生长曲线Fig.3 The growth curve of A. anophageferens under differential initial densities

表1 不同起始密度下抑食金球藻的生长参数的比较Tab.1 The growth parameters of A. anophagefferens population at different initial cell densities
2.3 共培养实验两种藻细胞的生长比较
2.3.1 处理①中两种藻的生长比较 当 C︰A=1︰4时, 小球藻和抑食金球藻的生长情况见图 4。小球藻从第4天起进入指数生长期, 在第 18天时种群密度达到1775 × 104cell/mL; 而抑食金球藻自接种起种群一直处于缓慢的增长状态, 一直未出现指数性的增长, 在第16天进入稳定期后细胞密度维持在235×104cell/mL, 仅为对照组K值的4.58%。实验结束时共培养体系中抑食金球藻细胞数目与对照组相比有着显著性差异(P<0.05)。

图4 初始接种密度比C:A=1:4条件下小球藻和抑食金球藻的种群生长情况Fig.4 The population growth of C. vulgaris and A.anophageferens when the initial density proportion C:A=1:4
2.3.2 处理②中两种藻的生长比较 当 C:A=1:1时, 小球藻和抑食金球藻的生长情况见图 4。小球藻从第 3天起进入指数生长期, 在第18天时种群密度达到 1923×104cell/mL; 与小球藻相比抑食金球藻生长滞缓, 抑食金球藻的生长未出现明显的指数增长期和静止期。抑食金球藻的环境容量(K值)为160.667×104cell/mL, 仅为对照组K值的3.44%, 最后细胞密度维持在90×104cell/mL左右。实验结束时共培养体系中抑食金球藻细胞数目与对照组相比有着显著的差异(P<0.05)。
2.3.3 处理③中两种藻的生长比较 在本处理组中, 抑食金球藻和小球藻的生长情况如图6所示。共培养体系中, 小球藻从第2天起进入指数生长期, 在第18天种群密度达到2123.75×104cell/mL, 生长未受到明显的影响。与小球藻相比, 共培养体系中抑食金球藻的生长受到了明显的抑制。抑食金球藻的生长未出现明显的指数增长期和静止期。环境容量(K值)为117×104cell/mL, 仅约为对照组K值的 2.51%, 最后细胞密度维持在80×104cell/mL左右。实验结束时共培养体系中抑食金球藻细胞数目与对照组相比有着显著的差异(P<0.05)。

图5 初始接种密度比C:A=1:1条件下小球藻和抑食金球藻的种群生长情况Fig.5 The population growth of C. vulgaris and A. anophageferens when the initial density proportion C: A=1:1
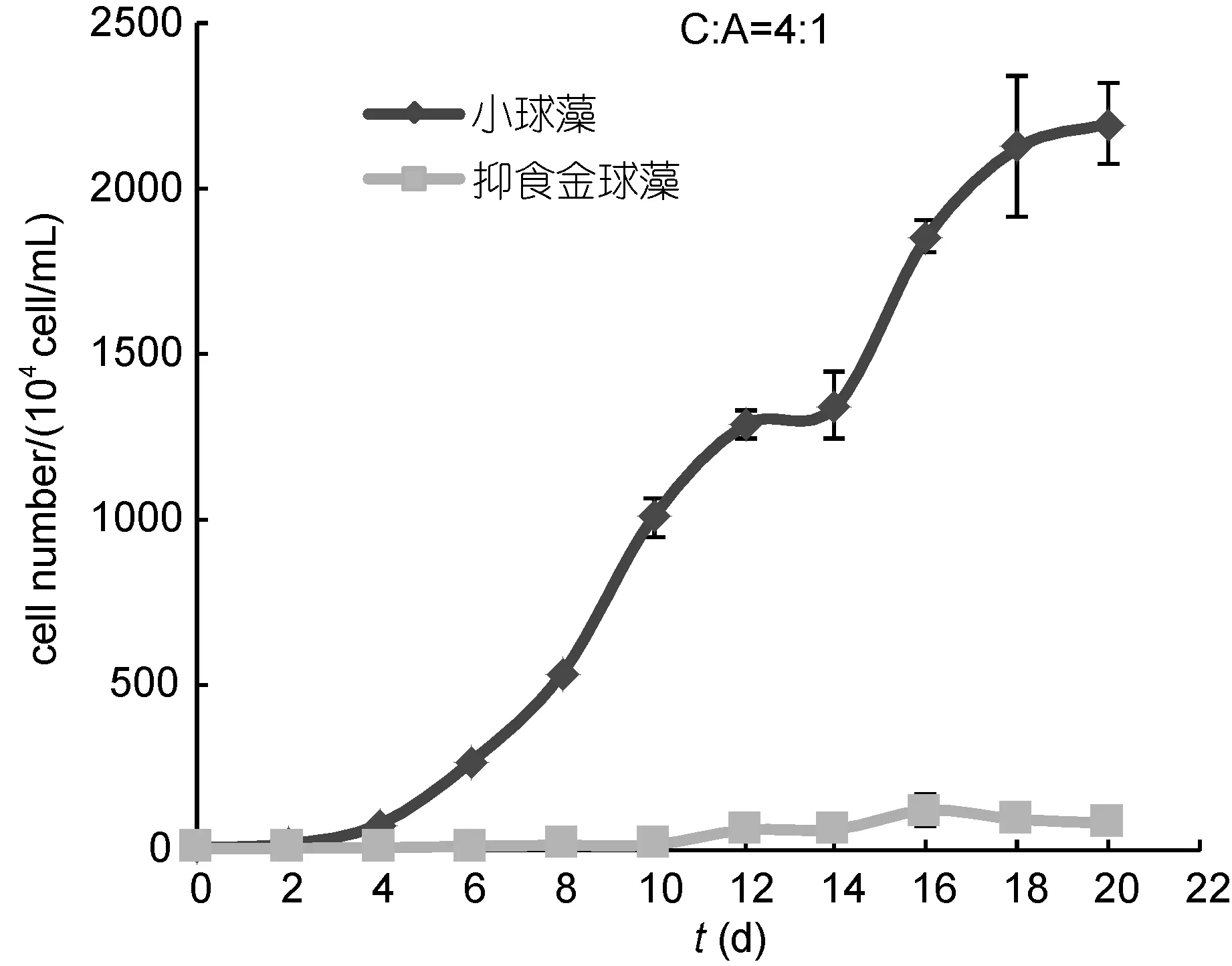
图6 初始接种密度比C:A=4:1条件下小球藻和抑食金球藻的种群生长情况Fig.6 The population growth of C. vulgaris and A.anophageferens when the initial density proportion C:A= 4:1
2.4 小球藻培养滤液对抑食金球藻的生长及叶绿素荧光参数的影响
2.4.1 小球藻培养滤液对抑食金球藻细胞密度的影响 加入不同量的小球藻培养滤液后对抑食金球藻细胞生长的影响见图7(A)。加入5mL小球藻培养滤液(②组)对抑食金球藻的生长并未产生明显影响,随着培养天数的增加, ①、②组细胞密度逐渐增加,1—7 d内与对照组(①)相比细胞密度均无显著性差异;加入10mL小球藻培养滤液的③组细胞密度先减少后增加, 培养结束时细胞密度明显低于对照组, 细胞的生长受到了显著的抑制作用(P<0.05); 分别加入20、35、50 mL小球藻培养滤液的④、⑤、⑥组细胞密度并未增加, 而是逐渐减少至较低水平(<5×104cell/mL),抑食金球藻的藻的生长受到了明显的抑制(P<0.05),培养结束时③、④、⑤、⑥组间细胞密度无显著性差异(P=0.876)。


图7 小球藻培养滤液对抑食金球藻的生长及叶绿素荧光参数的影响Fig.7 Effect of C. vulgaris culture medium filtrate on growth and fluorescence parameters of A. anophageferens
2.4.2 小球藻培养滤液对抑食金球藻叶绿素荧光参数的影响 小球藻培养滤液对抑食金球藻叶绿素荧光参数的影响见图7(B—F)。单因子方差分析结果显示: 第 1天, 各组各叶绿素荧光参数与对照组(①)相比差异均无显著性差异; 第2天时, 小球藻培养滤液对抑食金球藻的影响凸显出来, ②组的各叶绿素荧光参数与对照无显著差异, 但④、⑤、⑥组的Fv/Fm、ΦPSⅡ、alpha值下降剧烈, 几乎检测不到荧光信号,与对照差异显著(P<0.05), ③组的 Fv/Fm、ΦPSⅡ、alpha值也显著低于对照组(P<0.05); 第3—7天, ②组的各叶绿素荧光参数与对照无显著差异, ③组的各荧光参数的值逐渐恢复, 培养结束时已与对照无显著性差异, 但④、⑤、⑥组的各参数变化剧烈, 其中Fv/Fm、ΦPSⅡ、alpha值首次出现了不同程度的明显上升, 但持续2 d之后又跌落下来, Ik值在高于对照组的范围内大幅波动、rETRmax值亦上下波动。
3 讨论
3.1 单培养条件下抑食金球藻的生长状态
结合图3及表1发现, 不同起始密度对种群的生长有明显的影响, 随着起始密度的增加, 抑食金球藻的K值有逐渐降低的趋势, 董云伟等在研究赤潮常见原因种塔玛亚历山大藻(Alexandrium tamarense)单培养的生长状态时亦得到了相似的规律(董云伟等,2004)。另外, 值得注意的是不同的起始密度下抑食金球藻种群在接种后 5d内的生长都是非常缓慢的, 种群数量基本处于稳定状态, 而当种群密度一旦超过一定阈值, 会立即进入指数增长期, 并持续较长时间的快速增长, 如接种密度为1×104cell/mL时, 种群从第 6天的 2.8×104cell /mL迅速增加至第 14天的1770×104cell /mL; 接种密度为 2×104cell/mL 时, 种群从第4天的2.77×104cell/mL迅速增加至第14天的1370×104cell/mL; 接种密度为 4×104cell/mL 时, 种群从第7天的 4.2×104cell/mL迅速增加至第15天的1475×104cell/mL。指数增长的时间都持续了9d左右,进入稳定期时都达到了较高的细胞密度(5000×104cell/mL左右)。
上述现象清晰地表明抑食金球藻具有藻细胞活性持续时间长、生长速度快、稳定期细胞密度高的特点, 这可能是抑食金球藻褐潮暴发后很难控制的原因之一(Gobler et al, 2004)。
3.2 共同培养条件下小球藻对抑食金球藻生长的影响
由图4、图5、图6可知两种藻以不同的比例共同培养, 小球藻都对抑食金球藻的生长产生了抑制作用, 与对照相比抑食金球藻的最大环境容量都明显下降。随着抑食金球藻细胞接种密度比由小到大,相比于对照组的 K值越来越小(占比分别为 4.58%、3.44%及 2.51%), 抑食金球藻生长受到的抑制作用亦越来越强。
3.3 小球藻培养滤液对抑食金球藻生长及叶绿素荧光参数的影响
实验结果显示: 加入5 mL的小球藻滤液不会对抑食金球藻的生长产生影响, 但当加入的量≥10 mL就会对抑食金球藻的生长产生显著的抑制作用, 加入的量≥20 mL时抑食金球藻细胞数量不会再增加而是逐渐减少至5×104cell/mL以下。潘克厚等(2007)将微藻种间竞争的机理主要分为资源竞争、化感作用和细胞接触。结合共培养实验和小球藻滤液培养实验结果, 小球藻对抑食金球藻抑制作用应是通过化感作用实现的, 即小球藻分泌的胞外产物中含有对抑食金球藻的生长具有强烈抑制作用的化感物质。
为深入探讨小球藻对抑食金球藻的化感抑藻机理, 作者开展了小球藻培养液对抑食金球藻生长及叶绿素荧光参数的影响研究。Fv/Fm是PSⅡ的最大光化学量子产量, 反映 PSⅡ的最大光能转换效率, 非胁迫条件下该参数的变化极小, 胁迫条件下该参数明显下降。本实验结果显示加入5 mL以上的小球藻培养滤液的组别, 接种后第 2天抑食金球藻的 Fv/Fm的值都出现了明显下降, 这说明抑食金球藻的 PSⅡ已受到损害。其中加入10 mL的处理组, 经过一定时间后可恢复至与对照无显著差异的水平, 说明 PSⅡ受到的这种程度损伤可以恢复。但加入20、35、50 mL的处理组, 经过一段时间也没有恢复到正常水平, 并且细胞密度没有出现增长的趋势而是逐渐降低。因此,作者认为当加入的小球藻滤液超过一定量时, 即可对抑食金球藻 PSⅡ造成不可恢复的损伤, 进而造成抑制抑食金球藻的生长, 直至死亡。
加入5 mL以上的小球藻培养滤液的组别, 接种后第2天抑食金球藻ΦPSⅡ、Alpha的值都出现了明显下降。ΦPSⅡ是PSⅡ实际光化学量子产量, 它反映了 PSⅡ反应中心在有部分关闭情况下实际原初光能捕获效率。ΦPSⅡ的降低说明小球藻滤液阻止抑食金球藻细胞同化力(NADPH, ATP)的形成, 从而影响对碳的固定与同化, 进而影响细胞的生长。Alpha是快速光曲线的初始斜率, 反映了植物对光能的捕获能力, Alpha的降低说明藻细胞对光能的利用效率下降。Ik是最小饱和光强, 与植物对强光的耐受能力有关,Ik的上升说明小球藻滤液的加入可以在一定程度上增强抑食金球藻细胞对强光的耐受能力, 但 Ik值大幅波动也说明了藻细胞光系统处于不正常状态, 不利于光合作用的正常进行, 进而影响抑食金球藻的生长。
3.4 小球藻在褐潮应急处置中的应用前景
张雅琪等(2013)进行了改性黏土对褐潮种的去除研究, 实验发现改性黏土对抑食金球藻的去除效率普遍很低。Randhawa等(2012)发现一定量的 H2O2可有效去除高密度的抑食金球藻, 但是费用比较昂贵。因此, 目前国内外还没有能够有效应急处置褐潮的方法。本实验结果表明在共同培养体系中的小球藻及单培养的小球藻滤液对抑食金球藻均有着强烈的抑制作用, 表明小球藻在近岸贝类养殖区褐潮危害的应急处置中具有极大的应用潜力。若将新鲜的小球藻浓缩液缓释于贝类养殖的微环境中, 则既可抑制抑食金球藻的生长又可为养殖微环境中贝类提供饵料的微藻, 这将对降低褐潮对养殖贝类的危害及提高养殖经济效益具有非常重要的实际应用价值。但上述研究均是在实验生态学条件下完成的, 具有稳定的光照, 营养盐和适宜的温度, 且排除共栖异养细菌等诸多环境因子对微藻间相互作用的影响(Nakashima et al, 2006; Yu et al, 2006)。因此, 若要将小球藻或小球藻化感物质规模化应用于贝类养殖海域褐潮危害的应急处置之前还需做进一步实践摸索。
4 结论
(1) 单培养体系中, 抑食金球藻具有藻细胞活性持续时间长、生长速度快、稳定期细胞密度高(5×107cell/mL)的特点, 这可能是抑食金球藻褐潮暴发后很难控制的原因之一。
(2) 共培养实验中, 小球藻对抑食金球藻生长具有强烈的抑制作用, 且抑制作用随着小球藻所占比例的升高而增强; 滤液实验中发现, ≥10mL小球藻培养滤液的加入可对抑食金球藻的生长和叶绿素荧光参数产生显著的影响(P<0.05), 生长速度减缓或滞长, 叶绿素荧光参数Fv/Fm、ΦPSⅡ、alpha的值降低,Ik的值增加, PSⅡ受到损害, 随着滤液加入量的增加,损害程度加深, 并且不可恢复。
王金凤, 2007. 三种海洋经济微藻与赤潮异湾藻的竞争研究.青岛: 中国海洋大学硕士学位论文, 24—25
毕相东, 王宏坡, 郭永军等, 2016. 一种饵料微藻浓缩液缓释仪: 中国, 201520754681. 2016-01-13
刘爱英, 宋秀凯, 秦华伟等, 2013. 2011年烟台四十里湾微微型金藻褐潮分析. 海洋湖沼通报, (3): 73—79
杨小茹, 苏建强, 郑天凌, 2008. 化感作用在赤潮调控中的意义及前景. 环境科学学报, 28(2): 219—226
宋林生, 邱丽梅, 刘 瑞等, 2013. 一种抑食金球藻的快速检测方法: 中国, 201310409553. 2013-12-25
张雅琪, 俞志明, 宋秀贤等, 2013. 改性黏土对褐潮生物种Aureococcus anophagefferens的去除研究. 海洋学报,35(3): 197—203
国家海洋局. 2010—2014. 2009—2013中国海洋灾害公报. 北京: 国家海洋局
董云伟, 董双林, 刘相义, 2004. 不同起始浓度对塔玛亚历山大藻和赤潮异弯藻种群竞争的影响. 中国海洋大学学报,34(6): 964—968
廖 洋, 杨锡畅, 2012. 褐潮来袭: 危害大 待破解. 中国科学报, 2012-07-25(A1) 要闻
潘克厚, 王金凤, 朱葆华, 2007. 海洋微藻间竞争研究进展.海洋科学, 31(5): 58—62
Bricelj V M, Lonsdale D J, 1997. Aureococcus anophagefferens:Causes and ecological consequences of brown tides in U.S. mid-Atlantic coastal waters. Limnol Oceanogr, 42(5): 1023—1038
Bricelj V, MacQuarrie S, Schaffner R, 2001. Differential effects of Aureococcus anophagefferens isolates (“brown tide”) in unialgal and mixed suspensions on bivalve feeding. Mar Biol, 139(4): 605—616
Cosper E M, Dennison W C, Carpenter E J et al, 1987. Recurrent and persistent brown tide blooms perturb coastal marine ecosystem. Estuaries, 10(4): 284—290
Gobler C J, Boneillo G E, Debenham C J et al, 2004. Nutrient limitation, organic matter cycling, and plankton dynamics during an Aureococcus anophagefferens bloom. Aquati Microb Ecol, 35(1): 31—43
Kong F Z, Yu R C, Zhang Q C et al, 2012. Pigment characterization for the 2011 bloom in Qinhuangdao implicated “brown tide” events in China. Chin J Oceanol Limnol, 30(3): 361—370
Nakashima T, Miyazaki Y, Matsuyama Y et al, 2006. Producing mechanism of an algicidal compound against red tide phytoplankton in a marine bacterium γ-proteobacterium.Appl Microbiol Biotechnol, 73(3): 684—690
Probyn T, Pitcher G, Pienaar R, 2001. Brown tides and mariculture in Saldanha Bay, South Africa. Mar Pollut Bull,42(5): 405—408
Ralph P J, Gademann R, 2005. Rapid light curves: a powerful tool to assess photosynthetic activity. Aquati Bot, 82(3):222—237
Randhawa V, Thakkar M, Wei L P, 2012. Applicability of hydrogen peroxide in brown tide control-culture and microcosm studies. PLoS One, 7(10): e47844
Sieburth J M, Johnson P W, Hargraves P E, 1988. Ultrastructure and ecology of Aureococcus anophageferens gen. et sp. nov.(Chrysophyceae): The dominant picoplankter during a bloom in Narragansett Bay, Rhode Island, summer 1985.Journal of Phycol, 24(3): 416—425
Yu J, Tang X X, Tian J Y et al, 2006. Effects of elevated CO2on sensitivity of six species of algae and interspecific competition of three species of algae. J Environ Sci, 18(2):353—358
Zhang Q C, Qiu L M, Yu R C et al, 2012. Emergence of brown tides caused by Aureococcus anophagefferens Hargraves et Sieburth in China. Harmful Algae, 19: 117—124
