一株耐受高浓度硫酸镁单细胞绿藻的分类学鉴定及单盐胁迫对其生长的影响*
2016-01-15刘旭东刘国祥胡征宇
刘旭东 刘国祥 胡征宇
(1. 中国科学院水生生物研究所 武汉 430072; 2. 中国科学院大学 北京 100049)
胶球藻(Coccomyxa Schmidle)是一类生境多样化群体, 它们可以营自由生活(Verma et al, 2009), 可与原生动物、地衣、高等植物银杏等光合共生(Lohtander et al, 2003; Trémouillaux-Guiller et al, 2007; Hoshina et al, 2008), 抑或寄生于海洋无脊椎动物(Stevenson et al, 1974)。
胶球藻类的分类较为混乱(Ettl et al, 1995)。胶球藻属的第一个新种(Coccomyxa dispar Schmidle)于1901年由Schmidle发现。Schmidle描述了其主要特征: 两端不对称的近椭圆形细胞, 单个或几个细胞被一层薄薄的胶被所覆盖, 色素体片状并位于细胞侧壁, 蛋白核缺失(Schmidle, 1901)。该种也成为胶球藻属的正模式种, 而之后 Fott的研究基于该种与Gloeocapsa confluens Kützing的相似性, 于1974年将C. dispar重新命名为Coccomyxa confluens (Kützing)Fott, 并成立后者为胶球藻属的副模式种(Fott,1974)。该属自定义以来, 一直争议不断。Schmidle认为该属与Dactylococcus, Dactylothece及Raphidium亲缘关系较近(Schmidle, 1901)。1913年, 基于Coccomyxa dispar以似亲孢子繁殖的特性, Chodat将胶球藻属归入 Protococcoidee (Chodat, 1913)。之后,由于观察到细胞的横二分裂, Printz将该属置于Pleurococcaceae (Jagg, 1933)。Jagg通过对胶球藻细胞大量的观察和培养, 否认了 Printz的观点, 并将该属重新归回 Protococcoidee, 并说明了胶球藻生境的非特异性, 同时在 Coccomyxa subellipsoidea中观察到动孢子的存在(Jagg, 1933)。然而, 随着伪胶球藻属的提出, 胶球藻属的分类地位重新变得有争议。胶球藻属被归于胶球藻科, 而Herndon将胶球藻科放在他所新建的 Chlorosphaerales目下(Herndon, 1958)。Groover等认为 Chlorosphaerales目应当被重新命名为Chlorosarcinales, 此目包括那些兼有营养分裂方式和无性生殖形成动孢子的属(Groover et al, 1969)。1966年, Bourrelly将胶球藻科另置于绿球藻目之下(Bourrelly, 1966)。胶球藻科无动孢子, 似乎不应该归于Chlorosarcinales之下, 所以 Bourrelly的观点在当时看来是较为合理的(Stevenson et al, 1974)。1974年,基于该属与Palmelogloea protuberans Kützing的相似性, Fott将之归入Palmogloeaceae(Fott, 1974)。随着分子系统发育学研究的兴起, 胶球藻属的分类地位逐渐清晰。该属位于共球藻纲, 并与微拟球藻属(Nannochloropsis)亲缘关系较近(Lohtander et al,2003)。2003年, Stefan Zoller等对于胶球藻与Omphalina共生研究认为, 胶球藻主要分为3大支系,即营自由生活株系, 与地衣Omphalina共生株系及与地衣Peltigerales共生株系(Zoller et al, 2003)。
Koršikov于 1953年发现并描述了伪胶球藻属(Pseudococcomyxa Koršhikov, 1953)的 第 一 个 新 种(Pseudococcomyxa adhaerens Korsh)。该种单细胞, 长椭圆形, 细胞壁薄并且无胶被覆盖, 色素体片状侧生,于核所在的细胞中部有一个凹陷点。藻细胞无性繁殖时, 原生质体连续分裂, 第一次为横分裂, 而之后为沿对角线分裂, 并产生2或4个似亲孢子。子孢子拉长并产生自己的细胞壁后, 由母细胞壁一端破裂开口释放。休眠期时, 藻细胞形成厚壁孢子, 并有红色素产生。无四集体藻型阶段。用墨汁或苯胺蓝染藻细胞, 可见其一或两端具有胶液团, 但若形成群体, 则居于底部的细胞无此胶液团形成。伪胶球藻分布广泛,并主要于土壤中存在。Korshikov认为其介于Oocystaceae和 Ankistrodesmaceae之间, 并且从似亲孢子的形成和拉长的细胞形状上看更加偏向于后者,而后者中的一些种也能在细胞极端产生胶液团(Koršikov, 1953)。1981 年, Fott认为该种与 Coccomyxa simplex Mainx是同一株藻, 故成立新组合种Pseudococcomyxa. Simlex (Mainx) Fott (Fott, 1981)。Marvan等将伪胶球藻置于 Selenastraceae中(Marvan et al, 1984), 而Pröschold等恢复了其系统发育位置于共球藻纲 Elliptochloris类群。Pröschold等进一步揭露了P. simplex与其它胶球藻株系的系统发育位置很近, 因此, 为了避免分类学的混淆, Coccomyxa simplex Mainx的分类地位被重新建立(Pröschold,2011)。
本研究藻株为实验室75g/L浓度的硫酸镁溶液中偶然发现并分离得到。1958年, Fott发现伪胶球藻(Pseudococcomyxa adhaerens)自发出现在实验室化学溶液中(Fott et al, 1958)。1965年, Braune同样在他实验室储存的蒸馏水及硫酸镁溶液中发现伪胶球藻,并通过实验证明硫酸镁溶液中的伪胶球藻并非来自于空气污染, 而是蒸馏水中本身带入的(Braune,1964)。Rivasseau同样提到Coccomyxa actinabiotis可以在蒸馏水中生存(Rivasseau et al, 2013)。
我们的研究拟着重使用分子系统发育学手段并结合形态学及生理特征对生长于硫酸镁溶液中的藻株进行分类学鉴定。另一方面, Fv/Fm比值是光系统Ⅱ的最大光量子产率, 反映 PSⅡ反应中心的内禀光能转换效率, 或PSⅡ的最大光能转换效率, 其中, Fm是饱和脉冲激发得到的藻细胞的最大荧光, Fv是可变荧光, 即Fm与Fo(初始荧光)之差。在非胁迫条件下, 此参数变化很小, 但在胁迫条件下, 此参数变化较大,因此它是反映微藻生长环境良好与否的一个重要参数(尹翠玲等, 2007)。我们拟通过在不同培养条件下对藻株 Fv/Fm值的测量, 初步探究其耐受硫酸镁单盐的生理特性。
1 材料与方法
1.1 材料
本研究所用藻株为实验室75g/L硫酸镁溶液中采集并分离培养所得, 所用培养基为BG11(Stanier et al,1971)。送至中国科学院淡水藻种库, 所得编号FACHB-1785。
1.2 形态学观察
1.2.1 LM 观察 将新鲜培养的活细胞直接使用显微镜(LEICA DMC 5000)进行显微结构的观察, 并用配套软件进行拍照。
1.2.2 TEM 观察 将培养的藻细胞离心收集后,送至中国科学院水生生物研究所分析测试中心进行电镜样品制备, 经过固定, 脱水, 渗透, 包埋, 切片,染色后, 使用TEM(Hitachi TEM system HC-1)进行观察(殷明焱等, 2009)。
1.3 分子测定方法
1.3.1 基因组DNA的提取 取新鲜的指数生长期的藻细胞于 10000 r/min离心 1min去上清液, 加入300μL Tris-HCl悬浮缓冲液, 移入1.5mL EP管中, 充分震荡摇匀, 以收集到高密度的藻细胞。使用MiniBeadbeater石英珠研磨均质器(Biospec Product,Inc.)将藻细胞于4800 r/min研磨30s, 用以打破细胞壁。使用AxyPrep基因组DNA提取试剂盒(杭州爱思进生物技术有限公司)提取藻细胞基因组 DNA, 并以其作为模板扩增ITS及18S rDNA片段。
1.3.2 18S rDNA的扩增 设计使用50μL PCR扩增体系, 其中包括模板DNA 10μL, 正反引物各1μL,Taq Buffer 5μL, Taq 酶 0.65μL, dNTP1μL 和 ddH2O 31.35μL。扩增程序为 95°C预变性 5min; 94°C变性1min, 56°C 复性 1 min, 72°C 延伸 1.5 min (共 34个循环); 72°C延伸10 min。用于扩增18S rDNA的引物为通用引物, 序列如下:
正 向 引 物 (18SF): 5’-CCAACCTGGTTGATCCT GCCAGTA-3’
反向引物(18SR): 5’-CCTTGTTAACGACTTCAC CTTCCTCT-3’
1.3.3 ITS序列的扩增 设计使用50μL PCR扩增体系, 其中包括模板 DNA 10μL, 正反引物各 1μL,Taq Buffer 5μL, Taq酶 0.65μL, dNTP 1μL 和 ddH2O 31.35μL。扩增程序为 95°C预变性 5min; 94°C变性1min, 56°C 复性 1 min, 72°C 延伸 1.5 min(共 34个循环); 72°C延伸10 min。用于扩增ITS rDNA序列的引物为通用引物, 序列如下:
正向引物(ITSF): 5′-CAAGGTTTCCGTAGGTGA-3′
反向引物(ITSR): 5′-GGCATCCTGGTTAGTTTC T -3′
1.3.4 扩增产物的回收与测序 扩增产物经1%琼脂糖凝胶电泳分离后, 使用胶回收试剂盒(Axygen,AP-GX-50)回收, 电泳缓冲液为 TAE。将回收得到的PCR产物交由北京擎科新业生物技术有限公司测序。
1.3.5 系统进化树的构建 通过 GenBank数据库下载相关序列。将所得序列使用软件MEGA 5.05进行比对和手工矫正。DNA数据的碱基组成分析, 碱基转换与颠换比率分析, 核苷酸替代饱和分析以及分类阶元之间的遗传距离分析等, 也同样采用 MEGA 5.05完成。系统发育树的构建采用最大似然法(ML)和贝叶斯法(BI)。ML树采用软件PAUP 4.0构建, 其最适取代模型及参数由Modeltest程序得到。贝叶斯树采用软件 MrBayes(v3.1.2)(Huelsenbeck et al,2001)。ML法以最大邻接树为起点进行启发式搜索,NNI交换算法, 并选取普通时间可逆模型(GTR+G+I)作为ML分析的最适取代模型。Bayesian树的进化模型同 ML, 位点间差异比率采用 γ分布比率差异(gamma-distributed rate variation), 其中部分为不变位点(a proportion of invariant sites), 其余参数为默认值;采用MCMC法运算10000000代, 每10000代取样1次, 从得到的 1000个样本中舍弃 250个老化样本后总结得到共有树。
1.4 不同培养液对藻株FACHB-1785的影响
设计 11种培养条件, 即蒸馏水, 0.3mmol/L MgSO4(为BG11标配MgSO4浓度), 3mmol/L MgSO4,30mmol/L MgSO4, 300mmol/L MgSO4, 600mmol/L MgSO4, 1200mmol/L MgSO4(pH=5.75), 1200mmol/L NaCl (pH=6.59), 1200mmol/L CaCl2(pH=5.10),1200mmol/L MgCl2(pH=5.82), 1200mmol/L Na2SO4(pH=5.79)。每天摇 3次, 并定时使用分光光度计(UV-1700)测定藻液在 680nm波长处的吸光度值, 用OD680变化表征藻细胞的生长情况。
1.5 PSⅡ最大光能转化效率(Fv/Fm)的测定
使用德国Walz公司产Water-PAM水样叶绿素荧光仪(Walz, Effeltrieh, Germany)进行叶绿素荧光参数的测定。将所养各组藻液于第 13天测定 Fv/Fm值。测量前将微藻样品暗适应 15min。叶绿素荧光参数Fv/Fm可在荧光仪上直接读出, 其中用饱和脉冲[4800μmol/(m2·s), 持续时间为 0.8s)激发得 Fm(最大荧光)。
1.6 数据分析
用Origin 7.5软件作图。用SPSS 13.0软件进行单因子方差分析。
2 实验结果
2.1 形态学观察结果
单细胞, 或无明显胶被的聚集群体(图 1a—1i)。细胞椭圆形。色素体侧位, 长片状, 幼时 1个(图1e—1f), 成熟后多为分叶的2瓣、或2个(图1a—1d,1g—1h)。无蛋白核。成熟细胞长6—9微米, 宽5—7微米, 长宽比为 1.2—1.5 倍(图 1a—1d, 1g—1h)。以形成2—4个似亲孢子进行无性繁殖(图1g—h)。
在胶球藻属胶被不明显的几个物种中, 本株藻和胶球形胶球藻C. gloeobotrydiformis Reisigl 1969形态相似, 都为椭圆形、具有较小的长宽比值, 且色素体在成熟后不止1个。但胶球形胶球藻的色素体可达3个, 有些分布在细胞两端。而本株藻细胞无论在生境条件下或培养条件下, 色素体均侧位并与细胞纵轴平行, 成熟细胞多为分叶的2瓣, 绝不为多个。
生长于蒸馏水环境中的藻细胞内油滴含量增加, 叶绿体体积变小(图 1p); 而 1200mmol/L 的MgSO4对藻细胞形态影响较小, 叶绿体颜色变黄,细胞内含物增加(图 1o); 1200mmol/L的NaCl使藻细胞部分白化, 细胞内积累大量内含物, 叶绿体收缩明显(图 1l); 1200mmol/L的 CaCl2, MgCl2和Na2SO4使细胞大量白化, 内含物充满细胞, 细胞趋于死亡(图 1k, 1m, 1n)。

图1 藻株FACHB-1785显微图片Fig.1 Micrographs of strain FACHB-1785
2.2 分子系统发育分析结果
2.2.1 基于 18S rDNA基因序列构建的系统进化树(图 2) 将所选 18S序列进行比对后剪切, 得到由27条长度为1684bp的序列所组成的矩阵。所有位点中有1327(78.8%)个保守位点, 346(20.5%)个可变位点,239(14.2%)个简约信息位点。碱基组成分析显示所有序列平均碱基组成为A=24.4%, T/U=25.4%, C=22.0%,G=28.2%, A+T含量(49.8%)少于G+C含量(50.2%)。碱基转换/颠换比(R)为1.72。用配对序列之间的转换距离和颠换距离对未校准过的P-distance距离分别作图, 得到的碱基替换饱和性分析结果显示, 转换和颠换替代都与 P-distance距离呈线性关系, 并且转换速率大于颠换, 即序列未达饱和。18S系统进化树的构建旨在显示胶球藻类群所处的分类地位及该类群内各分支所处的位置。如图所示, 所选藻株位于胶球藻类群之中, 属于胶球藻属。整个胶球藻类群与Elliptochloris类群亲缘关系最近, 并与 Nannochloris和Choricystis类群共处于共球藻纲下的一个分支内。
2.2.2 基于 ITS rDNA序列构建的系统进化树(图3)ITS序列比对产生一个含有52个长度为710 bp的序列矩阵。所有位点中有415个可变位点, 其中372个为简约信息位点。碱基组成分析显示所有序列的平均碱基组成为A=21.7%, T=18.7%, C=30.5%, G=29.1%,A+T含量(40.4%)小于 G+C含量(59.6%), 碱基转换/颠换比为 1.469。在序列饱和性分析中, 转换和颠换与P-distance遗传距离的线形相关显示这些位点没有突变饱和。基于ITS序列构建的系统进化树用于显示胶球藻属内各种间的关系。该树结果显示, 本研究藻株 FACHB-1785与另外两株藻共居于一个小分支(Clade C), 与它们分别仅有4和5个碱基差异。该小分支与一支胶球藻株系群(Clade A)和一支多伪胶球藻株系群(Clade B)亲缘关系较近。
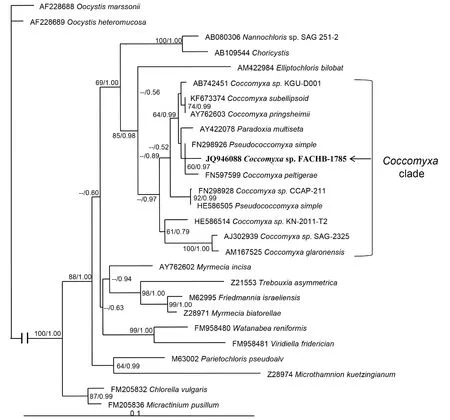
图2 基于18S rDNA基因序列构建的系统进化树Fig.2 ML tree and Bayes tree inferred from 18S rDNA sequences

图3 基于ITS rDNA基因序列构建的系统进化树Fig.3 ML tree and Bayes tree inferred from ITS rDNA
2.3 不同培养液对胶球藻FACHB-1785的影响
2.3.1 不同浓度MgSO4对胶球藻FACHB-1785细胞密度的影响(图4a) 从图中可以看出, 各组藻细胞中, 生长状况最好的为 3mmol/L MgSO4组, 而0.3mmol/L MgSO4组次之。蒸馏水组藻细胞没有经历下降过程, 但上升缓慢, 最终与 30mmol/L MgSO4组的生长状况相差不大(P>0.05)。除蒸馏水组之外, 其余各组藻细胞密度均经历了先下降, 2天左右之后逐渐回升的过程, 可见单盐硫酸镁的加入对藻细胞产生了一定的胁迫作用, 但胶球藻FACHB-1785可以通过短期(2天)的适应而逐渐恢复生长。随着单盐硫酸镁的浓度的增高(大于 3mmol/L), 藻细胞的生长开始出现被抑制的趋势, 并随浓度的增大, 抑制加深,1200mmol/L MgSO4组的细胞密度显著低于其它各组(P<0.05)。
2.3.2 1200mmol/L的各组盐对胶球藻 FACHB-1785细胞密度的影响(图 4b) 实验结果显示,1200mmol/L MgSO4组藻细胞的终生物量显著高于其它各组(P<0.05), 而 Na2SO4组则显著低于其它各组(P<0.05)。1200mmol/L MgSO4组藻细胞经历了先下降,后上升的过程, 而其余各组藻细胞密度则先急剧下降, 而后缓慢下降, 这说明胶球藻FACHB-1785对高浓度单盐 MgSO4的有一定的耐受性, 而对其它盐则无此耐受性。
2.3.3 不同浓度MgSO4对胶球藻FACHB-1785光系统Ⅱ最大量子产率(Fv/Fm)的影响(图 4c) 结果显示, 各组Fv/Fm值显示了与细胞密度OD值相似的结果。3mmol/L MgSO4组藻细胞的光系统Ⅱ最大量子产率值最高, 0.3mmol/L MgSO4组次之, 蒸馏水组与30mmol/L MgSO4组藻细胞终 Fv/Fm值相差不大(P>0.05), 而 1200mmol/L MgSO4组则显著低于其它各组(P<0.05), 说明一定浓度硫酸镁对藻细胞光系统Ⅱ最大量子产率的增高有一定的促进作用, 但若浓度过高则对藻细胞光系统Ⅱ会产生一定的胁迫。
2.3.4 1200mmol/L的不同盐对胶球藻FACHB-1785光系统Ⅱ最大量子产率(Fv/Fm)的影响(图 4d) 由图显示, 1200mmol/L MgSO4组藻细胞的 Fv/Fm值显著大于其它各组(P<0.05)。而其它各组中, MgCl2组Fv/Fm值最大, 其余各组差异不显著(P>0.05), 但均较低, 其中 Na2SO4组最低, 仅有0.0605, 说明除了MgSO4盐以外, 1200mmol/L的其它盐严重抑制了胶球藻FACHB-1785的光系统Ⅱ最大量子产率(Fv/Fm)。
3 讨论
球状气生绿藻通常由于细胞形状单一且典型的分类特征较少, 而不能完全通过形态学评估来反应其进化地位, 其中, 胶球藻和伪胶球藻是这种形态界限模糊的典型代表(Neustupa et al, 2008)。与共球藻纲的其它藻相同的是, 相比于传统的形态学分类方法,胶球藻的分子数据结果暗示了其属内更加丰富的物种多样性(Neustupa et al, 2008)。其中, 核ITS序列区域有着更高的变异性, 并被广泛用于较低分类级别的系统发育分析(Trémouillaux-Guiller et al, 2007)。但胶球藻属内半数以上已确定种并无分子数据, 仅从分子数据上无法准确判断一株藻的系统发育位置。故本研究结合了形态学方法与系统发育方法共同判断本藻株FACHB-1785所属的分类地位。
本研究的系统进化树包含了大多数已知分子序列的胶球藻。从两株进化树中均可以看出, 本株藻FACHB-1785位于胶球藻属内, 并与一支与地衣Peltigerales共生的胶球藻株系群(Clade A)和一支多伪胶球藻株系群(Clade B)亲缘关系较近。ITS系统进化树更适合处理种间的关系(Bock et al, 2011)。从ITS系统进化树来看, 本藻株所属支系Clade C与Clade A和Clade B显著的分为三支, 并得到一定自展支持值的支持(ML/BI: 69/0.97)。另外, Clade C支系还未在前人的相关文献中提到。
另外, 从整个胶球藻属来看, 本藻株的形态特征是独特的。胶球藻属内, 细胞长宽比, 形状, 大小, 胶被形态及叶绿体形态和位置为分种的主要特征(Ettl et al, 1995)。就本藻株而言, 区别于其它种的主要特征在于胶被形态和叶绿体特征。本藻株胶被不明显。在胶球藻属胶被不明显的几个物种中, 本藻株和胶球形胶球藻C. gloeobotrydiformis Reisigl 1969形态相似, 都为椭圆形、具有较小的长宽比值(1.2—1.5), 且色素体在成熟后不止1个。但胶球形胶球藻的色素体可达3个, 有些分布在细胞两端。而本藻株细胞无论在生境条件下或培养条件下, 色素体均侧位并与细胞纵轴平行, 成熟细胞多为分叶的2瓣, 绝不为多个。
通过以上比较, 我们综合认为本藻株FACHB-1785为胶球藻属下一个不确定种, 并可能是一个新种。

图4 胶球藻FACHB-1785在不同培养条件的生长Fig.4 Growth of strain FACHB-1785 under different culture conditions
另外, 由于简单胶球藻(Coccomyxa simplex)的分类地位被重新确立(Pröschold et al, 2011), 伪胶球藻的分类地位需要进行修订(Krienitz et al, 2012)。最近的分子数据表明胶球藻与伪胶球藻形成一个单一的共球藻纲类群, 并包含许多种, 传统的胶液产生不同的标准难以作为分属的特征(Neustupa et al, 2008)。该观点得到本研究结果支持。几株伪胶球藻在两株系统进化树, 特别是基于ITS所构建的系统进化树中, 并未完全与胶球藻分开。ITS树中, 几株伪胶球藻共居于一支株系, 但该株系中仍有其它胶球藻存在, 伪胶球藻不能从胶球藻中独立出来。故将其独立为一属的观点仍需更多证据支持, 胶液产生不同的标准可能只是胶球藻属的分种特征。
有意思的是, 藻株FACHB-1785除了在高浓度硫酸镁溶液中表现出一定的耐受性外, 在蒸馏水中同样表现出较好的耐受特性。镁是构成叶绿素的中心元素, 其含量与相对叶绿素含量呈极显著相关(张广越等, 2010)。Hermans等的研究证明缺镁胁迫可以引起叶绿体结构与功能的异常, 叶绿体含量下降, 进而直接影响PSⅠ与PSⅡ的功能(Hermans et al, 2005)。本研究中, 蒸馏水组的藻细胞虽然生长缓慢, 叶绿体体积变小(如图 1p), 光系统Ⅱ活性略有降低, 但细胞通过一定时期的适应而逐渐恢复(如图 4a, 4c), 这说明藻株可以耐受极低浓度镁对细胞产生的影响。与对照组蒸馏水组相比, 高浓度(1200mmol/L)其它盐(NaCl,CaCl2, MgCl2, Na2SO4)的加入使细胞大部分白化, 叶绿体受损失色严重(如图1k—1n), 藻细胞浓度持续下降(如图 4b), 但高浓度(1200mmol/L)硫酸镁盐组藻细胞则通过4天的适应而逐渐恢复生长(如图4b), 说明该藻株对硫酸镁盐有独特的单盐抗性, 而光系统Ⅱ最大量子产率(Fv/Fm)值的显著差异(如图 4d)则暗示了高浓度其它单盐可能通过影响藻株叶绿体的正常功能, 进而影响了细胞的正常生长, 而在高浓度单盐硫酸镁条件下, 细胞通过对叶绿体的保护, 从而维持了一定速率的细胞增长。Braune对于伪胶球藻的蒸馏水及高盐环境耐受特性的研究表明, 藻细胞增长所需的营养物质可能来源于蒸馏水, 并认为藻细胞可能通过进入“生理干燥期”来抵抗蒸馏水及高盐环境带来的不利因素(Braune, 1964)。
可以预见的是, 本藻株因其独特的硫酸镁单盐耐受性而具有潜在的应用价值。在富油藻株的筛选中,抗逆能力是其中重点考察的指标, 极端环境耐受藻株可最大限度的降低杂藻和敌害生物的侵染, 具有户外大规模培养的条件(刘建国等, 2013)。本藻株可在通气条件下大量培养, 一定浓度硫酸镁盐的加入不仅提高了藻株的生物量(图4a), 其一定的胁迫也促进了胞内油脂积累的增加(图 1a—1i, 1o), 同时可以抑制其它可能杂藻的生长, 其较高的抗污染特性使其具有成为优良产油藻株的潜质。
4 结论
自实验室硫酸镁单盐溶液中分离得到一株绿藻,通过分子系统发育学分析, 结合形态学区别及生理特征, 综合认定为一种胶球藻(Coccomyxa sp.)。对其耐受硫酸镁溶液的初步探索实验结果表明, 藻株FACHB-1785对硫酸镁单盐及蒸馏水胁迫有着独特的抗性, 而光系统Ⅱ最大量子产率(Fv/Fm)的显著差别则暗示了相比于其它单盐溶液, 藻株可以更有效的抵御硫酸镁对于光合系统的胁迫。这些特征同时表明该藻株有良好的抗杂藻污染特性, 具有潜在应用前景。
尹翠玲, 梁 英, 冯力霞等, 2007. 氮浓度对盐生杜氏藻和纤细角毛藻叶绿素荧光特性及生长的影响. 海洋湖沼通报,(1): 101—110
刘建国, 龙元薷, 黄 园等, 2013. 微藻生物柴油研究现状与发展策略. 海洋科学, 37(10): 132—141
张广越, 彭良志, 淳长品等, 2010. 脐橙叶片镁、硼含量变化与缺素黄化的关系. 园艺学报, 37(8): 1317—1324
殷明焱, 胡晓燕, 曾呈奎, 2009. 胶州湾有毒藻华形成种里氏金色藻(Chrysochromulina leadbeateri)的分类学研究. 海洋与湖沼, 40(6): 799—802
Bock C, Krienitz L, Pröeschold T, 2011. Taxonomic reassessment of the genus Chlorella (Trebouxiophyceae) using molecular signatures (barcodes), including description of seven new species. Fottea, 11(2): 293—312
Bourrelly P, 1966. Les Algues d´Eau Douce: Initiation à la Systémique, I. Les Algues Vertes. Pairs, FRA: N. Boubée &Cie, 572
Braune W, 1964. Pseudococcomyxa adhaerens Korshikoveine an extreme Lebensbedingungen angepaßte kokkale Grünalge.Archiv für Mikrobiol, 49(2): 176—182
Chodat R, 1913. Monographies d'algues en Culture Pure. In:Matériaux Pour la Flore Cryptogamique Suisse, 4: 224—234
Ettl H, Gärtner G, 1995. Syllabus der Boden-, Luft- und Flechtenalgen. Stuttgart, GER: Gustav Fischer Verlag, 721
Fott B, 1974. Taxonomie der palmelloiden Chlorococcales(Familie Palmogloeaceae). Preslia, 46: 1—31
Fott B, 1981. Nomenklatorische Änderungen bei einigen Chlorokokkalalgen. Preslia, 53: 1—7
Fott B, Komárek J u, 1958. Über eine häufig übersehene Grünalge: Pseudococcomyxa adhaerens Korshikov. Preslia,30: 76—77
Groover R D, Bold H C, 1969. Phycological Studies. VIII. The Taxonomy and Comparative Physiology of the Chlorosarcinales and Certain Other Edaphic Algae. Texas,USA: University of Texas Press, No.6907, 165
Hermans C, Verbruggen N, 2005. Physiological characterization of Mg deficiency in Arabidopsis thaliana. J Exp Bot,56(418): 2153—2161
Herndon W, 1958. Studies on chlorosphaeracean algae from soil.Am J Bot, 45(4): 298—308
Hoshina R, Imamura N, 2008. Multiple origins of the symbioses in Paramecium bursaria. Protist, 159(1): 53—63
Huelsenbeck J P, Ronquist F, 2001. MRBAYES: Bayesian inference of phylogenetic trees. Bioinformatics, 17(8):754—755
Jagg O, 1933. Coccomyxa Schmidle, Monographie einer Algengattung. Beitr. Kryptogamenflor. Schweiz, 8: 1—132
Koršikov O A, 1953. Pidklas Protokokovi (Protococcineae).Viznačnik prisnovodnich vodorostej ukrajinskoi RSR, V.Kiev: Akad. Nauk USSR, 439
Krienitz L, Bock C, 2012. Present state of the systematics of planktonic coccoid green algae of inland waters.Hydrobiologia, 698(1): 295—326
Lohtander K, Oksanen I, Rikkinen J, 2003. Genetic diversity of green algal and cyanobacterial photobionts in Nephroma(Peltigerales). Lichenologist, 35(4): 325—339
Marvan P, Komárek J, Comas A, 1984. Weighting and scaling of features in numerical evaluation of coccal green algae(genera of Selenastraceae). Arch Hydrobiol Algol Stud,37(Suppl. 67): 363—399
Neustupa J, Nemjová K, 2008. Quantitative assessment of morphological variation of six Pseudococcomyxa strains by geometric morphometric descriptors. Fottea, 8(2): 111—116
Pröschold T, Darienko T, Silva P C et al, 2011. The systematics of Zoochlorella revisited employing an integrative approach.Environ Microbiol, 13(2): 350—364
Rivasseau C, Farhi E, Atteia A et al, 2013. An extremely radioresistant green eukaryote for radionuclide biodecontamination in the nuclear industry. Energy Environ Sci,6(4): 1230—1239
Schmidle W, 1901. Ueber drei Algengenera. Ber Deutsch Bot Ges,19: 10—24
Stanier R Y, Kunisawa R, Mandel M et al, 1971. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriol Rev, 35(2): 171—205
Stevenson R N, South G R, 1974. Coccomyxa parasitica sp. nov.(Coccomyxaceae, Chlorococcales), a parasite of giant scallops in Newfoundland. Br Phycol J, 9(3): 319—329
Trémouillaux-Guiller J, Huss V A R, 2007. A cryptic intracellular green alga in Ginkgo biloba: ribosomal DNA markers reveal worldwide distribution. Planta, 226(2): 553—557
Verma V, Bhatti S, Huss V A R et al, 2009. Photosynthetic inorganic carbon acquisition in an acid-tolerant, free-living species of Coccomyxa (Chlorophyta). J Phycol, 45(4):847—854
Zoller S, Lutzoni F, 2003. Slow algae, fast fungi: exceptionally high nucleotide substitution rate differences between lichenized fungi Omphalina and their symbiotic green algae Coccomyxa. Mol Phylogenet Evol, 29(3): 629—640
