N/P比失衡对两种硅藻元素组成及水体中氮磷组成的影响*
2016-01-15李超伦赵增霞刘梦坛
陈 蕾 李超伦① 赵增霞 刘梦坛
(1. 中国科学院海洋研究所海洋生态与环境科学重点实验室 青岛 266071; 2. 中国科学院大学 北京 100049;3. 海洋国家实验室海洋生态与环境科学功能实验室 青岛 266071; 4. 山东胶州湾海洋生态系统国家野外科学观测研究站 青岛 266071)
中肋骨条藻和三角褐指藻是广泛分布于近岸海域, 并在诸多海域有赤潮记录的硅藻(霍文毅等, 2001;林凤翱等, 2008; 许翠娅等, 2010; 梁瑜, 2010), 两者均是植食性动物的常见饵料(李捷等, 2005, 2007; 李超伦等, 2007), 其元素组成对植食性动物具有重要的影响。目前, 关于 N/P比失衡对两种硅藻影响的研究大多集中在不同N/P比条件下浮游植物生长状况以及脂肪酸等某些化合物组成变化的方面(李荷芳等, 2000;廖启斌等, 2000; 蒋冰飞等, 2007; 张玉君, 2010), 少见关于微藻元素组成变化的报道(李铁等, 2000)。实验同时测定培养液营养盐变化的研究更为少见。因此,本文以这两种硅藻为实验对象, 分析了培养过程中培养液营养盐含量的变化, 探究了其在 N/P比失衡培养条件下的元素(C、N、P)组成变化, 以期为N/P比失衡对微藻元素组成及其影响的研究提供基础参数。
1 材料与方法
1.1 藻种预培养
三角褐指藻Phaeodactylum tricornutum (PT)和中肋骨条藻 Skeletonema costatum (SC), 在温度为 20°C±0.5°C, 光暗比(L/D)为12h︰12h, 光照为4000 lx条件下用f/2培养液培养至指数生长期备用。培养所用海水为取自青岛汇泉湾附近的自然海水, 经孔径为0.20µm的混合纤维滤膜过滤, 煮沸灭菌, 室温冷却后备用。
1.2 实验方法
将微藻在正常(自然海水按照f/2培养基要求, 添加各培养液; 定义为对照组, 简称为C组)、高N/P(自然海水按照f/2培养基要求, 添加除PO43–-P之外的各培养液; N/P>16, 定义为高 N/P组, 简称 P组)和低N/P(自然海水按照f/2培养基要求, 添加除NO3–-N之外的各培养液; N/P<16, 定义为低N/P组, 简称N组)三种条件下进行培养。接种浓度均为3μgC/mL。
每处理组设置3个重复。在上述三种条件下, 培养 5天(微藻处于正常生长平台期), 摇匀后, 取部分藻液, 抽滤到GF/F玻璃纤维膜(马弗炉450°C灼烧5h,酸洗后烘干)上收集藻细胞。继续培养至15天(不添加营养盐, 微藻部分死亡), 同样方法收集藻细胞。样品经–50°C冷冻干燥48h后保存, 用以测定微藻细胞的C、N和P含量。同时, 滤出的水样于–20°C保存, 用以测定培养液中各营养盐的含量。
碳氮元素的测定使用元素分析仪(德国 elementar公司, EL), 样品经称重和锡舟包覆后进样分析。另将用于测定磷元素含量的样品称重, 置于 100mL烧杯中, 加入硝酸高氯酸于电热板加热消解, 后定容至25mL, 在 ICP等离子发射光谱仪(Thermo Fisher Scientific)上对磷元素含量进行分析测定。营养盐含量(NO3–-N、NH4+-N、NO2–-N 和 PO43–-P)的测定使用全自动海水营养盐分析仪(QuAAtro, Bran+Luebbe GmbH Co.)。
1.3 数据处理
采用极差, 以计算微藻在三种培养条件下, 元素化学计量比的变异程度。计算公式为: 极差=最大值–最小值。
采用SPSS16.0对各处理组间进行差异性检验。
2 结果
2.1 N/P比失衡条件下微藻培养液营养盐含量的变化
三角褐指藻的可溶性总氮(DIN, NO3–-N、NH4+-N和NO2–-N的总称)在对照组中, 随时间的变化趋势(0天>5天>15天)与中肋骨条藻的变化趋势(0天>5天>15天)一致; 高N/P组和低N/P组也表现出了相同的一致性(图1a)。但DIN随时间的变化趋势在三处理组间表现出了差异性。对照组的 DIN浓度随时间逐渐降低; 培养5天到15天, 高N/P组和低N/P组的DIN浓度变化较小。高N/P组因DIP的缺少影响到了微藻对DIN的吸收。
(1)系统为存储应用程序中的所有数据访问提供实时审核。我们使用电子数据文件作为数据单元,对数据对象的所有操作进行审计,并使用区块链进行记录。通过这种方式,可以收集和监测控制所有电子数据访问情况。
三种培养条件下, 两种硅藻的可溶性磷(DIP, 文中指 PO43–-P)随时间的变化趋势均表现出了一致性(图1b)。培养5天与15天, 对照组的DIP浓度相近;而高N/P组和低N/P组的DIP浓度随时间逐渐降低。与DIN不同的是, 低N/P组DIN的缺少对DIP的吸收影响较小。
三角褐指藻和中肋骨条藻培养液的 DIN/DIP值在对照组的变化趋势均为 0天<15天<5天。高 N/P组表现出了与对照组不同的变化趋势, 由于DIP值在15天时持续的降低, 使得DIN/DIP值在15天时高于5天时。而低N/P组由于DIN15天时较5天时没有较大的变动, 使得 DIN/DIP15天时并不比 5天时降低,反而升高。
2.2 N/P比失衡对两种硅藻C、N、P化学计量比的影响
2.2.1 N/P比失衡对两种硅藻C/P值的影响 研究发现(图2a)N/P比失衡的培养条件(对照组、高N/P组和低 N/P组)影响了两种硅藻的 C/P值; 且不同硅藻经过不同时间的培养后, 其C/P值的变动幅度(3处理组C/P值的极差表示)也不同。

图1 N/P比失衡条件下, 微藻培养液营养盐含量(µmol/L)的变化Fig.1 In the changes in the nutrient content of the culture under N/P ratio imbalance conditions
三角褐指藻在三种培养条件下, 培养5天的C/P值变化趋势为 P 组(704.994)>C 组(139.030)>N 组(53.543), 三者间存在极显著差异(P<0.01); 三者的极差为651.451。培养15天后, 趋势为P组(1118.625)>C组(226.698)>N 组(76.259), 三者间存在极显著差异(P<0.01); 极差为 1042.366。高 N/P培养条件使三角褐指藻的 C/P值显著增加; 随培养时间的增长, 其C/P值变动幅度增大。
中肋骨条藻的三个处理组的 C/P值变化趋势略有不同。其培养 5天的 C/P值变化趋势为 P组(193.578)>N 组(83.520)>C 组(58.869), 三者间存在极显著差异(P<0.01); 极差为134.709。培养15天后, 趋势为 P 组(195.348)>N 组(123.701)>C 组(105.257), 三者间存在极显著差异(P<0.01); 极差为 90.091。中肋骨条藻的C/P值在高N/P培养条件下显著增加; C/P值变动幅度随时间的增长具有减少的趋势, 且表现出了比三角褐指藻更强的稳定性。
2.2.2 N/P比失衡对两种硅藻 C/N值的影响 图2b显示, 三角褐指藻在培养5天后, C/N值的变化趋势为N组(8.437)>P组(8.180)>C组(4.844), 三者间存在极显著差异(P<0.01), 三者极差为 3.598。培养 15天后, 变化趋势为 P组(12.127)>N 组(9.208)>C 组(6.219), 三者间存在极显著差异(P<0.01); 极差为5.908。
中肋骨条藻在培养5天后, 该值变化趋势为N组(5.768)>P组(5.260)>C 组(4.719), 三者间存在极显著差异(P<0.01); 极差为 1.048。培养 15天后趋势为 N组(9.219)>C 组(6.274)>P组(4.918), 三者间存在极显著差异(P<0.01); 极差为4.301。
两种硅藻在低N/P培养条件下, C/N值均显著增加; 该值变动幅度随时间的增长都表现出增大的趋势, 但中肋骨条藻的C/N值表现出更强的稳定性。
2.2.3 N/P比失衡对两种硅藻N/P值的影响 培养5天后的三角褐指藻, 其N/P值变化趋势为: 趋势为P组(85.216)>C 组(28.669)>N 组(6.384), 三者间存在极显著差异(P<0.01); 极差为78.832(图2c)。培养15天后, 趋势为 P 组(92.860)>C 组(36.118)>N 组(8.343),三者间存在极显著差异(P<0.01); 极差为84.518。
中肋骨条藻培养 5天后, 变化趋势为 P组(36.840)>N 组(14.228)>C 组(12.463), 三者间存在极显著差异(P<0.01); 极差为24.378。培养15天后, 趋势为P组(40.096)>C组(16.791)>N组(13.256), 三者间存在极显著差异(P<0.01); 极差为26.841。
各种 N/P比失衡培养条件中, 均以高 N/P组的N/P值最高。两种硅藻的N/P值变动幅度随时间的增长都表现出增大的趋势, 但中肋骨条藻的N/P值表现出更强的稳定性。
2.3 N/P比失衡对两种硅藻元素含量的影响
结果显示(图 3)同种硅藻在N/P比失衡的培养条件下, P含量的变化幅度均大于N含量, P含量表现出了更强的不稳定性。
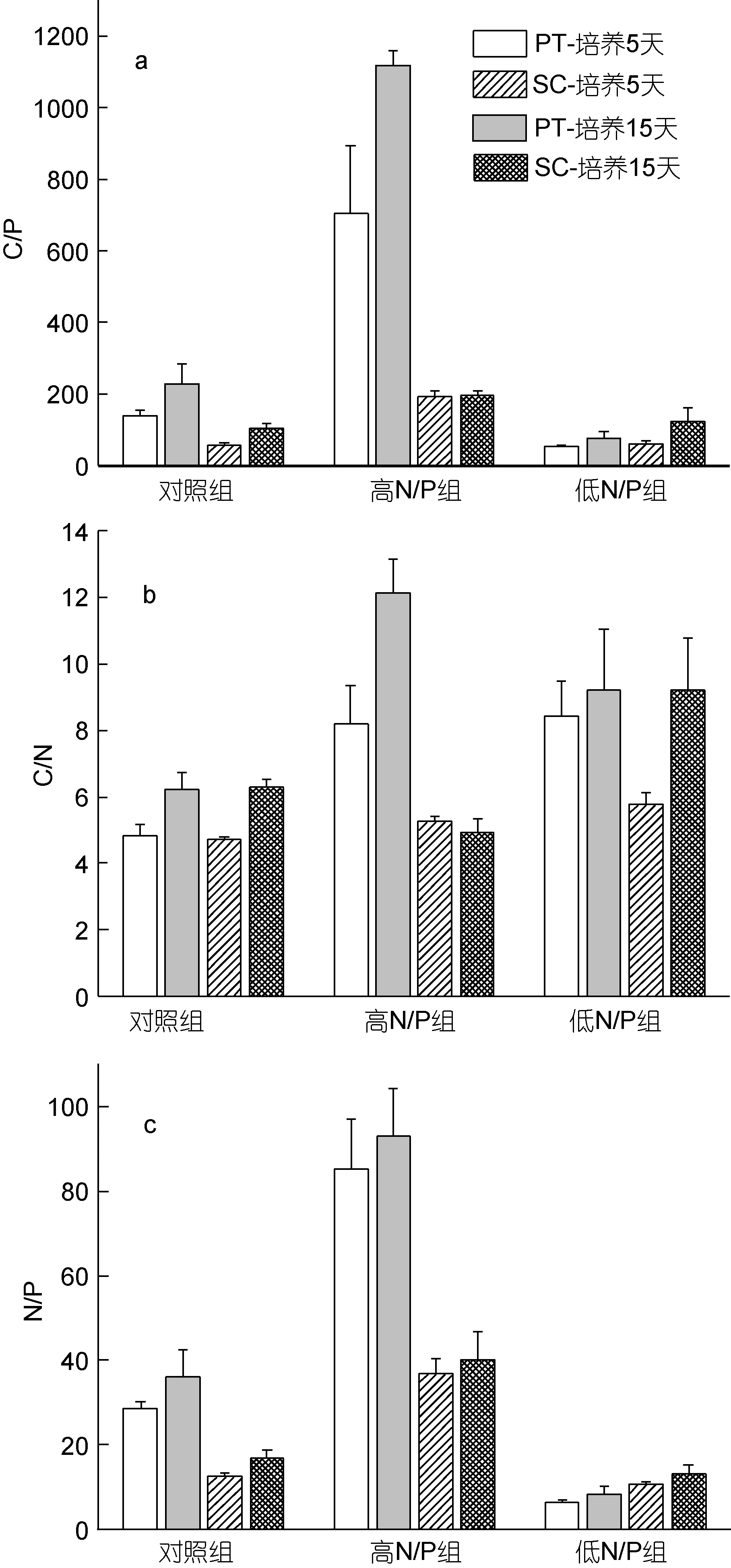
图2 三角褐指藻P. tricornutum (PT)和中肋骨条藻S.costatum (SC)在三种条件下(对照组、高N/P组和低N/P组)培养5天和15天, 藻体的C/P值(a)、C/N值(b)、N/P值(c)Fig.2 Changes in algae body chemical composition of P.tricornutum (PT) and S. costatum (SC) after 5 and 15 d cultures in three groups (the control, high N/P, and low N/P)a: C/P ratio; b: C/N ratio; c: N/P ratio
培养5天后, 三角褐指藻的P含量最高组(低N/P组, 0.471%)是最低组(高N/P组, 0.047%)的10.0倍。而N含量最高组(对照组, 2.770%)仅是最低组(低N/P组, 1.363%)的2.0倍。同样, 三角褐指藻经15天培养后, P含量最高组(低N/P组, 0.328%)是最低组(高N/P组, 0.029%)的 11.4倍。而 N含量的最高组(对照组,1.800%)仅是最低组(高N/P组, 1.203%)的1.5倍。总之, 三角褐指藻在相同培养条件下, P含量的不稳定性比N含量高。
中肋骨条藻经培养5天后, P含量最高组(低N/P组, 0.540%)是最低组(高N/P组, 0.164%)的3.3倍。而N含量的最高组(对照组, 2.853%)仅是最低组(低N/P组, 2.607%)的1.1倍。培养15天后, P含量最高组(对照组, 0.282%)是最低组(高N/P组, 0.105%)的2.7倍。而N含量最高组(对照组, 2.140%)仅是最低组(低N/P组, 1.563%)的1.4倍。中肋骨条藻的P含量在N/P比失衡的培养条件下, 也表现出了更强的不稳定性。

图3 三角褐指藻P. tricornutum (PT)和中肋骨条藻S.costatum (SC)在三种条件下(对照组、高N/P组和低N/P组)培养5天和15天, 藻体的C含量(a)、N含量(b)和P含量(c)Fig.3 Changes in algae body chemical composition of P.tricornutum (PT) and S. costatum (SC) after 5 d and 15 d cultures in three groups (the control, high N/P, and low N/P)a: C content; b: N content; c: P content
3 讨论
从本实验结果来看, N/P比失衡(对照组、高N/P组和低 N/P组)的培养条件影响了两种硅藻的 C/P、C/N和N/P值。高N/P比条件下, C/P值较对照组大幅度增加; 低N/P比条件下, C/N值较对照组大幅度增加。这与相关研究的结果一致。例如, Jensen等(2004)发现N/P比失衡(对照组、高N/P组和低N/P组)条件下, 斜生栅藻(Scenedesmus obliquus, 绿藻)藻细胞的元素组成(C/P、C/N和N/P值)也存在差异, 其中C/P值在高N/P组条件(626.00±23.70)下最高, C/N值在低N/P组条件(21.85±1.06)下最高, N/P值在高N/P组条件(50.79±2.24)下最高, 这与本实验两种硅藻在 N/P比失衡条件下培养 5天的元素组成结果趋势保持一致, 但变动幅度略有差异, 这应该是不同实验藻种所造成的。Schoo等(2010)研究发现对照组和高N/P组培养条件下, 隐藻(Rhodomonas salina, 隐芽植物)的C/P值存在显著差异(P<0.05), 同样, 高N/P组的值大于对照组。李铁等(2000)使用的方法是测定过滤前后藻液的氮磷总量, 差减间接得出藻体中的氮磷含量,发现中肋骨条藻(Skeletonema costatum)和新月菱形藻(Nitzsehia closteztuma)的P含量在不同培养条件下的变动幅度要大于N含量, 这与本实验的结果一致。近半个世纪以来, 近岸部分海域营养盐结构已经发生改变(胡明辉等, 1989; Sundareshwar et al, 2003;Dyhrman et al, 2006), 偏离Redfield比。根据N/P比失衡对不同微藻元素组成影响的实验结果, 可以推知 N/P比失衡海区的浮游植物的元素组成可能已经发生改变。同时, 微藻元素组成的改变影响其自身营养物质(如蛋白质、脂肪酸等)的含量(Brown et al,1997; 张玉君, 2010; Lai et al, 2011; Koch et al, 2012),使得植食者的食物品质下降, 对不同植食者的生长产生不同程度的影响(Urabe et al, 2003; Urabe et al,2009; Schoo et al, 2013)。在未来几十年, 这可能会使海洋生物群落发生缓慢演替, 进而对整个生态系统产生深远影响(陈蕾等, 2014)。
本实验结果显示中肋骨条藻的元素组成(C/P、C/N和N/P值)在对照组、高N/P组和低N/P组培养条件下的变动幅度均小于三角褐指藻, 即N/P比失衡对中肋骨条藻的影响较三角褐指藻要小。因此, 从元素组成方面来看, 海区以中肋骨条藻为饵料的植食者受到 N/P比失衡的影响要小于以三角褐指藻为饵料的植食者。目前海区浮游植物元素组成的研究尚少,后续的相关研究需要进行大量工作, 以积累海区的基础资料(陈蕾等, 2014)。另外, 结果显示中肋骨条藻在高 N/P组条件下培养 5天和 15天后的元素组成(C/P、C/N和N/P值)均无显著差异, 而在对照组条件下培养的元素组成(C/P、C/N和N/P值)均存在显著差异。可推测中肋骨条藻在磷不足海区死亡后对海水营养结构的调整作用下降, 同时对有机碎屑的元素组成造成了干扰。
本研究发现, 同种硅藻的P含量较N含量表现出了更强的不稳定性; 高N/P组的DIN含量因培养液中PO43–-P的不足受到影响, 而低N/P组的DIP含量并没有受到DIN不足的影响。由此, 可以认为微藻生长对P的限制作用更敏感。孙育平等(2011)认为高N/P组对生物量的影响比低N/P组更为敏感, 从另一方面证实了上述结论。一般认为, P汇集的主要单位是RNA(Sterner et al, 2002), 海洋物种N库中蛋白质含量最高, 其次为氨基酸(Ventura, 2006)。而蛋白质多组成有机体的固有结构, 这可能是 N含量表现出更强稳定性的原因。同时, 由于RNA控制着蛋白质合成,因此P也在一定程度上影响了有机体对N的吸收。另外, 培养15天各实验组DIN和DIP的消耗速率均低于相应实验组培养5天的消耗速率, 这说明部分微藻细胞的死亡裂解释放出营养盐, 补充了培养液营养盐的消耗。
4 结语
综上所述, 在N/P比失衡的条件下, 两种硅藻的C、N、P含量以及 C/P、C/N、N/P值均发生变化。这些元素组成的变化势必会沿食物链向上传递(Boersma et al, 2008), 进而对生态系统的生源要素循环产生影响, 甚至会影响到整个生态系统的结构和功能(陈蕾等, 2014)。同时, 研究发现N/P比失衡培养条件下, 培养液DIN浓度和DIP浓度产生不同程度的变化。浮游植物在海区的生物量较大, 尤其赤潮海域,其对营养盐的消耗将加剧或者缓和营养限制, 对水体营养盐结构产生巨大影响。因此, 在当前近海富营养化日趋严重情况下, 既需要关注水体氮、磷等失衡对浮游植物群落演替的影响, 同时也要关注浮游植物本身生源要素的改变及其沿食物网的级联效应,为深入了解富营养化影响下海洋生态系统的演变规律与趋势提供一个新的视角。
王修林, 孙 霞, 韩秀荣等, 2004. 2002年春、夏季东海赤潮高发区营养盐结构及分布特征的比较. 海洋与湖沼, 35(4):323—331
许翠娅, 黄美珍, 杜 琦, 2010. 福建沿岸海域主要赤潮生物的生态学特征. 台湾海峡, 29(3): 434—441
孙育平, 赵曰水, 2011. 不同氮、磷浓度下亚心形扁藻的生长及水体中氮、磷变化. 水产科学, 30(4): 197—201
李 铁, 胡立阁, 史致丽, 2000. 营养盐对中肋骨条藻和新月菱形藻生长及氮磷组成的影响. 海洋与湖沼, 31(1):46—52
李 捷, 李超伦, 张 展等, 2005. 桡足类与硅藻相互作用的研究进展. 生态学杂志, 24(9): 1085—1089
李 捷, 蒲新明, 张 展等, 2007. 两种藻类饲喂中华哲水蚤的繁殖差异. 海洋水产研究, 28(1): 38—44
李荷芳, 周汉秋, 2000. 营养盐对小球藻的生长、脂肪含量及EPA含量影响的研究. 海洋科学集刊, 42: 55—64
李超伦, 孙 松, 王 荣, 2007. 中华哲水蚤对自然饵料的摄食选择性实验研究. 海洋与湖沼, 38(6): 529—535
杨世民, 王丽莎, 石晓勇, 2014. 2009年春季胶州湾浮游植物群落结构特征. 海洋与湖沼, 45(6): 1234—1240
杨世民, 王丽莎, 石晓勇, 2015. 2009年夏季胶州湾同步调查浮游植物群落结构特征. 海洋与湖沼, 46(1): 102—108
宋秀凯, 袁廷柱, 孙玉增等, 2011. 山东乳山近海海洋卡盾藻(Chattonella marina)赤潮发展过程及其成因研究. 海洋与湖沼, 42(3): 425—430
张玉君, 2010. 环境因素对浮游生物脂肪酸影响的研究. 青岛:中国海洋大学硕士学位论文
陈 蕾, 李超伦, 2014. 海洋浮游生物的生态化学计量学研究进展. 应用生态学报, 25(10): 3047—3055
林凤翱, 卢兴旺, 洛 昊等, 2008. 渤海赤潮的历史、现状及其特点. 海洋环境科学, 27(S2): 1—5
胡明辉, 杨逸萍, 徐春林等, 1989. 长江口浮游植物生长的磷酸盐限制. 海洋学报, 11(4): 439—443
梁 瑜, 2010. 典型赤潮藻对氮磷营养要素的响应. 广州: 暨南大学硕士学位论文
蒋冰飞, 孙颖颖, 王长海, 2007. 营养盐对球等鞭金藻生长和脂肪酸含量及组分的影响. 海洋通报, 26(5): 56—61
廖启斌, 李文权, 陈清花等, 2000. 营养盐对三角褐指藻脂肪酸含量与百分组成的影响. 海洋环境科学, 19(2): 6—9
霍文毅, 俞志明, 邹景忠等, 2001. 胶州湾中肋骨条藻赤潮与环境因子的关系. 海洋与湖沼, 32(3): 311—318
Boersma M, Aberle N, Hantzsche F M et al, 2008. Nutritional limitation travels up the food chain. International Review of Hydrobiology, 93(4—5): 479—488
Brown M R, Jeffrey S W, Volkman J K et al, 1997. Nutritional properties of microalgae for mariculture. Aquaculture,151(1—4): 315—331
Dyhrman S T, Chappell P D, Haley S T et al, 2006. Phosphonate utilization by the globally important marine diazotroph Trichodesmium. Nature, 439(7072): 68—71 Elser J J, Dobberfuhl D R, Mackay N A et al, 1996. Organism size, life history, and N/P stoichiometry. BioScience, 46(9):674—684
Falkowski P G, Davis C S, 2004. Natural proportions. Nature,431(7005): 131
Jensen T C, Verschoor A M, 2004. Effects of food quality on life history of the rotifer Brachionus calyciflorus Pallas.Freshwater Biology, 49(9): 1138—1151
Koch U, Martin-Creuzburg D, Grossart H -P et al, 2012.Differences in the amino acid content of four green algae and their impact on the reproductive mode of Daphnia pulex.Fundamental and Applied Limnology, 181(4): 327—336
Lai J X, Yu Z M, Song X X et al, 2011. Responses of the growth and biochemical composition of Prorocentrum donghaiense to different nitrogen and phosphorus concentrations. Journal of Experimental Marine Biology and Ecology, 405(1—2):6—17
Myers V B, Iverson R I, 1981. Phosphorus and nitrogen limited phytoplankton productivity in northeastern Gulf of Mexico coastal estuaries. In: Neilson B J, Cronin L E eds. Estuaries and Nutrients. Clifton, USA: Humana Press, 569—582
Redfield A C, 1934. On the Proportions of Organic Derivatives in Sea Water and Their Relation to the Composition of Plankton. Liverpool, UK: Liverpool University Press
Redfield A C, 1958. The biological control of chemical factors in the environment. American Scientist, 46: 205—221
Ryther J H, Dunstan W M, 1971. Nitrogen, phosphorus, and eutrophication in the coastal marine environment. Science,171(3975): 1008—1013
Schoo K L, Aberle N, Malzahn A M et al, 2010. Does the nutrient stoichiometry of primary producers affect the secondary consumer Pleurobrachia pileus? Aquatic Ecology, 44(1):233—242
Schoo K L, Malzahn A M, Krause E et al, 2013. Increased carbon dioxide availability alters phytoplankton stoichiometry and affects carbon cycling and growth of a marine planktonic herbivore. Marine biology, 160(8): 2145—2155
Sterner R W, Elser J J, 2002. Ecological Stoichiometry: the Biology of Elements from Molecules to the Biosphere. New Jersey, USA: Princeton University Press
Sundareshwar P V, Morris J T, Koepfler E K et al, 2003.Phosphorus limitation of coastal ecosystem processes.Science, 299(5606): 563—565
Urabe J, Togari J, Elser J J, 2003. Stoichiometric impacts of increased carbon dioxide on a planktonic herbivore. Global Change Biology, 9(6): 818—825
Urabe J, Waki N, 2009. Mitigation of adverse effects of rising CO2on a planktonic herbivore by mixed algal diets. Global Change Biology, 15(2): 523—531
Ventura M, 2006. Linking biochemical and elemental composition in freshwater and marine crustacean zooplankton. Marine Ecology Progress Series, 327: 233—246
