基于ZooScan图像技术的南黄海夏季浮游动物群落结构分析*
2016-01-15代鲁平李超伦王世伟王延清
代鲁平 李超伦① 王世伟 王延清 张 芳
(1. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 青岛 266071; 2. 中国科学院大学 北京 100049; 3. 中国科学院海洋研究所 山东胶州湾海洋生态系统国家野外科学观测研究站 青岛 266071; 4. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266071)
浮游动物是海洋生态系统中的重要次级生产者,在海洋生态系统物质循环和能量流动中起着承上启下的关键作用。浮游动物丰度和生物量(干重、含碳量、含氮量)是海洋浮游动物定量研究的关键参数。传统获取丰度的人工镜检网采样品的方法由于存在工作量大、耗时等因素的限制, 导致大量样品无法被及时分析, 数据获取严重滞后。同时, 直接测定浮游动物干重和碳、氮含量的方法也具有耗时、费力、破坏样品等缺点。因此, 如何快速有效地实现浮游动物样品的识别和分析是当前浮游动物生态学研究的瓶颈问题之一(Culverhouse et al, 2003)。
浮游动物图像扫描分析系统(ZooScan Integrated System, ZooScan)是一种半自动化系统, 能够快速准确地获得浮游动物样品的数量、大小和种类等信息,在国内外浮游动物生态学研究中逐渐受到关注并得到有效应用(孙晓霞等, 2011;孙松等, 2013; Marcolin et al, 2013; 代鲁平等, 2014; García-Comas et al,2014)。国内关于ZooScan图像技术的研究多集中在利用 ZooScan获得体型参数(体长、面积或体积等)进行生物量推算, 分别建立不同浮游动物类群的经验转换公式(毕永坤, 2012; 孙松等, 2013), 而针对ZooScan用于浮游动物混合样品和群落结构的研究尚未见报道。
南黄海是我国重要的陆架边缘海, 具有复杂的物理海洋学特征和较高的浮游动物多样性(Wang et al,2004; Zuo et al, 2006)。很多学者对南黄海的浮游动物群落结构进行了研究(郑执中, 1965; 陈清潮等, 1980;左涛等, 2005; 陈洪举等, 2009; 王亮等, 2013), 这些研究中, 大多使用大型浮游生物网或浅水Ⅰ型浮游生物网(孔径 500μm)采集样品, 而关于使用中型浮游生物网采集南黄海浮游动物的报道较少。Hopcrof等(2001)和 Turner(2004)发现, 不同网型所采集的浮游动物组成和生物量差异显著。因此, 对南黄海中型浮游生物网样品开展研究具有一定的必要性。
本研究基于ZooScan图像技术, 针对中型浮游生物网网采样品, 分析了浮游动物混合样品的体积生物量与实测干重、含碳量和含氮量的相关关系, 同时,对南黄海夏季的浮游动物群落结构进行了研究, 并与历史资料进行对比, 以期为ZooScan图像技术应用于我国近海浮游动物群落结构的研究奠定方法基础。
1 材料与方法
1.1 站位设置和样品采集
于2013年8月17日至9月1日期间对南黄海海域进行了调查, 共设置 14个海洋生物调查站位(图1)。在每个站位, 用标准中型浮游生物网(网口面积0.2m2, 孔径 160μm)进行从距海底 4m 处至表层的垂直拖网。采集的浮游动物样品用分样器平均分为两部分: 一部分用 5%甲醛溶液保存, 带回实验室进行种类鉴定计数; 另一部分用不同孔径的筛绢逐级过滤,将浮游动物分为 160—500μm, 500—1000μm, 1000—2000μm和>2000μm等 4个粒径级, 然后用蒸馏水快速冲洗, 分别抽滤到事先于马弗炉中以 480°C灼烧5h去除有机质后的GF/C玻璃纤维滤膜(孔径1.2μm,直径 47mm)(Whatman公司, 英国)上, 置于-20°C 保存, 回实验室后用于干重、含碳量和含氮量的测定。
1.2 基于ZooScan的样品鉴定计数和体积生物量测定
回实验室后, 采用ZooScan系统(Hydroptic公司,法国)对甲醛保存的浮游动物样品进行分类和计数,方法参见 http://www.zooscan.com, 扫描精度为4800dpi。将样品鉴定到类群, 分类群计数。浮游动物各类群的丰度以每立方米海水中的个体数表示(ind./m3), 滤水量由网口面积乘以拖网水深测得。
同时, 根据ZooScan获得的浮游动物体积, 推算得到浮游动物各类群的体积生物量, 单位为mm3/m3。本研究中, 将浮游动物个体近似为长椭球体, 利用ZooScan扫描得到的椭圆的长轴(Major)和短轴(Minor), 根据长椭球体体积公式得到浮游动物个体体积: V=(4/3)π(Major/2)(Minor/2)2。
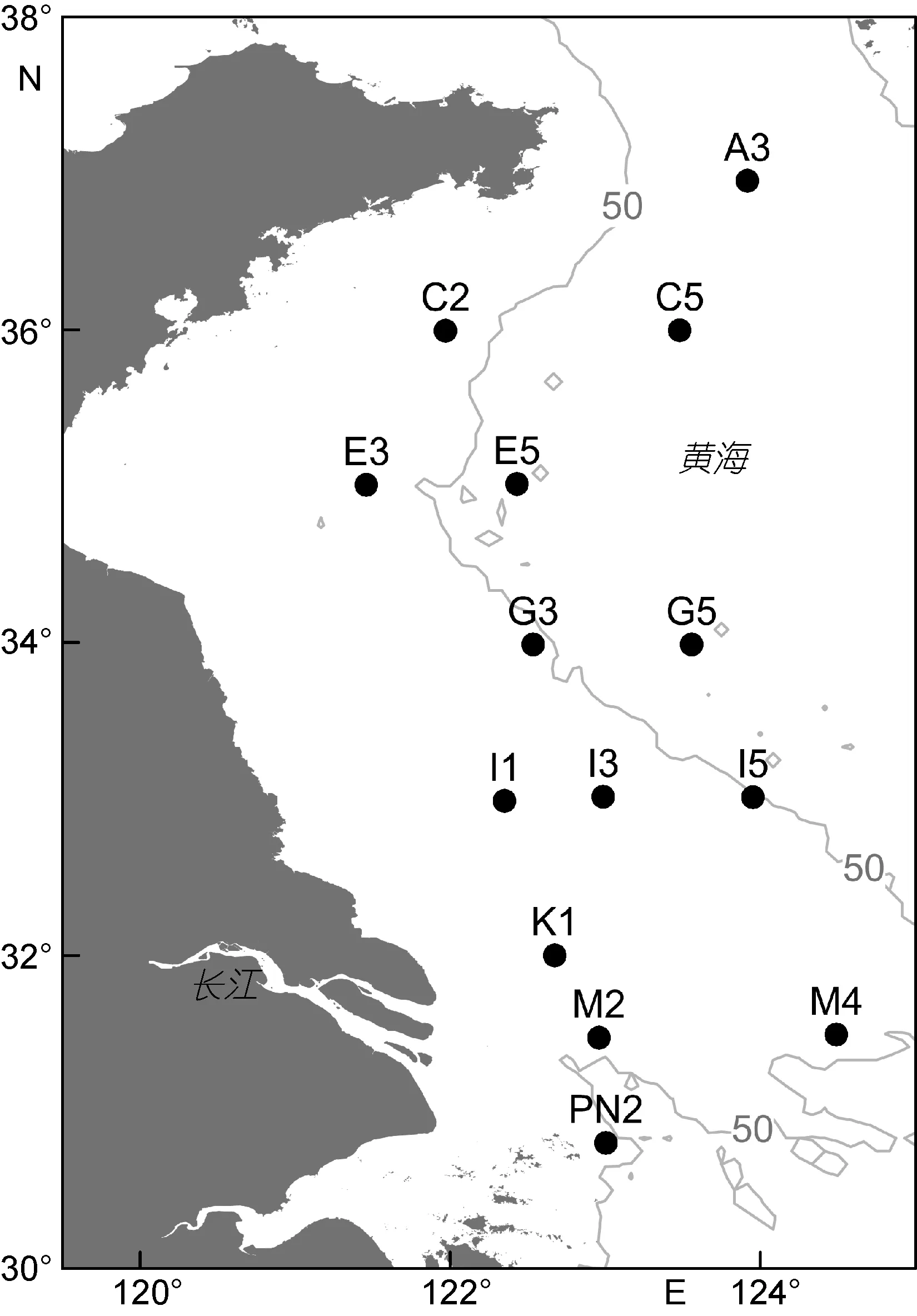
图1 南黄海浮游生物调查站位(图中灰色线为50m等深线)Fig. 1 Zooplankton sampling stations in the South Yellow Sea
1.3 传统方法测定生物量
回实验室后, 将-20°C保存的浮游动物样品置于冷冻干燥机(FD-1A-50, 北京博医康实验仪器有限公司, 中国)中, -50°C冷冻干燥48h后称重, 得到干重。将冻干的样品用玛瑙研钵磨成均匀粉末, 置于锡舟中, 使用 Elementar vario El cube元素分析仪(Elementar公司, 德国)测得含碳量和含氮量。干重、含碳量和含碳量的单位为μg/m3。
1.4 数据分析
浮游动物体积生物量和干重、含碳量、含氮量的相关关系, 根据浮游动物体形参数和生物量关系的适用模型: Y=α×Xβ(Wiebe et al, 1975), 将体积生物量和干重、含碳量、含氮量数据分别进行以10为底的对数转化, 然后进行 Pearson相关分析; 用具有相关关系的变量通过线性回归获得回归方程。以上数据分析均使用SPSS软件完成。
以站位为分类单位, 将ZooScan得到的不同类群中不同粒径级的体积生物量数据经 log10(X+1)转化后, 基于 Bray-Curtis相似性系数进行聚类分析(Field et al, 1982), 得到浮游动物群落的划分。以上数据分析均使用PRIMER软件完成。
2 结果与分析
2.1 体积生物量与干重、含碳量、含氮量的相关性分析
比较浮游动物体积生物量和实测生物量(干重、含碳量和含氮量), 可以看出, 总体积生物量和总干重、总含碳量、总含氮量均具有极显著的相关关系,并进一步得到回归直线: log10(总干重)=2.37+0.54log10(总体积生物量), log10(总含碳量)=2.10+0.49log10(总体积生物量), log10(总含氮量)=1.53+0.48log10(总体积生物量) (表1, 图2)。在不同粒径组方面, 160—500μm和1000—2000μm粒径组的体积生物量和干重、含碳量、含氮量间具有显著的相关性, 但是在500—1000μm和>2000μm粒径组相关性不显著。
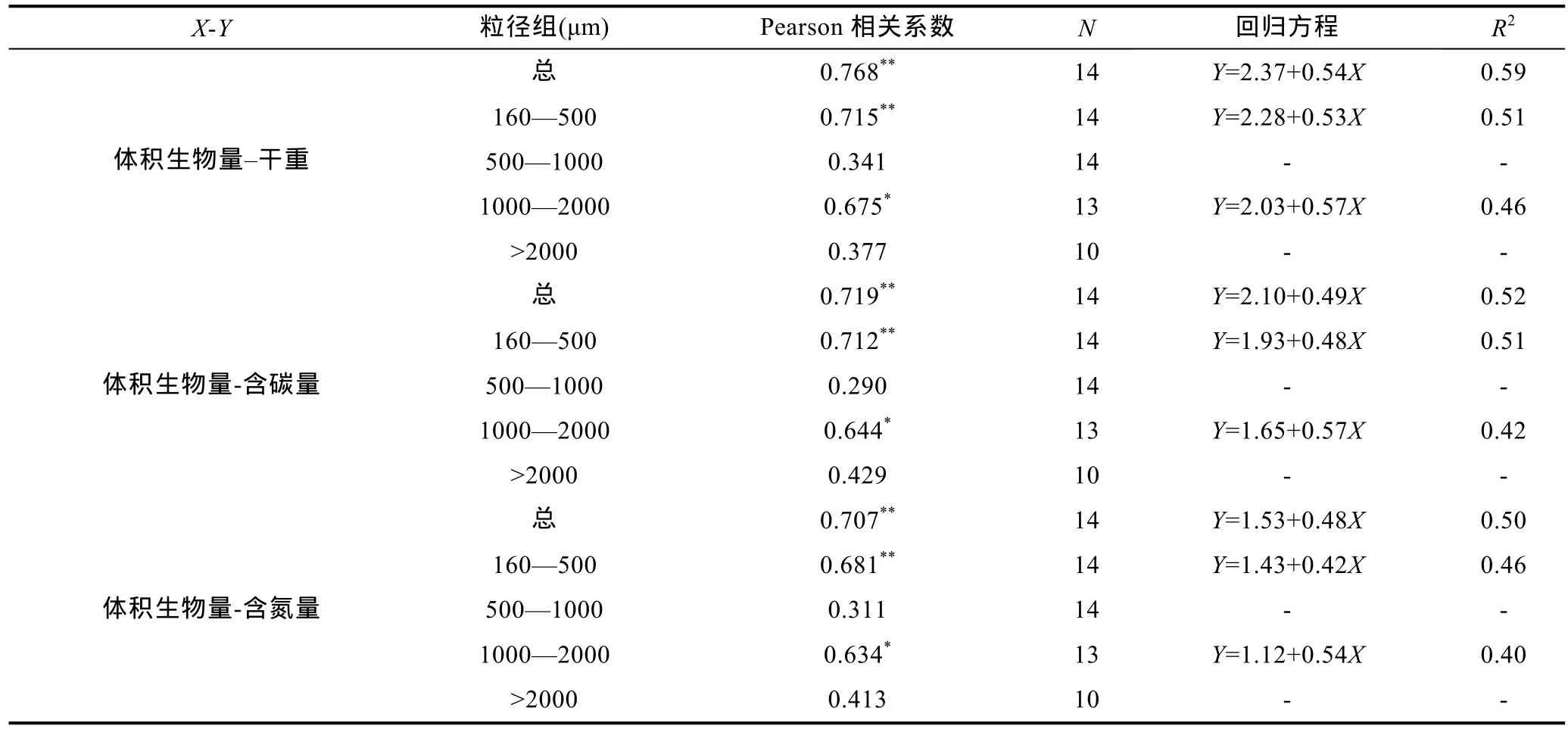
表1 体积生物量和实测生物量(干重、含碳量和含氮量)的相关关系Tab. 1 Correlation of biovolume to dry mass, carbon content, and nitrogen content
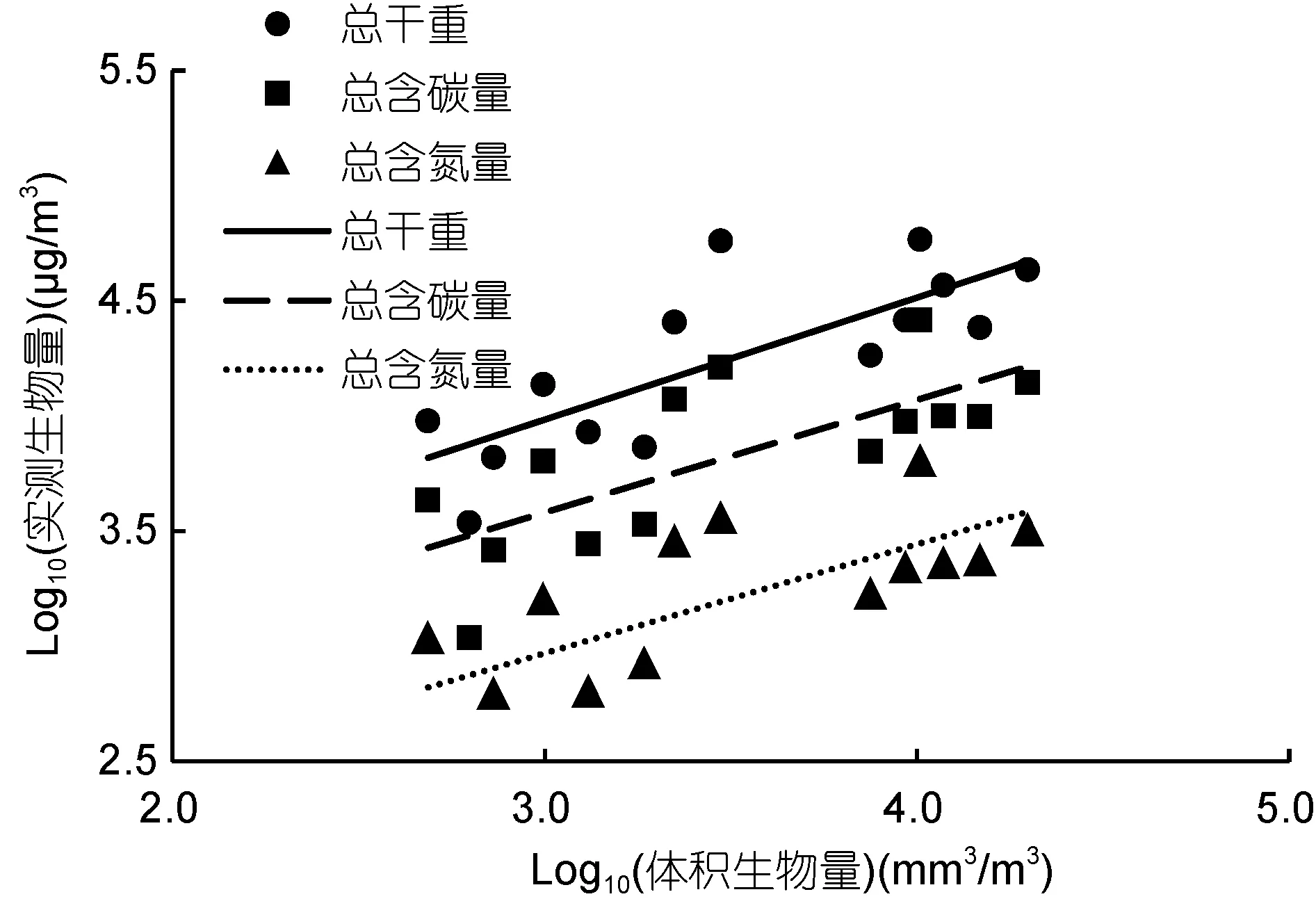
图2 体积生物量和实测生物量的回归直线Fig. 2 Regression of biovolume and measured biomass
2.2 南黄海夏季浮游动物的群落结构
2.2.1 浮游动物丰度、生物量和类群 根据ZooScan的结果, 调查海区浮游动物丰度的变化范围 为 2067.7—182125.7ind./m3, 平 均 为 (34343.0±52923.4)ind./m3, 呈现南高北低、近岸高外海低的变化趋势(图 3)。体积生物量的变化范围为 485.9—19881.7mm3/m3, 平均为(6048.7±6257.9)mm3/m3, 呈现南高北低的规律。干重、含碳量和含氮量的变化范围分别为(3.4—58.3)×103μg/m3、(1.1—26.1)×103μg/m3和(0.3—6.4)×103μg/m3, 平均值分别为(24.2±18.5)×103μg/m3、(8.9±6.7)×103μg/m3和(2.1±1.6)×103μg/m3,三者均呈现与体积生物量一致的变化规律(图3)。
本海区鉴定的浮游动物共计 15个类群, 包括夜光虫(Noctiluca scintillans)、桡足类(Copepoda)、放射虫(Radiolaria)、被囊类(Tunicata)、毛颚类(Chaetognatha)、多毛类(Polychaeta)、介形类(Ostracoda)、腹足类(Gastropoda)、水母类(Medusa)、枝角类(Cladocera)、端足类(Amphipoda)、磷虾类(Euphausiacea)、莹虾类(Luciferida)、无节幼体(Nauplius larva)和其它浮游动物等。在丰度方面, 夜光虫、桡足类和放射虫是三大优势类群, 对丰度的贡献率分别为 53.7%, 21.1%和10.7%; 在体积生物量方面, 毛颚类、夜光虫和被囊类的贡献率位居前三名, 分别为31.6%, 19.8%和17.7%。
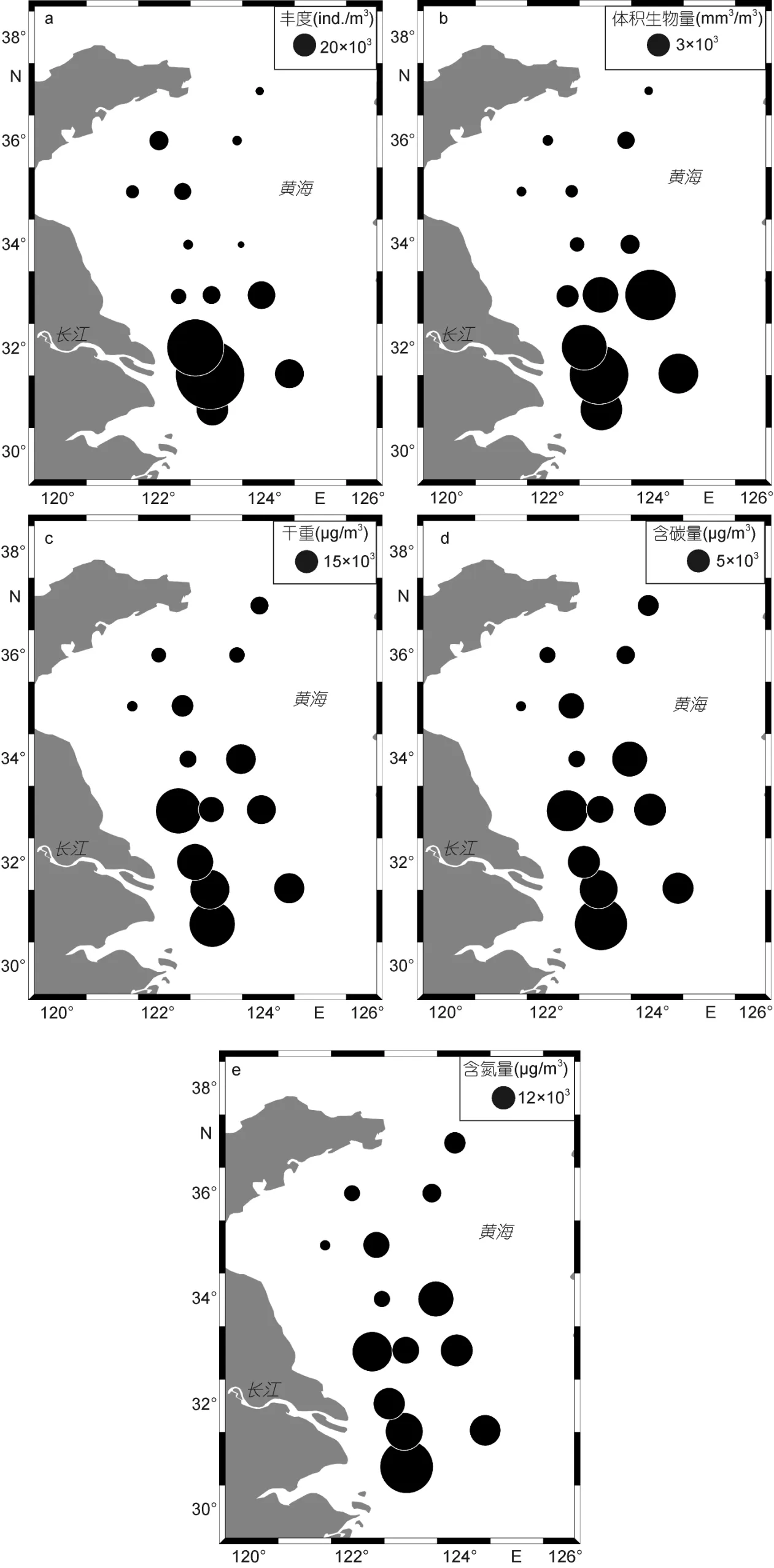
图3 浮游动物丰度和生物量的水平分布Fig.3 Horizontal distribution of zooplankton abundance and biomass
2.2.2 浮游动物组群划分 如图 4a所示, 取相似性系数为 35%, 调查站位可划分为 4个组群。33°N以北50m等深线以深的站位称之为黄海中部组群(YC)(图 4b), 该组群主要位于黄海冷水团影响范围内。33°N以北水深小于50m的站位称之为黄海近岸组群(YN)。33°N及其以南的黄海、东海交汇区又可分为黄东海交汇区组群1(YE1)和黄东海交汇区组群2 (YE2),分别包括33°N断面的站位和33°N以南的站位。
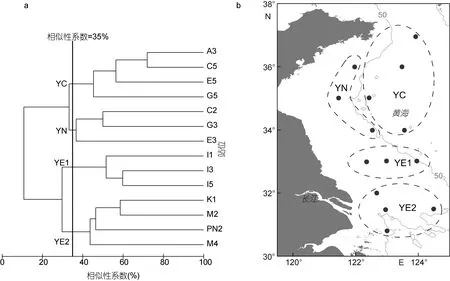
图4 调查站位浮游动物的聚类分析树状图及各组群地理分布 (b图中灰色线为50m等深线)Fig. 4 Dendrogram of cluster analysis based on zooplankton biovolume size spectra and geographical distribution of zooplankton groups
黄海中部组群具有总丰度的最低值(表 2)。桡足类是绝对的优势类群, 对总丰度的贡献率高达91.1%(图5)。在体积生物量方面, >2000μm粒径组对总体积生物量的贡献最大, 主要由磷虾类构成, 而在其它三个粒径组, 桡足类所占比例最高(图6)。
黄海近岸组群的优势类群为桡足类, 其对总丰度的贡献率为 62.7%, 其次是夜光虫, 占 19.5%(图5)。该组群具有最低的总体积生物量(表 2)。随粒径级的增加, 毛颚类和端足类所占比例增加。此外, 该组群中1000—2000μm粒径组的丰度和生物量在四个组群中均具有最小值, 主要由毛颚类组成(图6)。
黄东海交汇区组群 1的总丰度和总体积生物量均居于中间水平(表 2)。该组群胶质类浮游动物在总丰度中所占比例较高, 夜光虫所占比例较黄海近岸组群也有所升高, 桡足类仍是优势类群, 对总丰度的贡献率为33.7%, 略高于夜光虫(图5)。此外, 该组群中1000—2000μm粒径组的丰度和生物量在四个群组中均具有最大值, 主要由被囊类组成(图6)。
黄东海交汇区组群 2具有最大的总丰度值和总生物量值(表 2)。就丰度而言, 夜光虫是该组群的绝对优势类群, 占总丰度的比例高达 62.2%, 其次是放射虫, 贡献率为 13.3%, 桡足类位居第三, 仅占12.4%(图5)。就体积生物量而言, 500—1000μm粒径组的贡献最大, 主要由夜光虫组成; >2000μm粒径组的贡献与之相当, 主要由毛颚类组成(图6)。
3 讨论
3.1 体积生物量与干重、含碳量、含氮量的相关性
利用浮游动物体型参数(体长、面积或体积等)间接推算生物量的方法在国内外已有较多的研究(Wiebe et al, 1975; Uye, 1982; Lehette et al, 2009; 孙晓霞等, 2014), 但这些研究主要集中在不同的浮游动物类群方面(Hernández-León et al, 2006; Di Mauro et al, 2011; 孙松等, 2013)。本研究中, 基于ZooScan获得的浮游动物混合样品的总体积生物量结果与传统方法实测获得的干重、含碳量和含氮量均具有显著的相关关系, 说明对于浮游动物混合样品, 由体型参数推算生物量的方法是可行的。
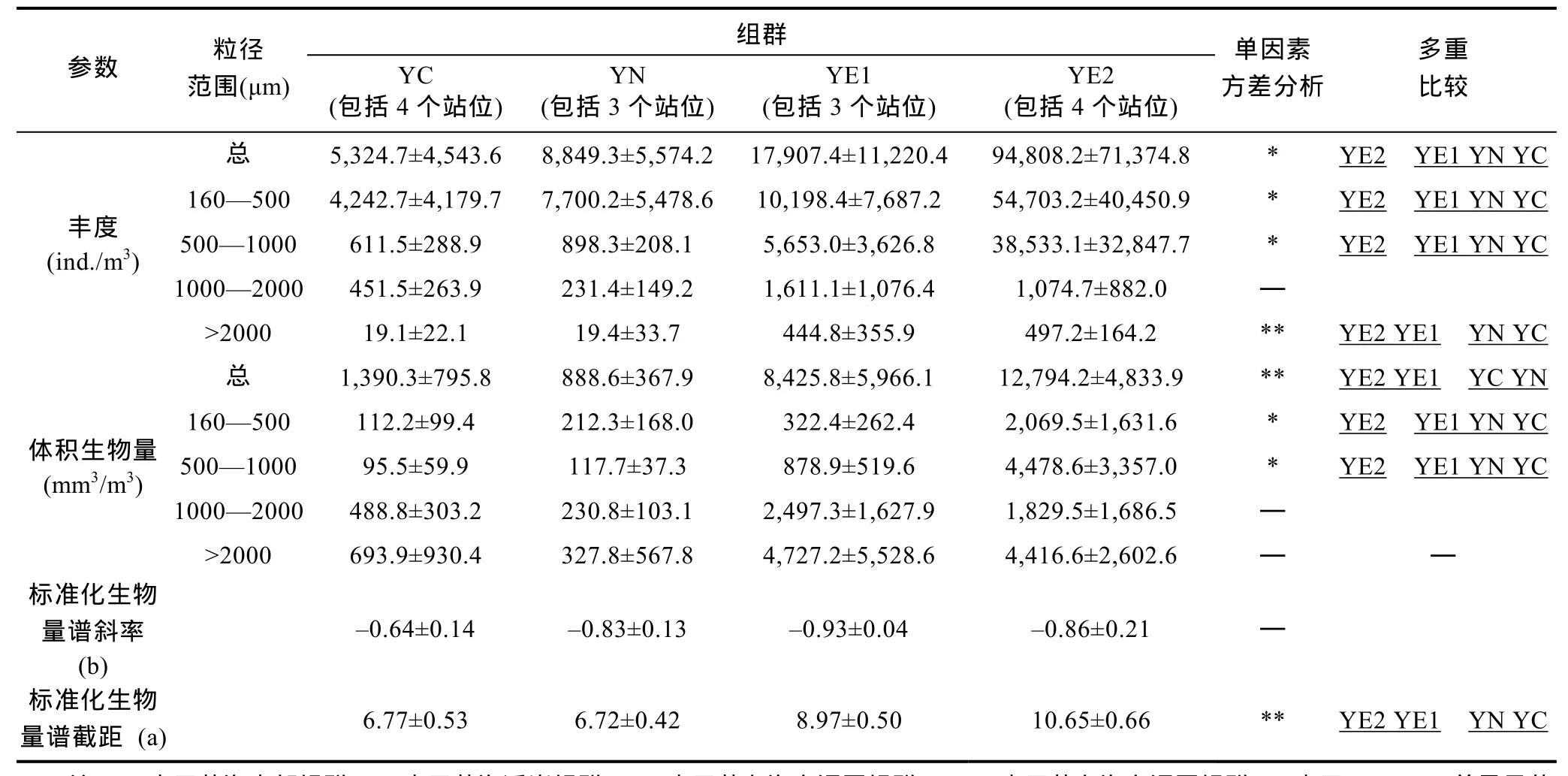
表2 四个组群的浮游动物丰度和体积生物量的比较Tab. 2 Comparison in zooplankton abundance and biovolume among the four groups
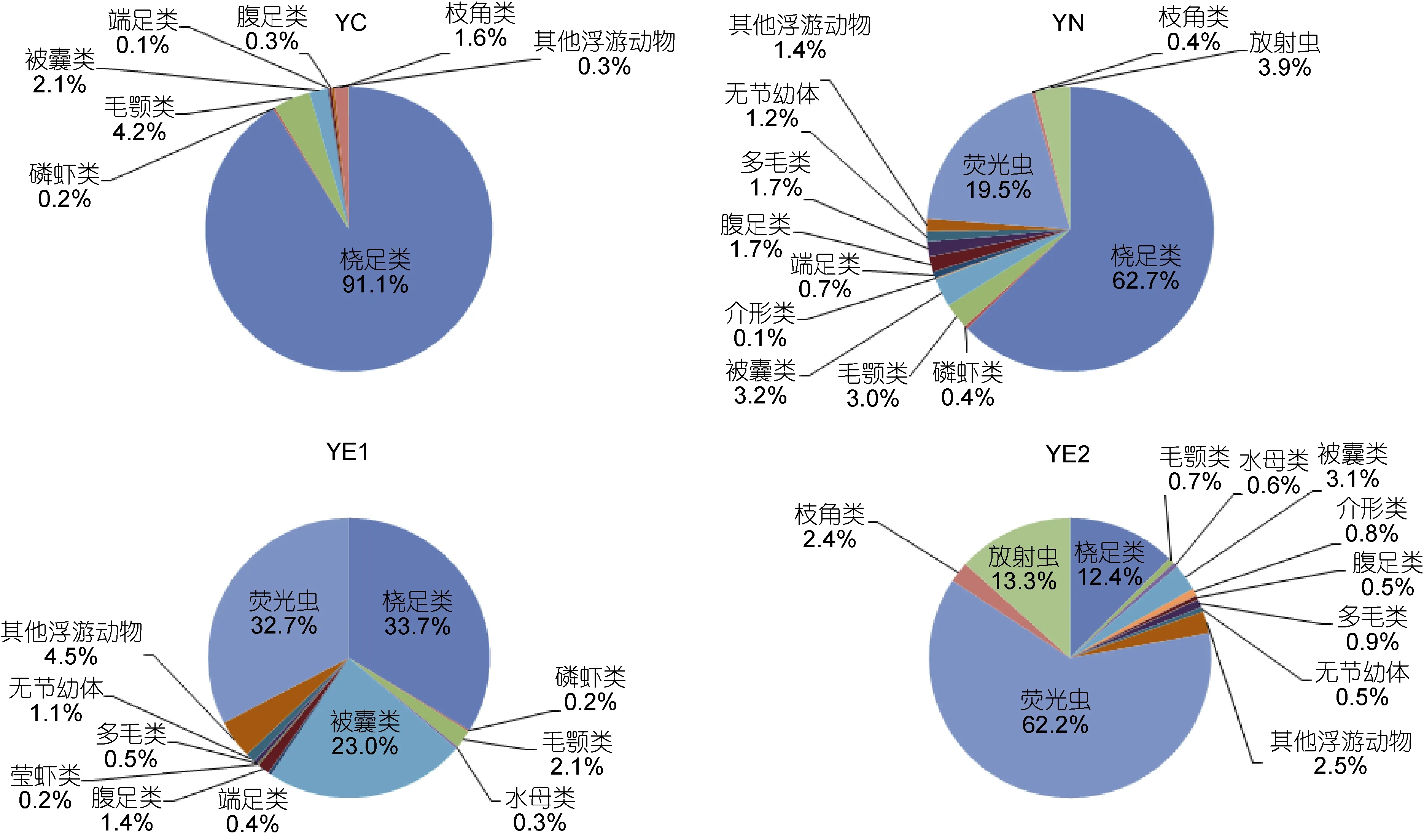
图5 四个组群浮游动物的主要类群组成(基于丰度)Fig. 5 Composition among major zooplankton groups in the four groups (in abundance)
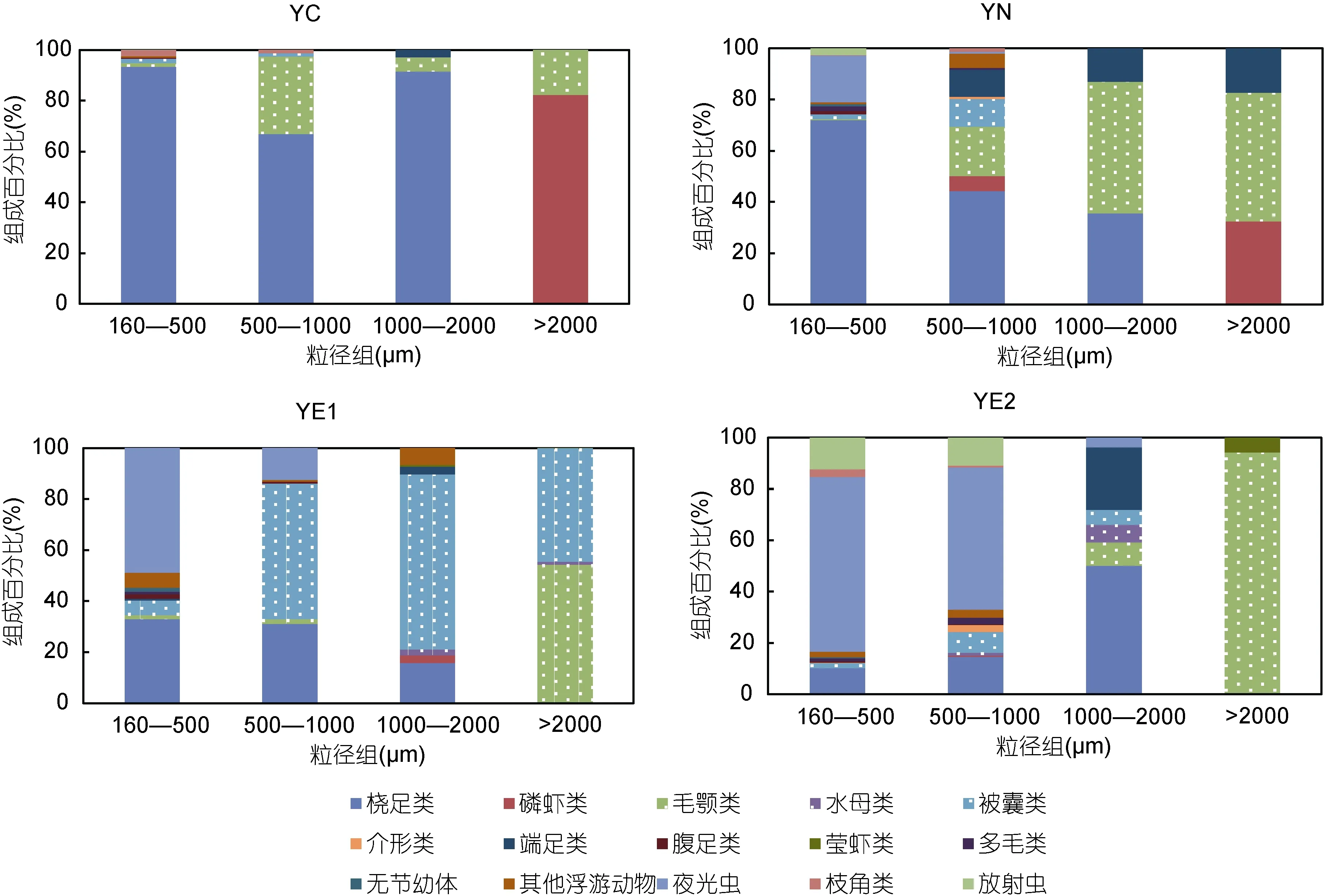
图6 四个组群不同粒径组的类群组成(基于体积生物量)Fig. 6 Biovolume composition of zooplankton taxonomic groups in each size class for the four groups
体积生物量与实测干重、含碳量和含氮量的相关性在有些粒径组并未呈现, 这可能是由于类群组成的差异所导致。在>2000μm粒径组, 毛颚类和被囊类等胶质类浮游动物的体积生物量占有绝对优势, 由于胶质类浮游动物含水量大, 影响了该粒径组的体积(Bode et al, 1998; 毕永坤, 2012; Dai et al, 2016),因此该粒径组未呈现相关性可能是由于胶质类浮游动物含量较高造成的。在500—1000μm粒径组, 也未呈现体积生物量与实测干重、含碳量和含氮量的相关性。在该粒径组, 夜光虫对总体积生物量的贡献率高达48%, 其具有较高的含水量(寇建山, 2011)。被囊类和水母类等含水量较高的胶质浮游动物对该粒径组总体积生物量的贡献率也较高, 而桡足类等含水量较少的非胶质类浮游动物占总体积生物量的比例较小。由此可见, 类群组成差异是影响体积生物量与实测干重、含碳量和含氮量相关与否的重要因素。
3.2 群落划分
本研究将南黄海浮游动物群落划分为四个组群:黄海中部组群、黄海近岸组群、黄东海交汇区组群1和 2。其中, 黄海中部组群和黄海近岸组群与以往研究结果相一致。在过去对南黄海浮游动物群落的研究中, 多采用大型浮游生物网网采样品, 并基于丰度和环境要素将南黄海浮游动物划分为黄海中部群落和黄海沿岸群落(郑执中, 1965; 陈清潮等, 1980; 左涛等, 2005)。而本研究基于ZooScan图像技术分析了中型浮游生物网的样品, 并依据浮游动物的体积生物量进行划分, 得到了与以往研究相近的结果。这既验证了利用 ZooScan图像技术进行群落结构分析的结果是可信的, 同时也充分说明, 南黄海中部群落和沿岸群落是相对稳定的两个浮游动物群落(郑执中,1965; 中国科学院海洋研究所浮游生物组, 1977; 陈清潮等, 1980; 左涛等, 2005)。
本研究中的黄东海交汇区组群1和2在地理分布上, 位于左涛(2003)划分的黄东海交汇水混合群落范围内。陈清潮等(1980)也曾指出, 在黄海、东海具有相对稳定性的群落之间, 还存在一个混合群落。然而,我们发现, 黄东海交汇区组群1和2在类群组成方面存在较大差异。就丰度而言, 被囊类在黄东海交汇区组群1中对总丰度的贡献率为23.0%, 远高于其在黄东海交汇区组群2中的贡献率(3.1%)。而夜光虫在黄东海交汇区组群2中占有绝对优势, 其对总丰度的贡献率高达 62.2%, 远远超过其在黄东海交汇区组群 1中的比例(32.7%)。在体积生物量方面, 黄东海交汇区组群1中被囊类的生物量(平均为4295.5mm3/m3)远远超过黄东海交汇区组群 2(平均为 510.1mm3/m3), 而黄东海交汇区组群 2中的毛颚类生物量(平均为4331.5mm3/m3)远高于黄东海交汇区组群 1(平均为2585.7mm3/m3)。所以本研究中将黄东海交汇区组群划分为组群1和组群2。导致这一结果的可能原因是:一方面, 研究表明, 采样过程中使用大型浮游生物网会低估中小型浮游动物个体(Hopcroft et al, 2001;Turner, 2004; 王晓, 2012), 而中型浮游生物网对较小个体的采集效率更高(左涛等, 2008; 李雨苑, 2014)。以往研究多使用大型浮游生物网, 对夜光虫等类群的采集效率较低, 而本研究使用中型浮游动物网样品, 结果表明, 夜光虫在黄东海交汇区组群2中对浮游动物总丰度的贡献率达到很高的水平。另一方面可能是由于季节的差异。本研究中的黄东海交汇区组群2位于长江口区域, 具有相对低的表层盐度, 受长江冲淡水的影响显著。长江口区域浮游动物生物量的季节变化与径流量具有相关性, 丰水期浮游动物的生物量高于枯水期(陈亚瞿等, 1995; 徐兆礼, 2005)。本研究的调查时间为8月份, 属于丰水期, 长江径流比较强盛, 带来大量丰富的营养盐(齐衍萍, 2008; 孔维,2014), 为浮游动物的生长繁殖提供了适宜的条件,有利于浮游动物很好的发展, 使得黄东海交汇区组群 2的浮游动物丰度和生物量远远高于黄东海交汇区组群 1。因此不同于以往研究的结果, 本研究将黄东海交汇区进一步划分为黄东海交汇区组群 1和黄东海交汇区组群2。
4 结论
本研究表明浮游动物混合样品的体积生物量与实测干重、含碳量和含氮量具有极显著的相关关系,说明将 ZooScan图像技术用于浮游动物混合样品中由体型参数估算生物量具有可行性。进而基于ZooScan图像技术, 将南黄海夏季的浮游动物划分为四个组群: 黄海中部组群、黄海近岸组群、黄东海交汇区组群1和2。其中, 黄海中部组群和黄海近岸组群是具有相对稳定性的两个群落, 与历史研究一致。而黄东海交汇区组群1和2的范围受采样调查中使用的浮游生物网型和季节变化的影响。本研究表明, 利用 ZooScan图像技术能够快速获取浮游动物的丰度和体积生物量信息, 为我国近海浮游动物群落结构的研究提供了一种快速、可行的方法, 这对开展海洋浮游动物的定量研究具有重要意义。
致谢 感谢冯颂、孙永坤、汤宏俊、王卫成等同仁在浮游动物样品现场采集和干重测定工作中的大力帮助!感谢天津大学魏皓教授课题组提供的温、盐数据!感谢“北斗”考察船全体工作人员在采样过程中给予的无私帮助!
王 亮, 李超伦, 于 非, 2013. 冬季南黄海浮游动物群落结构及其对黄海暖流的指示. 海洋与湖沼, 44(4): 853—859
王 晓, 2012. 南黄海浮游动物群落及环境因子对其分布影响的研究. 青岛: 中国海洋大学博士学位论文, 57—60
中国科学院海洋研究所浮游生物组, 1977. 中国近海浮游生物的研究. 全国海洋综合调查报告, 第 8册. 北京: 中华人民共和国科学技术委员会海洋组海洋综合调查办公室编辑出版, 1—159
孔 维, 2014. 2011年夏、秋季黄海WP2型网采浮游动物的群落特征. 青岛: 中国海洋大学硕士学位论文, 29—31
左 涛, 2003. 东、黄海浮游动物群落结构研究. 青岛: 中国科学院研究生院(海洋研究所)博士学位论文, 13—47
左 涛, 王 荣, 陈亚瞿等, 2005. 春季和秋季东、黄海陆架区大型网采浮游动物群落划分. 生态学报, 25(7):1531—1540
左 涛, 王 俊, 唐启升等, 2008. 秋季南黄海网采浮游生物的生物量谱. 海洋学报, 30(5): 71—80
代鲁平, 李超伦, 孙晓霞等, 2014. 2012年冬季菲律宾海浮游动物丰度和生物量的水平分布. 海洋与湖沼, 45(6):1225—1233
毕永坤, 2012. 基于ZooScan技术的浮游动物体形参数和生物量关系研究. 青岛: 中国科学院研究生院(海洋研究所)硕士学位论文, 17—48
齐衍萍, 2008. 夏、冬季黄东海浮游动物群落生态学研究. 青岛: 中国海洋大学硕士学位论文, 30—41
孙 松, 毕永坤, 孙晓霞, 2013. 基于图像技术的胶州湾浮游动物优势种体型参数与生物量转换关系研究. 海洋与湖沼, 44(1): 15—22
孙晓霞, 孙 松, 2014. 海洋浮游生物图像观测技术及其应用.地球科学进展, 29(6): 748—755
孙晓霞, 孙 松, 王世伟等, 2011. 图像自动识别技术在胶州湾浮游动物生态学研究中的应用. 海洋与湖沼, 42(5):647—653
李雨苑, 2014. 2012年春、秋季黄海WP2型网采浮游动物的群落特征. 青岛: 中国海洋大学硕士学位论文, 4—37
陈亚瞿, 徐兆礼, 王云龙等, 1995. 长江口河口锋区浮游动物生态研究Ⅰ生物量及优势种的平面分布. 中国水产科学,2(1): 49—58
陈洪举, 刘光兴, 2009. 2006年夏季长江口及其邻近水域浮游动物的群落结构. 北京师范大学学报(自然科学版), 45(4):393—398
陈清潮, 陈亚瞿, 胡雅竹, 1980. 南黄海和东海浮游生物群落的初步探讨. 海洋学报, 2(2): 149—157
郑执中, 1965. 黄海和东海西部浮游动物羣落的结构及其季节变化. 海洋与湖沼, 7(3): 199—204
徐兆礼, 2005. 长江口邻近水域浮游动物群落特征及变动趋势.生态学杂志, 24(7): 780—784
寇建山, 2011. 青岛南部近海浮游动物群落结构研究. 青岛:中国海洋大学硕士学位论文, 30—35
Bode A, Álvarez-Ossorio M T, González N, 1998. Estimations of mesozooplankton biomass in a coastal upwelling area off NW Spain. Journal of Plankton Research, 20(5):1005—1014
Culverhouse P F, Williams R, Reguera B et al, 2003. Do experts make mistakes? A comparison of human and machine indentification of dinoflagellates. Marine Ecology Progress Series, 247: 17—25
Dai L P, Li C L, Yang G et al, 2016. Zooplankton abundance,biovolume and size spectra at western boundary currents in the subtropical North Pacific during winter 2012. Journal of Marine Systems, 155: 73—83
Di Mauro R, Cepeda G, Capitanio F et al, 2011. Using ZooImage automated system for the estimation of biovolume of copepods from the northern Argentine Sea. Journal of Sea Research, 66(2): 69—75
Field J G, Clarke K R, Warwick R M, 1982. A practical strategy for analysing multispecies distribution patterns. Marine Ecology Progress Series, 8: 37—52
García-Comas C, Chang C Y, Ye L et al, 2014. Mesozooplankton size structure in response to environmental conditions in the East China Sea: How much does size spectra theory fit empirical data of a dynamic coastal area?. Progress in Oceanography, 121: 141—157
Hernández-León S, Montero I, 2006. Zooplankton biomass estimated from digitalized images in Antarctic waters: A calibration exercise. Journal of Geophysical Research,111(C5): C05S03
Hopcroft R R, Roff J C, Chavez F P, 2001. Size paradigms in copepod communities: a re-examination. Hydrobiologia,453(1): 133—141
Lehette P, Hernández-León S, 2009. Zooplankton biomass estimation from digitized images: a comparison between subtropical and Antarctic organisms. Limnology and Oceanography: Methods, 7(4): 304—308
Marcolin C D R, Schultes S, Jackson G A et al, 2013. Plankton and seston size spectra estimated by the LOPC and ZooScan in the Abrolhos Bank ecosystem (SE Atlantic). Continental Shelf Research, 70: 74—87
Turner J T, 2004. The importance of small planktonic copepods and their roles in pelagic marine food webs. Zoological Studies, 43(2): 255—266
Uye S I, 1982. Length-weight relationships of important zooplankton from the Inland Sea of Japan. Journal of the Oceanographical Society of Japan, 38(3): 149—158
Wang R, Zuo T, 2004. The Yellow Sea warm current and the yellow sea cold bottom water, their impact on the distribution of zooplankton in the southern Yellow Sea. Journal of the Korean Society of Oceanography, 39(1): 1—13
Wiebe P H, Boyd S, Cox J L, 1975. Relationships between zooplankton displacement volume, wet weight, dry weight,and carbon. Fishery Bulletin, 73(4): 777—786
Zuo T, Wang R, Chen Y Q et al, 2006. Autumn net copepod abundance and assemblages in relation to water masses on the continental shelf of the Yellow Sea and East China Sea.Journal of Marine Systems, 59(1—2): 159—172
