华重楼根际土芽胞杆菌多样性研究
2016-01-15陈倩倩刘波刘国红车建美龚海艳
陈倩倩+刘波+刘国红+车建美+龚海艳

摘 要 为了解华重楼根际芽胞杆菌种群多样性信息,本研究采用稀释平板法分离福建省光泽县华重楼品种根际的芽胞杆菌,并对其进行16S rRNA序列分析。结果表明:从华重楼根际共分离到17个形态差异的芽胞杆菌菌株;16S rRNA序列分析表明,17个菌株鉴定为8个种,归属于4个属,芽胞杆菌属(Bacillus)、赖氨酸芽胞杆菌属(Lysinibacillus)、类芽孢杆菌属(Paenibacillus)和绿芽胞杆菌属(Viridibacillus),其中芽胞杆菌属的种类和数量最多。经抑菌试验分析,芽孢杆菌属的特基拉芽孢杆菌FJAT-43012对尖孢镰刀菌具有抑制作用。本研究结果表明,华重楼根际芽胞杆菌种群多样性较为丰富。本研究对芽胞杆菌资源的开发和利用提供良好的实验材料和理论基础。
关键词 芽胞杆菌 ;华重楼 ;根际土壤 ;多样性
分类号 Q938.1
Diversity of Culturable Bacillus Species from Paris Linnaeus
Rhizosphere Soil
CHEN Qianqian LIU Bo LIU Guohong CHE Jianmei GONG Haiyang
(1 Agrobiological Resource Research Institute,
Fujian Academy of Agriculture Sciences, Fuzhou, Fujian 350003
2 Ministry of Education Key Laboratory of Biopesticide and Chemical Biology,
Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Abstract The aim of this study was to determine the diversity of the cultivable Bacillus species population in the rhizosphere of Paris Linnaeus. Bacillus species were isolated from the soil samples from Guangze, Fujian Province by using dilution plating technique on Nutrient-Agar medium. 17 isolates were obtained through morphological difference, andidentified by 16S rRNA. Phylogenetic analysis based on 16S rRNA gene sequencing showed that the 17 isolates were grouped into 4 genera (Bacillus, Lysinibacillus, Paenibacillus and Viridibacillus) with 9 distinct species. All of these species were owned to the genus Bacillus. B.tequilensis FJAT-43012 possessed significantly inhibitory activities against Fusarium oxysporum. In conclusion, the result of this study showed that the population diversity of the cultivable bacteria was abundant andvarious. The findings providean important scientific base for the development and utilization of Bacillus resources.
Keywords Bacillus ; Paris Linnaeus ; rhizosphere soil ;diversity
华重楼(Paris Linnaeus)属百合科多年生草本植物,又名灯台七、七叶一枝花等,具有清热解毒、消肿止痛、凉肝定惊等功效,此外还有止血、抗肿瘤、免疫调节及保护心血管等多方面的生理活性,是一些重要中成药和新药如云南白药、宫血宁等主要成分之一[1-2],开发和利用这一自然资源有十分重要的意义。我国为该属植物的分布中心之一,共有19种,种类多,广泛分布于福建、云南、四川、江苏、安徽、浙江、江西等省区[3],福建是华重楼的主要分布区。华重楼根茎多年生,茎叶当年倒苗,繁殖率低,从发芽到药用,一般需5年以上,种子存在二次休眠,资源再生慢[4]。药用植物多与微生物共生,根际微生物通过产生各种代谢产物影响植物生长和营养物质的吸收、固氮或植物激素的产生[5-7]。植物根际是土壤-植物生态系统物质交换的环境,土壤细菌既是土壤微生物区系的重要组成部分,也是土壤物质流和能量流的主要推动者[8]。
芽孢杆菌是土壤和植物微生态的优势微生物种群,其特征是能够产生抗逆性强的芽孢,这对菌体的生存、产品加工及其在环境中的存活和定殖都十分有利,是一种理想的生防菌,许多性状优良的拮抗菌株已成功地应用于植物病害的生物防治中[9]。分离、筛选各种不同的芽胞杆菌为生物农药的开发等提供了基础资源[10],具有重要意义。土壤是芽胞杆菌主要的来源,对华重楼根系土芽胞杆菌的研究,可揭示微生物种群构成,推动促生菌的发掘,有效解决资源保护和开发利用的矛盾问题。本次试验从采集自福建省南平市光泽县的华重楼根系土中分离芽胞杆菌,对其进行系统分类,探究该土壤是否含有促进华重楼生长的特殊功能芽孢杆菌。
1 材料与方法
1.1 材料
1.1.1 供试土样
本次试验所用土样为苏海兰于2015年4月采集。采集地点为福建省南平市光泽县用刮刀轻轻刮取附着在华重楼根表面的土壤,视为根际土壤。土壤样品采集后放入无菌袋内,置于4℃冰箱备用。
1.1.2 培养基
NA培养基:牛肉浸膏0.3%,酵母浸膏0.1%,蛋白胨0.5%,葡萄糖1%,琼脂1.7%,pH 7.0~7.2。
LB培养基:胰蛋白胨 1%,酵母浸粉0.5%,NaCl 0.5%,琼脂 1.7%,pH 7.0~7.2。
发酵液体培养基:葡萄糖 0.5%,牛肉膏 0.3%,蛋白胨 1%,MgSO4·7H2O 0.02%,pH 7.0~7.2。
1.2 方法
1.2.1 菌株分离纯化
将采自于福建省南平市光泽县华重楼根系土,进行系列10倍梯度稀释后,置到80℃的水浴中加热10 min,然后涂布于LB培养基,30℃培养3~5 d后,挑取平板上的单菌落进行连续划线纯化保存菌株。
16S rRNA扩增:DNA提取按照DNA提取试剂盒(generay bitehch)操作。以芽胞杆菌基因组为模板,16S rRNA扩增采用细菌通用16S rRNA引物[11]27F (5′-GAGTTTGATCCTGGCTCAG-3′)和1492R(5′-ACGGCTACCTTGTTACGACTT-3′),由上海博尚生工生物工程技术服务有限公司合成。PCR反应试剂:10×Buffer, dNTP(10 mM/each),Taq酶(2.5 U/μL,上海博尚生工生物工程技术服务有限公司),100 bp Marker(上海英骏生物技术有限公司)。扩增条件为 94℃,预变性4 min;94℃变性1 min,50℃退火1 min,72℃延伸1 min,进行35个循环;72℃延伸10 min。PCR产物的检测:取各模板的全部 PCR产物,加入相应量的6×Loading Buffer,点样于1.0%的琼脂糖凝胶中,以100 bp plus Marker作为标准分子量,100 V电压,电泳40 min,核酸染料染色。
测序由上海博尚公司完成,序列同源性比对在EzTaxon[12](http://eztaxon-e.ezbiocloud.net/)进行。
1.2.2 芽胞杆菌的系统发育分析
根据对分离得到的芽胞杆菌16S rRNA基因序列鉴定的结果,利用ClustalX 1.81软件进行序列比对分析[13],采用软件Mega 6.0对芽胞杆菌的16S rRNA基因序列构建聚类[14-15]。使用邻接法 (Neighbor Joining)进行序列分析和系统发育树的建立。
1.2.3 FJAT-43012对尖孢镰刀菌FJAT-30512的抑制实验
将FJAT-43012和FJAT-30512在30℃、170 r/min下分别培养2和3 d。吸取尖孢镰刀菌FJAT-30512菌悬液1.0 mL,加入到熔化并冷却到50℃的100 mL 0.9%PDA培养基中,混匀后作为上层培养基,倾覆在已凝固的PDA培养基上。待上层培养基凝固后,待平板冷却后在平板中间打直径6 mm孔,注入FJAT-43012发酵液上清100 μL,以加无菌水为对照,每个处理3次重复,30℃培养2 d,测抑菌圈直径。
2 结果与分析
2.1 华重楼根际土壤中芽胞杆菌的分离鉴定
从福建省南平市光泽县华重楼的根际土中分离到17株芽胞杆菌,菌落形态见图1。根据菌落形态特征,包括菌落颜色、表面干湿度、是否光滑、是否有光泽、边缘是否整齐等,对17株分离芽胞杆菌进行分析,可分为10大类。其中FJAT-42999、FJAT-43004、FJAT-43006:菌落湿润,呈白色,表面光滑、圆形扁平、边缘波形、不透明;FJAT-43002、FJAT-43003、FJAT-43010:菌落淡黄色,圆形扁平、湿润、边缘整齐、不透明;FJAT-43001:菌落点状,呈淡黄色,光滑而粘稠、圆形凸起、边缘整齐、透明;FJAT-43004:菌落湿润,呈黄色,湿润、圆形隆起、边缘整齐、不透明;FJAT-43000和FJAT-43009:菌落呈黄色,粗糙、扁平、边缘波形、不透明;FJAT-43005、FJAT-43007和FJAT-43008:菌落粗糙,呈淡黄色,有褶皱、边缘波形、不透明;FJAT-43011:菌落呈黄色,粗糙、根状、扁平、不透明;FJAT-43012:菌落干燥,呈黄色,有褶皱、圆形扁平、边缘整齐、透明;FJAT-43013:菌落湿润,呈黄色,粗糙、圆形扁平、边缘整齐、不透明;FJAT-43014和FJAT-43015:菌落干燥,有褶皱、圆形扁平、边缘裂片、不透明。
利用细菌16S rRNA通用引物27F和1492R进行PCR扩增,在1 500 bp处有特异性条带。测序结果与Ez-Taxon数据库中16S rRNA序列比对分析。17株芽胞杆菌与GenBank数据库中已报道菌株具有较高的相似性(≥98%),17株芽胞杆菌鉴定为4属9个种,分别为芽胞杆菌属(Bacillus)的简单芽胞杆菌(B. simplex)、食丁酸芽胞杆菌(B. butanolivorans)、惠州芽胞杆菌(B. huizhouensis)、炭疽芽胞杆菌(B. anthracis)、特基拉芽胞杆菌(B. tequilensis)和图瓦永芽胞杆菌(B. toyonensis);赖氨酸芽胞杆菌属(Lysinibacillus)的解木糖赖氨酸芽胞杆菌(L. xylanilyticus);类芽孢杆菌属(Paenibacillus)的土地类芽胞杆菌(P. terrigena);绿芽胞杆菌属(Viridibacillus)的内德绿芽胞杆菌(V. arenosi),均属于芽胞杆菌科(Bacillaceae)。
2.2 华重楼根际芽胞杆菌数量分析
通过表1数据可以得出,在华重楼的根基土壤中,芽胞杆菌属的含量为3.7×105 cfu/g,绿芽胞杆菌属含量为4×104 cfu/g,赖氨酸芽胞杆菌属的含量为3×105 cfu/g,类芽胞杆菌属的含量为5×104 cfu/g。芽孢杆菌属的含量最高,种类也最丰富,其次为赖氨酸芽孢杆菌属。
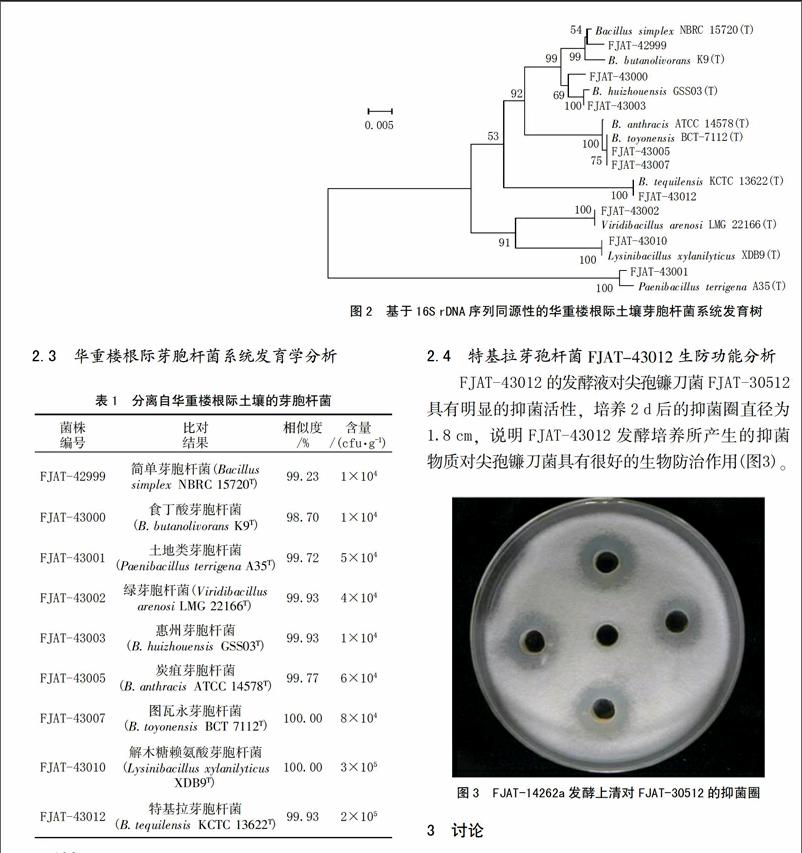
2.3 华重楼根际芽胞杆菌系统发育学分析
根据系统进化树(图2),可见所鉴定的9种芽胞杆菌主要分布于5个分支上,为此可将其可归结为5小类:B.simplex、B. butanolivorans或B. butanolivorans:FJAT-42999、FJAT-43000、FJAT-43003;B. toyonensis或B. anthracis:FJAT-43005、FJAT-43007;B. tequilensis:FJAT-43012;Paenibacillus terrigena:FJAT-43001;Viridibacillus arenosi或Lysinibacillus xylanilyticus:FJAT-43002、FJAT-43010。
2.4 特基拉芽孢杆菌FJAT-43012生防功能分析
FJAT-43012的发酵液对尖孢镰刀菌FJAT-30512具有明显的抑菌活性,培养2 d后的抑菌圈直径为1.8 cm,说明FJAT-43012发酵培养所产生的抑菌物质对尖孢镰刀菌具有很好的生物防治作用(图3)。
3 讨论
自然界中的植物与微生物共生,而根际是微生物与植物相互作用的微环境。微生物利用植物根系分泌的代谢产物及脱落物中的物质,如糖类、氨基酸和酶等为营养微生物自身生长和繁殖[16]。在这种营养较为丰富的环境中,微生物的数量和群落远高于散土,其中细菌对根际物质的利用率和敏感性高于放线菌、真菌、藻类和原生动物等,从而在根际中最为活跃并占主导地位,并能在植物根系定殖和共生。据伯杰细菌鉴定手册描述,芽胞杆菌属是一类产生芽胞的革兰氏阳性细菌,菌体呈杆状,能够形成内生芽胞,营好氧或兼性厌氧生活。Pisa等[17]发现,芽胞杆菌和假单胞菌(Pseudomonas)是典型的土壤微生物,它们能够利用植物根系的分泌物和脱落物进行快速生长繁殖,可以从植物根际中分离获得。
在华重楼根际土中分离得到4属9个种的芽胞杆菌,其中的优势种群为解木糖赖氨酸芽胞杆菌和特基拉芽胞杆菌,菌落含量分别为3×105和2×105 cfu/g。Lee等[18]由森林的腐殖土中分离出解木糖赖氨酸芽胞杆菌,这种芽胞杆菌能够降解木聚糖。木聚糖是植物细胞中半纤维素的主要成分,占植物细胞干重的35%,是一种丰富的生物质资源,是自然界中除纤维素之外含量最丰富的多糖[19],可替代石油作为新能源。野生华重楼多生于山地林下或路旁草从的阴湿处,土壤中植物枯枝败叶多,与上文Lee等的分离环境类似,因而能够分离到解木糖赖氨酸芽胞杆菌。自然界中很大一部分木聚糖未被有效利用,造成很大的资源浪费,此种芽胞杆菌具有转化这种难降解吸收资源的应用前景。特基拉芽胞杆菌具抑制细菌,如大肠杆菌生物膜形成的作用[20],华重楼根际土分离的特基拉芽胞杆菌FJAT-43012发酵液对尖孢镰刀菌FJAT-30512具有明显的抑菌活性,可能帮助华重楼抵御真菌病害。此外,绿芽胞杆菌属含量为4×104 cfu/g,这种芽胞杆菌首次于2005年在荷兰农业研究基地Drentse A分离[21],目前对这类芽胞杆菌的研究较少,功能还未明确。在华重楼的根际土壤中,共分离到四个属的可培养的芽胞杆菌,种类丰富。其中的解木糖赖氨酸芽胞杆菌FJAT-43010可作为新能源的开发利用的潜力菌株;特基拉芽胞杆菌FJAT-43012可作为农业上的生防菌。本研究对芽胞杆菌资源的开发和利用提供良好的实验材料和理论基础。
参考文献
[1] 汤海峰,赵越平,蒋永培. 重楼属植物的研究概况[J]. 中草药,1998,29(12):839-842.
[2] 袁理春,陈 翠,杨丽云,等. 滇重楼根状茎繁殖诱导初报[J]. 中药材,2004,27(7):477.
[3] 李 恒. 重楼属植物[M]. 北京: 科学出版社,1998.
[4] 李运昌. 滇重楼的无性繁殖[J]. 云南植物研究,1986,8(2):209-212.
[5] 李 祎,杨彩云,郑天凌. 自然环境中细菌的生存方式及其群落特征[J]. 应用与环境生物学报,2013,19 (4):553-560.
[6] Brown M E. Seed and root bacterization[J]. Annual Reviewof Phytopathology, 1974, 12: 311-331.
[7] Swaby R L. Stimulation of plant growth byorganic matter[J]. Journal of the Australian Institute of Agricultural Science, 1942, 8: 156-163.
[8] 张 英,朱 颖,姚 拓,等. 分离自牧草根际四株促生菌株互作效应研究[J]. 草业学报,2003,22(1):29-37.
[9] 任士伟,邢小霞,董向丽. 生防芽孢杆菌的分离筛选与初步鉴定[J]. 现代农药,2011,10(1):44-47.
[10] 胡婵娟,刘国华,吴雅琼. 土壤微生物生物量及多样性测定方法评述[J]. 生态环境学报,2011,20(6/7):1 161-1 167.
[11] 王志颖,刘 鹏,徐 艳. 2013. 抑制剂对铝胁迫下油菜根系代谢有机酸和相关酶活性的影响[J]. 环境科学学报,2013, 33(5): 1 430-1 440.
[12] RE·布坎南,NE·吉本斯.伯杰细菌鉴定手册:第8版[M]. 北京:科学出版社,1984:729-760.
[13] Thompson J D, Gibson T J, Plewniak F, et al. The CLUSTAL_X windows interface: Flexible strategies formultiple sequence alignment aided by quality analysistools[J]. NucleicAcids Research, 1997, 25: 4 876-4 882.
[14] Saitou N, Nei M. The neighbor-joining method: A newmethod for reconstructing phylogenetic trees[J]. MolecularBiology and Evolution, 1987(4): 406-425.
[15] Tamura K, Stecher G, Peterson D, et al. MEGA6: Molecularevolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013,30: 2 725-2 729.
[16] Pisa G, Magnani G S, Weber H, et al. Diversity of 16S rRNA genes from bacteria of sugarcane rhizosphere soil[J]. Brazilian Journal of Medical and Biological Research, 2011,44: 1 215-1 221.
[17] Lee C S, Jung Y T, Park S, et al. 2010. Lysinibacillus xylanilyticus sp. nov., a xylan-degrading bacterium isolated from forest humus[J]. International Journal of Systematic and Evolutionary Microbiology Feb, 2010, 60(Pt 2): 281-286.
[18] Gregory A C E, Connell A, Bolw ell P G. Xylans[J]. Biotechnology and Genetic Engineering Reviews, 1998, 15(4): 439-455.
[19] Kim O S, Cho Y J, Lee K, et al. Introducing EzTaxon-e: A prokaryotic 16S rRNA gene sequence database withphylotypes that represent uncultured species[J]. InternationalJournal of Systematic and Evolutionary Microbiology, 2012, 62: 716-721.
[20] Arun K P, Nilotpala P G M. Application of Lipopeptide Biosurfactant Isolatedfrom a Halophile: Bacillus tequilensis CH for Inhibitionof Biofilm[J]. Appl Biochem Biotechnol, 2013, 171: 1 362-1 375.
[21] Heyrman J, Rodríguez-Díaz M, Devos J, et al. Bacillusarenosi sp. nov., Bacillus arvi sp. nov. and Bacillus humi sp. nov., isolated from soil[J]. International Journalof Systematic and Evolutionary Microbiology, 2005, 55: 111-117.
