乙酰半胱氨酸口服溶液抑菌剂抑菌效力研究
2016-01-13刘艳,王志宏,曲金瑶等
通信作者:丁勃,男,研究方向:微生物检验,Tel:0531-81216552,E-mail:muscularding@126.com
乙酰半胱氨酸口服溶液抑菌剂抑菌效力研究
刘艳1,王志宏2,曲金瑶3,丁勃4
(1.烟台市食品药品检验检测中心,山东 烟台 264000;2.龙口市出入境检验检疫局,山东 龙口 265700;
3.山东绿叶制药有限公司,山东 烟台 264000;4.山东省食品药品检验研究院,山东 济南 250101)
摘要:目的对乙酰半胱氨酸口服溶液中所添加的抑菌剂抑菌效力进行确认。方法将金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、白色念珠菌和黑曲霉作为挑战菌株,分别加入到抑菌剂含量为处方浓度0、80%、100%和120%的4组乙酰半胱氨酸口服溶液中,在不同时间段检测样品中微生物的存活情况。结果不含抑菌剂的乙酰半胱氨酸不具有充分的抗菌活性,抑菌剂含量为处方浓度80%、100%和120%的乙酰半胱氨酸口服溶液,均可有效抑制微生物的生长繁殖。结论可选择1.95 mg·mL-1的苯甲酸钠和1.49 mg·mL-1的羟苯甲酯钠,复合使用,作为乙酰半胱氨酸口服溶液的抑菌剂。
关键词:乙酰半胱氨酸口服溶液;抑菌剂;抑菌效力;苯甲酸钠;羟苯甲酯钠
作者简介:刘艳,女,研究方向:保健食品、化妆品及药品检验,E-mail:liuyan4u@163.com
中图分类号:R927.1文献标识码:A
Studies on antimicrobial effectiveness of antimicrobial preservatives for Acetylcysteine Oral Solution
LIUYan1,WANGZhi-hong2,QUJin-yao3,DINGBo4
(1.YantaiCityInstituteforFoodandDrugControl,Yantai264000,China;2.LongkouEntry-ExitInspection
andQuarntine,Longkou265700,China;3.ShandongLuyePharmaceuticalCo.,Ltd.,Yantai264000,China;
4.ShandongInstituteforFoodandDrugControl,Jinan250101,China)
Abstract:ObjectiveTo demonstrate the effectiveness of antimicrobial preservatives that were added to Acetylcysteine Oral Solution.MethodsStaphylococcus aureus,Escherichia coli,Pseudomonas aeruginosa,Candida albicans and aspergillus niger were used as challenging strains and added into four sets of Acetylcysteine Oral Solution with concentrations of antimicrobial preservatives at 0,80%,100% and 120% respectively.Survival rates of microbes were then examined at different points in time.ResultsThe Acetylcysteine Oral Solution with concentrations of antimicrobial preservatives at 0,80%,100% and 120% could inhibit the growth of microorganisms sufficiently,except for the sample with no antimicrobial preservatives.Conclusion1.95 mg·mL-1 sodium benzoate and 1.49 mg·mL-1 sodium methyl parahydroxybenzoate can be used as antimicrobial preservative for Acetylcysteine Oral Solution.
Key words:Acetylcysteine Oral Solution;Antimicrobial preservatives;Antimicrobial effectiveness;Sodium benzoate;Sodium methyl parahydroxybenzoate
乙酰半胱氨酸口服液主要适用于慢性支气管炎等咳嗽有黏痰而不易咳出的患者。本品为多剂量口服制剂,主药为乙酰半胱氨酸,另含有依地酸二钠、香精、羧甲基纤维素钠和纯化水等辅料,10%氢氧化钠调节pH值在6.4左右。本品不含明显抗菌活性物质,且所含水分、pH值环境等较适宜微生物存活。《中国药典》2010年版(二部)附录ⅪⅩ N抑菌效力检查法指导原则规定,如果药物本身不具有充分的抗菌活性,那么应根据制剂特性添加适宜的抑菌剂,以防止制剂在正常储藏和使用过程中可能发生的微生物污染和繁殖使药物发生变质而对使用者造成危害,尤其是多剂量包装的制剂[1]。通过对未加入抑菌剂的乙酰半胱氨酸口服液进行抑菌效力检查试验,表明本品不能有效抑制挑战微生物的生长繁殖。因此,本品应加入适宜的抑菌剂,并对其抑菌效力的有效性进行确认。
1试验仪器、菌种与培养基
1.1试验仪器HFsafe-900生物安全柜;MJ-250-I生化培养箱;GHP-9270型隔水式恒温培养箱;INFORS AG CH-4103电热培养相;MLS-3780型压力蒸汽灭菌器;VITEK 2 DensiCHEK plus比浊仪;Sartorius CP225D电子天平。
1.2试验菌种铜绿假单胞菌(Pseudomonasaeruginosa)[CMCC(B)10104];大肠埃希菌(Escherichiacoli)[CMCC(B)44102];金黄色葡萄球菌(Staphylococcusaureus)[CMCC(B)26003];白色念珠菌 (Candidaalbicans) [CMCC(F)98001];黑曲霉(Aspergillusniger) [CMCC(F)98003]。以上菌种0代均来自中国药品生物制品检定所医学菌种保藏中心,工作使用第3代传代菌种。
1.3试验培养基胰酪胨大豆肉汤培养基(TSB,批号:3102321);胰酪胨大豆琼脂培养基(TSA,批号:3102359);沙氏葡萄糖液体培养基(批号:3102267);沙氏葡萄糖琼脂培养基(批号:3102306),均购于广东环凯微生物科技有限公司,经培养基的适用性检查,结果符合规定。
2菌液制备方法
接种大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌的新鲜培养物至胰酪胨大豆琼脂培养基,30~35 ℃培养18~24 h;接种白色念珠菌的新鲜培养物至沙氏葡萄糖琼脂培养基,20~25 ℃培养24~48 h。取上述培养物加适量的0.9%无菌氯化钠溶液,将琼脂表面的培养物洗脱,无菌操作将上述洗脱物转移至无菌试管内,加入适量0.9%无菌氯化钠溶液并采用比浊法制成每1 mL含菌数为108 cfu的菌悬液。接种黑曲霉新鲜培养物至沙氏葡萄糖琼脂斜面培养基,23~28 ℃培养5~7 d,加入含0.05%聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱,用含0.05%聚山梨酯80的0.9%无菌氯化钠溶液制成每1 mL含菌量约为108 cfu的孢子悬液。
3未添加抑菌剂样品的抑菌效力测试
对未添加抑菌剂样品的抑菌效力进行测试,考察其在未添加抑菌剂的情况下对微生物的抑制或杀灭能力。根据结果,评估本品加入抑菌剂的必要性。
取未添加抑菌剂的样品5瓶,分别接种金黄色葡萄球菌、大肠埃希菌、铜绿假单孢菌、白色念珠菌和黑曲霉孢子悬液1 mL,使接种后供试液染菌量约为105~106 cfu·mL-1,充分混匀,模拟正常的使用条件20~25 ℃避光培养。培养过程中,分别在14 d和28 d对供试品中存活的微生物进行计数。同时,以0.9%无菌氯化钠溶液作为对照,按上述操作方法进行测试。
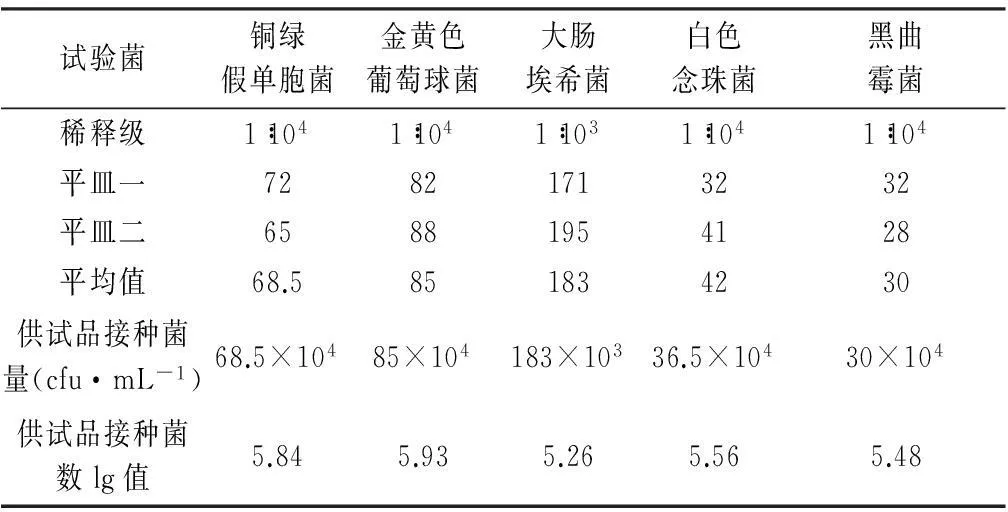
表1 样品接种菌量计数结果
3.1未添加抑菌剂样品中试验菌计数方法验证为准确计数14 d和28 d供试品中所含微生物,应对样品菌数测定方法进行验证,验证方法按《中国药典》2010年版(二部)附录Ⅺ J中计数方法的验证项下要求进行。菌数测定方法验证试验采用上述5种试验菌,细菌计数采用胰酪胨大豆琼脂培养基,真菌计数采用沙氏葡萄糖琼脂培养基。

表2 取1∶10供试液平皿法验证结果
菌落计数方法验证表明,可采用样品1∶10供试液,平皿法计数,作为未添加抑菌剂样品中试验菌计数方法。
3.2未添加抑菌剂样品的抑菌效力测试结果用pH 7.0无菌氯化钠-蛋白胨缓冲液将样品稀释成1∶10、1∶102、1∶103、1∶104等稀释级,采用平皿法进行计数。细菌、白色念珠菌选取30~300 cfu,黑曲霉选取小于100 cfu作为菌数报告依据。未添加抑菌剂样品14 d和28 d对数减少值见表3。

表3 未添加抑菌剂样品14 d和28 d对数减少值
抑菌效力试验测定结果表明,相比较0.9%的无菌氯化钠溶液,不含抑菌剂的乙酰半胱氨酸口服液对上述试验菌,整体表现出一定的抑制作用,但是对个别微生物抑制作用并不明显。例如,铜绿假单孢菌在14 d菌量减少值仅为0.701 g,不符合抑菌剂抑菌效力判定标准。而且,在药物的正常储存和使用过程中,可能会发生的微生物污染情况更为复杂。综上分析表明,乙酰半胱氨酸口服液本身并不具备充分的抗菌活性,为保证用药安全,应加入适宜的抑菌剂。
4添加抑菌剂样品的抑菌效力测试
本品以苯甲酸钠和羟苯甲酯钠联合应用,作为抑菌剂,苯甲酸钠浓度为1.95 mg·mL-1,羟苯甲酯钠1.49 mg·mL-1,在保证抑菌效能的同时降低了抑菌剂的使用总量。根据药用辅料手册记载,本品成分及包装与上述抑菌剂均无配伍禁忌[2]。本次试验拟对包含处方浓度抑菌剂(A组)、80%标准浓度抑菌剂(B组)和120%标准浓度抑菌剂(C组)3种样品进行抑菌效力试验测试。
每组样品取5瓶,分别接种金黄色葡萄球菌、大肠埃希菌、铜绿假单孢菌、白色念珠菌和黑曲霉孢子悬液1 mL,使接种后供试液染菌量约为105~106cfu·mL-1,充分混匀,模拟正常的使用条件20~25 ℃避光培养。培养过程中,分别在14 d和28 d对供试品中存活的微生物进行计数。
4.1添加抑菌剂样品试验菌计数方法验证A、B、C 3种样品中,C样品抑菌剂含量最高,因此,相同稀释级A和B样品组菌落计数方法可按C样品方法进行。方法验证结果表明(见表4),C样品1∶10供试液可采用平皿法进行菌落计数。
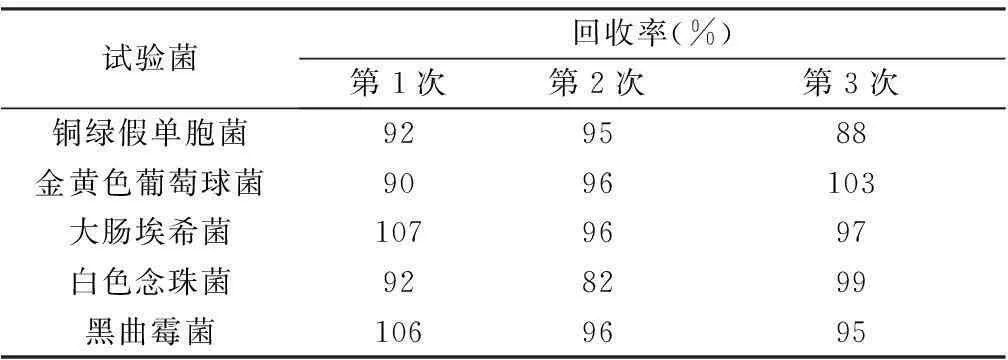
表4 C样品1∶10供试液平皿法验证结果
4.2添加抑菌剂样品的抑菌效力测试结果用pH 7.0无菌氯化钠-蛋白胨缓冲液将样品稀释成1∶10、1∶102、1∶103、1∶104等稀释级,采用平皿法进行计数。细菌、酵母菌选取30~300 cfu,真菌选取小于100 cfu作为菌数报告依据。样品14 d和28 d菌落计数结果见表5、6;与试验菌初始值比较,计算A、B、C组样品中微生物的菌数lg减少值见表7。
5结果
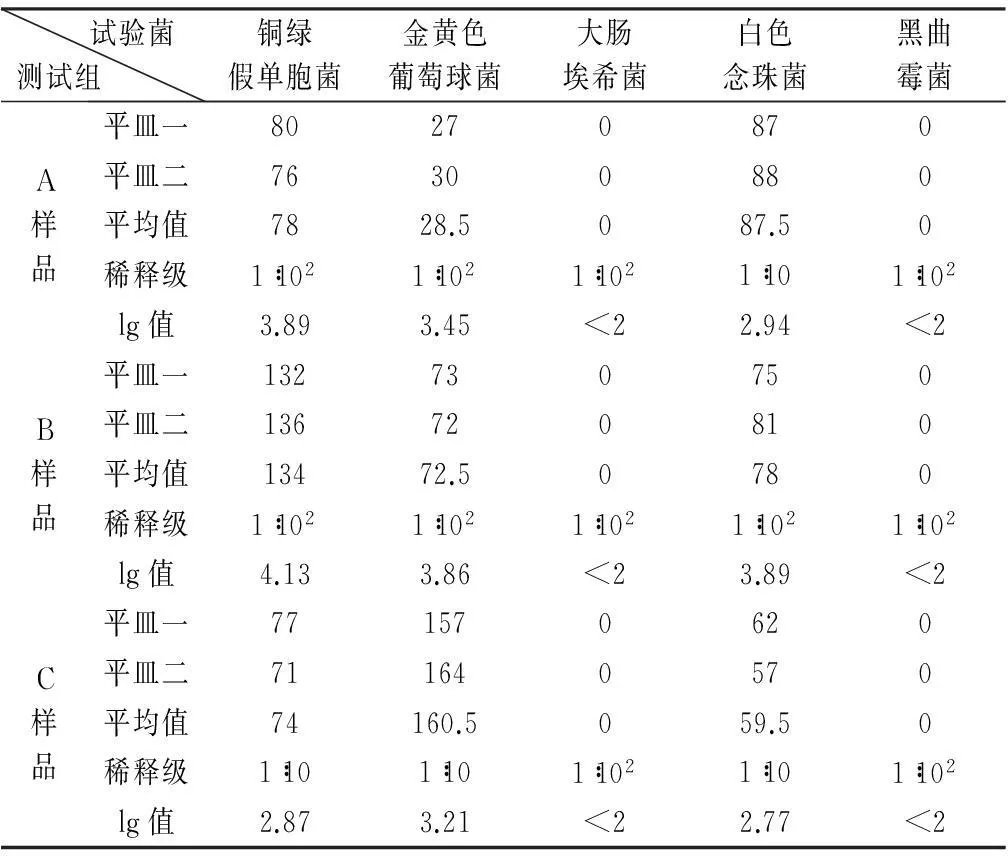
表5 添加抑菌剂样品14 d菌落计数结果

表6 添加抑菌剂样品28 d菌落计数结果
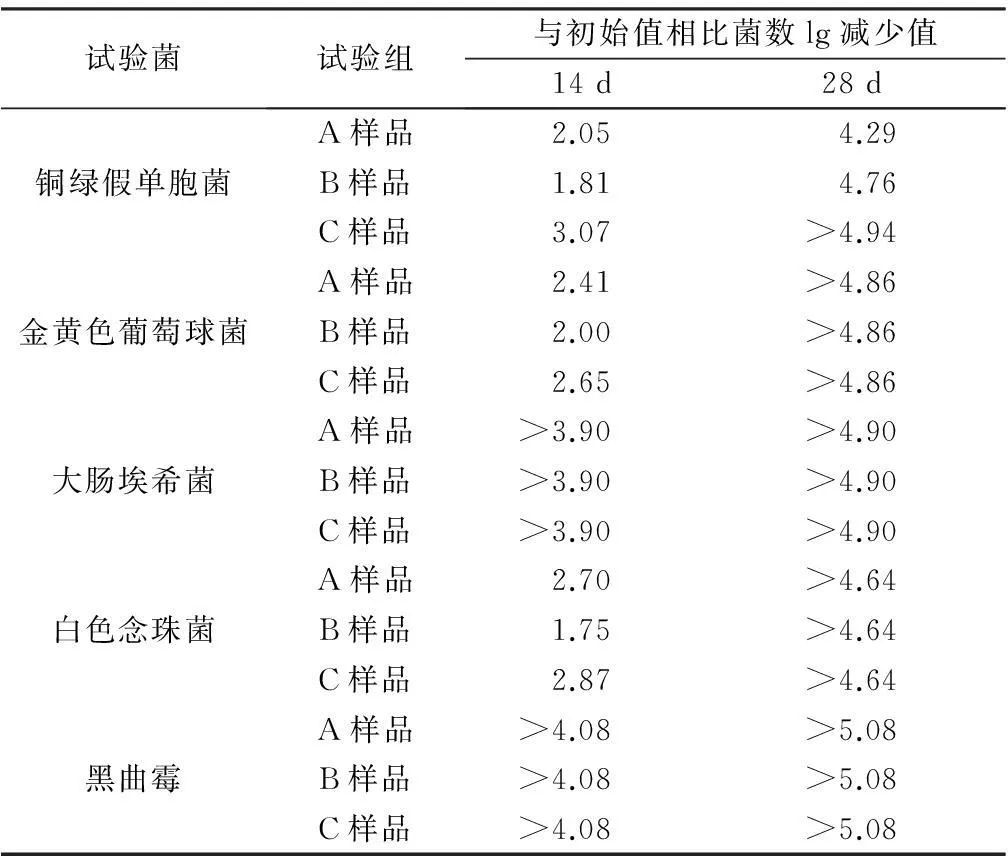
表7 添加抑菌剂样品14 d和28 d菌数lg下降值
由上表计算结果分析,含有处方浓度抑菌剂的样品(A组)、含有80%处方浓度抑菌剂的样品(B组)和含有120%处方浓度抑菌剂的样品(C组),14 d菌数下降值均不少于1.01 g,14 d到28 d菌数均不增加,按抑菌剂抑菌效力判定标准,3组乙酰半胱氨酸口服液抑菌效力均符合规定。
6讨论
6.1《中国药典》2010年版附录中,首次收载了抑菌剂效力检查法指导原则。即将颁布的《中国药典》2015年版,将抑菌效力检查法指导原则调整为抑菌效力检查法。对药物抗菌活性的确认,确保药物在贮藏和使用过程中的安全性,已经逐渐成为常规的检查项目。新标准执行之初,如何具体的去操作该项实验,许多实验人员在细节上仍较为迷茫,本文就乙酰半胱氨酸口服溶液抑菌剂的抑菌效力进行了确认,详细介绍了口服溶液抑菌效力试验的操作流程。
6.2在药物的生产过程中,抑菌剂添加量的允许偏差是±20%[5]。因此,在药物的研发阶段应对抑菌剂处方浓度的80%和120%进行有效性确认,保证抗菌活性的有效性不受投料偏差的影响。
6.3采用复合防腐剂,利用防腐剂间的协同作用,可以扩大杀菌和抑菌范围,并使作用强而迅速[6]。乙酰半胱氨酸口服溶液采用1.95 mg·mL-1的苯甲酸钠和1.49 mg·mL-1的羟苯甲酯钠复合使用,试验结果表明对革兰氏阳性菌(金黄色葡萄球菌)、革兰阴性菌(大肠埃希菌和铜绿假单孢菌)繁殖体、酵母菌(白色念珠菌)和真菌(黑曲霉)有较强的抗菌活性,有效避免样品在正常贮藏和使用过程中的微生物污染和繁殖。
参考文献:
[1]国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010:附录215-216.
[2]R.C.罗,P.J.舍斯基,P.J.韦勒.药用辅料手册[M].郑俊民译.北京:化学工业出版社,2005:447.
[3]苏德模,马绪荣,许华玉,等.药品微生物学检验技术[M].上海:华龄出版社,2007:546-550.
[4]俞树荣.微生物学和微生物学检验[M].北京:人民卫生出版社,2001:451-460.
[5]宁黎丽.眼用制剂研发过程中应关注抑菌剂的合理使用和质量控制[J].中国药学杂志,2007,42(23):1836-1838.
[6]成海平.药品研发中防腐剂的应用及质控[J].中国新药杂志,2005,14(8):954-956.
[7]丁勃,徐晓洁,谢元超.氢溴酸加兰他敏口服液添加抑菌剂筛选与抑菌效力研究[J].药物分析杂志,2011,31(12):2312-2317.
[8]胡春红,陈龙,李季平,等.苯甲酸钠和山梨酸钾的复配抑菌效果研究[J].中国调味品,2012,37(3):46-49.
