阻断钙激活钾通道对宫颈癌细胞增殖及钾通道电流的影响
2016-01-12刘玲,聂丹,范凌晔等
·论著·
阻断钙激活钾通道对宫颈癌细胞增殖及钾通道电流的影响
刘玲,聂丹,范凌晔,詹平,钱燕萍,毛熙光
(泸州医学院附属医院,四川泸州646000)
摘要:目的观察钙激活性中电导钾离子通道(IKCa1)被阻断后对宫颈癌HeLa细胞增殖及IKCa1膜电位的影响。方法分别用IKCa1阻断剂克霉唑和RNA干扰法阻断HeLa细胞的IKCa1后,用RT-PCR技术检测HeLa细胞的IKCal mRNA,MTT法检测细胞OD值,膜片钳技术检测细胞IKCa1电流。结果克霉唑阻断IKCa1后,HeLa细胞的IKCa1 mRNA表达降低、IKCa1电流减弱、细胞OD值下降,与对照组相比,P均<0.05。RNA干扰法阻断IKCa1后,Hela细胞的IKCa1 mRNA表达下降、IKCa1电流减弱、细胞OD值降低,与空白对照组和阴性转染组相比,P均<0.05。结论 阻断IKCa1能有效抑制HeLa细胞增殖,下调细胞IKCa1 mRNA的表达,降低其IKCa1电流;IKCa1通过调控HeLa细胞膜电位而影响其信号传递,调控HeLa细胞的增殖。
关键词:离子通道;钾离子通道;钙激活性中电导钾离子通道;钾离子通道阻断剂;克霉唑;小分子干扰RNA技术;宫颈癌细胞;HeLa细胞株
doi:10.3969/j.issn.1002-266X.2015.43.001
中图分类号:R737.33文献标志码:A
基金项目:四川省科技厅应用基础研究基金资助项目(2008JY0014-1);四川省卫生厅科研基金资助项目(110373);四川省泸州市科技局科研项目(2013LZLY-J30)。
作者简介:第一刘玲(1981-),女,硕士,主治医师,主要研究方向为妇科肿瘤、生殖内分泌。E-mail: eye99@163.com
作者简介:通信毛熙光(1965-),男,硕士,教授,主要研究方向为妇科肿瘤。E-mail: mxg6639@163.com
收稿日期:(2015-07-07)
Effects of blocking intermediate-conductance-Ca2+-activated K+channels
on proliferation of cervical cancer cells and potassium channel current
LIULing,NIEDan,FANLing-ye,ZHANPing,QIANYan-ping,WANGChun-yan,MAOXi-guang
(TheAffiliatedHospitalofLuzhouMedicalCollege,Luzou646000,China)
Abstract:ObjectiveTo investigate the effects of blocking intermediate-conductance-Ca2+-activated K+ channels (IKCa1) on the cell proliferation and the membrane potential changes of IKCa1 in cervical cancer HeLa cells. MethodsIKCal of HeLa cells was blocked with IKCa1 channel inhibitor (clotrimazole, CLT) and RNA interference, respectively. RT-PCR was used to detect the expression of IKCal mRNA in HeLa cells. The OD value of cells was detected by MTT, and IKCal current was detected by the patch clamp technique in HeLa cells. ResultsWhen IKCal was blocked with CLT in HeLa cells, the expression of IKCal mRNA was decreased, IKCal current wakened and the OD value of cells decreased as compared with that of the control group (all P<0.05). When IKCal was blocked by small interfering RNA technology in HeLa cells, the expression of IKCal mRNA reduced, IKCal current wakened, and the OD value of cells decreased as compared with that of the blank group and negative transfection group (all P<0.05). ConclusionsBlocking IKCa1 could inhibit cell proliferation, down-regualte the expression of IKCa1 mRNA and cut down the IKCal current in HeLa cells. IKCa1 could regulate the cell proliferation of HeLa cells by directly regulating the membrane potential and thus affecting its signal transmission.
Key words: ion channel; potassium channel; intermediate-conductance-Ca2+-activated K+channels; potassium channel blocker; clotrimazole; small interfering RNA technology; cervical carcinoma cells; HeLa cell line
目前,宫颈癌的发病机制尚不明确。离子通道是一种成孔蛋白,它通过允许某种特定类型的离子依靠电化学梯度穿过该通道,帮助细胞建立和控制质膜间的微弱电压差,以维持细胞调控信息的正常表达和传递,这些离子通道存在于所有细胞的细胞膜上[1~3]。离子通道包括钾离子通道家族、氯离子通道家族、钙离子通道家族、质子通道家族等。其中钾离子通道的功能异常在肿瘤细胞的生长繁殖过程中发挥了重要作用。在人类子宫内膜癌、乳腺癌、膀胱癌、结肠癌、胶质母细胞瘤中均发现有钙激活性中电导钾离子通道(IKCa1)蛋白的高表达[4,5]。我们的前期研究[6]也发现,宫颈癌组织和细胞中IKCa1蛋白呈高表达。2012年2月,我们采用小分子干扰RNA(shRNA)技术和钾离子通道阻断剂克霉唑阻断IKCa1后观察了宫颈癌HeLa细胞的增殖情况及其IKCa1膜电位的变化。现将结果报告如下。
1材料与方法
1.1主要材料宫颈癌细胞株HeLa由重庆医科大学病理学实验室惠赠,培养于含10%小牛血清的RPMI1640培养基中。pGenesil-1.1质粒、大肠杆菌菌株DH5α购自武汉晶赛生物技术工程有限公司;质粒pGenesil-IK1、质粒pGenesil-IK2、质粒pGenesil-HK由作者所在实验室构建。
1.2HeLa细胞IKCa1的阻断、IKCa1 mRNA检测、增殖情况观察、IKCa1电流检测方法
1.2.1HeLa细胞IKCa1的克霉唑阻断、IKCa1 mRNA检测、增殖情况观察、IKCa1电流检测方法将钾离子通道阻断剂克霉唑干粉用无水乙醇和含10%小牛血清的RPMI1640培养液配制,终浓度分别为5、10、20、40 μmol/L。将HeLa细胞调整密度为1×105/mL的细胞悬液。取100 μL细胞悬液接种至96孔培养板,培养24 h后弃培养液,分别加入5、10、20、40 μmol/L的克霉唑制剂180 μL(分别为实验1、2、3、4组);另取同样密度的HeLa细胞悬液加入含等量无水乙醇的无克霉唑培养液180 μL(对照组);每组6孔,继续培养,分别于培养24、48、72 h时,用RT-PCR法检测细胞的IKCa1 mRNA:TRIzol提取各组细胞总RNA,逆转录生成cDNA。以cDNA为模板、GAPDH为内参照扩增IKCa1。IKCa1扩增引物:上游 5′-GTGCGTGCAGGATTTAGGG-3′,下游5′-TGCTAAGCAGCTCAGTCAGGG-3′,扩增片段为856 bp;GAPDH扩增引物:上游5′-ATGCTGGCGCTGAGTACGTC-3′,下游5′-GGTCATGAGTCCTTCCACGATA-3′,扩增片段为263 bp。扩增条件:94 ℃预变性4 min,加Tat/酶,94 ℃ 45 s,57 ℃ 45 s,72 ℃ 1 min,循环30次,终延伸72 ℃ 10 min。反应产物用2%琼脂糖凝胶进行电泳,分析并检测各电泳条带的积分光密度,结果以IKCa1 mRNA与GAPDH mRNA的积分光密度比值表示。在上述相同时间点、用MTT法检测细胞OD值。
取HeLa细胞,胰蛋白酶消化,调整细胞密度为2×105/mL,接种于培养瓶,用RPMI1640完全培养液培养24 h后分组(对照组、实验组)并分别加入无克霉唑培养液、含克霉唑培养液(克霉唑浓度为20 μmol/L),继续培养48 h,PBS冲洗。收集细胞制备单细胞悬液,用膜片钳技术检测其IKCa1电流:将膜片钳的电极轻压到细胞表面进行负压抽吸,使之形成1~4 GΩ高阻封接,破膜后补偿串联电阻及抵消电容电流,形成全细胞记录形式。信号经膜片钳放大器( EPC29,HEKA)放大,用Axon “pCLAMP”(美国)采集、分析数据。
1.2.2HeLa细胞IKCa1的shRNA技术阻断、IKCa1 mRNA检测、增殖情况观察、IKCa1电流检测方法选取我们前期成功构建的pGenesil-1.1- IKCa1 shRNA(干扰序列)、pGenesil-1.1-HK(阴性对照序列)重组质粒载体,用LipofectamineTM2000脂质分别转染HeLa细胞,并将细胞分为pGenesil-IKCa1 shRNA组(转染组)、pGenesil-HK组(阴性对照组),另设HeLa细胞对照组(空白对照组),继续培养,分别于培养24、48、72 h时,用RT-PCR法检测HeLa细胞的IKCa1 mRNA(方法同上),MTT法检测细胞OD值。取培养48 h时的细胞,用荧光显微镜观察绿色荧光蛋白以判断转染情况并筛选出转染阳性细胞,用膜片钳技术检测其IKCa1电流:取各组转染阳性HeLa细胞,接种于多聚赖氨酸载玻片上,37 ℃孵育1 h,选择形态正常、大小中等的细胞为实验样本,IKCa1电流检测方法同上。
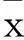
2结果
2.1克霉唑阻断IKCa1的HeLa细胞IKCa1 mRNA表达、增殖情况、IKCa1电流变化
2.1.1克霉唑阻断IKCa1的HeLa细胞IKCa1 mRNA表达变化不同时间点各组HeLa细胞IKCa1 mRNA的表达见表1。由表1可见,随克霉唑浓度增加和作用时间延长,实验1、2、3、4组HeLa细胞IKCa1 mRNA的表达水平明显下降;各时间点组间相比,P均<0.05;实验1、2、3、4组与对照组相比,P均<0.05。
2.1.2克霉唑阻断IKCa1的HeLa细胞OD值变化不同时间点各组HeLa细胞OD值见表2。由表2可见,实验1、2、3、4组HeLa细胞OD值逐渐降低;各时间点组间相比,P均<0.05;实验1、2、3、4组与对照组相比,P均<0.05。

表1 不同时间点各组HeLa细胞IKCa1 mRNA的

表2 不同时间点各组HeLa细胞OD值
2.1.3克霉唑阻断IKCa1的HeLa细胞IKCa1电流变化在钳制膜电位为+60 mV时,对照组及实验组IKCa1电流分别为(23.07±5.47)、(9.84±4.46)pA/pF,两组相比,P>0.05。
2.2shRNA技术阻断IKCa1的HeLa细胞IKCa1 mRNA表达、增殖情况、IKCa1电流变化
2.2.1shRNA技术阻断IKCa1的HeLa细胞IKCa1 mRNA的表达变化不同时间点各组HeLa细胞IKCa1 mRNA的表达见表3。由表3可见,随培养时间延长,转染组HeLa细胞IKCa1 mRNA的表达水平逐渐下降;各时间点转染组IKCa1 mRNA与阴性对照组和空白对照组相比,P均<0.05;阴性对照组与空白对照组相比,P均>0.05。
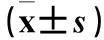
表3 不同时间点各组HeLa细胞IKCa1 mRNA的
2.2.2shRNA技术阻断IKCa1的HeLa细胞OD值变化不同时间点各组HeLa细胞OD值见表4。由表4可见,各时间点转染组HeLa细胞OD值降低,与阴性对照组和空白对照组相比,P均<0.05;阴性对照组和空白对照组各时间点的OD值相比,P均>0.05。
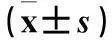
表4 不同时间点各组HeLa细胞OD值
2.2.3shRNA技术阻断IKCa1的HeLa细胞IKCa1电流变化在钳制膜电位为+60 mV时,空白对照组、阴性对照组、转染组IKCa1电流分别为(21.25±4.67)、(21.3±5.51)、(10.93±4.4)pA/pF,转染组与空白对照组和阴性地照组相比,P均<0.05;空白对照组和阴性地照组相比,P>0.05。
3讨论
IKCa1作为钾离子通道家族中的一个重要组成部分,通过调节细胞内钙离子浓度和调节细胞膜电位,参与了细胞的多种生物学活动,如细胞因子的分泌、电解质的转运、渗透压的维持、细胞迁移及增殖等生理活动[7~9]。IKCa1的基因活化、增强表达、通道开放和电压强度变化、通道密度参数等都影响肿瘤细胞的增殖,这表明IKCa1与恶性肿瘤的发生及发展密切相关[10,11]。Susumu等[12]研究发现,人前列腺增生组织中IKCa1蛋白高表达,IKCa1抑制剂可抑制前列腺组织的增生。Joanne等[13]研究发现,IKCa1调控人胚胎肾HEK293细胞的增殖,阻断IKCa1通道能抑制HEK293细胞增殖,而IKCa1表达的细胞增殖能力增强,IKCa1对HEK293细胞增殖的调控可能是通过ERK1/2和JNK信号途径共同作用完成的。
克霉唑作为已知的IKCa1阻断剂已被广泛应用[14]。本研究用克霉唑干预HeLa细胞后,细胞IKCa1 mRNA的表达水平下降、IKCa1电流减弱,表明克霉唑能有效阻断HeLa细胞IKCa1通道。此外,本研究将IKCa1干扰质粒转染HeLa细胞,细胞IKCa1 mRNA的表达水平下降、电流减弱,表明IKCa1基因下调能有效阻断HeLa细胞IKCa1通道。本研究用克霉唑及shRNA技术阻断IKCa1后,随克霉唑浓度升高和作用时间延长,对HeLa细胞生长的抑制作用也增强。可见阻断IKCa1,细胞增殖受到明显影响。张英丽等[15]研究发现,KCa3.1的相对特异性阻断剂TRAM-34明显影响子宫内膜癌细胞株HEC1-A 和Ishikawa的增殖,且呈剂量及时间依赖性;应用RNA干扰技术可抑制HEC-1-A和Ishikawa细胞株中KCa3.1的蛋白表达并抑制细胞的增殖。Haren等[16]通过免疫组化、PCR等生物学手段和膜片钳技术研究发现,IKCa1在乳癌组织和乳腺癌细胞中的表达升高,IKCa1 mRNA和蛋白表达水平也升高,并且升高幅度与肿瘤的期别、分化程度及转移密切相关。我们的前期研究发现[6],宫颈癌组织中IKCa1 mRNA表达明显高于正常宫颈组织,本研究发现IKCa1基因被阻断和沉默后HeLa细胞IKCa1 mRNA的表达也明显降低、IKCa1电流减弱,可能是IKCa1通道被阻断以及IKCa1基因被沉默后,细胞的电位和能量转运受到影响,细胞的渗透压发生改变,细胞失水,其物质代谢和生长代谢受到影响,使细胞不能获得足够的营养,继而出现功能紊乱而发生坏死、崩解,细胞数量明显减少。这与De Marchi等[17]研究发现的IKCa1对细胞线粒体的影响一致。
综上所述,阻断IKCa1能下调Hela细胞IKCa1 mRNA的表达,有效抑制HeLa细胞增殖,降低其IKCa1电流。IKCa1通过调控HeLa细胞膜电位而影响其信号传递,调控HeLa细胞的增殖。在深入探讨IKCa1的作用机制及其对细胞生长调控的基础上,研究开发具有对宫颈癌特异性的抑制IKCa1活性或表达的药物,将有助于宫颈癌的治疗。
参考文献:
[2] Weisbrod D, Peretz A, Ziskind A, et al. SK4 Ca2+activated K+channel is a critical player in cardiac pacemaker derived from human embryonic stem cells[J].Proc Natl Acad Sci U S A, 2013,110(18):1685-1694.
[3] Hayashi ML, Wang J, Hede SE, et al. An intermediate-conductance Ca2+-activated K+channel is important for secretion in pancreatic duct cells[J]. Am J Physiol Cell Physiol, 2012,303(2):151-159.
[4] Roy JW, Cowley EA, Blay J, et al. The intermediate conductance Ca2+-activated K+channel inhibitor TRAM-34 stimulates proliferation of breast cancer cells via activation of oestrogen receptors[J]. Br J Pharmacol, 2010,159(3):650-658.
[5] Wang ZH, Shen B, Yao HL, et al. Blockage of intermediate-conductance- Ca2+-activated K+channels inhibits progression of human endometrial cancer[J].Oncogene, 2007,26(35):5107-5114.
[6] 林海蕤,毛熙光,王定玉.人宫颈鳞状上皮细胞癌组织中IKCa1 mRNA的表达及意义[J].山东医药,2012,52(46):47-79.
[7] Adelman JP, Maylie J, Sah P. Small-conductance Ca2+-activated K+channels: form and function[J]. Annu Rev Physiol, 2012,74(12):245-269.
[8] N′Gouemo P. Targeting BK (big potassium) channels in epilepsy[J]. Expert Opin Ther Targets, 2011,15(11):1283-1295.
[9] Berkefeld H, Fakler B, Schulte U. Ca2+-activated K+channels: from protein complexes to function[J]. Physiol Rev, 2010,90(4):1437-1459.
[10] Wullf H, Kolski-Andreaco A, Sankaranarayanan A, et al. Modulators of small -and intermediate-conductance calcium-activated potassium channels and their therapeutic indications[J]. Curr Med Chem, 2007,14(13):1437-1457.
[11] Bloch M, Ousingsawat J, Simon R, et al. KCNMAI gene amplification promotes tumor cell proliferation in human prostate cancer[J]. Oncogene, 2007,26(17):2525-2534.
[12] Susumu O, Satomi Ni, Yoshiyuki K, et al. Intermediate-conductance Ca2+-activated K+Channel, KCa3.1, as a novel therapeutic target for benign prostatic hyperplasia [J]. J Pharmacol Exp Ther, 2011,338(2):528-536.
[13] Joanne EM, Daniel CD, Kirk LH, et al. Calcium-acivated K+channels increase cell proliferation independent of K+conductance [J]. Am J Physiol Cell physiol, 2011,300(4):792-802 .
[14] Kast RE. Profound blockage of CXCR4 signaling at multiple points using the synergy between plerixafor, mirtazapine, and clotrimazole as a new glioblastoma treatment adjunct[J]. Turk Neurosurq, 2010,20(4):425-429.
[15] 张英丽,赵明智,鹿欣,等.KCa3.1表达改变对子宫内膜癌细胞增殖、细胞周期及凋亡的影响[J].肿瘤,2009,29(4):323-328.
[16] Haren N, Khorsi H, Faouzi M, et al. Intermediate conductance Ca2+activated K+channels are expressed and functional in breast adenocarcinomas: correlation with tumour grade and metastasis status[J]. Histol Histopathol, 2010 ,25(10):1247-1255.
[17] De Marchi U, Sassi N, Fioretti B, et al. Intermediate conductance Ca2+- activated potassium hannel (KCa3.1) in the inner mitochondrial membrane of human colon cancer cells[J]. Cell Calcium, 2009,45(5):509-516.

