大黄素在低氧肠应激损伤中细胞自噬的保护作用
2016-01-11哈小琴王怡君高彩燕
郑 英, 哈小琴, 王怡君, 王 娟, 高彩燕
(1.甘肃中医学院 甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室, 甘肃 兰州 730000; 2.兰州军区 兰州总医院, 甘肃 兰州 730050; 3.兰州大学 第二医院, 甘肃 兰州 730030)
大黄素在低氧肠应激损伤中细胞自噬的保护作用
郑英1, 哈小琴2*, 王怡君2, 王娟3, 高彩燕3
(1.甘肃中医学院 甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室, 甘肃 兰州730000; 2.兰州军区 兰州总医院, 甘肃 兰州730050; 3.兰州大学 第二医院, 甘肃 兰州730030)
摘要:研究了大黄素在低氧肠应激损伤中通过细胞自噬机制如何起保护作用.以IEC-6细胞为研究对象,采用噻唑蓝染色法(MTT)筛选出最佳大黄素浓度.在常氧(氧浓度20.9%)及低氧环境下(氧浓度5%)6 h、24 h后,用噻唑蓝染色法(MTT)检测其细胞存活率;采用流式细胞仪检测细胞周期,并通过实时荧光定法(Real-Time PCR)检测自噬相关基因Beclin-1及LC3的表达.噻唑蓝染色法(MTT)结果表明,与常氧对照组相比,在低氧条件下无大黄素组细胞生存率明显降低(P<0.01),而大黄素组细胞生存率无明显差异(P>0.05);流式细胞仪结果表明,相对于无大黄素组,大黄素组可明显促进细胞进入分裂期(P<0.01);Real-Time PCR结果表明,在低氧6 h、24 h后大黄素组Beclin-1及LC3基因表达量均上调(P<0.05).可知在低氧肠应激性损伤下,大黄素通过自噬机制起保护作用.
关键词:自噬; 低氧; 肠应激性损伤; 大黄素; 保护
0引言
高原低氧是造成肠道应激性损伤的主要原因之一.低氧可诱发自噬[1].自噬是一种细胞保持自身稳态及存活的机制,它通过形成的自噬溶酶体不断降解细胞内的各种成分并提供可循环利用的必需原料,从而最大程度地维持细胞正常生命活动[2].自噬(Autophagy)是低氧条件下保护细胞的一种应激反应,增强的自噬促进细胞在缺血缺氧等饥饿状态下的存活[3].已有研究发现,自噬存在于低氧肠应激性损伤中[4],但其具体分子机制及信号通路仍未完全研究清楚,尤其是自噬在低氧肠应激性损伤中的作用尚存在较大争议.
大黄素是一种从掌叶大黄的根茎中所提取到的羟基蒽醌类化合物,其具有多种功效,如抑菌、抗炎、改善微循环、抗癌等,具有较好的临床应用价值[5].已有研究证明,大黄素对于肠道黏膜屏障损伤有明显的保护作用[6],但其具体分子机制仍然未能完全研究清楚.
在低氧条件下,肠道作为全身最大的免疫器官,其自身的自稳功能对全身的保护起着举足轻重的作用[7].本文以大鼠肠上皮隐窝细胞IEC-6为研究对象,筛选出最佳大黄素浓度,在低氧环境下行MTT、细胞周期检测明确大黄素对肠上皮细胞的保护作用,在基因水平上检测自噬相关基因,从而阐明在低氧肠应激性损伤下,大黄素可能通过增强自噬机制而起保护作用.目前,本研究工作在国内外文献中罕见报道.
1实验部分
1.1实验材料
大鼠小肠隐窝上皮细胞IEC-6细胞株,购自于中国科学院典型培养物保藏中心昆明细胞库;大黄素,购自于合肥博美生物科技有限责任公司;高糖DMEM培养基干粉,Gibco公司;胎牛血清,Hyclone公司;胰蛋白酶,Gibco公司;碘化丙啶、四甲基偶氮唑蓝、二甲基亚枫,购于Sigma公司.
1.2实验方法
1.2.1细胞培养
细胞株IEC-6细胞置于含10%胎牛血清、1.0×105U/L 青霉素和链霉素等的高糖DMEM培养基中,于37 ℃、饱和湿度5%CO2条件下培养,每2~3 d换液1 次,待细胞长至80%融合,经0.25%胰蛋白酶+0.02%EDTA消化后,按1∶2比例进行传代,取对数生长期细胞用于实验.
1.2.2大黄素最佳浓度筛选
取对数生长期IEC-6细胞加入96孔板中,每孔加入4×104个/mL细胞,终体积为100 uL,置37 ℃、5% CO2饱和湿度培养箱中培养24 h后,分别加入不同浓度大黄素40μmol/L、20μmol/L、10μmol/L、5μmol/L、2.5μmol/L、1.25μmol/L,同时设立对照孔,分别平行3个复孔.
各组分别培养72 h 后,弃上清,加20μL MTT,继续培养4 h后,吸去上清,每孔加DMSO 150μL,置震荡器振荡10 min,用自动酶标仪测定在570 nm 波长处的吸光度(A)值.
实验重复3 次,按以下公式计算细胞存活率:
细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%
1.2.3低氧处理后细胞存活率检测
取对数生长期IEC-6细胞加入96孔板中,每孔加入4×104个/mL细胞,终体积为100μL,对照孔加入5%FBS培养液,实验组加入含最佳大黄素浓度的5%FBS培养液,48小时后,置于氧浓度为5%的三气培养箱中0 h、6 h、24 h后,弃上清,加20μL MTT,继续培养4 h后,吸去上清,每孔加DMSO 150μL,置震荡器振荡10 min,用自动酶标仪测定在570 nm 波长处的吸光度(A)值.
实验重复3 次,按以下公式计算细胞存活率:
细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%
1.2.4细胞周期检测
取对数生长期IEC-6细胞加入25 cm2培养瓶中,每瓶加入1×106个/mL细胞,对照孔加入5%FBS培养液,实验组加入含最佳大黄素浓度的5%FBS培养液,48小时后,置于氧浓度为5%的三气培养箱中0 h、6 h、24 h后,弃上清,0.25%胰蛋白酶+0.02%EDTA消化,收集细胞置离心管,9 000 r/min 离心3 min,冷PBS洗3 次,用75%乙醇1 mL固定过夜,PI 染液(含5 mg PI、2 mg RnaseA、500μL 1% TritonX-100、100 mg 枸橼酸钠、5 mL 0.9% 生理盐水、加三蒸水至100 mL),室温下避光染色15 min,400目筛网滤过,用流式细胞仪检测DNA含量,分析细胞周期.
结果用ModFit 软件分析.实验重复3次.
1.2.5自噬相关基因检测
取对数生长期IEC-6细胞加入25 cm2培养瓶中,每瓶加入1×106个/mL细胞,对照孔加入5%FBS培养液,实验组加入含最佳大黄素浓度的5%FBS培养液,48小时后,置于氧浓度为5%的三气培养箱中0 h、6 h、24 h后,弃上清,使用TRIzol法提取RNA,紫外分光度仪上测RNA的纯度及浓度.
使用试剂盒配置反转录体系.ABI PRISM 7300 Real-Time PCR System 进行PCR.结果用2^-△△Ct法分析.
1.2.6统计学方法
2结果与讨论
2.1不同浓度大黄素对细胞存活率的影响
MTT结果显示,随着大黄素浓度的增加,细胞存活率先升高后降低,在浓度为5μmol/L时具有明显促进细胞生长的作用,其结果如图1所示.

图1 不同浓度大黄素的细胞存活率
2.2低氧下Beclin-1、LC3基因的表达
如表1所示,Real-Time PCR结果显示:与常氧对照组相比,低氧6小时、24小时后自噬相关基因Beclin-1及LC3表达量均上调(P<0.05).
低氧6小时后,Beclin-1基因表达量为:无大黄素组是常氧对照组的12.64倍,大黄素组是常氧对照组的25.26倍;LC3基因表达量为:无大黄素组是常氧对照组的5.63倍,大黄素组是常氧对照组的12.05倍.
低氧24小时后,Beclin-1基因表达量为:无大黄素组是常氧对照组的22.62倍,大黄素组是常氧对照组的17.60倍;LC3基因表达量为:无大黄素组是常氧对照组的3.09倍,大黄素组是常氧对照组的6.04倍.
可见,相对于常氧对照组,在低氧6小时后,大黄素组Beclin-1及LC3基因表达量较无大黄素组明显增多(P<0.05);而在低氧24小时后,大黄素组Beclin-1基因表达低于无大黄素组(P>0.05),大黄素组LC3基因表达高于无大黄素组(P<0.01).
低氧24小时与低氧6小时后相比,大黄素组Beclin-1及LC3表达量均降低(P<0.01).24小时后的Beclin-1基因表达量与6小时后相比,大黄素组相对于无大黄素组有下降(P>0.05);24小时后的LC3基因表达量与6小时后相比,大黄素组高于无大黄素组(P<0.01).

表1 自噬相关基因表达
注:*与常氧对照组相比,P<0.05;△与低氧24小时后无大黄素组相比,P>0.05;##与低氧24小时后无大黄素组相比,P<0.01;%%与低氧6小时后大黄素组相比,P<0.01
2.3大黄素对IEC-6细胞存活率的影响
如表2~3所示,分别在低氧6小时、24小时后,无大黄素组与常氧对照组相比存活率明显降低(P<0.01),大黄素组与常氧对照组相比存活率没有明显差异(P>0.05).结果显示,在低氧条件下,大黄素对IEC-6细胞具有较好的保护作用,能明显地促进细胞生长.
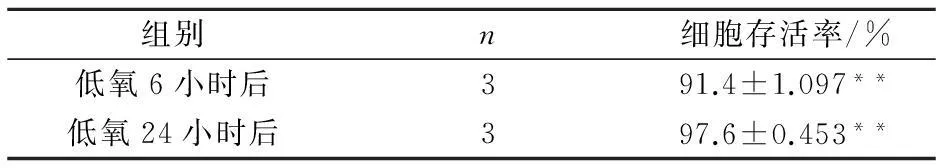
表2 无大黄素组与常氧对照组相比存活率

注:**与常氧对照组相比,P<0.01
注:△与常氧对照组相比,P>0.05
2.4大黄素对细胞周期的影响
如表4所示,细胞周期显示:与常氧对照组相比,低氧下大黄素组较无大黄素组处于S期细胞明显增多(P<0.01),提示大黄素可明显促进细胞进入分裂期.

表4 大黄素组与常氧对照组细胞周期比较
注:**与常氧对照组相比,P<0.01.
3结论
随着海拔的升高,大气压下降,引起氧分压降低,从而导致低比重的缺氧[8].高原低氧是肠道黏膜屏障应激性损伤的主要原因之一.高原低氧所致肠粘膜屏障的损伤可引起肠道功能紊乱,甚至诱发全身炎症反应综合症并危及生命[9].应激性是指在短时间内机体对外界刺激所作出的全身非特异性反应,其目的是使机体适应环境.自噬(Autophagy)是缺氧条件下保护细胞的一种应激反应,增强自噬可促进细胞在缺血缺氧等饥饿状态下的存活[3].已有研究表明,大黄素对于肠道黏膜屏障损伤有保护作用[6].因此,本研究对大黄素在低氧肠道应激性损伤的保护作用是否与增强细胞自噬机制有关进行了研究.
本研究经MTT法筛选出大黄素对IEC-6细胞的最佳促生长作用的浓度为5μmol/mL.分别对大黄素组、无大黄素组在低氧6小时、24小时后的自噬相关基因Beclin-1、LC3的表达进行了研究,Beclin-1与LC3基因被认为与自噬活动密切相关[10-13].
Real-Time PCR结果显示,低氧6小时及24小时后,相对于常氧对照组,大黄素组和无大黄素组的Beclin-1、LC3基因的表达量均上调(P<0.01).尤其在低氧6小时后,大黄素组的Beclin-1与LC3基因表达量相对无大黄素组明显增多(P<0.01),提示低氧引起急性应激时大黄素可促进细胞自噬的发生.低氧24小时与低氧6小时后相比,大黄素组Beclin-1及LC3表达量均降低(P<0.01),说明在低氧较短时间内(6小时),大黄素组明显增强了自噬相关基因Beclin-1与LC3的表达.
低氧条件下,MTT检测结果显示大黄素具有明显保护细胞、促细胞生长的作用;流式细胞仪对细胞周期进行了分析,结果显示相比较无大黄素组,大黄素可明显促进细胞进入分裂期.
综上所述,我们可以推测,大黄素在低氧条件下,尤其在短时期内(6小时)对细胞的保护作用可能是通过增强细胞的自噬机制来进行的,最终促进细胞进入分裂期,使得整个内环境在受到损害后仍处于正常状态.但关于大黄素的具体作用位点及相关的信号通路仍不清楚,后续实验将对这一部分进行深入研究.
近年来,由于突发事件、严重自然灾害等,在西部高海拔地区作业人员越来越多,而高海拔低氧是引起高原疾病尤其是肠粘膜屏障损伤的最主要应激因素[14].对于低氧所致的全身应激性疾病,肠道功能的恢复已经作为重要的治疗指标之一[15].因此,研究新型、高效且适用于高海拔肠应激损伤防治的药物,已成为当今生命科学亟待解决的问题之一.在肠道应激性损伤中,自噬的调节已经成为了一个有潜力的治疗目标.
参考文献
[1] Blagosklonny M V.Hypoxia,mtor and autophagy converging on senescence or quiescence[J].Autophagy,2013,9(2):260-264.
[2] Ohsumi Y.Historical landmarks of autophagy research[J].Cell Research,2014,24(1):9-23.
[3] Stefan W.Rytera Amkc.Autophagy:An Integral component of the mammalian stress response[J].J Biochem Pharmacol Res,2013,1(3):176-188.
[4] Kroemer G,Marino G,Levine B.Autophagy and the integrated stress response[J].Molecular cell,2010,40(2):280-293.
[5] 熊兴富.中药大黄主要有效成分药理学研究进展[J].中医临床研究,2014,6(10):143-146.
[6] 丁博文,嵇武,白小武,等.大黄素对肠上皮细胞损伤的保护作用及机制研究[J].东南国防医药,2012,14(3):199-202.
[7] Yoshiyuki Goto H K.Epithelial barrier:An interface for the cross-communication between gut flora and immune system[J].Immunological Reviews,2012,245:147-63.
[8] Chris Imray A W,Andrew Subudhi,Robert Roach.Acute mountain sickness:Pathophysiology,prevention,and treatment[J].Progress in Cardiovascular Diseases,2010,52(6):467-484.
[9] 杨定周,周其全, 李素芝.高原缺氧致急性胃肠黏膜损伤及其与多器官功能障碍综合征的关系[J].高原医学杂志,2009,19(3):44-45.
[10] Wirawan E,Lippens S,Vanden Berghe T,et al.Beclin-1:A role in membrane dynamics and beyond[J].Autophagy,2012,8(1):6-17.
[11] Fu L L,Cheng Y,Liu B.Beclin-1:Autophagic regulator and therapeutic target in cancer[J].The International Journal of Biochemistry & Cell Biology,2013,45(5):921-924.
[12] Green D R,Levine B.To be or not to be?How selective autophagy and cell death govern cell fate[J].Cell,2014,157(1):65-75.
[13] Slobodkin M R,Elazar Z.The atg8 family:Multifunctional ubiquitin-like key regulators of autophagy[J].Essays in Biochemistry,2013,55:51-64.
[14] 杨定周,周其全,李素芝.胃肠粘膜屏障损伤与高原多器官功能障碍综合征[J].西南国防医学,2008,18(2):295-298.
[15] 伍民生,梁健.重症监护病房危重患者肠功能障碍诊治进展[J].医学综述,2013,19(2):326-329.
Emodin in hypoxic intestinal stress damage
and the protection of autophagy
ZHENG Ying1, HA Xiao-qin2*, WANG Yi-jun2, WANG Juan3, GAO Cai-yan3
(1.Provincial-Level Key Laboratory for Molecular Medicine of Major Diseases and The Prevention and Treatment with Traditional Chinese Medicine Research in Gansu Colleges and Universities, Gansu University of Chinese Medicine, Lanzhou 730000, China; 2.Lanzhou General Hospital of Lanzhou Military Region, Lanzhou 730050, China; 3.The Second Hospital, Lanzhou University, Lanzhou 730030, China)
Abstract:Research on emodin in hypoxia stress damage,which protect the cell through the autophagy system.IEC-6 cells as the research object,selects the best concentration of emodin by MTT method,respectively under the constant oxygen (20.9% oxygen concentration) and low oxygen (5% oxygen concentration) after 6 h and 24 h,tests cell survival rate by MTT,detects the cell cycle using flow cytometry instrument,and tests autophagy related genes by Real Time-PCR.MTT results suggest:compared with the control group,under the condition of low oxygen without emodin group cell survival rate was significantly lower (P<0.01);No significant difference was observed between the control group and emodin group (P>0.05).Flow cytometry results suggest:emodin group can obviously promote cell into the split phase (P<0.01).Real-Time PCR results suggest:at low oxygen after 6 hours and 24 hours, the expressions of Beclin-1 and LC3 gene expression increased significantly (P<0.05) in emodin group.In hypoxia stress damage, emodin may as a protector through the autophagy system.
Key words:autophay; hypoxia; intestinal stress damage; emodin; protection
中图分类号:R574
文献标志码:A
文章编号:1000-5811(2015)02-0134-05
通讯作者:
作者简介:郑英(1983-),女,甘肃天水人,在读硕士研究生,研究方向:中西医结合基础哈小琴(1968-),女,甘肃陇南人,主任医师,博士,研究方向:干细胞及基因药物,842917389@qq.com
基金项目:甘肃省科技厅杰出青年科技基金项目(1111RJDA004)
收稿日期:*2014-12-13
