原发性胆汁性胆管炎患者血清自身抗体及生化指标的特征分析*
2016-01-11周晓冬刘会利赵汉东刘红莉西安市第八医院检验科西安710061
周晓冬,刘会利,赵汉东,刘红莉(西安市第八医院检验科,西安 710061)
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是由自身免疫介导的胆汁淤积性慢性肝脏疾病,起病隐匿,进展缓慢,可进一步发展为肝硬化、门静脉高压、肝衰竭。近年来我国PBC的发病率呈不断上升趋势,但目前尚无根治的方法,研究[1]显示:在疾病早期及时应用熊去氧胆酸(UDCA)等治疗能改善血清生化指标及肝组织学病变从而延缓病情进展,晚期则效果甚微,故早发现、早诊断、早治疗是控制此病的关键。随着自身抗体的检测技术的发展,国内外已有大量的关于PBC早期诊断和自身抗体特点的报道,本研究对65例PBC,81例病毒性肝病和50例健康对照组自身抗体的表达差异、生化指标的特征,以及自身抗体与生化指标间相关性的分析,以期总结PBC的实验室诊断特征,进一步提高对此病的早期认识和鉴别诊断。
1 材料与方法
1.1 研究对象 收集2011年1月~2015年12月在西安市第八医院初诊的 PBC患者64例,其中男性9例,女性55例,年龄37~73岁,平均年龄56.94±8.93岁;病毒性肝病患者81例,男性45例,女性36例,年龄43~75岁,平均年龄54.86±8.72岁,其中乙型肝炎53例,丙型肝炎28例。体检健康对照者50例,男性32例,女性18例,年龄40~71岁,平均年龄53.23±6.25岁。PBC诊断标准采用2009年美国肝脏病学会推荐的PBC诊断指南:①胆汁淤积的生物化学改变,主要是指无其他原因解释的碱性磷酸酶(ALP)升高,B超检查胆道系统正常;②AMA-M2阳性(AMA-M2/抗gp210阳性);③肝活检组织检查,符合PBC改变。符合上述三项之中的二项可诊断为PBC[2]。病毒性肝病患者入选标准采用2004与2005年我国制定的丙型病毒性肝炎与乙型病毒性肝炎防治指南中的诊断标准[3]。
1.2 试剂和仪器 自身抗体选用德国欧蒙医学实验诊断股份有限公司的自身抗体谱IgG检测试剂盒、自身免疫性肝病IgG类抗体检测试剂盒、EURO Star III Plus荧光显微镜、EURO BIot Master II免疫印迹仪;生化指标选用迈瑞全自动BS-800生化分析仪。
1.3 方法
1.3.1 采集空腹静脉血6 ml,置于2个促凝试管中,分离血清。
1.3.2 间接免疫荧光法(IIF):自身抗体谱IgG检测试剂盒包被有4种抗原基质:Hep-2、猴肝、大鼠胃、大鼠肾脏,可检测抗核抗体(ANA)、抗线粒体抗体(AMA)、抗平滑肌抗体(ASMA)、抗肝肾微粒体抗体(LKM)。按试剂盒说明书操作,荧光显微镜观察细胞或组织内出现特异性绿色荧光,血清稀释度≥1∶100判为阳性。
1.3.3 免疫印迹法(IBT):自身免疫性肝病IgG类抗体试剂盒可检测AMA-M2,M2-3E,抗Sp100抗体、抗PML抗体、抗gp210抗体、抗LKM-1抗体、抗LC-1抗体、抗SLA/LP抗体、Ro52。血清按照1∶100稀释,按照试剂盒要求操作,用欧蒙公司的计算机程序(EURO Line Scan)自动判读条带的阴阳性和着色强度。
1.3.4 全自动生化分析仪检测血清总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转移酶(GGT)、总胆固醇(TC)。
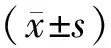
2 结果
2.1 三组人群的自身抗体结果 见表1。PBC组ANA和AMA以及其高滴度(≥1∶320)的阳性率

表1 间接免疫荧光法检测三组人群的自身抗体结果(n,%)
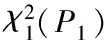
明显高于病毒肝炎组和健康对照组,差异有统计学意义(P<0.01);AMSA和LKM三组间两两比较,差异均无统计学意义(P>0.05)。PBC组的荧光模型主要表现为胞浆颗粒型59.38%(38/64),核颗粒型15.63%(10/64),着丝点型12.50%(8/64),核点型3.13%(2/64),核膜型1.56%(1/64),核仁型1.56%(1/64)。病毒性肝炎组无特征性核型。2.2 三组人群的自身免疫肝病抗体结果 见表2。PBC患者中AMA-M2,M2-3E,sp100,gp210,Ro52五种抗体与病毒性肝炎组及健康对照组比较,差异均有统计学意义(P<0.01);其余PML,SLA/LP,LC-1,LKM-1三组之间比较差异均无统计学意义(P>0.05);健康对照组均未检出肝抗原抗体。
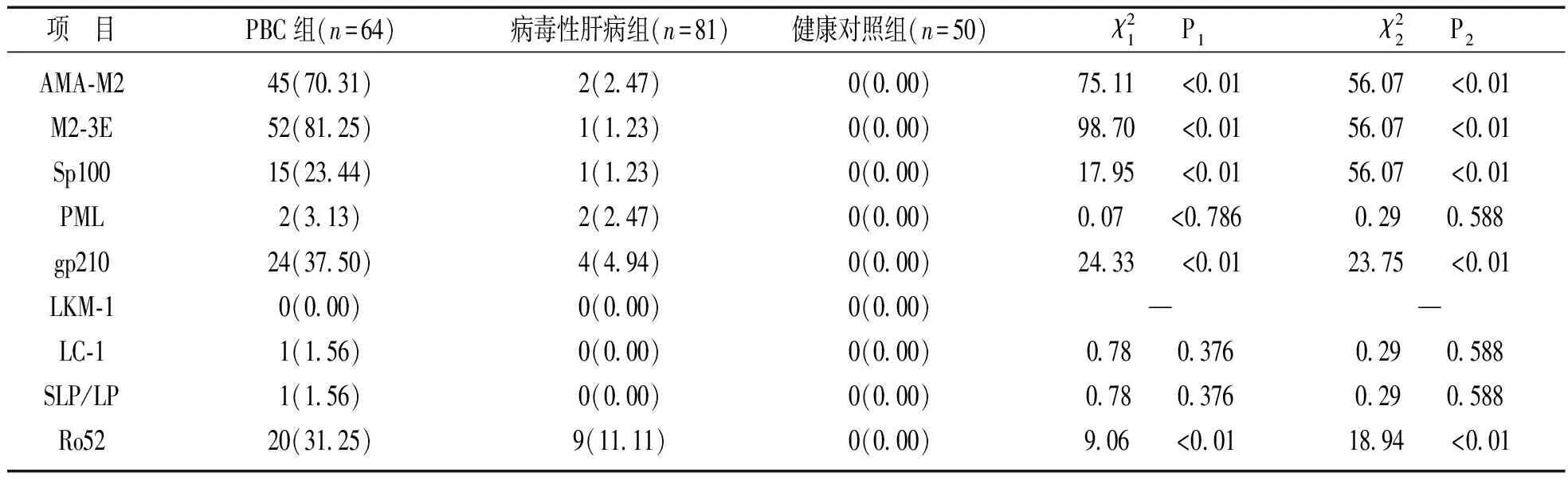
表2 免疫印迹法检测三组人群的自身免疫肝病抗体检测结果(n%)
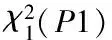
2.3 三组人群的生化指标结果 见表3。PBC组和病毒性肝炎组患者血清中TBIL,ALT,AST,ALP,GGT,TC都有不同程度的升高,除PBC组和病毒性肝炎组ALT的比较、病毒性肝炎组和健康对照组TC的比较差异无统计学意义(P>0.05),其余三组间两两比较差异均有统计学意义(P<0.05)。
2.4 PBC组自身抗体与生化指标的相关性 见表4。PBC组中,仅抗gp210抗体阳性和阴性两组间TC的差异有统计学意义(P<0.05),其余包括AMA-M2阳性和阴性两组的生化指标之间比较,差异均无统计学意义(P>0.05)。
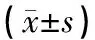
表3 三组人群的生化指标结果
注:a.PBC组与病毒性肝炎组相比,P<0.05;b.PBC组与健康对照组相比,P<0.05;c.病毒性肝炎与健康对照组相比,P<0.05;d.PBC组与病毒性肝炎组相比P>0.05;e.病毒性肝炎组与健康对照组相比,P>0.05。

表4 PBC组中AMA-M2阴/阳性组、gp210阴/阳性组生化指标的比较
3 讨论
原发性胆汁性胆管炎(PBC)是自身免疫性肝病常见的一种疾病,患者血清可检测出与肝脏疾病相关的高滴度的自身免疫性抗体,主要累及中年女性,男女比例为1∶(9~10),中位发病年龄为50岁左右。何丽芬[4,5]等研究都报道PBC患者血清中自身抗体的阳性率情况,二者结果有所差异,本研究结果显示PBC患者以女性为主,男女比例为1∶6.22,平均年龄56.94岁;血清中自身抗体阳性率与前述报道存在差异,如ANA阳性率高出报道[4]22.25%,AMA-M2阳性率高出报道[5]12.83%,Sp100阳性率于两者报道之间,其余与上述报道基本相符。秦雯等[5]报道PBC患者的荧光核型依次为颗粒型、着丝点型、胞质型;文献[6]报道,PBC患者常见荧光模型为着丝点型、核膜型和核点型,其中核膜型AMA是PBC的一个特异性血清学指标,有助于PBC的诊断。本研究PBC患者的荧光模型以胞浆颗粒型为主,与上述报道[5,6]不太一致。以上报道中PBC患者自身抗体的阳性率和荧光模型之间有一些差异,可能与实验方法、试剂、地域以及患者治疗阶段药物的影响有关,病毒性肝病患者血清中为无特征性荧光模型的低滴度的自身抗体,而且阳性率明显低于PBC患者。UDCA是目前美国肝病学会、食品药品监督管理局(FDA)唯一推荐治疗PBC 的药物,临床上运用UDCA联合激素或免疫抑制剂治疗,而病毒性肝病主要是干扰素抗病毒治疗并提高免疫力治疗,若两者误诊治疗方案相反便会加重病情,因此检测自身抗体和特征性荧光模型对PBC的诊断和鉴别有重要的价值。
AMA是PBC高度特异性的抗体,特异度95%,PBC患者在临床症状、生化和组织学异常表现出现之前,血清中即可出现高滴度的AMA。AMA的靶抗原有M1~M9九个亚型,其中M2是PBC的标志性抗体,敏感度95%~98%,特异度86%~97%[4]。M2-3E是AMA-M2的3个靶抗原的三联融合蛋白(BPO),包括丙酮酸脱氢酶复合体E2亚单位(PDC-E2)、支链二酮酸脱氢酶复合体E2亚单位(BCOADC-E2)、2-酮戊二酸脱氢酶复合体E2亚单位(OGDC-E2),这些酶催化酮酸底物氧化脱羧,定位于线粒体内膜。国内文献报道[7]AMA-M2和M2-3E的阳性率为78.4%和92.2%。国外文献[8]PBC患者血清中AMA-M2靶抗原的阳性率明显高于AMA-M2。本研究AMA-M2和M2-3E阳性率比以上报道偏低,但M2-3E阳性率相比AMA-M2高出10.77%,与报道相符。因此,AMA-M2和M2-3E联合检测可作为PBC早期诊断重要的免疫学指标,对于无症状患者AMA-M2和M2-3E阳性、尤其M2-3E单独阳性时应高度怀疑PBC,并建议肝组织活检进一步诊断,以免漏诊。
与PBC相关的自身抗体还有抗gp210抗体、抗Sp100抗体和Ro52。抗gp210抗体是核孔复合物中一种完整的膜蛋白抗体,PBC患者中特异度高达99%,敏感度10%~41%[2],并很少出现在其他的自身免疫疾病中。研究[9]显示gp210阳性PBC患者易进展为肝衰竭,也有研究表明gp210与PBC患者预后无关[6];李凤惠等[10]研究发现gp210阳性主要出现在AMA或AMA-M2阴性患者中,推测血清抗gp210的检测有助于AMA-M2阴性PBC患者的诊断。抗Sp100抗体靶抗原是相对分子质量为100×103的可溶性酸性磷酸化核蛋白,点状分布于细胞核内,对PBC的诊断特异度达94%[5],并显示AMA阴性的PBC患者Sp100阳性率明显高于AMA阳性患者,且Sp100阳性多出现在疾病晚期和疾病进展较快的PBC中,因此抗Sp100阳性与PBC病情严重程度及预后有相关性。唐映梅等[11]检测PBC患者gp210和Sp100的阳性率分别为26.7%和16.90%。本研究PBC患者中gp210和Spl00阳性率比上述报道高,与研究[6]一致;Sp100在AMA阴性中的阳性率(66.66%)明显高于AMA阳性中的阳性率(13.46%),与报道[5,6]相符;但由于积累的AMA阴性病例太少,关于gp210和Sp100对PBC疾病进程和预后的影响研究并不充足。Ro52是一个相对分子质量为52 000的蛋白质以及与其相连的小RNA组成,参与细胞的转录调节过程,存在于多种自身免疫性疾病中并特异度较低,是目前已知的抗核糖核蛋白抗体中分布最广、最常见的一种抗体。本研究显示PBC组Ro52阳性率比病毒性肝病组高26.66%,其差异表明Ro52也是PBC诊断的一个重要的自身抗体指标。
PBC以慢性非化脓性胆管炎为特征,主要累及小叶间及间隔胆管,以汇管区周围损害逐渐增多扩展到肝实质损害。病毒性肝炎以肝细胞变性坏死为主,并伴有不同程度的炎性细胞浸润、肝细胞再生和纤维组织增生。血清ALT和AST主要来源于肝细胞胞浆和肝细胞线粒体;ALP广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织经肝脏向胆外排出的一种酶;GGT在肝内主要存在于肝细胞浆和肝内胆管上皮中。因此,肝功能指标的改变在一定程度上与疾病分期及组织学损害严重度有关。本研究显示PBC患者与病毒肝炎患者比较肝细胞的损害无明显差异,肝内胆管损害和胆汁淤积比较严重,其中ALP最高1 592.7U/L,GGT最高2 436.0U/L,TBIL最高443.1 μmol/L;另外,同年龄组病毒性肝炎并不影响患者TC的变化,而PBC患者的TC有明显升高,最高13.13 mmol/L,说明PBC患者肝脏损害的同时脂代谢也受到一定的影响。UDCA治疗PBC后6~9个月内90%的患者肝功能得以改善,但PBC相关的自身抗体特征不会改变[2]。因此,生化指标不仅可用于PBC的鉴别诊断,还可用于疾病分期和疗效观察。
另外,本研究通过对PBC患者中AMA-M2阴性/阳性组、gp210阳性/阴性组生化指标的比较,表明除TC外,自身抗体AMA-M2和gp210与肝脏损害无相关性,与报道[4,12]相符。李虎等[13]最新报道Th9细胞亚群在PBC中的显著升高与TBIL,ALT,AST,GGT有相关性,并且参与PBC的发生和发展。这提示我们继续积累病例从新的方向对PBC进行更深入的研究。
综上所述,PBC患者血清中可检出多种自身抗体,特异性抗体AMA,AMA-M2,M2-3E,Sp100,gp210在PBC中的表达有一种或几种同时出现,其中任何一种自身抗体单独出现都可提示早期PBC;并且结合生化指标可对PBC进行鉴别诊断、病程分期和疗效评价。
[1] Cuperus FJ,Halilbasic E,Trauner M.Fibrate treatment for primary biliary cirrhosis[J].Curr Opin Gastroenterol,2014,30(3):279-286.
[2] European Association for the Study of the Liver.EASL clinical practice guidelines:management of cholestatic liver diseases[J].J Hepatol,2009,51(2):237-267.
[3] 姚光弼.临床肝脏病学[M].2版.上海:上海科学技术出版社,2011:556-560.
Yao GB.Introdution clinical liver epidemiology[M].Second Edition.Shanghai:Shanghai Scientific and Technical Publishers,2011:556-560.
[4] 何丽芬,赖伊杰,赖力英,等.原发性胆汁性肝硬化的临床特点[J].中南大学学报(医学版),2015,40(12):1333-1339.
He LF,Lai YJ,Lai LY,et al.Clinical features of patients with primary biliary cirrhosis[J].Journal of Central South University(Medical Edition),2015,40(12):1333-1339.
[5] 秦 雯,余 俊.原发性胆汁性肝硬化自身抗体检测结果分析及临床应用[J].检验医学与临床,2015,12(4):484-485,488.
Qin W,Yu J.Results analysis and clinical application of auto-antibodies detection in primary biliary cirrhosis[J].Laboratory Medicine and Clinic,2015,12(4):484-485,488.
[6] 李秀娥,王 禺,赵 雅.自身免疫性肝病相关自身抗体谱的检测在原发性胆汁性肝硬化患者中的临床应用[J].现代检验医学杂志,2012,27(4):65-67.
Li XE,Wang Y,Zhao Y.Clinical significance of detection autoimmune liver disease related autoantibody profiles in patients with primary biliary cirrhosis[J].Journal of Modern Laboratory Medicine,2012,27(4):65-67.
[7] 张 丽,白石山.原发性胆汁性肝硬化患者血清AMA-M2及其靶抗原检测的阳性率对比[J].内蒙古医学杂志,2013,45(5):529-533.
Zhang L,Bai SS.Contrast of AMA-M2 and its target antigen detection sensitivity in patient’s serum with prinary biliary cirrhosis[J].Inner Mongolia Medical Journal,2013,45(5):529-533.
[8] Bruan S,Berg C,Buck S,et al.Catalytic domain of PDC-E2 contains epitopes recognized by antimitochondrial antibodies in primary biliary cirrhosis[J].World J Gastroenterol,2010,16(8):973-981.
[9] Cuperus FJ,Halilbasic E,Trauner M.Fibrate treatment for primary biliary cirrhosis[J].Curroopin Gastroenterol,2014,30(3):279-286.
[10] 李凤惠,吕洪敏,向慧玲,等.血清抗GP210抗体对PBC患者的诊断价值[J].天津医科大学学报,2011,17(4):549-552.
[11] 唐映梅,包维民,尤丽英,等.原发性胆汁性肝硬化患者血清抗GP210和抗SP100检测的临床意义[J].实用肝脏病杂志,2011,14(2):132-134.
Tang YM,Bao WM,You LY,et al.Clinical significance of serum anti-SP100 and anti-GP210 detection in diagnosis of patients with primary biliary cirrhosis[J].Journal of Clinical Hepatology,2011,14(2):132-134.
[12] 邵幼林,张锁才,吴剑明,等.抗Gp210阳性原发性胆汁性肝硬化患者临床特征[J].海南医学杂志,2016,27(5):766-769.
Shao YL,Zhang SC,Wu JM,et al.Clinical characteristics of patients of primary biliary cirrhosis with anti Gp210 positive[J].Hainan Medical Journal,2016,27(5):766-769.
[13] 李 虎,陈 燕,张 蕾,等.原发性胆汁性肝硬化患者外周血Th9细胞表达增高及其临床意义[J].现代检验医学杂志,2016,31(3):16-18,21.
Li H,Chen Y,Zhang L,et al.Expression of Th9 cells from peripheral blood of primary biliary cirrhosis patients and its clinical significance[J].Journal of Modern Laboratory Medicine,2016,31(3):16-18,21.
