微小RNA-132对胰腺癌SW1990细胞增殖及凋亡的影响
2016-01-11刘海斌,华莹,金洲祥
·论著·
微小RNA-132对胰腺癌SW1990细胞增殖及凋亡的影响
刘海斌华莹金洲祥
【摘要】目的观察微小RNA-132(miR-132)转染人胰腺癌细胞株SW1990后对细胞增殖及凋亡的影响,并探讨其作用机制。方法采用实时荧光定量PCR(RT-qPCR)法检测28例胰腺癌及匹配的癌旁正常胰腺组织miR-132的表达。采用脂质体将miR-132转染SW1990细胞,以未转染及转染错义miR-132的细胞分别作为空白对照和阴性对照。应用CCK-8法、DAPI染色法检测细胞的增殖及凋亡;将转染细胞种植于裸鼠皮下成瘤,应用TUNEL法检测种植瘤细胞凋亡;免疫组化法检测转染细胞的mucin-4、HER-2、p-FAK蛋白表达及种植瘤组织mucin-4、Ki-67蛋白表达。结果28例胰腺癌及癌旁正常胰腺组织miR-132的相对表达量分别为0.46±0.11和1.24±0.36,差异有统计学意义(P<0.05)。转染细胞的miR-132表达量为2.95±0.46,显著高于阴性对照组的0.84±0.17(P<0.05);转染组细胞培养48、72、96 h时的存活率分别为阴性对照组56.5%、44.7%、37.4%(P值均<0.05);细胞凋亡率为41.6%,显著高于阴性对照组的5.7%(P<0.05);转染细胞mucin-4、HER-2、p-FAK蛋白的表达较阴性对照组显著下调(0.76±0.14比2.94±0.42,0.34±0.04比1.75±0.33,0.27±0.03比2.74±0.24,P值均<0.01)。与阴性对照组比较,转染组裸鼠皮下移植瘤生长明显被抑制[(0.23±0.05)g比(0.59±0.13)g,P<0.05],瘤内肿瘤细胞凋亡明显增加[(21.7±4.7)%比(5.2±0.7)%,P<0.05],mucin-4和Ki-67蛋白表达显著下调(64.35±7.16比281.34±36.62,30.75±4.61比148.05±21.34,P值均<0.01)。而阴性对照组与空白对照组间的差异均无统计学意义。结论转染miR-132对胰腺癌SW1990细胞有显著的增殖抑制和凋亡诱导作用,其机制可能与下调mucin-4、HER-2、p-FAK等蛋白的表达有关。
【关键词】胰腺肿瘤;微RNAs;细胞增殖;细胞凋亡
DOI:10.3760/cma.j.issn.1674-1935.2015.01.010
基金项目:省卫生厅资助项目(2012A122)
收稿日期:(2014-07-30)
Effects of microRNA-132 on the proliferation and apoptosis in human pancreatic cancer cells SW1990LiuHaibin,HuaYing,JinZhouxiang.DepartmentofHepaticSurgery,SecondAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325000,China
Correspondingauthor:LiuHaibin,Email:wzykdx203109@126.com
Abstract【】ObjectiveTo observe the effect of miR-132 transfection on proliferation and apoptosis of pancreatic cancer SW1990, and to explore the underlying mechanism. MethodsThe expression of miR-132 in the pancreatic cancer tissue and the adjacent tissues in 28 pancreatic cancer patients were detected by real-time quantitative polymerase chain reaction (RT-qPCR). miR-132 was transfected into SW1990 cells by using liposome method, untransfected cells and cells with missense miR-132 transfection were used as black control and negative control. The proliferation and apoptosis was detected by CCK-8 assay and DAPI staining. The transfected cells were implanted in nude mice as xenograft tumor, and TUNEL was used to detect the apoptosis; immunohistochemistry was used to detect the expression of Ki-67 and mucin-4 protein in the xenograft tumors and mucin-4, HER-2, p-FAK protein in transfected cells. ResultsThe expression levels of miR-132 in pancreatic cancer tissue and adjacent tissues were 0.46±0.11 and 1.24±0.36, and the difference between

作者单位:325000浙江温州,浙江省温州医学院附属第二医院肝胆外科
通信作者:刘海斌,Email: wzykdx203109@126.com
the two groups was statistically significant (P<0.05). The expression level of miR-132 in transfected SW1990 cells was 2.95±0.46, which were significantly higher than those in negative control(0.84±0.17); the survival rate of transfected cells at 48, 72, 96 h was 56.5%, 44.7%, 37.4% of negative control cells. The apoptosis rate in transfected cells was 41.6%, and the corresponding value was 5.7% in negative control, and the difference was statistically significant(P<0.05). The expression levels of mucin-4, HER-2, p-FAK in nagative control were 2.94±0.42, 1.75±0.37 and 2.74±0.24, and the corresponding values in transfected cells were 0.76±0.14, 0.34±0.04 and 0.27±0.03, and the difference between the two groups was statistically significant (P<0.05). In vivo, the growth of xenograft tumors in transfected nude mice was significantly inhibited [(0.23±0.05)vs(0.59±0.13)g,P<0.05], the apoptosis of xenograft tumor cells was significant increased [(21.7±4.7)%vs(5.2±0.7)%,P<0.05]. The expressions of mucin-4 and Ki-67 protein in nagative control was 281.34±36.62 and 148.05±21.34, and the corresponding values in transfection group were 64.35±7.16 and 30.75±4.61, and the difference was statistically significant (P<0.05). ConclusionsmiR-132 transfection has an effect of inhibiting proliferation and promoting apoptosis on SW1990 cells, and the mechanism may be down-regulation of mucin-4, HER-2, p-FAK protein rxpression.
【Key words】Pancreatic neoplasms;MicroRNAs;Cell proliferation;Apoptosis
微小RNA(microRNA, miRNAs)是一种内源性非编码小分子RNA,在组织炎症反应、细胞增殖与凋亡、组织分化以及恶性肿瘤发生和发展等多种病理过程中发挥重要作用[1]。miR-132是当前研究热点之一,它不仅在结肠癌和肺癌等多种恶性肿瘤细胞中表达下调,同时与恶性肿瘤的转移有着密切的关系[2-3]。本研究检测miR-132在胰腺癌组织中的表达,并将miR-132转染至胰腺癌细胞株SW1990,观察其对SW1990细胞增殖和凋亡的影响,探讨其作用机制。
材料与方法
一、材料
收集2004年8月至2013年7月间温州医学院附属第二医院肝胆外科行手术切除并经病理证实的28例胰腺癌及匹配的癌旁正常胰腺组织标本。28例患者中男性15例,女性13例,年龄46~72岁,中位年龄54岁。术前均未行放、化疗。全部标本取材后迅速置于-80℃冰箱保存备用。人胰腺癌细胞株SW1990购自中科院上海细胞库,常规培养、传代。4~6周龄雌性BALB/c-nu/nu品系裸鼠,体重18~20 g,购自中科院上海动物实验中心,饲养于温州医学院动物实验中心SPF级屏障系统的层流架内,室温(25±1)℃,相对湿度40%~60%。
二、方法
1.胰腺癌组织miR-132表达的检测:用Trizol试剂提取胰腺癌组织及癌旁正常胰腺组织的总RNA。采用PrimeScript逆转录试剂盒(日本TakaRa公司)逆转录成cDNA,采用SYBR实时荧光定量试剂盒(Invitrogen公司)行实时定量PCR检测miR-132表达,按说明书操作。PCR反应条件:95℃ 30 s,95℃ 5 s,60℃ 34 s,40循环,72℃延伸7 min。以U6 snRNA作为内参。通过仪器自带软件获取Ct值,根据公式2-△△Ct计算miR-132的相对表达量。
2.miR-132转染细胞及分组:取对数生长期SW1990细胞,按每孔4×106个细胞密度接种于6孔板,每孔2 ml。细胞贴壁后分为空白对照组、阴性对照组及转染组,在培养基中分别加入浓度为50 nmol/L的Lipofectamine 2000、CyTM3标记miR-132错义链、CyTM3标记miR-132 mimic(均购自锐博生物科技有限公司),培养24 h后收集细胞,在荧光显微镜下观察细胞转染效率。
3.转染细胞miR-132表达检测:取转染48 h的SW1990细胞,用Trizol试剂提取细胞总RNA,采用Hairpin-itTMmiRNAs qPCR Quantitation Kit行实时定量PCR检测miR-132表达,按说明书操作,以U6 snRNA作为内参,根据公式2-△△Ct计算miR-132的相对表达量。
4.转染细胞的增殖及凋亡检测:取转染24 h的SW1990细胞制成单细胞悬液,以每孔4×103个细胞密度接种于96孔板,每孔200 μl。细胞贴壁后分别培养24、48、72、96 h,每组设5个复孔,以仅加入等量PBS的孔调零。在各培养时间点结束前1 h加CCK-8溶液(南京凯基生物科技发展有限公司)0.01 ml,继续培养1 h,上酶标仪测各孔波长为490 nm的吸光度值(A490值)。细胞存活率=实验组A490值/对照组A490值×100%。
取转染24 h的SW1990细胞,调整细胞密度为1×105/ml。取1 ml细胞悬液滴于普通载玻片上培养过夜,用甲醛固定,再加DAPI溶液(南京凯基生物科技发展有限公司)染色5 min,置荧光显微镜下观察。取20个低倍视野,每个视野计数200个细胞,计算凋亡细胞占总细胞数的百分率,取均值。
5.转染细胞mucin-4、HER-2、p-FAK、FAK蛋白表达检测:取转染miR-132的SW1990细胞,用细胞裂解液裂解细胞,用Bradford法测量蛋白浓度。取50 μg蛋白常规行蛋白质印迹法检测mucin-4、HER-2、p-FAK、FAK蛋白的表达,以β-actin为内参。兔抗人mucin-4、HER-2、p-FAK、FAK、β-actin一抗均购自Santa Cruz公司,工作浓度均为1∶1 000,HRP标记的羊抗兔IgG工作浓度1∶2 500。最后ECL发光,X片曝光、显影,用Quantity One 4.6.2(BIO, RAD)软件分析各条带灰度值,以目的条带与内参条带的灰度值比表示蛋白的相对表达量。
6.裸鼠皮下胰腺癌种植瘤模型建立及分组:将15只裸鼠按完全随机法分成空白对照组、阴性对照组和转染组,分别在裸鼠右侧大腿背部皮下注射对数生长期的空白对照组、阴性对照组和转染组的SW1990细胞,细胞密度为2×107/ml,每只裸鼠注射0.2 ml。注射4周后处死裸鼠,剥离裸鼠皮下种植瘤标本,称重。
7.皮下种植瘤的细胞凋亡检测:采用TUNEL法检测种植瘤的细胞凋亡。按试剂盒(深圳晶美生物技术有限公司)说明书操作。TUNEL染色阳性细胞判定标准为胞质不着色,胞核染成棕褐色,核固缩,染色质凝集成块或边集。取5个低倍视野,每个视野计数200个细胞。凋亡指数=凋亡细胞数/细胞总数×100%,取均值。
8.种植瘤组织Ki-67、mucin-4蛋白表达检测:取种植瘤组织,经甲醛固定、石蜡包埋、切片,采用免疫组化法检测瘤组织Ki-67、mucin-4蛋白表达。免疫组化SP试剂盒购自德国宝灵曼公司,按说明书操作。在低倍镜下随机选择20个视野,用Image-Pro Plus6.0图像处理软件分析Ki-67、mucin-4的IOD值。
三、统计学处理
结果
一、胰腺癌及癌旁正常胰腺组织miR-132 表达
28例胰腺癌及癌旁正常胰腺组织miR-132的相对表达量分别为0.46±0.11和1.24±0.36,差异有统计学意义(t=6.509,P<0.05)。
二、各组SW1990细胞miR-132的表达量
空白对照组、阴性对照组和转染组SW1990细胞的miR-132表达量分别为0.73±0.15、0.84±0.17和2.95±0.46,差异有统计学意义(t=52.181,P<0.05),转染效率达到实验要求(图1)。

图1 转染miR-132的SW1990细胞
三、各组SW1990细胞增殖及凋亡的变化
转染组SW1990细胞培养48、72、96 h时的存活率分别为阴性对照组56.5%、44.7%、37.4%,差异有统计学意义(F=127.947,P<0.05)。
荧光显微镜下观察到空白对照组和阴性对照组细胞的核完整,大小一致,而转染组细胞核出现明显固缩和凋亡小体等改变(图2)。转染组、阴性对照组、空白对照组的细胞凋亡率分别为41.6%、5.7%和6.4%,差异有统计学意义(F=137.634,P<0.05)。

图2 空白对照组(2A)、阴性对照组(2B)、转染组(2C)细胞的凋亡(荧光显微镜 ×400)
四、各组SW1990细胞mucin-4、HER-2、p-FAK、FAK蛋白表达
转染组细胞mucin-4、HER-2和p-FAK蛋白的表达较两对照组明显下调,而FAK的表达无明显变化(表1,图3)。


组 别mucin-4HER-2p-FAK空白对照组2.57±0.311.38±0.263.12±0.43阴性对照组2.94±0.421.75±0.332.74±0.24转染组0.76±0.140.34±0.040.27±0.03F值18.12923.75342.889P值0.0030.001<0.001

图3 空白对照组(1)、阴性对照组(2)、转染组(3)SW1990细胞的mucin-4、HER-2、p-FAK、FAK蛋白表达
五、miR-132转染对裸鼠胰腺癌皮下种植瘤生长的影响
各组裸鼠皮下种植瘤的成瘤率均为100%,实验过程中裸鼠均无死亡。空白对照组、阴性对照组和转染组平均种植瘤重量分别为(0.48±0.16)、(0.59±0.13)、(0.23±0.05)g(图4),转染组裸鼠种植瘤重量显著低于空白对照组和阴性对照组,差异有统计学意义(F=25.107,P<0.05)。

图4 各组裸鼠的皮下种植瘤大小
六、各组裸鼠胰腺癌皮下种植瘤的细胞凋亡
空白对照组、阴性对照组、转染组种植瘤的细胞凋亡指数分别为(3.8±0.5)%、(5.2±0.7)%、(21.7±4.7)%(图5),差异有统计学意义(F=53.698,P<0.05)。
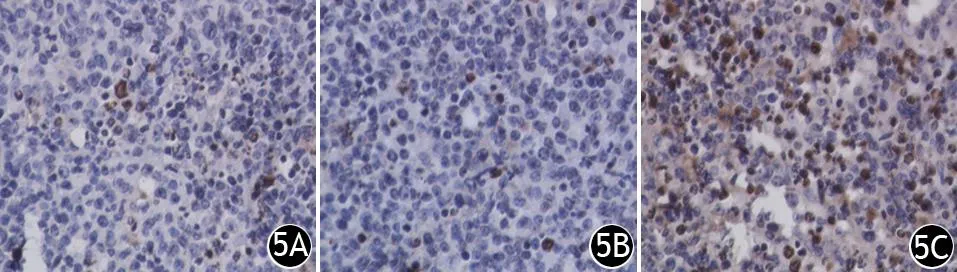
图5 空白对照组(5A)、阴性对照组(5B)、转染组(5C)裸鼠胰腺癌皮下种植瘤的凋亡细胞(TUNEL法 ×400)
七、各组裸鼠胰腺癌皮下种植瘤组织Ki-67、mucin-4表达
转染组种植瘤组织的Ki-67和mucin-4的阳性表达强度均明显低于空白对照组和阴性对照组,差异有统计学意义(图6、表2)。

图6 空白对照组(6A)、阴性对照组(6B)、转染组(6C)裸鼠胰腺癌皮下种植瘤Ki-67(左)、mucin-4(右)的表达(免疫组化 ×400)
近年来研究表明,miRNAs与恶性肿瘤的发生和发展关系密切,其中miR-132 是目前比较公认的抑癌性miRNA。目前已发现几十种miR-132的靶基因,其中大多数已被证实可直接调控肿瘤细胞的增殖、侵袭和转移等[3-4]。但miR-132对胰腺癌生长和凋亡的作用尚未见报道。本研究结果表明,miR-132在胰腺癌组织中的表达明显下调,表明miR-132参与胰腺癌的发展过程。

表2 各组裸鼠种植瘤组织Ki-67和mucin-4的表达 ± s)
癌症的发生是多基因和多因素共同参与的细胞增殖、分化以及凋亡异常的过程。既往的研究报道,miR-132能抑制恶性肿瘤生长,并诱导细胞凋亡[5-6],但尚无体内实验的研究报道。本研究将miR-132转染胰腺癌SW1990细胞,结果显示转染细胞的miR-132表达显著上调,细胞的增殖被抑制,凋亡增加;转染细胞种植于裸鼠皮下形成的胰腺癌皮下种植瘤的体积明显缩小,重量明显降低,且Ki-67阳性表达强度明显下降,种植瘤内细胞凋亡明显增加,进一步证实miR-132对胰腺癌细胞增殖和凋亡的调控作用。
研究发现,mucins家族蛋白在恶性肿瘤的发生和发展以及逃避机体免疫监视等多种病理生理过程中发挥重要作用,在恶性肿瘤的诊断中亦具有一定价值[7-8]。mucin-4在正常组织细胞中低表达或无表达,但在肿瘤组织细胞中高表达[9]。此外,mucin-4与恶性肿瘤细胞对化疗药物耐药性关系密切[10]。膜蛋白HER-2/ErbB-2作为与mucin-4共存蛋白,在稳定mucin-4蛋白中起关键作用,与多种恶性肿瘤的发生和发展密切相关[11-12]。本研究结果显示,SW1990细胞转染miR-132后,mucin-4和HER-2蛋白的表达显著下调,表明mucin-4可能作为miR-132的靶蛋白,在调控胰腺癌细胞增殖和凋亡过程中发挥一定的作用。文献报道,FAK作为HER-2的下游蛋白[13],其磷酸化(p-FAK)与恶性肿瘤的发生、发展、侵袭和转移等行为密切相关[14]。本研究结果显示,转染miR-132后可显著抑制SW1990细胞p-FAK的表达,与mucin-4和HER-2表达下调结果相一致。
参考文献
[1]Wu R, Li F, Zhu J, et al. A functional variant at miR-132-3p, miR-212-3p, and miR-361-5p binding site in CD80 gene alters susceptibility to gastric cancer in a Chinese Han population[J]. Med Oncol, 2014, 31(8):60.
[2]Zheng YB, Luo HP, Shi Q, et al. miR-132 inhibits colorectal cancer invasion and metastasis via directly targeting ZEB2[J]. World J Gastroenterol, 2014, 20(21):6515-6522.
[3]You J, Li Y, Fang N, et al. MiR-132 suppresses the migration and invasion of lung cancer cells via targeting the EMT regulator ZEB2[J]. PLoS One, 2014, 9(3):e91827.
[4]You J, Li Y, Fang N, et al. MiR-132 suppresses the migration and invasion of lung cancer cells via targeting the EMT regulator ZEB2[J]. PLoS One, 2014, 9(3):e91827.
[5]Wong HK, Veremeyko T, Patel N, et al. De-repression of FOXO3a death axis by microRNA-132 and -212 causes neuronal apoptosis in Alzheimer′s disease[J]. Hum Mol Genet, 2013, 22(15):3077-3092.
[6]Cheng AM, Byrom MW, Shelton J, et al. Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis[J]. Nucleic Acids Res, 2005, 33(4):1290-1297.
[7]Dharmaraj N, Chapela PJ, Morgado M, et al. Expression of the transmembrane mucins, MUC1, MUC4 and MUC16, in normal endometrium and in endometriosis[J]. Hum Reprod, 2014, 29(8):1730-1738.
[8]Nakayama J. Dual roles of gastric gland mucin-specific o-glycans in prevention of gastric cancer[J]. Acta Histochem Cytochem, 2014, 47(1):1-9.
[9]Shibahara H, Higashi M, Koriyama C, et al. Pathobiological implications of mucin (MUC) expression in the outcome of small bowel cancer[J]. PLoS One, 2014, 9(4):e86111.
[10]Workman HC, Sweeney C, Carraway KL 3rd. The membrane mucin Muc4 inhibits apoptosis induced by multiple insults via ErbB2-dependent and ErbB2-independent mechanisms[J]. Cancer Res, 2009, 69(7):2845-2852.
[11]Kaur S, Sharma N, Krishn SR, et al. MUC4-mediated regulation of acute phase protein lipocalin 2 through HER2/AKT/NF-κB signaling in pancreatic cancer[J]. Clin Cancer Res, 2014, 20(3):688-700.
[12]Chaturvedi P, Singh AP, Chakraborty S, et al. MUC4 mucin interacts with and stabilizes the HER2 oncoprotein in human pancreatic cancer cells[J]. Cancer Res, 2008, 68(7):2065-2070.
[13]Luo CW, Wu CC, Ch'ang HJ. Radiation sensitization of tumor cells induced by shear stress: the roles of integrins and FAK[J]. Biochim Biophys Acta, 2014, 1843(9):2129-2137.
[14]Owens LV, Xu L, Dent GA, et al. Focal adhesion kinase as a marker of invasive potential in differentiated human thyroid cancer[J]. Ann Surg Oncol, 1996, 3(1):100-105.
(本文编辑:屠振兴)
