模拟航天失重大鼠自发活动的改变
2016-01-09薛涛,邬丽莎,陈善广等
研究报告
模拟航天失重大鼠自发活动的改变
薛涛1,2,邬丽莎1,陈善广3,李莹辉4,曲丽娜4,刘新民2,王琼1
(1.泸州医学院,四川 泸州646000;2.中国医学科学院药用植物研究所,北京100093;
3.中国航天员科研训练中心人因工程重点实验室,北京100094;
4.中国航天员科研训练中心航天医学基础与应用国家重点实验室,北京100094)
【摘要】目的通过观察模拟航天失重尾吊21 d大鼠自主活动的改变,为航天失重引起功能改变提供评价方法以及为航天防护措施研究提供参考。方法30只Wistar大鼠随机分为对照组、假尾吊组、尾吊组,每组10只。将所有动物置于模拟失重尾部悬吊实时监测装置中进行造模21 d,造模期间每周检测动物摄食饮水量和体重变化,同时,每天8:00pm提取当天被监控动物(8:00am~12:00am)、(2:00pm~6:00pm)、白天(8:00am~8:00pm)、晚上(8:00pm~8:00am)、24 h等5个时段自主活动数据。 结果 正常大鼠上、下午运动量无显著差异,晚上活动量显著高于白天活动量,运动时间和运动路程是白天的2~3倍;尾吊组大鼠在造模10 d后昼夜节律开始紊乱,昼夜运动量越来越接近,假尾吊组大鼠造模10 d内运动状态不稳定,个体差异较大,10 d后趋于稳定,昼夜运动量比值接近对照组大鼠。结论正常大鼠为夜行性动物,晚上活动量为白天活动量的2~3倍,假尾吊组大鼠经21 d造模后昼夜节律不改变,而尾吊21 d后大鼠昼夜节律逐渐消失。
【关键词】模拟失重;大鼠;自发活动
[基金项目]国家自然科学
[作者简介]薛涛,女,硕士生,研究方向:神经药理,E-mail: 549488512xuetao@sina.com。
[通讯作者]王琼,女,医学博士,副研究员,研究方向:中药神经药理学与航天医学,E-mail: wqimplad@126.com。
【中图分类号】Q95-33 R332【文献标识码】 A
doi:10.3969.j.issn.1671.7856. 2015.001.004
The different characteristics of spontaneous activity in
simulated weightlessness in rats
XUE Tao1,2,WU Li-Sha1,CHEN Shan-guang3,LI Ying-hui4,QU Li-na4,LIU Xin-min2,WANG Qiong1
(1. Luzhou Medical College, Sichuan Luzhou 646000,China; 2.Institute of Medicinal Plant Development,
Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China;
3. National Key Laboratory of Human Factors Engineering, China Astronaut Research and Training Center,
Beijing 100094, China; 4.State Key Laboratory of Space Medicine Fundamentals and Application,
China Astronaut Research and Training Center, Beijing 100094, China)
Abstract【】ObjectiveTo observe the different characteristics of spontaneous activitiy after simulated weightlessness 21 days in rats, aimed to provide a evaluation method for space weightlessness induced function change in human beings and to provide a reference for researches on the astronauts protective measures. Methods 30 Wistar male rats were randomly divided into three groups, the control group, the sham tail-suspended hindlimb unloading group (the sham group), the tail-suspended hindlimb unloading group (the suspending group), ten animals in each group. All animals were placed in the simulated space flight environmental equipment which has a real-time monitor system for 21 days. During the 21 days, the intake of water, food and the body weight were measured every week. Meanwhile, five independent activity data were collect every day, for example, morning(8:00am~ 12:00am), afternoon(2:00pm~6:00pm), daytime(8:00am~8:00pm),night(8:00pm~8:00am),and whole day (8:00am~8:00am). ResultsThe spontaneous activity of normal rats in the control group between morning and afternoon had no significant difference, but it is significantly between night and daytime. The movement time and distance in night are 2-3 times than that of the daytime. After 10 days of tail suspending, the circadian rhythm was disordered, and the spontaneous activity in day and night become more similar in rats of the suspending group. Because of the individual difference, the spontaneous activity is not stable at the first 10 days in rats of the sham group, but after 10 days, it become close to the control group. Conclusion Rat is nocturnal animal and sleeps in the daytime, the spontaneous activity in night is 2-3 times as compared with the daytime. The sham tail-suspended hindlimb unloading 21 days can not influence the circadian rhythm in rats. Tail suspending 21 days will caused to the disappearance in the circadian rhythm in rats.
【Key words】Simulated weightlessness;Rats;Spontaneous acitivity
随着我国航天事业的发展,近年来,越来越多的科学家将注意力集中在航天医学研究中。航天飞行环境中,航天员所处的失重状态会导致机体流体静压消失,血液头向分布,下肢血液减少,从而引起各种生理和心理上的改变,造成其工作能力的下降[1-2],因此在地面建立航天模拟环境进行相关的科学研究显得尤其重要[3-6]。大鼠尾部悬吊法是目前应用最为广泛的动物模拟失重效应模型[7-10],有报道指出[11],模拟失重尾部悬吊法可导致大小鼠心血管系统功能紊乱[12-13]、失重骨丢失[14-15]、肌肉萎缩[16-17]、认识功能障碍[18]等多种身心疾病,但模拟失重尾部悬吊对动物自发活动的研究却鲜有报道。本课题在研究模拟失重环境对动物的行为影响过程中,研制了动物模拟失重尾部悬吊实时监测装置。本实验应用此装置,监测全天24 h内各个时段大鼠的运动状态,旨在通过研究模拟航天失重所致大鼠自发活动的改变,来研究航天环境对航天员可能存在的影响,以期为地面模拟失重条件下相关机制研究及防护措施提供实验参考,为航天医学问题研究提供实验依据。
1材料和方法
1.1实验动物
清洁级雄性Wistar大鼠,体重(180~200 g),购自北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】。实验在中国医学科学院药用植物研究所进行【SYXK(京)2008-0019】,光/暗周期12h/12h,光照时间8:00~20:00,实验室温度22℃~25℃,所有动物均可自由获得水和食物。
1.2实验设备和装置
大鼠尾吊模拟失重尾部悬吊实时监测装置由中国航天员中心,中国医学科学院药用植物研究所和泸州医学院联合研发。该仪器采用计算机处理系统自动记录,首次实现长期、实时在线的监测、分析、提取处理大鼠模拟失重尾吊和非尾吊状态下的活动数据、活动轨迹,可检测不同时段大鼠的尾吊运动总时间、尾吊运动路程、尾吊运动速度、非尾吊运动速度、非尾吊运动时间、非尾吊运动路程等多个参数。采用隔音隔光尾吊笼,每笼放1只大鼠,四笼为一个单元,箱顶配置一个与计算机相连的摄像头,并用图像采集卡采集动物活动信息,由软件自动实时记录、保存、分析处理大鼠活动全过程。模拟失重尾部悬吊实时监测装置硬件连接图如图1:
1.3分组及造模
大鼠适应性饲养3 d后,按体重随机将30只Wistar大鼠分为3组:对照组,假尾吊组,尾吊组,每组10只。对照组:大鼠置于模拟失重尾部悬吊实时监测装置中,不予其他任何处理。假尾吊组:大鼠置于模拟失重尾部悬吊实时监测装置中,尾部吊起,但后肢及躯干并未离开地面。尾吊组:大鼠置于模拟失重尾部悬吊实时监测装置中,大鼠尾部吊起并抬高,双后肢离地,躯干与水平面成30°,前肢着地。所有动物均单笼饲养,自由进食饮水。
1.4行为学检测
动物按相应分组在模拟失重尾部悬吊实时监测装置中造模3周,造模期间每天8:00pm提取当天被监控动物(8:00am~12:00am)、(2:00pm~6:00pm)、(8:00am~8:00pm)、(8:00pm~8:00am)、24 h等5个时段自主活动数据。同时,每周检测动物摄食饮水量和体重变化。摄食饮水量测定:造模前一天和造模第7、14、21天分别测定一次。测量当天上午8:00每只动物给予200 g饲料,200 mL水,第二天同一时刻收集剩余饲料和饮水,摄食饮水量以食物饮水消耗绝对值来评定。体重变化测定:在造模前一天和造模第7、14、21天分别称量体重并计算体重变化率,体重变化率=(第N周体重-实验前1天体重)/实验前1 d体重。
1.5统计分析

2结果
2.1摄食饮水量的变化
如表1所示,在实验开始前各组之间摄食饮水量均无统计学差异。造模3周后各组大鼠摄食饮水量也无统计学差异。
2.2体重的变化
如表2所示,大鼠体重在实验前无统计学差异,体重变化率在实验后1周出现显著性变化(P< 0.05),假尾吊组和尾吊组大鼠体重显著低于对照组(P< 0.05),这种差异持续到第3周,且有逐步增大的趋势。假尾吊组和尾吊组之间大鼠体重无统计学差异。
2.3不同时间段尾吊大鼠运动状态的变化
由图2所示,在各个时段对照组大鼠运动时间都少于假尾吊组和尾吊组;假尾吊组和尾吊组大鼠运动时间无显著性差异,但在造模1~10 d假尾吊运动状态不稳定,个体差异也很大,10 d之后运动状态趋于稳定。
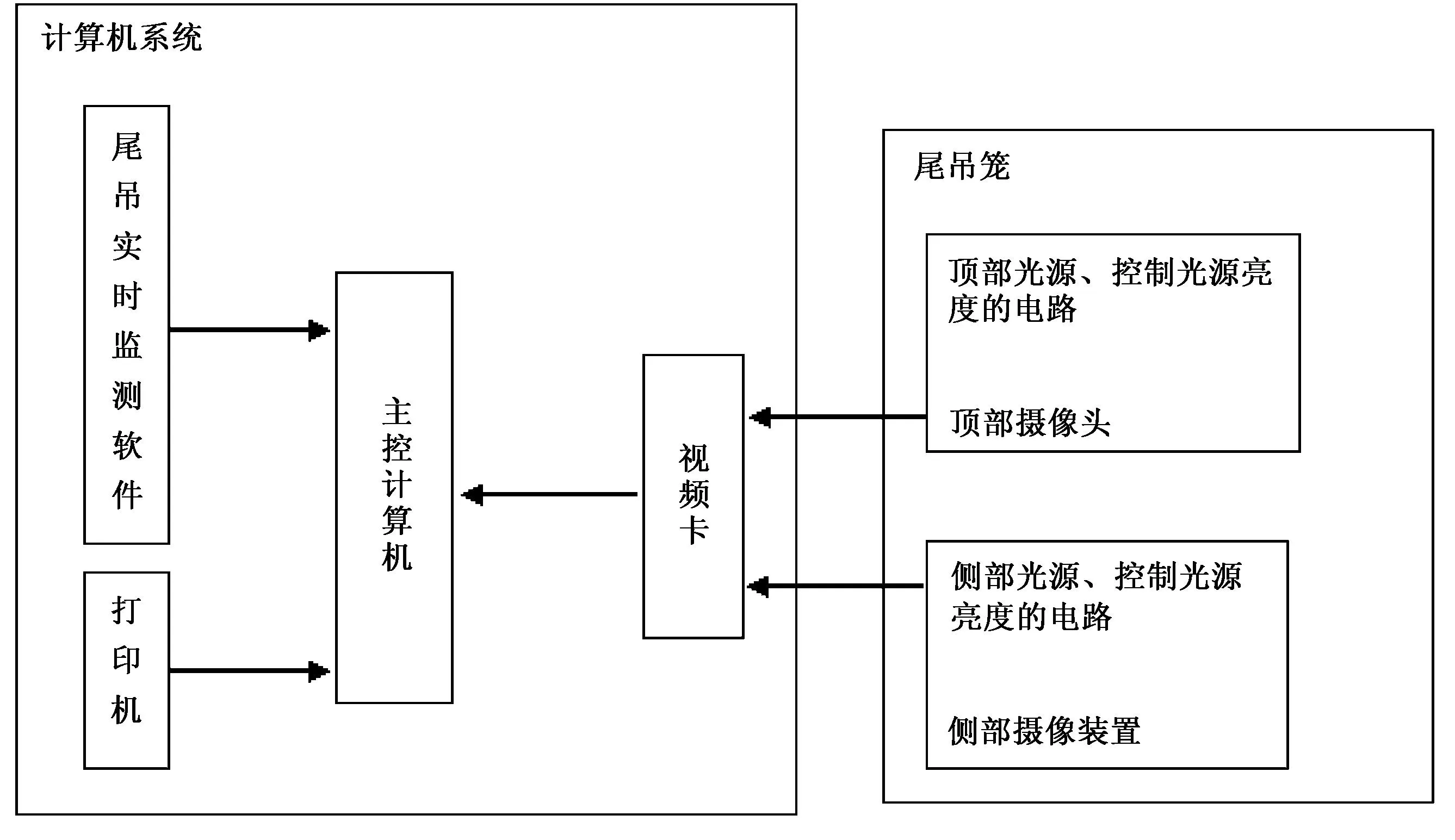
图1 大鼠模拟失重尾部悬吊实时监测装置硬件连接图 Fig.1 The schematic diagram of the real-time monitoring system for tail-suspend of rats

摄食量Food-intake饮水量Water-intake对照组Control假尾吊组Shamtailsuspension尾吊组Tailsuspension对照组Control假尾吊组Shamtailsuspension尾吊组Tailsuspension实验前1donedaybefore74.96±1.6869.44±3.4574.56±1.5293.22±3.2391.18±2.7188.82±2.92造模1周Thefirstweek74.88±2.3069.41±3.2377.02±1.1087.07±7.6789.83±2.5290.51±3.27造模2周Thesecondweek68.87±1.4864.61±4.2072.14±1.8799.35±3.5895.48±4.5998.93±3.00造模3周Thethirdweek100.73±1.5996.22±1.0796.75±2.73119.65±6.06130.61±20.63119.52±5.22
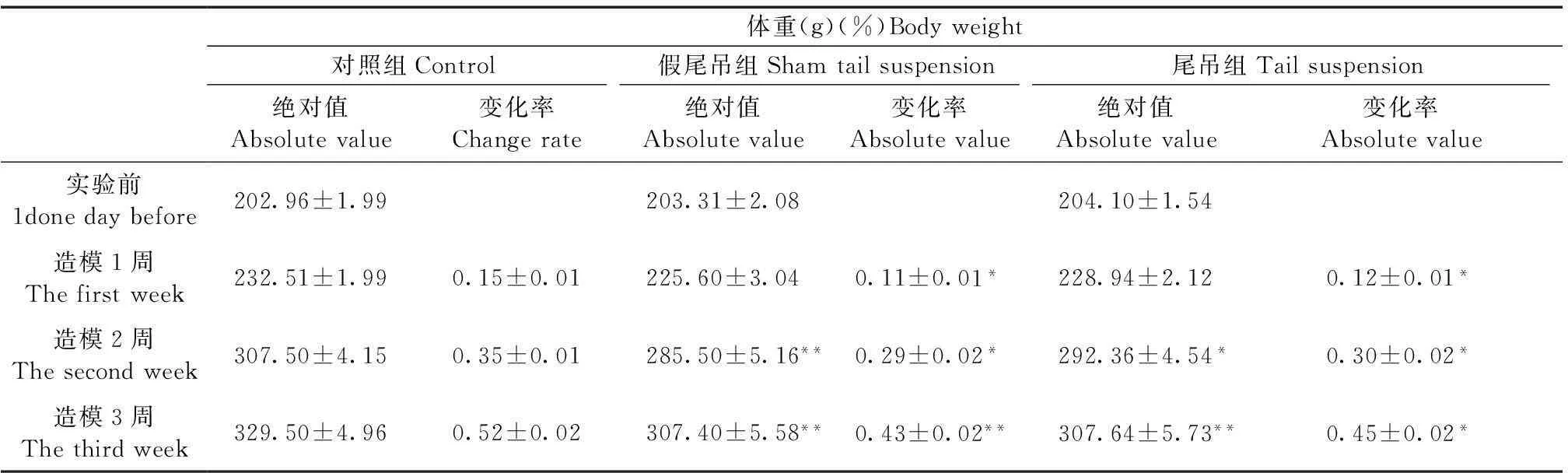
表2 尾部悬吊法对大鼠体重的影响
注:与对照组相比,*P< 0.05,**P< 0.01。
Note:*P< 0.05,**P< 0.01, as comared with Control group.

图2 尾部悬吊法对大鼠1天中不同时间段运动时间的影响 Fig.2 Effects of tail-suspended on movement time of different times of the day
图2A:假尾吊组与对照组相比差异显著,表现在第2、11天(P< 0.05),第1、4、5、6、12天(P< 0.01),尾吊组与对照组相比差异显著,表现在第2、3、9、10、13、15、18天(P< 0.05),第12天(P< 0.01),第11天(P< 0.001);
图2B:假尾吊组与对照组相比差异显著,表现在第10、11、18天(P< 0.05),第1、2、3、4、5、7、8、9、16、19天(P< 0.01),第12天(P< 0.001),尾吊组和对照组相比差异显著,表现在第1、2、14、16、18天(P< 0.05),第4、12、13、15天(P< 0.01),第9、10、11、17天(P< 0.001);
图2C:假尾吊组与对照组相比差异显著,表现在第10、13、18天(P< 0.05),第1、2、3、4、5、6、7、8、11、16、19天(P< 0.01),第9、12天(P< 0.001),尾吊组与对照组相比差异显著,表现在第1、3天(P< 0.05),第2、4、13、14、15、16、17、18天(P< 0.01),第9、10、11、12天(P< 0.001);
图2D:假尾吊组与对照组相比差异显著,表现在第1、4、6、8天(P< 0.05),第2、3天(P< 0.01),尾吊组与对照组相比差异显著,表现在第1、2、19天(P< 0.05),第3、5天(P< 0.01);
图2E:假尾吊组与对照组相比差异显著,表现在第5、7、11、12、19天(P< 0.05),第2、3、4、6、8天(P< 0.01),第1天(P< 0.001),尾吊组与对照组相比差异显著,表现在第3、13天(P< 0.05),第2、11天(P< 0.01),第1天(P< 0.001)。
如图3,三组大鼠运动路程趋势与运动时间趋势一致,对照组大鼠运动路程最短,尾吊组次之,假尾吊组运动路程最长。造模前10 d假尾吊组运动状态不稳定,10 d后运动状态趋于稳定。
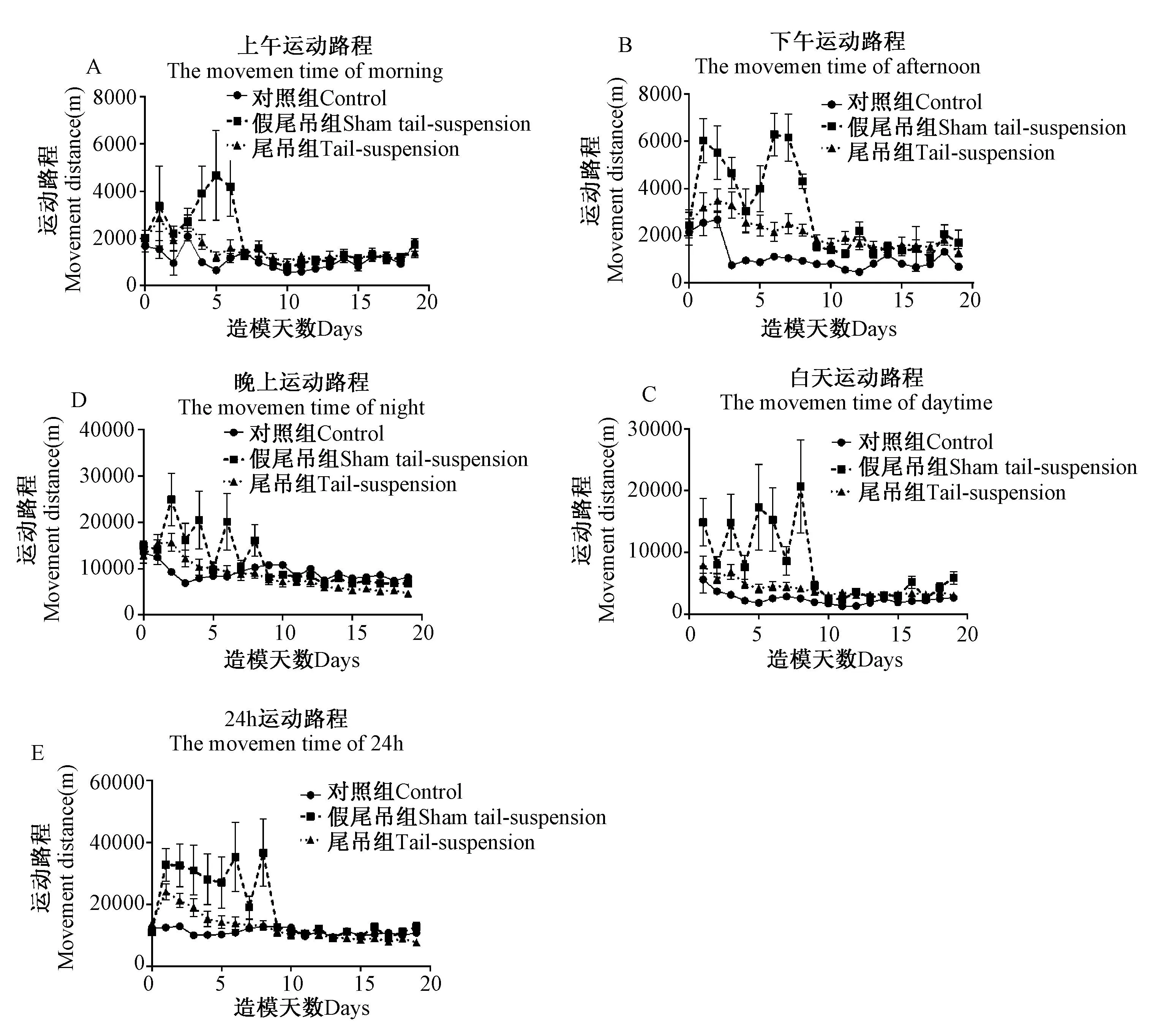
图3 尾部悬吊法对大鼠1天中不同时间段运动路程的影响 Fig.3 Effects of tail-suspended on movement distance of different times of the day
图3A:假尾吊组与对照组相比差异显著,表现在第2、5、12天(P< 0.05),第1、4、6天(P< 0.01),尾吊组与对照组相比差异显著,表现在第2、10、12天(P< 0.05),第11天(P< 0.001);
图3B:假尾吊组与对照组相比差异显著,表现在第2、10、11天(P< 0.05),第3、4、5、6、7、9、12、16、19天(P< 0.01),尾吊组与对照组相比差异显著,表现在第4、15天(P< 0.05),第10、12、13、17天(P< 0.01),第9、11天(P< 0.001);
图3C:假尾吊组与对照组相比差异显著,表现在第1、10、18天(P< 0.05),第2、4、7、11、12、16、19天(P< 0.01),第9天(P< 0.001),尾吊组与对照组相比差异显著,表现在第9、13、15、17天(P< 0.05),第10、11、12天(P< 0.001);
图3D:假尾吊组与对照组相比第3、9、17天(P< 0.05),尾吊组与对照组相比差异显著,表现在第9、12、15、16、18天(P< 0.05),第10、14、17、19天(P< 0.01);
图3E:假尾吊组与对照组相比差异显著,表现在第1、7天(P< 0.05),第3、4、5、6、8天(P< 0.001),尾吊组与对照组相比差异显著,表现在第4、5天(P< 0.05),第2、3、4天(P< 0.01)。
2.4大鼠昼夜运动状态的变化
如图4所示,正常大鼠晚上(8:00pm~8:00am)运动时间是白天(8:00am~8:00pm)运动时间的2~3倍。假尾吊组大鼠在前10d内运动状态不稳定,10 d后运动状态趋于稳定,昼夜运动量也表现出晚上运动量是白天运动量的2~3倍(图4 B)。尾吊大鼠的昼夜运动量差异随着尾吊天数的增加而减少,最终达到昼夜运动量无显著差异(图4 C,图6 C)。
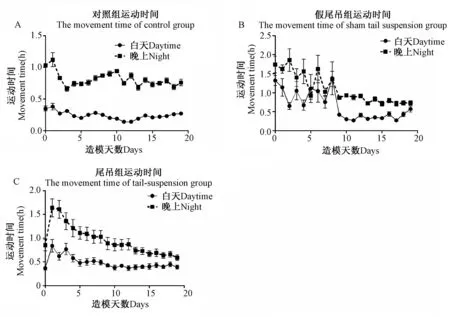
图4 尾部悬吊法对大鼠昼夜运动时间的影响 Fig.4 Effects of tail-suspended on movement time of day and night
图4A白天:与实验前1天相比差异显著,表现在第4、5、9、10、13、15、16天(P< 0.05),第1、11、12天(P< 0.01);
图4A晚上:与实验前1天相比差异显著,表现在第9天(P< 0.05),第10天(P< 0.01),第1天(P< 0.001);
图4B白天:与实验前1天相比差异显著,表现在第3、5、6天(P< 0.05),第1、8天(P< 0.001);
图4B晚上:与实验前1天相比差异显著,表现在第3、4、8天(P< 0.01),第1、2、6天(P< 0.001);
图4C白天:与实验前1天相比差异显著,表现在第4、5、7天(P< 0.05),第2天(P< 0.01),第1、3天(P< 0.001);
图4C晚上:与实验前1天相比差异显著,表现在第1、2天(P< 0.001)。
图5A白天:与实验前1天相比差异显著,表现在第4、9、13、15、16天(P< 0.05),第2、5、6、10、11、12天(P< 0.01);
图5A晚上:与实验前1天相比差异显著,表现在第9天(P< 0.05),第10天(P< 0.01),第1天(P< 0.001);
图5B白天:与实验前1天相比差异显著,表现在第3、8天(P< 0.01),第2、6天(P< 0.001);
图5B晚上:与实验前1天相比差异显著,表现在第5、6天(P< 0.05),第1、8天(P< 0.001);
图5C白天:与实验前1天相比差异显著,表现在第4、7天(P< 0.05),第2天(P< 0.01),第3天(P< 0.001);
图5C晚上:与实验前1天相比差异显著,表现在第5、7天(P< 0.05),第2天(P< 0.01)。
图6A白天:与实验前1天相比差异显著,表现在第2天(P< 0.05),第1天(P< 0.001);
图6A晚上:与实验前1天相比差异显著,表现在第8、12天(P< 0.05),第9、10天(P< 0.01),第1天(P< 0.001);
图6B白天:与实验前1天相比差异显著,表现在第1、3、6天(P< 0.01),第5、8天(P< 0.001);
图6B晚上:与实验前1天相比差异显著,表现在第3、8天(P< 0.05);
图6C白天:与实验前1天相比差异显著,表现在第4、6天(P< 0.05),第2天(P< 0.01),第1、3天(P< 0.001);
图6C晚上:与实验前1天相比差异显著,表现在第3天(P< 0.05),第1、2天(P< 0.001)。

图5 尾部悬吊法对大鼠昼夜运动速度的影响 Fig.5 Effects of tail-suspended on movement speed of dya and night
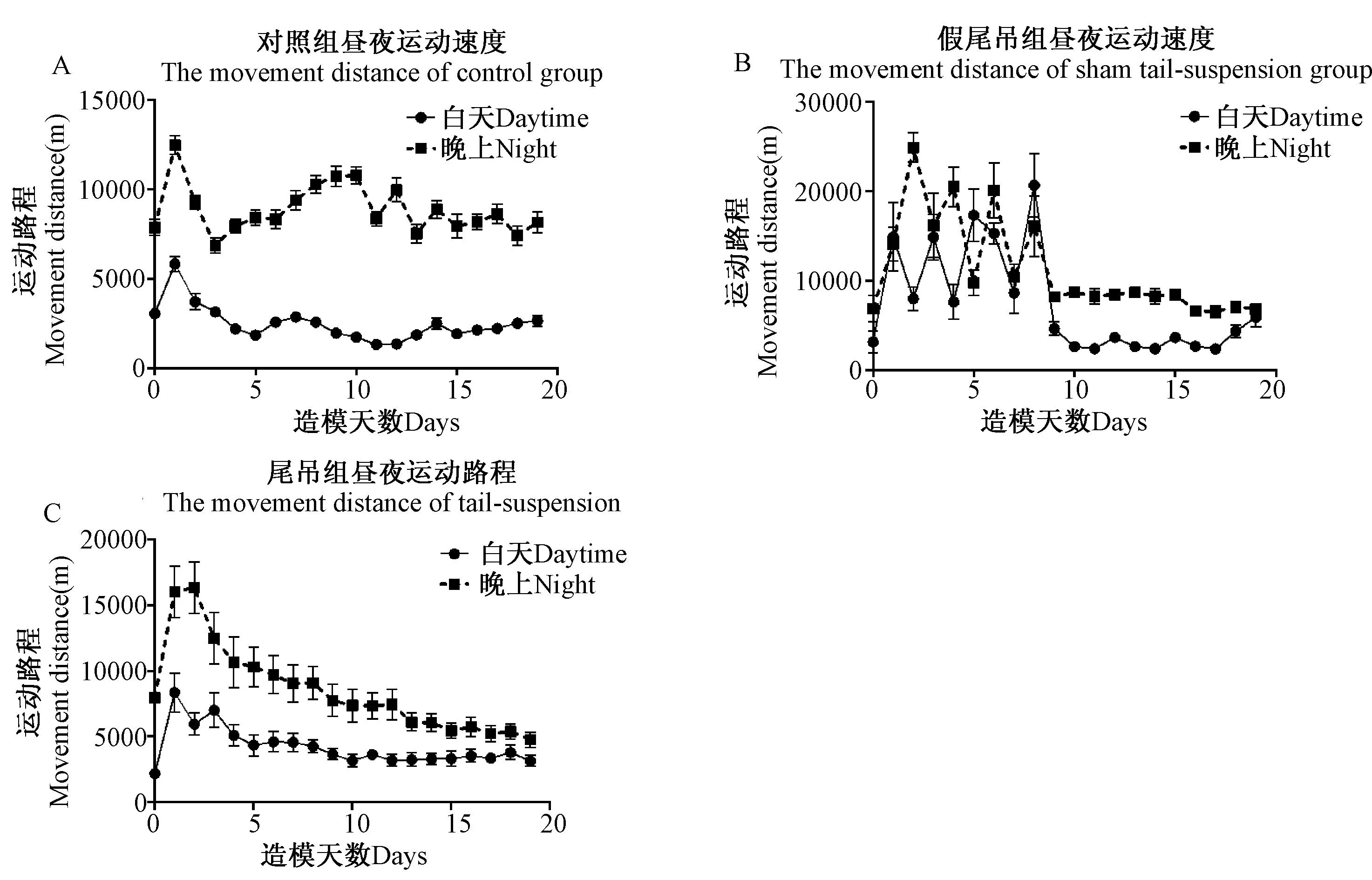
图6 尾部悬吊法对大鼠昼夜运动路程的影响 Fig.6 Effects of tail-suspended on movement distance of day and night
2.5大鼠上下午运动状态的变化
如图7,正常大鼠上午(8:00am~12:00am)和下午(2:00pm~6:00pm)运动量没有较大差异。
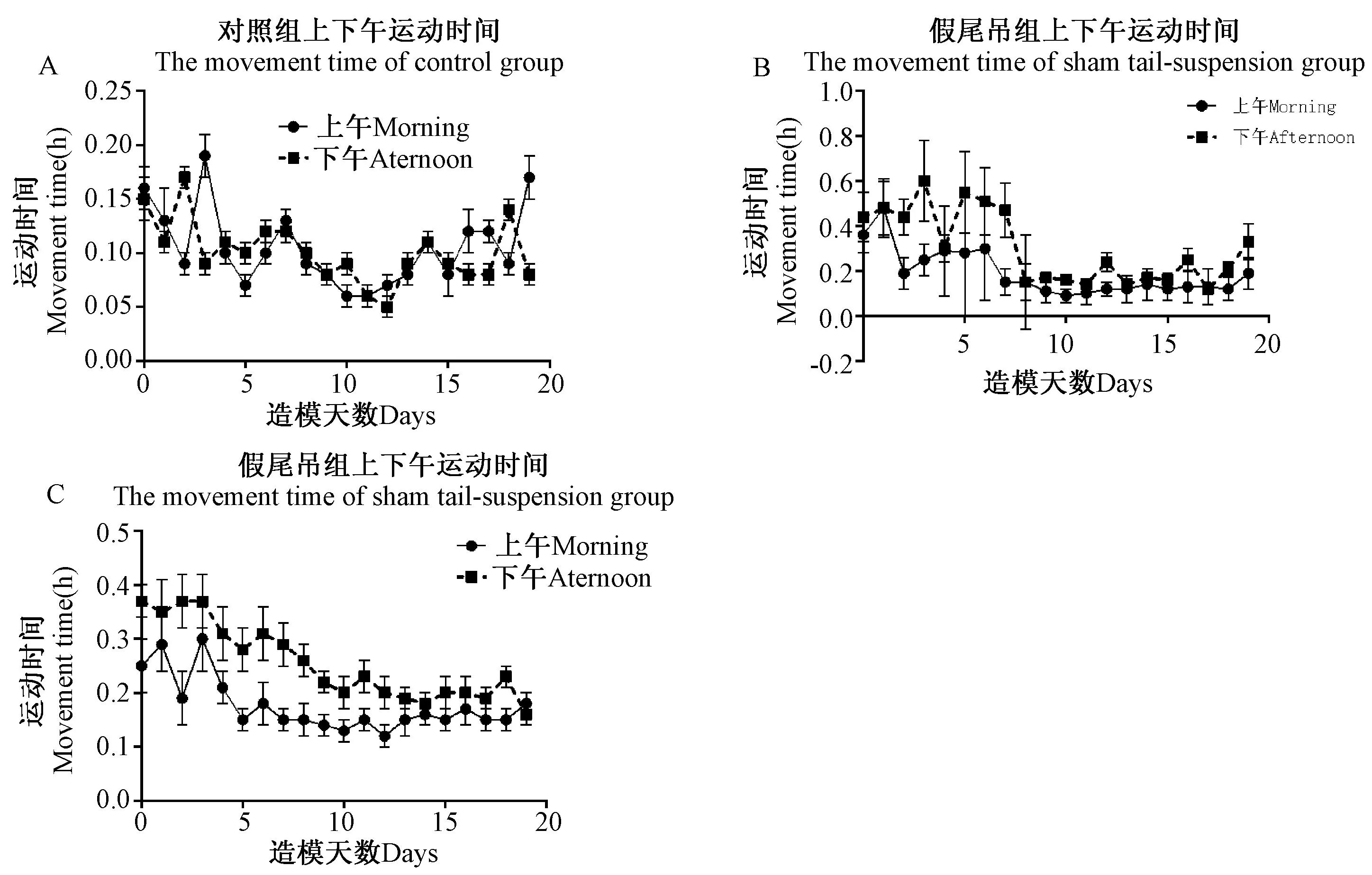
图7 尾部悬吊法对大鼠上下午运动时间的影响 Fig.7 Effects of tail-suspended on movement time of morning and afternoon
图7A上午:与实验前1天相比差异显著,表现在第10、11、19天(P< 0.05),第3天(P< 0.001);
图7A下午:与实验前1天相比差异显著,表现在第1天(P< 0.05);
图7B上午:与实验前1天相比差异显著,表现在第4、6天(P< 0.05),第5天(P< 0.01),第1天(P< 0.001);
图7B下午:与实验前1天相比差异显著,表现在第1、5、6、7、8天(P< 0.05),第3天(P< 0.01);
图7C上午:与实验前1天相比差异显著,表现在第3、16、19天(P< 0.05),第2、4天(P< 0.01),第1天(P< 0.001);
图7C下午:与实验前1天相比差异显著,表现在第5、8、9、11、12、18天(P< 0.05),第4、7天(P< 0.01),第2、3、6天(P< 0.001)。
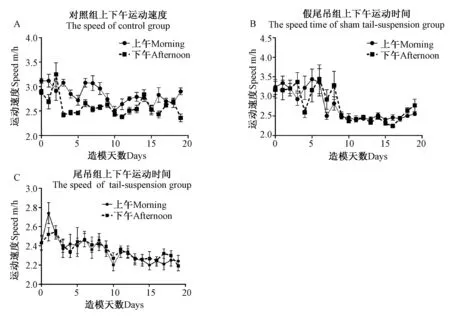
图8 尾部悬吊法对大鼠上下午运动速度的影响 Fig.8 Effects of tail-suspended on movement speed of morning and afternoon
图8A上午:与实验前1天相比差异显著,表现在第10、11、19天(P< 0.05),第1、8、16天(P< 0.01),第2、3、4、5、6天(P< 0.001);
图8A下午:与实验前1天相比差异显著,表现在第2天(P< 0.05),第4、11天(P< 0.01),第5、10、15天(P< 0.001);
图8B上午:与实验前1天相比差异显著,表现在第4、6天(P< 0.05),第5天(P< 0.01),第1天(P< 0.001);
图8B下午:与实验前1天相比差异显著,表现在第1、5、6、7、8天(P< 0.05),第4天(P< 0.01);
图8C上午:与实验前1天相比差异显著,表现在第1天(P< 0.05),第2、4天(P< 0.01),第1天(P<0.001);
图8C下午:与实验前1天相比差异显著,表现在第5、8天(P< 0.05),第3天(P< 0.01)。
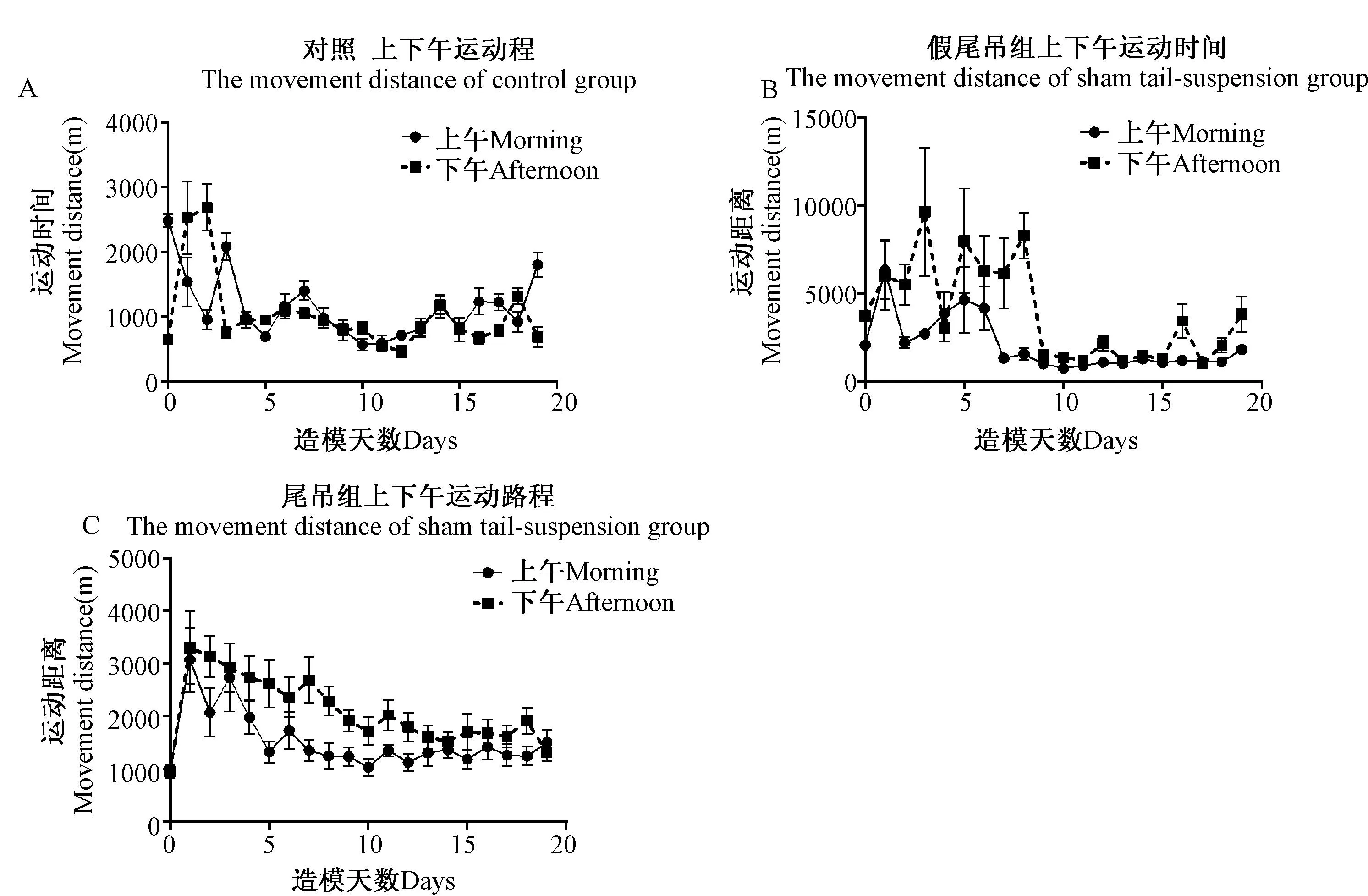
图9 尾部悬吊法对大鼠上下午运动路程的影响 Fig.9 Effects of tail-suspended on movement distance of morning and afternoon
图9A上午:与实验前1天相比差异显著,表现在第10、11天(P< 0.05),第19天(P< 0.01),第3天(P< 0.001);
图9A下午:与实验前1天相比差异显著,表现在第1、2天(P< 0.01);
图9B上午:与实验前1天相比差异显著,表现在第4、5、6天(P< 0.01),第1天(P< 0.001);
图9B下午:与实验前1天相比差异显著,表现在第5天(P< 0.05),第3天(P< 0.01);
图9C上午:与实验前1天相比差异显著,表现在第4天(P< 0.05),第2、3天(P< 0.01),第1天(P< 0.001);
图9C下午:与实验前1天相比差异显著,表现在第6、8天(P< 0.05),第4、5、7天(P< 0.01),第1、2、3天(P< 0.001)。
3讨论
自发活动是动物最基本的行为表现,在精神药理学、行为药理学、毒理学等各个领域都应用广泛[19],一般认为,中枢神经兴奋时总活动量增加,中枢神经抑制时总活动量减少[20],所以,动物自发活动实验是评价中枢神经兴奋或抑制状态的一项重要指标。随着计算机技术的发展,空场实验结合计算机数字化采样和分析技术,可自动记录短时间内实验动物自发活动的全过程,并分析其运动轨迹,得到一系列行为学指标,使实验更加高效、客观。本实验室在长期从事神经精神药物研究过程中,结合计算机视频跟踪技术,研制完成了自主活动实时测试分析处理系统并建立了相应的评价指标[21]。而该实验所用的动物模拟失重尾部悬吊实时监测装置就是复合了模拟航天失重环境及动物自主活动监测等多重功能的集模型制作和实验监控为一体的复合系统。
本实验研究证明,与对照组相比,假尾吊组、尾吊组大鼠摄食饮水量21 d内没有发生明显的改变,但体重却在造模1周后与对照组比出现了显著性差异。刘军莲等[22]在实验中也得出相似的结果,分析原因可能是由于尾吊大鼠和假尾吊大鼠长期处于应激状态,摄入的食物和水更多用于克服应激引起的不适感,因此尽管这三组大鼠摄食饮水量相同,但尾吊组和假尾吊组体重增长速率减慢。
啮齿类动物有昼伏夜行的昼夜节律特点,反应高级生物节律状况,迄今,对短时间内动物自发活动及对粗略的昼夜活动特点有较多研究[23],但缺乏对较长时间正常动物及模拟失重状态下动物自发活动的连续观察。本实验利用大鼠模拟失重尾部悬吊实时监测装置,连续21 d实时监测大鼠自由活动、假尾吊、尾吊三种状态下,上午(8:00am~12:00am)、下午(2:00pm~6:00pm)、白天(8:00am~8:00pm)、晚上(8:00pm~8:00am)、全天24 h,5个时段自主活动数据并进行分析,监测结果显示,对照组大鼠下午运动时间较假尾吊组和尾吊组少。而运动速度这一指标,对照组最快,假尾吊组次之,尾吊组最慢,这一状态晚上最为突出,这可能与假尾吊组和尾吊组尾部束缚有关。3组大鼠全天运动路程基本一致,下午对照组运动路程最少,晚上尾吊组运动路程最少。正常大鼠晚上运动时间和运动路程是白天的2~3倍,上下午运动量无显著差异。由此可见,在模拟失重状态下研究动物活动状态时,应把昼夜节律对模拟失重动物的活动指标的影响排除在外。
视交叉上核是哺乳动物最重要的昼夜节律起搏器,它调整着哺乳动物一系列生理行为和活动[24],若该核团被损毁,大鼠的各种内源性行为和激素分泌的昼夜节律消失,包括夜间活动,白天睡眠的行为。昼夜自发活动发现正常大鼠晚上运动量是白天运动量的2~3倍,尾吊组大鼠昼夜差异逐渐缩小,造模10 d后,昼夜活动量相近。假尾吊组虽说在造模10 d内运动状态不稳定,个体差异大,但10 d后,大鼠适应假尾吊环境,昼夜活动量比值接近对照组大鼠。说明大鼠昼夜节律的消失与尾部束缚无关,而与失重相关,由此可以推测,假尾吊大鼠虽说初期昼夜节律被打乱,但大脑并未受到实质性的损伤,这种昼夜节律的紊乱是可逆的;尾吊大鼠昼夜节律逐渐消失,可能是由于视交叉上核受到实质性损伤所致,具体机制需要下一步更详细的研究。
参考文献:
[1]Newberg AB. Changes in the central nervous system and their clinical correlates during long-term spaceflight[J].Aviat Space Environ Med,1994,65:562-572.
[2]沈羡云,兰景全,向求鲁,等. 模拟失重兔超慢涨落图的研究[J].中国空间科学技术,1989,9(4):59-65.
[3]Musacchia XJ, Fagette S. Weightlessness simulations for cardiovascular and muscle systems: validity of rat models[J]. J Gravit Physiol. 1997, 4(3):49-59.
[4]Morey-Holton E, Globus RK, Kaplansky A,etal. The hindlimb unloading rat model: literature overview, technique update and comparison with space flight data[J]. Adv Space Biol Med. 2005, 10:7-40.
[5]姜山峰,高云芳.模拟失重对大鼠情绪影响的初步研究[J].中国应用生理学杂志,2012,28(3):205-208。
[6]马静瑶,陈玲玲,王琼,等.模拟航天特因环境下大鼠认知功能的影响[J]. 中国比较医学杂志,2013,23(10):58-62.
[7]Morey-Holton ER,Wronski TJ. Animal models for simulating weightlessness[J]. Physiologist, 1981.24(Suppl.):45-46.
[8]董丽,王琼,刘新民,等,地面模拟失重实验方法概况[J]. 中国实验动物学报,2013,21(5):90-94.
[9]Morey-Holton ER,Globus RK. Hindlimb unloading rodent model technical aspects[J]. J App l Phys iol 2002, 92 (1):1367-1377.
[10]CHEN Jie, MA Jin, DING Zhao ping,etal. A modified tail suspension model for simulating long-term weightlessness[J]. Chinese Journal of Space Science, 1993, 2(4): 159-162.
[11]沈羡云,王林杰,我国失重生理学研究进展[J]. 航天医学与医学工程,2008,21(3):182-187.
[12]张文辉,亓鹏,何薇薇,等.模拟失重对大鼠心肌氧化应激水平的影响[J]. 中华保健医学杂志,2010,12(5):373-375.
[13]Williams D, Kuipers A, Mukai C,etal. Acclimation during space flight: effects on human physiology[J]. CMAJ,2009,180(13): 1317-1323.
[14]Alessandra Ruggiu, Ranieri Cancedda, Bone mechanobiology,gravity and tissue engineering:effects and insights[J]. Journal of Tissue Engineering and Regenerative Medicine,2014.
[15]万玉民,马永洁,张晓铀,等.回转对离体大鼠成骨细胞中骨粘连蛋白及骨桥素mRNA 的影响[J]. 生理学报,2005,57(3):384-388.
[16]Zhongquan Dai, Feng Wu, Jian Chen,etal. Actin Microfilament Mediates Osteoblast Cbfa1 Responsiveness to BMP2 under Simulated Microgravity[J]. PLOS ONE,2013,8(5):1-9.
[17]沈羡云,崔伟,马永烈,等. 30 d 尾吊大鼠血循环、肌肉和骨骼系统的变化[J]. 航天医学与医学工程,1999,12(4):277-280.
[18]Yuan Zhou, Yun Wang, Li-Lin Rao,etal. Disrupted resting-state functional architecture of the brain after 45-day simulated microgravity[J]. Behaviral Neuroscience,2014,200(8):1-9.
[19]Carey R, Damianopoulos E, Palma G. 8-OH DPAT can restore the locomotor stimulant effect of cocaine blocked by haloperidol[J]. Pharmacol Biochem Behav,2000,66(4):863.
[20]UZBAYI T,COSKUN I,KAYIR H,etal. Extract of Hypericum perforatum blocks caffeine-induced locomotor activity in mice: a possible role of nitricoxide[J]. Phytother Res,2007,21(5):415.
[21]王琼,买文丽,李翊华,等,自主活动实时测试分析处理系统的建立于开心散安神镇静作用验证[J],中草药,2009,40(11):1773-1779.
[22]刘军莲,李勇枝,白桂娥,等,航天特因环境下抑郁模型大鼠行为学食物及糖水消耗量变化[J]. 中国兽医杂志,2011,47(1):12-14.
[23]Madani R, Kozlov S, Akhmedov A,etal. Impaired explorative behavior and neophobia in genetically modified mice lacking or overexpressing the extracellular serine protease inhibitor neuroserpin[J]. Mol Cell Neurosci,2003,23(3):473-494.
[24]Decoursey PT, Buggy T. Restoration of locomotor rhythmicity in SCN-lesioned hamsters by transplantation of fetal SCN[J]. Neurosci Abstrs,1986,12(3):210.
〔修回日期〕2014-11-20
