可调控性uPA诱导表达系统的构建及功能鉴定
2016-01-09陈丽香,周晓静,刘文文等
研究报告
可调控性uPA诱导表达系统的构建及功能鉴定
陈丽香1,周晓静3,刘文文4, 周文江1,任晓楠1,于士颜1, 周晓辉1,2
(1.上海市公共卫生临床中心,上海201508;2.复旦大学医学分子病毒学教育部卫生部重点实验室,上海200032;
3.蚌埠医学院第一附属医院,安徽 蚌埠233004;4.赤峰学院附属医院,内蒙古 赤峰024000)
【摘要】目的构建可调控性尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,uPA)诱导表达系统并进行相关鉴定,可为进一步构建可诱导型肝脏人源化uPA-SCID动物模型奠定基础。方法可调控性uPA诱导表达系统即在强力霉素(doxycycline,Dox)诱导下通过tet-on系统调控uPA表达。为此,需要构建两个重组质粒,分别为pLNHXO1O2-Alb-GLUC-FMN2A-rtTA和pLNHXO5O6-TRE2-uPA-IRES-ZsGreen,前者引入Gaussia荧光素酶(gaussia enzyme fluorescent element,Gluc)与四环素反式激活因子(reverse tetracycline transactivator,rtTA)偶联表达,以便于监测rtTA表达水平;后者同时偶联表达ZsGreen,以便于用荧光显微镜观察基因表达。重组逆转录病毒载体进行表达功能鉴定后,将构建质粒与病毒包装衣壳蛋白VSV-G质粒共转染GP2-293包装细胞系后获得具有感染能力的病毒颗粒,利用该病毒感染NIH/3T3细胞,并用G418筛选出阳性细胞;期间各取部分细胞,使用PCR方法鉴定其基因组内是否含有相应基因转录调控本。结果成功构建pLNHXO1O2-Alb-GLUC-FMN2A-rtTA和pLNHXO5O6-TRE2-uPA-IRES-ZsGreen克隆。功能鉴定显示,pLNHXO1O2-Alb-GLUC-FMN2A-rtTA克隆可表达rtTA;pLNHXO5O6-TRE2-uPA-IRES-ZsGreen克隆转染HepG-Tet-on细胞,加Dox可诱导uPA表达。包装病毒感染NIH/3T3细胞后通过G418筛选获得单细胞克隆,通过PCR方法鉴定表明其基因组内含有相应转录本,从而成功构建uPA诱导表达稳定细胞株。结论本研究初步建立了可调控性uPA诱导表达系统,从而为可诱导肝损的uPA-SCID转基因小鼠的构建及在此基础上的肝脏人源化动物模型的建立奠定了基础。
【关键词】可调控肝脏损伤;Alb;uPA;肝脏人源化小鼠
[基金项目]国家重点基础研究发展计划(2012CB519005);上海市科技发展基金实验动物研究项目(12140900300);上海市卫生和计划生育委员会科研课题(20144Y0073);上海市公共卫生临床中心中心科研课题面上项目(2014M08)。
[作者简介]陈丽香(1988-),女,技术员,本科,研究方向:细胞生物学,E-mail: xiaripaomo@126.com。
[通讯作者]周晓辉(1973-),男,副研究员,博士,研究方向:病毒免疫学,E-mail: zhouxiaohui@shaphc.org。
【中图分类号】Q95-33R332【文献标识码】 A
doi:10.3969.j.issn.1671.7856. 2015.001.001
The establishment of the uPA inducible expression system
CHEN Li-xiang1,ZHOU Xiao-jing3,LIU Wen-wen4,ZHOU Wen-jiang1,REN Xiao-nan1,YU Shi-yan1,ZHOU Xiao-hui1,2
(1.Shanghai Public Health Clinical Center, Fudan University, Shanghai 201508,China;
2.Key Laboratory of Medical Molecular Virology, Ministry of Education and Health, Shanghai Medical College,
Fudan University, Shanghai 200032,China;3.The first affiliated hospital of bengbu medical college,
Anhui Bengbu 233004,China;
4.Affiliated hospital of Chifeng University, Neimenggu Chifeng 024000,China)
Abstract【】ObjectiveTo establish uPA inducible expression system using recombinant retroviral system for the further construction of inducible uPA-SCID animal model. Methods The Inducible expression system need to construct two plasmids:pLNHXO1O2-Alb-GLUC-FMN2A -rtTA and pLNHXO5O6-TRE2-uPA-IRES-ZsGreen respectively. Both plasmids were based on retroviral vector pLNHX, Albumin promoter gene (Alb) and rtTA gene or uPA gene and ZsGreen were obtained by PCR reaction and inserted into pLNHX. The Gaussia enzyme fluorescent element (GLUC) was used to monitor rtTA expression in pLNHXO1O2-Alb-GLUC-FMN2A-rtTA,and the ZsGreen for uPA expression monitoring in pLNHXO5O6-TRE2-uPA-IRES-ZsGreen.The correct constructed plasmids were transfected into packaging cell line GP2-293 to gain recombinant viral particles.NIH/3T3 cells were infected with these viral particles and selected with G418.Gene expression in the surviving cells was confirmed by the PCR method. ResultsThe recombinant retroviral vectors harbouring target genes were successfully cloned.The rtTA gene in pLNHXO1O2-Alb-GLUC-FMN2A-rtTA was expressed, and uPA can be induced to express in pLNHXO5O6-TRE2-uPA-IRES-ZsGreen by doxycycline (Dox) when the plasmid transfected into the HepG-Tet-on cell. The constructed recombinant two retroviral vectors were transfected into GP2-293 packaging cells respectively to gain infectious viral particles.Then,NIH/3T3 cells were infected with these viral particles and single-cell clones which stably expressed the transgenes were successfully established. Conclusion This study primarily established uPA inducible expression system, it laid a foundation for the murine model of inducible liver damage, and provided a novel technical platform for further building the liver humanised murine models for viral hepatitis studying.
【Key words】Controlled inducible liver damage;Alb;uPA;Liver-humanized mouse
尿激酶型纤溶酶原激活物uPA可以激活肝细胞内的纤溶蛋白酶原,导致肝细胞的损伤和坏死[1],目前被认为可能是建立理想肝脏损伤小鼠模型最合适的毒力基因。uPA参与多种生理病理过程,在肝脏再生过程中,它通过激活纤溶酶原可以清除坏死细胞碎片,破坏细胞外基质以促进肝脏结构的重构,从而有利于移植肝细胞的成活与增殖[2]。
肝脏损伤动物模型的建立是研究肝细胞移植和再生的关键性技术平台。外源异种肝细胞移植要在受体动物体内嵌合、再生成功,首要条件是受体本身肝脏有损伤,外源植入的肝细胞才有机会克服生存竞争而“殖民”成功;同时为防止免疫排斥往往需要受体动物有免疫缺陷。肝损小鼠模型是肝脏人源化小鼠模型建立的基础。uPA/SCID是目前应用较多的一个肝损/移植模型,在病毒性肝炎等人类肝脏重大疾病研究中发挥着重要作用。应用uPA/SCID模型,外源人肝细胞的嵌合重建率最高能达到99%。
但现有uPA/SCID小鼠模型也存在很多问题和缺陷。例如uPA杂合子对肝脏的损伤已很严重,纯合子新生鼠肝脏的损伤更严重,,造成很高的死亡率[3],使uPA小鼠繁育和保种比较困难。此外,小鼠某些肝细胞可能通过重组机制清除uPA转基因,并快速增殖,直到8~12周恢复整个肝脏,对移植入的肝细胞增殖能力造成很大的限制。因此,移植手术一般要在出生后最初两周内完成,以提高移植人肝细胞的嵌合成功率,但这也给模型建立增加了操作的难度[4-5]。
本研究通过建立基于tet-on的可调控肝脏损伤的uPA诱导表达系统,为进一步构建可诱导肝损的uPA-SCID动物模型奠定了基础。实现uPA毒性基因的可控表达,可克服现有uPA/SCID小鼠模型的缺陷,从而可能为肝炎病毒感染的免疫致病机制、药物及疫苗筛选评价研究等提供一个更加有力的研究平台。
1材料和方法
1.1质粒、菌株及试剂
质粒、菌株和细胞株:pUC19载体、逆转录病毒载体pLNHX购自美国Clontech公司;pTRE2hyg,pLVX-IRES-ZsGreen质粒实验室保存;大肠杆菌DH5α实验室保存;包装细胞GP2-293细胞系,NTH3T3购自中国科学院;人宫颈癌细胞Hela,人肝癌细胞HepG2及HepG2-Tet-on细胞实验室保存;PCR反应体系购自TaKaRa公司;逆转录试剂盒购自ToYoBo公司;限制性内切酶及10×buffer购自NEB公司;T4 DNA连接酶购自TaKaRa公司;质粒提取试剂盒,DNA胶回收试剂盒购自上海捷瑞生物技术有限公司;无内毒素质粒抽提试剂盒购自Omega公司;1640、DMEM、胎牛血清购自invitrogen公司;胰蛋白酶,强力霉素Dox及G418实验室保存;5×Passive Lysis Buffer购自Promega公司;Dual-Luciferase Reporter System检测试剂盒购自Promega公司;引物合成:博尚生物技术(上海)有限公司。

表1 克隆引物序列(包括酶切位点)
1.2仪器与设备
Cycler PCR仪购自Bio-Rad公司;离心机购自Eppendorf公司及Beckman公司;紫外-可见光分析成像系统购自Bio-Rad公司;酶标检测仪购自Thermo公司。
1.3重组质粒构建
1.3.1pUC19载体及pLNHX载体多克隆位点的改造
由于pUC19、pLNHX载体本身不具有后续实验所需的酶切位点,所以首先需对载体的多克隆位点进行改造。
pUC19M获得:在pUC19载体上插入含有MfeI、KpnI、BamHI、EcoRV、NotI等酶切位点的MCS:利用引物设计软件Vector-NTI设计引物,引物序列如表1 U19-O3O4:将设计的引物U19-03与U19-04以1∶1的比例混合后直接进行变性退火获得目的基因MCS。用EcoRI-HF/HindIII(Buffer2)对载体pUC19与MCS进行双酶切,酶切过夜后,对酶切产物进行割胶回收.将回收后的pUC19载体与MCS以1∶3的比例连接,连接条件:15℃连接4 h。连接产物转化感受态细胞DH5α,挑取克隆进行EcoRI-HF/HindIII双酶切鉴定,对阳性结果进行测序;pLNHXO1O2获得:对载体pLNHX进行改造引入MfeI、NotI位点从而构建新的载体pLNHXO1O2;利用引物设计软件Vector-NTI设计引物,引物序列如表1 LNHX-O1O2:将设计的引物LNHXO1与LNHXO2以1∶1的比例直接置于进行变性退火获得目的基因MCS。用XhoI/BglII(Buffer3)对载体pLNHX进行双酶切,酶切过夜后,对酶切产物进行割胶回收。将回收后的pLNHX载体与MCS以1∶3的比例连接,15℃连接4 h。转化感受态细胞DH5α,挑取克隆进行MfeI酶切鉴定,阳性克隆能够被酶切为线性条带,对阳性结果进行测序;pLNHXO5O6获得:在载体上插入含有MfeI、HpaI、BamHI、XhoI、MluI等酶切位点的MCS从而构建新的载体pLNHXO5O6:利用引物设计软件Vector-NTI设计引物,引物序列如表一LNHX-O5O6:将设计的引物LNHXO5与LNHXO6以1∶1的比例直接置于进行变性退火获得目的基因MCS。用XhoI/BglII(Buffer3)对载体pLNHX进行双酶切,酶切过夜后,对酶切产物进行割胶回收。将回收后的pLNHX载体与MCS以1∶3的比例连接,15℃连接4 h。转化感受态细胞DH5α,挑取克隆进行MfeI酶切鉴定,阳性克隆能够被酶切为线性条带对阳性结果进行测序。
1.3.2白蛋白启动子调控的rtTA克隆pLNHXO1O2-Alb-Gluc-FMN2A-rtTA及pLNHXO5O6-TRE2-uPA-IRES-ZsGreen克隆的构建
利用引物设计软件Vector-NTI设计引物,引物序列如表1。
以Jc1-Flag2质粒,pTet-on质粒及抽提的小鼠肝脏基因组DNA为模板进行PCR扩增,分别获得567 bp的Gluc-FMN2A,1 kb的rtTA基因及308 bp的Alb基因,将PCR产物进行割胶回收后逐一插入 pUC19M载体后将连接产物转化感受态细胞,挑取克隆进行酶切鉴定,对鉴定结果为阳性的质粒进行测序检测。将测序阳性的重组质粒进行酶切获得Alb-Gluc-FMN2A-rtTA基因再与pLNHXO1O2连接转化后挑取克隆进行酶切鉴定,对鉴定结果为阳性的质粒进行测序检测从而获得pLNHXO1O2-Alb-Gluc-FMN2A-rtTA阳性质粒;以pTRE2hyg质粒,pLVX-IRES-ZsGreen质粒及鼠肾cDNA为模板进行PCR扩增,分别获得433 bp的TRE2(四环素应答元件;tetracycline response element;TRE)启动子,1.3 kb的MCS-IRES-ZsGreen及1.3 kb uPA,并通过cmv引物退火连接获得70 bp的TRE2 cmv,将PCR产物进行割胶回收后逐一插入pLNHXO5O6载体后将连接产物转化感受态细胞,挑取克隆进行酶切鉴定,对鉴定结果为阳性的质粒进行测序检测,从而获得pLNHXO5O6-TRE2-uPA-IRES-ZsGreen阳性质粒;实验过程中测序发现TRE2缺少一段CMV,所以后期通过引物设计退火连接获得缺失的cmv,与建立的重组载体连接,由于插入了TRE2cmv,所以失去HpaI酶切位点,用HpaI酶切鉴定可以初步确定阳性克隆。
1.3.3用于pLNHXO1O2-Alb-Gluc-FMN2A-rtTA功能鉴定的pTRE2hyg-Fluc构建
利用引物设计软件Vector-NTI设计引物,引物序列如表1,以pIFNβ-Fluc为模板进行PCR扩增获得1.7 kb的Fluc,将Fluc及pTRE2hyg用BamHI,MluI进行酶切,回收,连接,转化,挑取克隆进行酶切鉴定从而获得pTRE2hyg-Fluc阳性质粒。
1.4重组逆转录病毒载体功能鉴定:双荧光素酶报告基因检测及荧光显微镜观察
双荧光素酶报告基因检测法:细胞铺板后转染相关质粒,48 h后用200 μL 1×Passive Lysis缓冲液裂解并收集上清。用Dual Luciferase Assay System 试剂盒和Lumat LB 9507仪器测定Fluc、Rluc活性,积分时间均为10 s,结果以Fluc和Rluc比值表示。
荧光显微镜检测法:细胞铺板后转染相应质粒,48 h后荧光显微镜观察。
1.5包装病毒的构建
无内毒素抽提质粒,经过OD260定量后与VSV-G包装蛋白共转染包装细胞GP2-293,转染采用LipofectamineTm2000进行。转染48 h后收集病毒。收集病毒即先在4℃ 3861 r/min离心15 min,将上清转移至超离管中再用超速离心机在4℃,16800 r/min离心2 h,弃去上清液,加入100 μL DMEM重悬并置于4℃溶解8 h使得病毒重新解离为可感染的单体,从而获得病毒原液用于感染靶细胞。
1.6阳性细胞的选择与培养
以NIH-3T3细胞作为靶细胞。于感染的前1 d将1×105的NIH-3T3细胞接种于60 mm细胞培养盘中。病毒感染前细胞先用无血清DMEM洗涤一次,再补以1.5 mL无血清DMEM同时加入100 μL病毒原液。感染2 h后重新更换为正常的新鲜培养液,继续培养24 h,再加入G418(800 μg/mL)筛选阳性克隆。
1.7PCR检测阳性细胞中目的基因的表达
将体外反复传代的阳性NIH/3T3细胞用Trizon裂解后抽提RNA并进行定量,用ToYoBo试剂盒逆转录后进行PCR鉴定。
2结果
2.1Fluc、Gluc-FMN2A、MCS-IRES-ZsGreen、rtTA、TRE2、Alb、uPA基因片段扩增
以pIFNβ-Fluc、Jc1-Flag2、pLVX-IRES-ZsGreen、pTet-on、pTRE2hyg质粒,抽提的小鼠肝脏基因组DNA和鼠肾cDNA为模板,引物序列见表1。进行PCR反应,扩增出1.7 kb的Fluc,567 bp的Gluc-FMN2A,1.3 kb的MCS-IRES-ZsGreen,1 kb的rtTA基因,433 bp的TRE2启动子,308 bp的Alb基因和1.3 kb uPA,对PCR产物进行琼脂糖凝胶电泳(图1)。结果显示:在预期位置看到了实验设想的条带。
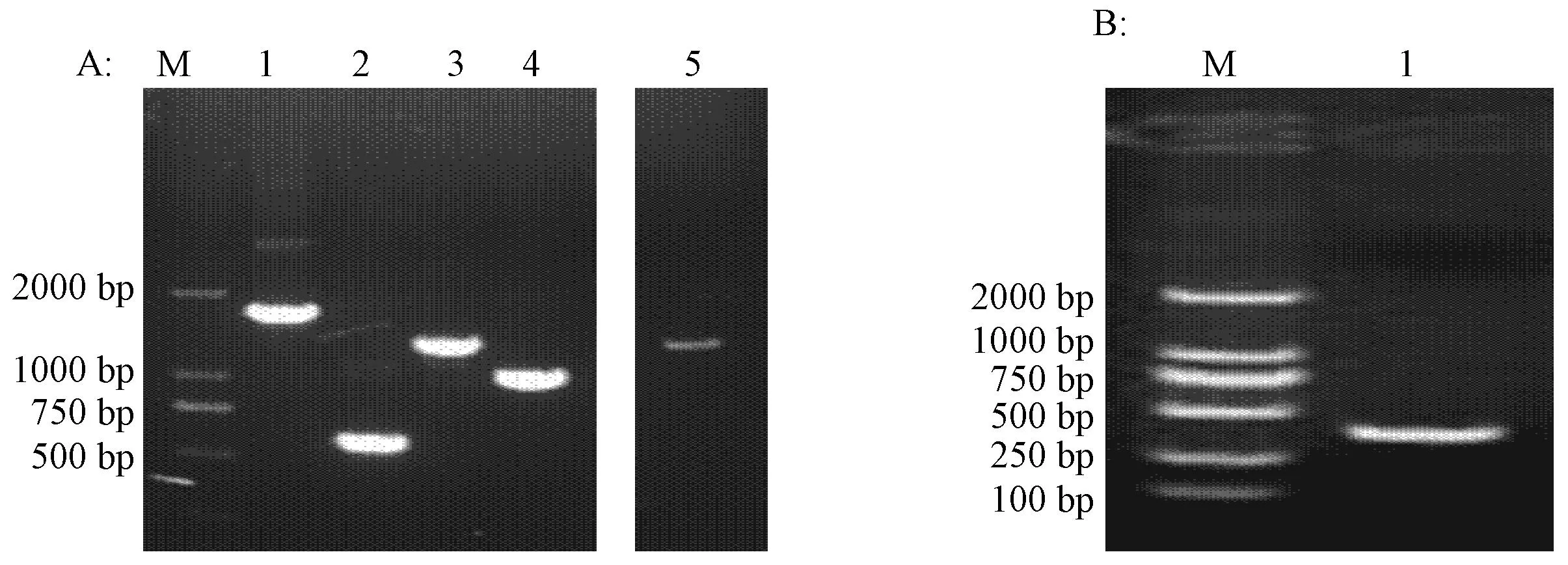
注:A:M:DL2000 Marker;1、2、3、4、5分别为Fluc(1.7 kb)、Gluc-FMN2A(567 bp)、MCS-IRES-ZsGreen(1.3 kb)、rtTA(1 kb)、uPA(1.3 kb),B:M:DL2000 Marker;1为Alb(308 bp)。 图1 Fluc、Gluc-FMN2A、MCS-IRES-ZsGreen、rtTA、uPA、Alb基因PCR产物图 Note:A:M:DL2000Marker;1:Fluc(1.7kb);2:Gluc-FMN2A(567 bp);3:MCS-IRES-ZsGreen (1.3 kb); 4:rtTA(1 kb);5: uPA(1.3 kb), B: M:DL2000 Marker;1: Alb(308 bp). Fig.1 PCR product of Fluc、Gluc-FMN2A、MCS-IRES-ZsGreen、rtTA、uPA、Alb gene
2.2重组质粒pLNHXO1O2-Alb-GLUC-FMN2A -rtTA、pLNHXO5O6-TRE2-uPA-IRES-ZsGreen及pTRE2hyg-Fluc的酶切鉴定
将改造后的pUC19M载体与PCR扩增获得的Alb,rtTA,Gluc-FMN2A基因片段经过酶切(酶切位点见表1),回收纯化,连接反应构建成功pUC19M-Alb-GLUC-FMN2A -rtTA,再通过PCR获得整个Alb-GLUC-FMN2A-rtTA基因片段,与改造后的pLNHXO1O2进行MfeI/NotI酶切连接反应,构建pLNHXO1O2-Alb-GLUC-FMN2A-rtTA重组质粒。阳性质粒经MfeI/NotI酶切鉴定获得5300 bp线性质粒和1875 bp Alb-GLUC-FMN2A-rtTA片段(图2C6),表明成功构建重组质粒pLNHXO1O2-Alb-GLUC-FMN2A -rtTA。
将改造后的pLNHXO5O6载体与PCR扩增获得的TRE2,MCS-IRES-ZsGreen,uPA基因片段及cmv引物退火连接获得的70 bp TRE2cmv依次连接,阳性克隆经MfeI/HpaI,XhoI/MluI,XhoI/BamHI酶切可分别获得均缺失70 bp TRE2cmv的5300 bp线性质粒和433 bp TRE2(图Ea2),5733 bp线性pLNHXO5O6-TRE2和1300 bp IRES-ZsGreen(图Eb1、2、4),7033 bp线性pLNHXO5O6-TRE2-IRES-ZsGreen和1300 bp uPA(图Ec3),经HpaI酶切鉴定(由于插入TRE2cmv,阳性质粒在扩增中会失去HpaI酶切位点),阳性 pLNHXO5O6-TRE2-uPA-IRES-ZsGreen不能被酶切(图Ed4),结果表明已成功构建pLNHXO5O6-TRE2-uPA-IRES-ZsGreen。
将pTRE2hyg载体与PCR扩增获得的Fluc基因片段经过BamHI/MluI酶切,回收纯化,连接反应构建pTRE2hyg-Fluc(图2DE)。阳性质粒经BamHI/MluI酶切鉴定获得5300 bp线性质粒和1700 bp Fluc片段见图2D1、3、5,表明成功构建重组质粒pTRE2hyg-Fluc。琼脂糖凝胶电泳结果显示:阳性质粒在预期位置看到实验设想的条带,将阳性质粒送检测序发现与预期结果一致。
2.3重组质粒pLNHXO1O2-Alb-GLUC-FMN2A-rtTA和pLNHXO5O6-TRE2-uPA-IRES-ZsGreen功能鉴定
2.3.1rtTA特异性表达检测
将重组病毒质粒pLNHX-Alb-Gluc-FMN2A-rtTA通过Fugen HD转染Hela细胞(宫颈癌细胞系)与HepG2细胞(肝癌细胞系)。由于Gluc与rtTA偶联表达可以自行分泌到细胞上清中,转染48 h后吸取细胞上清检测Gluc活性,即可判定rtTA表达。因为HepG2细胞是肝细胞来源,所以可以检测到Gluc的表达,而Hela细胞缺乏调控白蛋白启动子的特异性转录因子,不能启动Gluc/rtTA的表达。转染48 h后荧光检测结果显示:HepG2细胞中Gluc表达量为Hela细胞的10倍,表明引入的白蛋白启动子序列具有组织特异的生物学特性(图3A)。
2.3.2rtTA可调控的转录活性检测
在HepG2细胞内共转染pLNHX-Alb-Gluc-FMN2A-rtTA和pTRE2hyg-Fluc质粒,转染4 h后进行Dox(1 μg/mL)处理,通过引入Dox(检测Fluc活性,转染48 h后双荧光检测结果显示:加入Dox后Fluc/Gluc值为未加Dox诱导的2~3倍,确定pLNHX-Alb-Gluc-FMN2A-rtTA克隆表达的rtTA具有可调控的转录因子活性(图3B)。
2.3.3TRE2-uPA-IRES-ZsGreen表达的可调控性检测
将重组质粒pLNHXO5O6 -TRE2-uPA-IRES-ZsGreen转染HepG-Tet-on细胞,转染4 h后进行Dox(1 μg/mL)处理,转染48 h后观察ZsGreen绿色荧光表达,荧光观察结果显示:转入质粒的HepG-Tet-on细胞具有绿色荧光表达,确定了TRE2-uPA-IRES-ZsGreen表达的可调控性(彩插1图5)。

注:A:Tet-on系统原理图;B:pLNHXO1O2-Alb-GLUC-FMN2A-rtTA、pLNHXO5O6-TRE2-uPA-IRES-ZsGreen质粒结构图;C、D、E:质粒 pLNHXO1O2-Alb-GLUC-rtTA、pTRE2hyg-Fluc、 pLNHXO5O6 -TRE2-uPA-IRES-ZsGreen的构建; M:DL2000 Marker。 图2 质粒pLNHXO1O2-Alb-GLUC-FMN2A-rtTA、pTRE2hyg-Fluc和pLNHXO5O6-TRE2-uPA-IRES-ZsGreen的构建方法 Note:A:Tet-on system;B:schematic diagram of plasmid pLNHXO1O2-Alb-GLUC-FMN2A-rtTA、pLNHXO5O6-TRE2-uPA-IRES-ZsGreen; C、D、E:Construction of plasmid pLNHXO1O2-Alb-GLUC-rtTA、pTRE2hyg-Fluc、pLNHXO5O6 -TRE2-uPA-IRES-ZsGreen;M:DL2000 Marker. Fig.2 Construction of plasmid pLNHXO1O2-Alb-GLUC-FMN2A-rtTA、pTRE2hyg-Fluc and pLNHXO5O6-TRE2-uPA-IRES-ZsGreen

图3 重组质粒pLNHXO1O2-Alb-GLUC-FMN2A-rtTA功能鉴定 Fig.3 Functional identification of pLNHXO1O2-Alb-GLUC-FMN2A-rtTA
2.4阳性细胞NIH/3T3中目的基因表达的检测
包装病毒感染NIH/3T3细胞,通过G418(800 μg/mL)药物筛选获得阳性细胞,抽提RNA,逆转录后PCR检测细胞中目的基因的表达,引物见表1。经检测Alb-GLUC-rtTA-NIH/3T3细胞2~4号,TRE2-uPA-IRES-ZsGreen 2~4号在预期位置看到实验设想的条带,表明成功建立了uPA诱导表达系统。

图4 阳性细胞NIH/3T3中目的基因的表达 Fig.4 Expressing of target gene in NIH/3T3
3讨论
病毒性肝炎及相关脏器疾病是是危害人类生命和健康的重大公共卫生问题。以乙型肝炎病毒(hepatitis B virus,HBV)感染为例,目前全球约有HBV携带者3.5亿人,中国约有1.2亿人。丙型肝炎病毒(hepatitis C virus,HCV)感染也是一个世界范围的严重问题。HBV或HCV的感染是导致慢性肝病和肝癌的重要要病因,然而相关机制仍未完全阐明[5-6]。为了有效进行病毒性肝炎研究,需要建立可以模拟人类自然感染过程的合适的小动物模型。 现有的转病毒基因小鼠、病毒基因高压水动力法转染小鼠模型等,均非自然感染模型[7-17]。
鉴于HBV或HCV对人肝细胞受体的特殊嗜性,比较理想的小动物模型是肝脏人源化的小鼠模型,uPA/SCID小鼠模型即属于其中应用较多的一类。然而由于原有的uPA/SCID小鼠模型仍然存在诸多缺陷,对其更广泛的应用形成了限制。国际上病毒性肝炎著名学者Charles M. Rice和Alexander Ploss[18]提出,可诱导型肝损基础上的人肝/免疫双嵌合小鼠模型是代表人类肝脏病研究领域中新希望的地平线(new horizon)。可诱导型肝损伤模型无建模手术窗口期限制,而且由于毒性基因的可控表达也解决了种群繁育方面的困难,因此可克服原有uPA小鼠诸多缺点。
北京大学邓宏魁等[2]曾报道:利用tet-on调控系统以及腺病毒感染转入uPA基因的方法来实现 uPA可调控表达和定时肝损的发生。然而,由于维持uPA表达需反复进行腺病毒接种感染,宿主小鼠产生针对前次腺病毒感染产生的抗体可影响后续腺病毒感染的效率,从而降低uPA表达水平。而且,由于腺病毒感染本身可激活天然免疫,必然会干扰后续作为研究对象的HBV或HCV等病毒的感染过程,因此该模型只适合用于肝移植和再生的研究,并不适合用于HBV、HCV等的感染研究。
构建tet-on系统调控的uPA转基因/免疫缺陷小鼠模型是一个可完全避开上述通过腺病毒感染转入uPA基因的模型缺陷的策略[19-20]。本研究建立了基于tet-on的可调控性uPA诱导表达系统。通过PCR扩增成功获得目的基因Alb、GLUC、rtTA、TRE2、uPA、IRES-ZsGreen(图1),并将其插入改造后的pUC19、pLNHX载体中,酶切鉴定结果(图2)表明:已成功构建pLNHXO1O2-Alb-GLUC-FMN2A -rtTA和pLNHXO5O6-TRE2-uPA-IRES-ZsGreen重组质粒。后期我们对重组质粒功能进行检测,结果初步确定了Alb启动子、rtTA、TRE2具有表达活性(图3)。实验组Dox诱导后细胞有绿色荧光表达,可确定TRE2-uPA-IRES-ZsGreen表达的可调控性。
本研究所构建的可调控性uPA诱导表达系统将进一步用于构建可调控性uPA/SCID小鼠模型,所建立的小鼠作为肝脏人源化小鼠模型,可解决以往各种转病毒基因小鼠、病毒基因高压水动力法转染小鼠模型等的非自然感染过程的问题,同时由于实现了毒性基因uPA的可控表达,还可以克服原有uPA/SCID小鼠的品系繁育困难,手术窗口期限制等缺陷,从而为病毒性肝炎的研究提供一个更加有力的模型。
参考文献:
[1]Meuleman P,Libbrecht L,De Vos R,etal. Morphological and biochemical characterization of a human liver in a uPA-SCID mouse chimera [J]. Hepatology, 2005,41(4):847-856.
[2]Song X, Guo Y, Duo S,etal. A mouse model of inducible liver injury caused by tet-on regulated urokinase for studies of hepatocyte transplantation[J]. Am J Pathol, 2009,175(5):1975-1983.
[3]Heckel JL, Sandgren EP, Degen JL,etal. Neonatal bleeding in transgenic mice expressing urokinase-type plasminogen activator[J]. Cell, 1990,62(3):447-456.
[4]Sandgren EP,Palmiter RD,Heckel JL,etal. Complete hepatic regeneration after somatic deletion of an Albumin-plasminogen activator transgene[J]. Cell, 1991,66(2):245-256.
[5]Philip Meuleman, Geert Leroux-Roels. The human liver-uPA-SCID mouse:A model for the evaluation of antiviral compounds against HBV and HCV[J]. Antiviral Research, 2008,80(3): 231-238.
[6]Trépo C, Chan HL, Lok A. Hepatitis B virus infection[J]. Lancet, 2014,Jun 18.(14)60220-60228.
[7]Guidotti LG,Rochford R,Chung J,etal. Viral clearance without destruction of infected cells during acute HBV infection[J]. Science, 1999,284(5415):825-829.
[8]Baumert TF, Yang C, Schürmann P,etal. Hepatitis B virus mutations associated with fulminant hepatitis induce apoptosis in primary Tupaia hepatocytes[J]. Hepatology, 2005,41(2):247-256.
[9]Lin E, Luscombe C, Colledge D,etal. Long-term therapy with the guanine nucleoside analog penciclovir controls chronic duck hepatitis B virus infection in vivo[J]. Antimicrob Agents Chemother, 1998,42(8):2132-2137.
[10]Dandri M,Lutgehetmann M,Volz T,etal. Small Animal Model Systems for Studying Hepatitis B Virus Replication and Pathogenesis[J]. Seminars in liver disease, 2006,26(2):181-191.
[11]Kimura K,Kakimi K,Wieland S,etal. Interleukin-18 inhibits hepatitis B virus replication in the livers of transgenic mice[J]. J Virol, 2002,76(21):10702-10707.
[12]Robek MD,Boyd BS,Wieland SF,etal. Signal transduction pathways that inhibit hepatitis B virus replication [J]. Proc Natl Acad Sci USA, 2004,101(6):1743-1747.
[13]Guidotti LG,Matzke B,Schaller H,etal. High-Level Hepatitis B Virus Replication in Transgenic Mice[J]. Journal of Virology, 1995,69(10):6158-6169.
[14]Liu F,Song Y,Liu D,etal. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA[J]. Gene Therapy, 1999,6(7):1258-1266.
[15]Yang PL,Althage A,Chung J,etal. Hydrodynamic injection of viral DNA: A mouse model of acute hepatitis B virus infection[J]. Proc Natl Acad Sci USA, 2002,99(21):13825-13830.
[16]Konishi M,Tanaka H,Kaito M,etal. Ultrastructural demonstration of hepatitis B virus production in a mouse model produced by hydrodynamic transfection[J]. Int J Mol Med, 2007,20(1):31-36.
[17]Huang LR,Wu HL,Chen PJ ,etal. An immunocompetent mouse model for the tolerance of human chronic hepatitis B virus infection[J]. Proc Natl Acad Sci USA, 2006,103(47):17862-12867.
[18]De Jong YP, Rice CM, Ploss A. New horizons for studying human hepatotropic infections[J]. J Clin Invest, 2010,120(3):650-653.
[19]张一,黎晓敏,吕凤林,等. Cre/Loxp和四环素系统在基因可控表达中的应用[J]. 中国实验动物学报, 2007,(1):76-80.
[20]杨丽华,周常文. Tet-on调控的基因表达载体的构建与体外表达研究[J]. 徐州医学院学报, 2011,(2):81-83.
〔修回日期〕2014-11-20
