HIF-1信号通路在介导DMOG动员MSCs中的作用
2016-01-09胡韶君,余勤,刘丽珍等
研究报告
HIF-1信号通路在介导DMOG动员MSCs中的作用
胡韶君1,余勤1,刘丽珍2,葛婷婷1
(1.浙江中医药大学生命科学学院,杭州310053;
2.浙江大学医学院附属第一医院骨髓移植中心,杭州310003)
【摘要】目的探讨HIF-1及下游SDF-1α/CXCR4和VEGF/VEGFR 通路在介导DMOG动员MSCs中的作用机制。 方法 将雄性SD大鼠,随机分为五组:生理盐水对照组、DMOG组、YC-1组、AMD3100组、SU5416组。分别采用CFU-F法与流式细胞术检测大鼠骨髓和外周血中MSCs的数量;ELISA法检测骨髓上清及外周血清中SDF-1α及VEGF蛋白浓度;Western blotting法检测骨髓细胞中HIF-1α、SDF-1α及VEGF蛋白表达水平。 结果 同NS组比较,DMOG组CFU-Fs 数量显著增加,且CD45-CD90+细胞群比例增加(P < 0.05);同DMOG组比较,YC-1组、AMD3100组、SU5416组CFU-Fs数量均显著减少,且CD45-CD90+细胞群比例降低(P < 0.05);同DMOG组比较,YC-1组HIF-1α浓度及蛋白表达显著降低(P < 0.05),AMD3100组SDF-1α浓度及蛋白表达显著降低(P < 0.05),SU5416组VEGF浓度及蛋白表达显著降低(P < 0.05)。 结论 DMOG可能通过上调HIF-1α,从而调控其下游SDF-1α/CXCR4通路与VEGF/VEGFR通路诱导MSCs 的动员。
【关键词】间充质干细胞动员;DMOG;缺氧诱导因子-1α;基质细胞衍生因子-lα;血管内皮生长因子
[基金项目]国家自然科学基金(81270566);教育部高校博士点专项科研基金(20130101120022)。
[作者简介]胡韶君(1989-),硕士,研究方向:干细胞基础与临床研究。
[通讯作者]余勤(1962-),教授,博士生导师,研究方向:干细胞基础与临床研究,E-mail: qinyu3587@aliyun.com。
【中图分类号】R332【文献标识码】 A
doi:10.3969.j.issn.1671.7856. 2015.001.002
Mechanism of HIF-1 signaling pathway in mediating
MSCs mobilization with DMOG
HU Shao-jun1,YU Qin1,LIU Li-zhen2,GE Ting-ting1
(1. College of Life Science, Zhejiang Chinese Medical University, Hangzhou 310053, China;
2. Bone Marrow Transplantation Center, The First Affiliate Hospital, Medical School of Zhejiang University,
Hangzhou 310003, China)
Abstract【】ObjectiveTo explore the role of HIF-1 and its downstream SDF-1α/CXCR4 and VEGF/VEGFR pathway in mediating MSC mobilization with DMOG. Methods Male SD rats were randomly divided into five groups: Normal saline control group, DMOG group, YC-1 group, AMD3100 group, SU5416 group. We used CFU-F assay and flow cytometry to determine the number of MSCs in rat bone marrow (BM) and peripheral blood (PB) in each group, respectively. The concentrations of SDF-1α and VEGF both in BM and PB serum in each group were detected by ELISA. Western blotting was used to test protein levels of HIF-1α, SDF-1α and VEGF in BM. ResultsCompared with NS group, the number of CFU-Fs as well as the percentage of CD45-CD90+cells increased in DMOG group (P < 0.05); Compared with DMOG group, the number of CFU-Fs as well as the percentage of CD45-CD90+cells decreased in YC-1 group, AMD3100 group and SU5416 group (P < 0.05). Compared with DMOG group, the concentration and protein expression of HIF-1α decreased significantly in YC-1 group (P < 0.05), the concentration and protein expression of SDF-1α decreased significantly in AMD3100 group (P < 0.05), the concentration and protein expression of VEGF decreased significantly in SU5416 group (P < 0.05). Conclusion DMOG can induce MSCs mobilization possibly via up-regulating the expression of HIF-1α and activating its downstream SDF-1α/CXCR4 and VEGF/VEGFR pathway.
【Key words】Mesenchymal stem cells mobilization;DMOG;Hypoxia inducible factor-1α;Stromalcell-derived factor-lα;Vascular endothelial growth factor
间充质干细胞(mesenchymal stem cells,MSCs)动员指应用动员剂或采用动员措施促使骨髓中MSCs释放并迁移到外周血[1]。在组织损伤需要MSCs参与修复的第一时间,给予动员措施,MSCs即可在短时间内从骨髓进入循环池,迁移、归巢入损伤部位,参与损伤修复,此举具有体外细胞移植修复损伤无法比拟的低创性和高效性,因此MSCs动员方法及其机制的研究具有重要的临床意义[1-3]。但是,目前尚缺乏临床可行的MSCs 动员措施,动员机制也不明确。我们前期实验研究发现,脯氨酸羟化酶抑制剂—二甲基乙二酰基甘氨酸(dimethyloxaloylglycine,DMOG)对小鼠MSCs具有动员作用[4]。缺氧诱导因子-1α(hypoxia-inducible factor -1α,HIF-1α)是缺氧诱导MSCs动员的关键因子,在MSCs动员过程中起中心作用[5]。HIF-1直接调控的下游信号基质细胞衍生因子-1α(SDF-1α)/CXC族细胞因子受体4(CXCR4)通路与血管内皮生长因子(VEGF)/血管内皮生长因子受体(VEGFR)通路在干细胞动员与MSCs迁移中起重要作用[6]。
本研究通过给予HIF-1拮抗剂YC-1下调HIF-1的表达,CXCR4拮抗剂AMD3100阻断SDF-1/CXCR4通路,VEGFR拮抗剂SU5416阻断VEFG/VEGFR 通路,探讨HIF-1及下游SDF-1α/CXCR4通路和VEGF/VEGFR通路在DMOG诱导MSCs动员中的作用机制。研究结果将为MSCs动员剂的开发提供实验依据。
1材料和方法
1.1实验动物
清洁级SD大鼠,4周龄,80±10 g,雄性,来源于上海西普尔-必凯实验动物有限公司【SCXK(沪)2008-0016】。实验在浙江中医药大学动物实验中心进行【SYXK(浙)2008-0115】。
1.2主要试剂与仪器
药品及主要试剂:DMOG(Cayman公司);YC-1、AMD3100、SU5416(Sigma公司);兔抗大鼠CD45-FITC抗体、兔抗大鼠CD90-PE抗体、荧光同型对照抗体、兔抗大鼠HIF-1α抗体、兔抗大鼠SDF-1α抗体、兔抗大鼠VEGF抗体、兔抗大鼠GAPDH抗体、山羊抗兔二抗(Abcam公司);DMEM/F12 1∶1培养基(Invitrogen产品);胎牛血清(FBS,Gibco产品);红细胞裂解液(北京鼎国生物科技公司)、大鼠淋巴细胞分离液(天津灏洋生物制品科技有限公司);分子生物学实验常用试剂(Sigma公司);SDF-1α、VEGF ELISA检测试剂盒(RayBiotech公司)。
主要仪器:SpectraMax Plus384酶标仪(MD公司);FC500MCL型流式细胞仪(BectonDiekinson公司);Mini PROTEAN型垂直电泳槽、1703940 型半干转印槽(Bio-RAD公司)等。
1.3实验分组
雄性SD大鼠随机分为5组:①生理盐水对照组(NS):给予相同体积的生理盐水;②DMOG组:腹腔注射DMOG 40 mg/kg;③YC-1组:腹腔注射DMOG 40 mg/kg,YC-1 10 mg/kg;④AMD3100组:腹腔注射DMOG 40 mg/kg,AMD3100 5 mg/kg;⑤SU5416组:腹腔注射DMOG 40 mg/kg,SU5416 5 mg/kg。每组5只,连续给药7 d。
1.4大鼠骨髓及外周血单个核细胞提取
各处理组连续给药7 d后,无菌条件下取出大鼠股骨和胫骨,剔除肌肉、脂肪等,PBS冲出骨髓单个核细胞(bonemarrow mononuclear cells,BMMNCs),1000 r/min离心5 min,弃去上清,按1:2加入红细胞裂解液裂解5 min,1000 r/min离心5 min,重悬计数;10%水合氯醛(3.5 mL/kg)腹腔注射麻醉SD大鼠,无菌条件下,10 mL注射器取腹腔动脉血5 mL,缓慢加入含5 mL淋巴细胞分离液的离心管中,2000 r/min离心20 min,吸取白雾层,PBS洗涤2次后,重悬计数外周血单个核细胞(peripheral bloodmononuclear cells,PBMNCs)。
1.5大鼠骨髓及外周血中MSCs数量检测
将计数后BMMNCs及PBMNCs以3×106cells/mL重悬于含有20% FBS、1%青-链霉素的DMEM/F12培养基中,接种于25 cm2的塑料培养瓶中,置于37℃、5% CO2培养箱培养。7 d后换新鲜培养基,以后每3 d换液一次,培养14 d后,显微镜下观察计数骨髓CFU-Fs(将呈成纤维样生长,且细胞密度大于50个细胞的集落标记为1个CFU-F)与外周血CFU-Fs。CFU-Fs数量即为骨髓与外周血中MSCs数量。
1.6大鼠骨髓及外周血中CD45-CD90+细胞群比例检测
将1×105个BMMNCs及PBMNCs分别重悬于含100 μL PBS的流式管中,并设置单色及双色同型对照组。每管细胞加2 μL兔抗大鼠 CD45-FITC抗体及5 μL兔抗大鼠CD90-PE抗体。室温避光条件孵育30 min后,PBS洗去未结合抗体,流式细胞仪检测CD45-CD90+细胞群比例。
1.7骨髓上清及外周血清中SDF-1α、VEGF浓度检测
各处理组连续给药7 d后,无菌条件下取各组大鼠外周血、股骨及胫骨,方法如1.4。PBS冲出BMMNCs,4℃,1000 r/min离心10 min,收集骨髓上清;取各组大鼠外周血5 mL,4℃,1000 r/min离心20 min,收集外周血血清,酶联免疫吸附试验(enzyme-linked immunosorbent assays,ELISA)检测SDF-1α、VEGF浓度,具体过程按照试剂盒说明书操作。
1.8HIF-1α、SDF-1α及VEGF蛋白表达检测
取各组大鼠BMMNCs,方法如1.4。收集各组大鼠BMMNCs至1.5 mL EP管中,加200 μL预冷的细胞裂解液裂解样本5 min,充分裂解后,4℃,12000 r/min离心20 min,保留上清。马斯蓝染色法测定各组蛋白总量,将各组蛋白浓度稀释至5 μg/μL。SDS-PAGE电泳,半干法转膜,封闭2 h,分别加兔抗大鼠HIF-1α抗体、兔抗大鼠SDF-1α抗体、兔抗大鼠VEGF抗体、兔抗大鼠GAPDH抗体(HIF-1α稀释度1∶1000,SDF-1α稀释度1∶1000,VEGF稀释度1∶1000,GAPDH稀释度1∶2000,4℃孵育过夜,洗膜液漂洗3次,加山羊抗兔二抗(稀释度1∶2000)室温孵育1 h,洗膜液漂洗3次,ECL显影,待胶片出现清晰的蛋白条带,拍照,用Image J软件进行吸光度分析,测出各组样本蛋白相对表达水平。
1.9统计学处理

2结果
2.1CFU-F法与流式细胞术检测大鼠骨髓及外周血中MSCs数量
CFU-F法结果显示:DMOG组大鼠骨髓及外周血CFU-Fs数量较NS组显著增加(13.4±1.14VS 9.2±0.83;2.6±0.54VS 1.4±0.54,P< 0.05)。YC-1、AMD3100、SU5416组骨髓CFU-Fs数量较DMOG组显著降低(9.8±0.83、10.4±1.14、9.6±1.14 VS 13.4±1.14,P< 0.05),同时外周血CFU-Fs 数量也显著降低(1.2±0.83、1.6±0.54、1.6±0.54 VS 2.6±0.54,P< 0.05)(表1)。
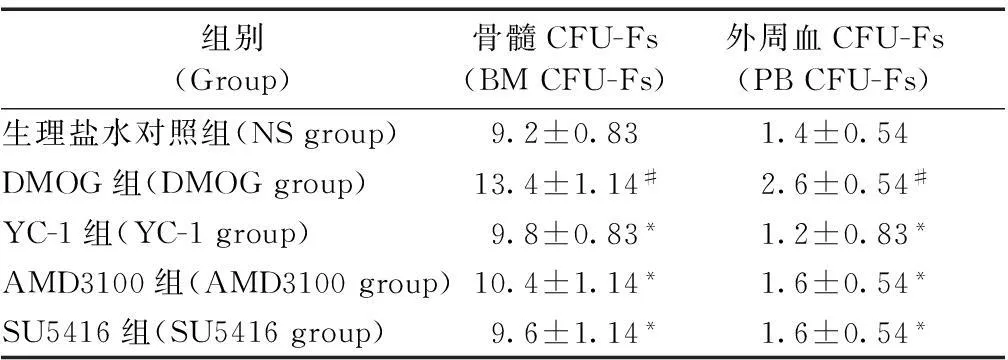
表1 骨髓及外周血中CFU-Fs数量
注:与NS组比较,#P< 0.05;与DMOG组比较,*P<0.05。
Note: Compared with NS group,#P<0.05; compared with DMOG group,*P<0.05.
流式细胞术结果显示:DMOG组骨髓与外周血中CD45-CD90+细胞群比例与NS组比较明显升高(3.67±0.17% VS 2.94±0.06%,15.3±0.33% VS 6.37±0.23%,P< 0.05)。YC-1、AMD3100、SU5416组骨髓与外周血中CD45-CD90+细胞群比例与DMOG组比较显著降低(2.52±0.05%、2.55±0.10%、2.48±0.07% VS 3.67±0.17%;12.6±0.31%、13.1±0.55%、11.6±0.53% VS 15.3±0.33%,P< 0.05)(彩插2图1)。
2.2ELISA检测大鼠骨髓上清及外周血清中SDF-1α,VEGF 浓度
ELISA检测结果显示:DMOG组处理7 d后,大鼠骨髓上清及外周血清中SDF-1α、VEGF浓度与NS组相比显著升高(P< 0.05)。AMD3100处理组大鼠骨髓上清及外周血清中SDF-1α浓度同DMOG相比显著降低(P< 0.05)。SU5416处理组大鼠骨髓上清及外周血清中VEGF浓度同DMOG相比显著降低(P< 0.05)(图2)。

注:A,骨髓上清SDF-1α浓度;B,骨髓上清中VEGF浓度;C,外周血清中SDF-1α浓度; D,外周血清中VEGF浓度。与NS组比较, *P<0.05。与DMOG组比较, #P<0.05。 图2 骨髓上清及外周血清中SDF-1α及VEGF浓度 Note:A, SDF-1α concentration in BM serum;B, VEGF concentration in BM serum;C, SDF-1α concentration in PB serum; D, VEGF concentration in PM serum. Compared with NS group, *P<0.05. Compared with DMOG group, #P<0.05. Fig.2 Quantification of SDF-1αand VEGF concentrations in BM and PB
2.3Western blotting法检测大鼠骨髓细胞中HIF-1α,SDF-1α,VEGF的表达
Western blotting结果显示,HIF-1α、SDF-1α、VEGF 表达在给予DMOG后明显增加(P< 0.05)。 YC-1组HIF-1α表达较DMOG组明显降低(P< 0.05)。AMD3100组SDF-1α表达较DMOG组明显降低(P< 0.05)。SU5416组VEGF表达较DMOG组显著降低(图3)。

注:A,各组大鼠骨髓细胞HIF-1α、SDF-1α、VEGF的表达水平;B、C、D:分别为HIF-1α、SDF-1α、 VEGF相对表达定量结果。与NS组比较, *P < 0.05。与DMOG 组比较, #P < 0.05。 图3 骨髓细胞中HIF-1α、SDF-1α及VEGF蛋白表达水平 Note:A:The expression level of HIF-1α, SDF-1α and VEGF in BM cells; B, C, D:Relative levels of HIF-1α, SDF-1α and VEGF proteins were presented as the fold increase normalized to NS. Compared with NS group, *P < 0.05. Compared with DMOG group, #P < 0.05. Fig.3 The protein expression of HIF-1α, SDF-1α and VEGF
3讨论
MSCs动员方法及其机制的研究具有重要的临床意义。我们前期研究发现脯氨酸羟化酶抑制剂—DMOG对小鼠MSCs具有动员作用[4],然而其潜在机制尚不十分明确。研究发现,脯氨酸羟化酶在HIF-1的调控中有至关重要的作用,因而被认为是体内的氧感受器[7]。HIF-1α是脯氨酸羟化酶(proline hydroxylase, PHD)唯一的底物。脯氨酸羟化酶抑制剂(PHD inhibitor,PHI)通过抑制PHD的活性,而抑制HIF-1α的羟化,减少常氧状态下HIF-1α的降解,从而稳定HIF-1α的表达,上调HIF-1信号通路。DMOG为酮戊二酸类似物,通过与内源性的2-酮戊二酸竞争从而抑制脯氨酸羟化酶,是当前脯氨酸羟化酶抑制剂研究的热点[8-9]。在本研究中,我们采用CFU-F法和流式细胞术定量检测骨髓及外周血中MSCs的数量,结果显示DMOG组骨髓与外周血MSCs数量较NS组显著增加,CD45-CD90+细胞群比例与NS组比明显升高,验证了DMOG对MSCs的动员作用。
HIF-1由HIF-1α及HIF-1β两个亚基构成,HIF-1β为HIF-1的构成性亚基,在细胞浆中稳定表达;HIF-1α为HIF-1的调节性亚基。YC-1作为靶向HIF-1α抑制剂,可以有效抑制动物体内HIF-1α的表达[10-12]。本研究结果发现,YC-1可以明显抑制HIF-1α上调。抑制HIF-1通路后,YC-1组的MSCs动员效率明显降低,且SDF-1α浓度及蛋白表达显著降低,表明HIF-1α在DMOG诱导的MSCs动员中起重要作用。研究证实,SDF-1α在内皮细胞受转录因子HIF-1直接调控。CXCR4是目前所知的SDF-1α的唯一受体。同时国内外研究与我们前期研究均发现SDF-1α/CXCR4通路在MSCs迁移中发挥重要作用[5]。AMD3100是SDF-1α受体CXCR4的阻断剂,能竞争性地结合CXCR4,有效阻断SDF-1α/CXCR4通路。我们研究结果发现,阻断SDF-1α/CXCR4通路后,AMD3100组MSCs动员效率明显降低,且SDF-1α浓度及蛋白表达显著降低。VEGF/VEGFR是介导骨髓微环境改变、促进MSCs迁移的重要通路。VEGF是受HIF-1直接调控的细胞生长因子,可通过与其特异性受体VEGFR结合激活酪氨酸蛋白激酶活性,促进内皮细胞分裂增殖、促进新生血管的形成、提高血管通透性[13]。SU5416是一种脂溶性小分子合成受体酪氨酸激酶抑制剂[14-15],它通过与酪氨酸激酶受体内激酶结构域结合竞争性抑制ATP而发挥作用。本研究通过SU5416特异性阻断VEGF/VEGFR通路,结果发现MSCs动员效率降低,且VEGF浓度及蛋白表达降低。既往研究证实,VEGF/VEGFR与SDF-1α/CXCR4通路存在一定的交互作用,VEGF可上调胶质瘤细胞与血管内皮细胞中SDF-1α及其受体CXCR4的表达,但并不影响SDF-1α向细胞外分泌[16-17]。本研究结果提示,SU5416抑制骨髓细胞VEGF表达的同时对SDF-1α蛋白表达也有一定的抑制作用,但骨髓上清中分泌型SDF-1α水平并没有显著变化。VEGF与SDF-1通路之间相互作用的具体机制还需进一步研究。
综上所述,DMOG诱导MSCs动员可能的作用机制为:机体接受DMOG后,抑制HIF-1α的羟化,HIF-1信号上调,调控其下游基因SDF-1α、VEGF 表达增加,故DMOG可能通过上调HIF-1,从而调控其下游SDF-1α/CXCR4通路与VEGF/VEGFR 通路诱导MSCs 动员。
参考文献:
[1]Levesque JP, Winkler IG, Larsen SR,etal. Mobilization of bone marrow-derived progenitors[M]. Handb Exp Pharmacol: Springer Berlin Heidelberg , 2007: 3-36.
[2]Mansilla E, Marin GH, Drago H,etal. Bloodstream cells phenotypically identical to human mesenchymal bone marrow stem cells circulate in large amounts under the influence of acute large skin damage: new evidence for their use in regenerative medicine[J]. Transplant Proc, 2006, 38(3): 967-969.
[3]Pitchford SC, Hahnel MJ, Jones CP,etal. Troubleshooting: Quantification of mobilization of progenitor cell subsets from bone marrow in vivo[J]. Pharmacol Toxicol Methods, 2010, 61(2): 113-121.
[4]刘伟,余勤,刘丽珍,等.脯氨酸羟化酶抑制剂对小鼠间充质干细胞的动员作用[J].浙江中医药大学学报,2013,37(12):1371-1376.
[5]Liu LZ, Yu Q, Lin J,etal. Hypoxia-inducible factor-1α is essential for hypoxia-induced mesenchymal stem cell mobilization into the peripheral blood[J]. Stem Cells and Development, 2011, 20(11): 1961-1971.
[6]Chen CP, Lee MY, Huang JP,etal. Trafficking of multipotent mesenchymal stromal cells from maternal circulation through the placenta involves vascular endothelial growth factor receptor-1 and integrins[J]. Stem Cells, 2008, 26(2): 550-561.
[7]Demidenko ZN, Blagosklonny MV. The purpose of the HIF-1/PHD feedback loop: to limit mTOR-induced HIF-1α[J]. Cell Cycle, 2011, 10(10): 1557-1562.
[8]Bernhardt WM, Gottmann U, Doyon F,etal. Donor treatment with a PHD-inhibitor activating HIFs prevents graft injury and prolongs survival in an allogenic kidney transplant model[J]. Proc Natl Acad Sci USA, 2009, 106(50): 21276-21281.
[9]Liu XB, Wang JA, Ogle ME,etal. Prolyl hydroxylase inhibitor dimethyloxalylglycine enhances mesenchymal stem cell survival[J]. Cell Biochem, 2009, 106(5): 903-11.
[10]Shin, DH, Kim, JH, Jung, YJ,etal. Preclinical evaluation of YC-1, a HIF inhibitor, for the prevention of tumor spreading[J]. Cancer Lett, 2007, 255(1):107-116.
[11]Yeo EJ, Chun YS, Cho YS,etal. YC-1: a potential anticancer drug targeting hypoxia-inducible factor 1[J]. Natl Cancer Inst, 2003, 95(7): 516-525.
[12]Pan SL, Guh JH, Peng, CY,etal. YC-1 [3- (5′-hydroxymethyl-2′-furyl) -1-benzyl indazole] inhibits endothelial cell functions induced by angiogenic factors in vitro and angiogenesis in vivo models[J]. Pharmacol Exp Ther, 2005, 314(1): 35-42.
[13]Fong GH. Regulation of angiogenesis by oxygen sensing mechanisms[J]. Mol Med, 2009, 87(6): 549-560.
[14]Mendel DB, Schreck RE, West DC,etal. The angiogenesis inhibitor SU5416 has long-lasting effects on vascular endothelial growth factor receptor phosphorylation and function[J]. Clin Cancer Res, 2000, 6(12): 4848-4858.
[15]Sukbuntherng J, Cropp G, Hannah A,etal. Pharmacokinetics and interspecies scaling of a novel VEGF receptor inhibitor, SU5416[J]. Pharm Pharmacol, 2001, 53(12): 1629-1636.
[16]Hong X, Jiang F, Kalkanis SN,etal. SDF-1 and CXCR4 are up-regulated by VEGF and contribute to glioma cell invasion[J]. Cancer Letters, 2006, 236(1): 39-45.
[17]David Z, Yevgeniy L, Li L,etal. Hypoxia-inducible factor 1 and VEGF upregulate CXCR4 in glioblastoma: implications for angiogenesis and glioma cell invasion[J]. Laboratory Investigation, 2006, 86 : 1221-1232.
〔修回日期〕2014-10-09
