鸡胚致死孤儿病毒和鸡减蛋综合症病毒多重PCR检测方法的建立及初步应用
2016-01-12王淑菁,付瑞,李晓波等
技术方法
鸡胚致死孤儿病毒和鸡减蛋综合症病毒多重PCR检测方法的建立及初步应用
王淑菁,付瑞,李晓波,王吉,卫礼,巩薇,岳秉飞,贺争鸣
(中国食品药品检定研究院实验动物资源研究所,国家实验动物质量检测中心,北京100050)
【摘要】目的建立鸡胚致死孤儿病毒(CELO)和鸡减蛋综合症病毒(EDS)的多重PCR检测方法并进行初步应用。方法参照GenBank提供的基因序列,设计了2对特异性引物分别扩增CELO长纤突蛋白和EDS六邻体蛋白的基因序列,建立检测CELO和EDS的多重PCR方法,考察该方法的特异性和敏感性,并使用该方法检测流感疫苗主种子批病毒是否存在外源性禽腺病毒的污染。结果该多重PCR方法成功扩增得到了两条特异性目的条带,并经测序验证。该方法特异性好,灵敏度显示核酸最低检测量可达10-4μg/mL。使用该方法检测12批次流感疫苗主种子批病毒,外源性禽腺病毒的检测结果均为阴性。结论成功建立鸡胚致死孤儿病毒和鸡减蛋综合症病毒的多重PCR检测方法,灵敏度高,特异性好。在流感疫苗主种子批病毒的外源性禽腺病毒的检测中具有很高的使用价值和应用前景。
【关键词】鸡胚致死孤儿病毒;鸡减蛋综合症病毒;禽腺病毒;多重PCR
[基金项目]实验动物质量检测关键技术研究(2013BAK11B01);中检院中青年发展研究基金课题(2013NC2)。
[作者简介]王淑菁(1985-),女,助理研究员,研究方向:实验动物病毒学。Email: wsj2008gogo@163.com。
[通讯作者]贺争鸣(1957-),男,研究员,研究方向:微生物学和免疫学。Email:zhengminghe57@163.com。
【中图分类号】S852.65 R332【文献标识码】 A
doi:10.3969.j.issn.1671.7856. 2015.001.012
Detection of chicken embryo lethal orphan virus and egg drop
syndrome virus by multiplex polymerase chain reaction
WANG Shu-jing,FU Rui,LI Xiao-bo,WANG Ji,WEI Li,GONG Wei,YUE Bing-fei,HE Zheng-ming
(National Institute for Food and Drug Control,Institute for Laboratory Animal Resources,
National Center for Monitoring of Laboratory Animal Health,Beijing 100050,China)
Abstract【】ObjectiveTo establish multiplex PCR assay for detection of chicken embryo lethal orphan virus(CELO)and egg drop syndrome virus (EDS). Methods According to GenBank gene sequence, two pairs of specific primers designed were amplified CELO long fiber protein and EDS hexon protein gene sequence. The specificity and sensitivity of multiplex PCR were tested. We also use the multiplex PCR to detect exogenous CELO and EDS in influenza virus. ResultsTwo target bands have been successfully amplified and verified by sequencing. The specificity of the method is better, and the sensitivity is 10-4μg/mL. The results of detecting exogenous CELO and EDS in 12 influenza virus were negative. ConclusionThe multiplex PCR assay for detection of CELO and EDS was established successfully, which have good specificity and high sensitivity, and have high value and application prospect for detecting exogenous CELO and EDS in influenza virus.
【Key words】Chicken embryo lethal orphan virus(CELO);Egg drop syndrome virus (EDS);Avian adenovirus;Multiplex PCR
鸡胚致死孤儿病毒(CELO)属于禽腺病毒I型,为无包膜双股DNA病毒。主要引起鸡的包涵体肝炎、再生障碍性贫血、呼吸道感染、出血性肠炎和产蛋量减少,常与禽类呼吸道病原微生物混合感染,导致死亡率增加。减蛋综合症病毒(EDSV)属于禽腺病毒III型,为无包膜双股DNA病毒,感染后主要在输卵管内大量繁殖,形成嗜碱性包涵体,引起产蛋量下降、蛋壳异常和蛋体畸形[1]。
在流感疫苗检定中,规定主种子批病毒需进行外源禽腺病毒I型和III型的检测。传统检测方法为使用血凝方法、琼脂扩散方法等血清学方法对鸡胚致死孤儿病毒(CELO)和减蛋综合症病毒(EDSV)进行检测,存在特异性、敏感性及仪器试剂方面的不足,需建立快速、特异性强的PCR检测方法[2-4]。
多重PCR是一种可在同一体系中同时检测多种病原体的分子生物学方法,灵敏度高,特异性强,能够对疾病做到快速、准确的诊断, 适合大量样品( 特别是混合感染样品) 中病原体的快速检测[5-6]。本研究拟建立一种能够同时检测鸡胚致死孤儿病毒和鸡减蛋综合症病毒的多重PCR方法,以期对流感疫苗主种子批病毒进行快速、准确的检测。
1材料和方法
1.1病毒
鸡胚致死孤儿病毒(CELO VR-432株)、小鼠腺病毒(MAdV)均购买于美国模式菌种收集中心,鸡减蛋综合症病毒(EDS AV127株)购于中国兽药监察所。猴腺病毒-1和猴腺病毒-20均为本科室保存。
1.2引物的设计
根据GenBank提供的基因序列,选择CELO和EDS保守特异的区域设计引物。针对CELO独有蛋白即长纤突蛋白基因序列设计一对引物(CELO-172F:5’TGCTGACTACCTCGCTCTAC3’;CELO-172R:5’ATACTGATGTTGCTTGGCTC3’),扩增条带为172 bp。针对EDS六邻体蛋白基因序列设计一对引物(EDS-516F:ACCCGCTTCGTTACACCAT;EDS-516R:CCCTTCGGAGAAATCCCTAC),扩增条带为516 bp。
1.3病毒DNA的提取
使用Qiagen基因组DNA提取试剂盒(QIAamp DNA Mini Kit,型号51304)提取病毒DNA,详细操作见产品说明书。
1.4单个PCR反应
PCR反应体系为25 μL,包括:10×PCR buffer 2.5 μL,dNTP 2 μL,ddH2O 17.35 μL,引物各1 μL,DNA 1 μL,HS Taq酶0.15 μL。PCR反应条件为:94℃ 预变性5 min;94℃ 1 min,52℃ 1 min,72℃ 1 min,35个循环;72℃ 10 min。PCR产物进行琼脂糖电泳测定。PCR产物送Takara公司进行序列测定。
1.5多重PCR反应及优化
PCR反应体系为25 μL,包括:10×PCR buffer 2.5 μL,dNTP 2 μL,ddH2O 16.35 μL,引物各0.75 μL,CELO DNA 1 μL,EDS DNA 1 μL,HS Taq酶0.15 μL。PCR反应条件为:94℃ 预变性5 min;94℃ 1 min,退火温度 1 min,72℃ 1 min,35个循环;72℃ 10 min。
对多重PCR的退火温度进行优化,选择50℃、52℃、54℃、56℃、58℃、60℃进行PCR反应。
1.6特异性试验
提取小鼠腺病毒、鸡胚致死孤儿病毒、鸡减蛋综合症病毒、猴腺病毒-1,猴腺病毒-20的DNA,考察该多重PCR方法的特异性。
1.7灵敏度试验
取CELO DNA与 EDS DNA各10 μL混匀,倍比稀释混合模板浓度从1~10-9μg/mL,考察该多重PCR方法的灵敏度。
1.8检测方法的应用
应用建立的多重PCR方法对流感疫苗主种子批病毒进行检测。
2结果
2.1单个PCR检测体系的建立
CELO经特异性引物扩增得到172 bp目的片段(图1);EDS经特异性引物扩增得到516 bp目的片段(图2)。将扩增得到的目的片段经测序后,与NCBI网站上的序列一致率均为100%。
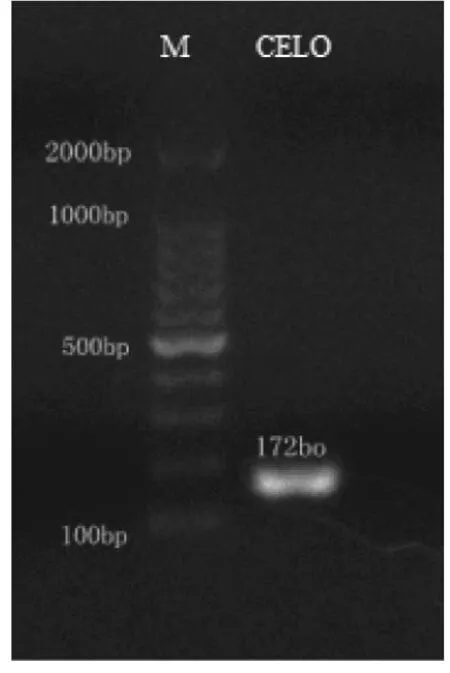
图1 CELO扩增目的条带 Fig.1 The PCR result of CELO

图2 EDS扩增目的条带 Fig.2 The PCR result of EDS
2.2多重PCR检测体系的建立及优化
多重PCR扩增CELO、EDS混合模板,得到172 bp和516 bp两条目的条带。将两条带分布切胶回收,转入T-easy 载体后测序,证实172 bp目的片段与CELO基因序列一致率为100%,516 bp目的片段与EDS基因序列一致率为100%。选择50℃~60℃的温度区间优化退火温度,结果显示在该温度区间均可扩增出两条特异的目的条带,没有非特异性扩增条带产生(图3)。
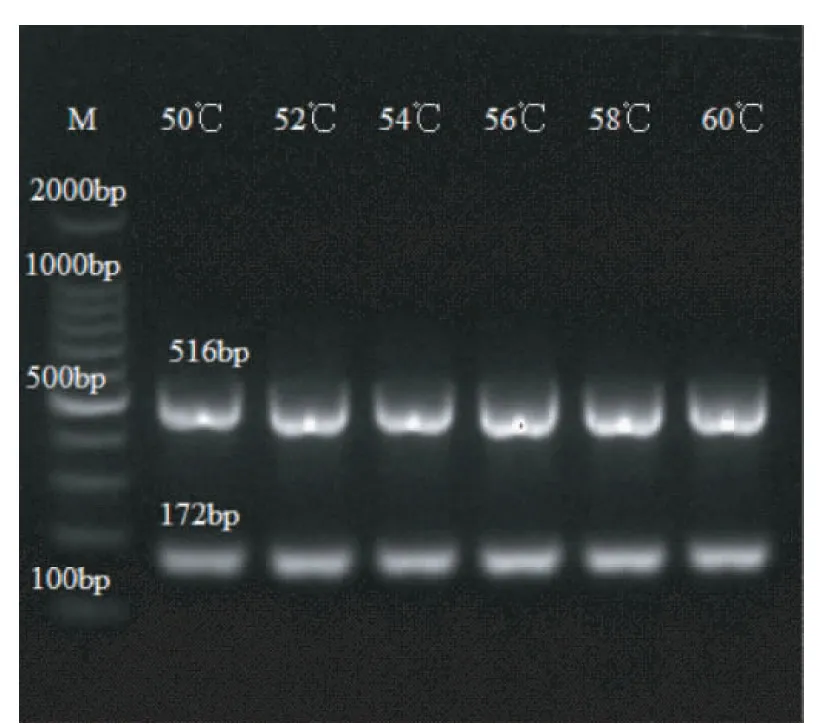
M:100 bp Marker 图3 多重PCR扩增CELO和EDS Fig.3 The multiplex PCR of CELO and EDS
2.3多重PCR方法特异性测定
以小鼠腺病毒、鸡胚致死孤儿病毒、鸡减蛋综合症病毒、猴腺病毒-1,猴腺病毒-20做对照,鸡胚致死孤儿病毒仅扩增得到其172 bp目的条带,鸡减蛋综合症病毒仅扩增得到其516 bp目的条带,小鼠腺病毒、猴腺病毒-1,猴腺病毒-20均未扩增出条带(图4)。
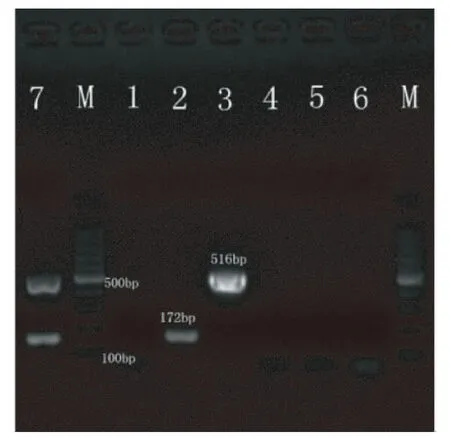
注:M:100 bp Marker;1:阴性对照;2:鸡胚致死孤儿病毒;3:鸡减蛋综合症病毒;4:小鼠腺病毒;5:猴腺病毒-1;6:猴腺病毒-20;7:鸡胚致死孤儿病毒和鸡减蛋综合症病毒混合模板(阳性对照)。 图4 多重PCR的特异性 Note:M:100 bp Marker;1:Negative control;2:CELO;3:EDS;4:MAdv;5:SAdv -1;6:SAdv -20;7:CELO and EDS mixture(Positive control). Fig.4 The specificity test of multiplex PCR
2.4多重PCR方法灵敏性测定
取CELO DNA与EDS DNA各10 μL混匀后进行倍比稀释,模板浓度从1~10-9μg/mL,多重PCR反应结果显示其灵敏度至10-4μg/mL(图5)。

注:M:100 bp Marker;1:1 μg/mL;2:10 -1 μg/mL;3:10 -2 μg/mL;4:10 -3 μg/mL;5:10 -4 μg/mL;6:10 -5 μg/mL;7:10 -6 μg/mL;8:10 -7 μg/mL;9:10 -8 μg/mL;10:10 -9 μg/mL;11:阴性对照。 图5 多重PCR的灵敏性 Note:M:100 bp Marker;1:1 μg/mL;2:10 -1 μg/mL;3:10 -2 μg/mL;4:10 -3 μg/mL;5: 10 -4 μg/mL;6:10 -5 μg/mL;7:10 -6 μg/mL;8:10 -7 μg/mL;9:10 -8 μg/mL;10:10 -9 μg/mL;11:Negative control. Fig.5 The sensibility test of multiplex PCR
2.5多重PCR检测流感疫苗主种子批病毒
提取送检的12批次流感疫苗主种子批病毒的DNA,经多重PCR进行检测,结果均为阴性(图6)。
3讨论
随着分子生物学技术的发展,使用PCR技术快速检测病原微生物的应用越来越多。周斌等[7]使用随机引物PCR扩增快速鉴定鸡胚致死孤儿病毒。
Yo Okuda等[8]使用PCR-RFLP方法扩增禽腺病毒I型长纤突蛋白基因序列,根据片段大小鉴定其是否为致病性腺病毒。马震原等[9]使用Taqman探针方法检测鸡产蛋下降综合征病毒,特异性强,灵敏度可达10 copies/μL。李文贵等[10]使用套氏PCR检测产蛋下降综合征病毒,灵敏度比常规PCR灵敏100倍,可检测出0.01fg的DNA模板。目前国内尚未报道鸡胚致死孤儿病毒和鸡减蛋综合症病毒的多重PCR方法。
在多重PCR反应中,设计特异性的引物是关键。本研究设计的引物是针对2种禽腺病毒各自保守的基因序列,它们分别是鸡胚致死孤儿病毒的长纤突蛋白和鸡减蛋综合症病毒的六邻体蛋白基因组序列,这些序列具有高度保守性,因此能作为PCR扩增的目的基因[1]。实验中扩增得到的目的产物经测序后比对,与NCBI上序列一致率均为100%。此外,对退火温度进行优化,在50℃~60℃温度区间内考查退火温度,结果表明,在该温度范围内,多重PCR均能得到很好的扩增,没有非特异性的扩增。对新建立的多重PCR方法进行特异性和灵敏度考察,其特异性强,灵敏度高,最低核酸检测量可至10-4μg/mL。

注:M:100 bp Marker;1-12为送检流感疫苗主种子批病毒;13:鸡胚致死孤儿病毒;14:鸡减蛋综合症病毒;15:鸡胚致死孤儿病毒和鸡减蛋综合症病毒病毒的阳性对照;16:阴性对照。 图6 多重PCR检测流感疫苗主种子批病毒 Note:M:100 bp Marker;1-12:Influenza virus;13:CELO;14:EDS;15:CELO and EDS mixture(Positive control);16:Negative control. Fig.6 The multiplex PCR result for detecting exogenous CELO and EDS in influenza virus
《中华人民共和国药典》2010年版三部中规定流感全病毒及裂解疫苗均需对毒种中外源性禽腺病毒进行检测。本研究建立的多重PCR方法能够对流感疫苗主种子批毒种中鸡胚致死孤儿病毒、鸡减蛋综合症病毒单独或混合污染进行快速、准确的检测及鉴定,结果表明,该方法特异性强、灵敏度高,具有很高的使用价值和应用前景。
参考文献:
[1]殷震,刘景华. 动物病毒学[M].北京:科学出版社,1997.
[2]国家药典委员会. 流感病毒裂解疫苗[S]. 中华人民共和国药典(2010年版,三部),162-164.
[3]周斌,刘华雷,曹瑞兵. 污染疫苗的禽腺病毒分离和鉴定[J]. 南京农业大学学报,2004,27 ( 3):78-80.
[4]智海东,解生亮,杨志,等. 鸡胚致死孤儿病毒琼脂扩散抗原的研制及应用[J]. 中国兽药科学,2009,39(08):718-722.
[5]冯育芳,邢进,岳秉飞,等. 实验犬布氏杆菌的多重PCR检测与分型鉴定[J]. 中国比较医学杂志,2011,21(5):57-61.
[6]张林,胡北侠,杨少华,等. 禽四种病毒多重PCR诊断技术的建立和应用[J]. 家畜生态学报,2011,32(4):71-74.
[7]周斌,曹瑞兵,芦银华,等. 随机引物PCR扩增鸡胚致死孤儿病毒DNA的研究[J]. 中国病毒学,2003,18(2):104-107.
[8]Yo Okuda,Masaaki Ono,Isao Shibata,etal. Comparison of the polymerase chain reaction-restriction fragment length polymorphism pattern of the fiber gene and pathogenicity of serotype-1 fowl adenovirus isolates from gizzard erosions and from feces of clinically healthy chickens in Japan[J]. Vet Diagn Invest,2006,18:162-167.
[9]马震原,李刚,李文超,等. TaqMan荧光定量PCR检测鸡产蛋下降综合征病毒方法的建立及应用[J]. 畜牧兽医学报,2012,43(5):767-772.
[10]李文贵,俞乃胜,宋建领. 减蛋综合症病毒套氏PCR检测技术的研究[J]. 中国兽药科技,2000,30(12):5-8.
〔修回日期〕2014-09-09
