邻苯二甲酸二丁酯与胰蛋白酶的相互作用
2016-01-08张国文,王亚萍
邻苯二甲酸二丁酯与胰蛋白酶的相互作用*

张国文,王亚萍
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
摘要:在模拟人体生理条件下(pH值为7.4),应用荧光光谱法、紫外光谱法和圆二色谱法(CD)并结合原子力显微镜(AFM)和分子模拟技术,研究了邻苯二甲酸二丁酯(DBP)对胰蛋白酶(Trypsin)的光谱性质、结构及催化活性的影响.结果表明,DBP通过氢键和范德华力与胰蛋白酶形成基态复合物而猝灭胰蛋白酶的内源荧光,DBP在胰蛋白酶上只有1个结合位点.同步荧光、紫外和CD光谱研究发现,DBP与胰蛋白酶的结合诱导了酶的α-螺旋、β-折叠和β-转角含量的减少,而增加了无规卷曲的含量.原子力显微镜图像显示,DBP的存在引起胰蛋白酶的表面形态发生变化,蛋白质发生了聚集.分子模拟结果表明,DBP结合于胰蛋白酶S1疏水空腔附近,与氨基酸His 57,Ser 195和Gly 193形成氢键.酶活测定结果显示,DBP的存在导致胰蛋白酶活性被抑制.
关键词:邻苯二甲酸二丁酯;胰蛋白酶;结合特性;分子模拟
文章编号:1007-2985(2015)01-0046-06
中图分类号:O657.3 文献标志码:A
DOI:10.3969/j.issn.1007-2985.2015.01.011
收稿日期:*2014-07-12
基金项目:国家自然科学基金资助项目 (21167013,31460422);高等学校博士点
作者简介:张国文(1966—),男,江西资溪人,南昌大学食品科学与技术国家重点实验室教授,博士,博士生导师,主要从事食品化学与生物分析化学研究.

邻苯二甲酸二丁酯(dibutyl phosphate,DBP)是一种环境中常见的邻苯二甲酸酯类塑化剂,主要用作塑料增塑剂,同时可以作为润滑剂、胶粘剂和化妆品等的载体.研究表明,DBP具有生殖发育毒性,对内分泌系统、中枢神经系统等具有损伤作用[3-4]且有一定的致癌性.近年来,已发生多起DBP在白酒中含量超标事件,由DBP所引起的食品安全问题也越来越受到人们的关注.胰蛋白酶(Trypsin)是人体胰脏中普遍存在的一种消化水解蛋白酶,它对精胺酸和赖氨酸肽键具有选择性水解作用,在消化过程中起重要作用.塑化剂可通过环境、食物链等途径进入人体,一旦被人类接触或食用,会对人体的消化系统产生影响,可能干扰胰蛋白酶的正常生理功能而影响人体消化功能.笔者应用多种光谱学方法并结合原子力显微镜和分子模拟技术,在模拟人体生理条件下,研究了DBP与胰蛋白酶的结合性质及其对胰蛋白酶结构和活性的影响,该研究为从分子水平上认识DBP在体内转运、代谢、蓄积以及毒性机理提供有价值的信息.
1实验部分
1.1 主要仪器与试剂
仪器:F-7000型荧光光度计(日本日立公司),UV-2450紫外-可见分光光度计(日本岛津公司),MOS 450 圆二色光谱仪(法国Bio-Logic公司),MFP-3D-SA原子力显微镜(美国Veeco公司),pHS-3C型酸度计(上海雷磁仪器厂).
试剂:胰蛋白酶购自Sigma公司,用pH值7.4的Tris-HCl缓冲溶液配制成浓度为1.5×10-6mol/L的贮备液;DBP标准品购自阿拉丁试剂公司,用无水甲醇配置成浓度为1.0×10-2mol/L的贮备液;N-苯甲酰-L-精氨酸乙酯盐酸盐(BAEE)标准品购自阿拉丁试剂公司,用上述缓冲溶液配置成浓度为6.0×10-3mol/L的贮备液;其他试剂均为分析纯,实验用水为超纯水.
1.2 实验方法
1.2.1 荧光光谱和紫外光谱测定于3 mL浓度为1.5×10-6mol/L胰蛋白酶溶液中逐次加入一定体积的浓度为1.0×10-2mol/L的DBP溶液(5 μL/次),混匀放置3 min,以280 nm为激发波长,激发/发射狭缝为2.5 nm进行荧光光谱测定,并扣除相应DBP的荧光光谱,内滤效应参照文献予以校正.同时测定上述样品在Δλ=15,60 nm时的同步荧光光谱.
1.2.2 酶活性测定准确移取3 mL浓度为1.5×10-6mol/L的胰蛋白酶溶液至石英比色皿中,扫描其吸收光谱后,依次加入一定量的DBP溶液(5 μL/次),混合均匀后放置3 min,扫描DBP-胰蛋白酶混合物在200~320 nm范围的紫外吸收光谱,并测定相应游离浓度的DBP的吸收光谱.
胰蛋白酶可催化N-苯甲酰-L-精氨酸乙酯盐酸盐(BAEE)为N-苯甲酰-L-精氨酸(BA),BA在253 nm处的紫外吸收远强于BAEE,通过定量测定加入胰蛋白酶前后253 nm处吸收峰值的变化可以检测胰蛋白酶活性.利用紫外-可见分光光度计的动力学/时间软件,在pH值7.4的Tris-HCl缓冲体系中,胰蛋白酶 (1.5×10-6mol/L)和不同浓度的DBP在37 ℃孵化3 h后(体系甲醇含量控制在体积分数0.03%以内),加入BAEE(7.0×10-4mol/L),每隔20 s测定体系在253 nm处的吸光值,并通过相对活性(%)=(R/R0)×100%,计算不同浓度DBP存在时胰蛋白酶的相对活性,其中R0为不加抑制剂时吸光度变化的斜率,R为含有不同浓度DBP的体系中吸光度变化的斜率.
1.2.3 圆二色光谱(CD)测定在持续氮气环境下,分别测定190~250 nm波长范围内游离胰蛋白酶和DBP/trypsin物质的量之比为2∶1和5∶1的DBP-胰蛋白酶混合物的CD光谱,并应用在线SELCON3软件计算与DBP结合前后胰蛋白酶各二级结构的含量(http://dichroweb.cryst.bbk.au.uk/html/home.shtml).
1.2.4 原子力显微镜成像配制一定浓度(1.5×10-9mol/L)的胰蛋白酶和物质的量之比为10∶1的DBP-胰蛋白酶复合物(nDBP/n胰蛋白酶= 10∶1),取5 μL滴于云母片上,室温放置过夜,干燥后于原子力显微镜下用轻敲模式观察样品,扫描成像.
1.2.5 分子模拟利用Autodock4.2软件结合Lamarckian Genetic Algorithm算法模拟DBP与胰蛋白酶的结合模式.胰蛋白酶晶体结构从蛋白质数据库获得,PDB编号为2ZQ1[10],进行分子对接前,对蛋白模型作除去水分子、加氢及加Gastriger电荷处理.配体DBP的3D结构由Sybyl × 1.1 (USA)软件画出,利用MMFF94力场使能量最小化.
2结果与讨论
2.1 DBP诱导胰蛋白酶荧光猝灭
图1显示25 ℃时DBP对胰蛋白酶荧光的猝灭.随着溶液中DBP浓度的不断增加,胰蛋白酶在347 nm处荧光发射峰强度有规律地降低,且峰位有轻微的红移,表明DBP与胰蛋白酶发生了相互作用,引起胰蛋白酶氨基酸残基微环境的改变[11].
荧光猝灭过程通常分为静态猝灭和动态猝灭,荧光猝灭数据可利用如下Stern-Volmer方程描述[12]:
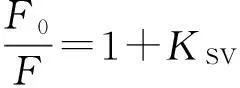
其中:F0和F分别表示加入DBP前后胰蛋白酶的荧光强度;KSV为猝灭常数;Kq为双分子猝灭速率常数;τ0为荧光寿命,其值约为2.80 × 10-9s[13];[Q]为猝灭剂DBP浓度.插图为25,31,37 ℃ 3个温度下DBP与胰蛋白酶相互作用的Stern-Volmer曲线,线性拟合得到的KSV值列于表1.结果显示,KSV值的变化趋势与温度变化呈负相关,且3个不同温度下的Kq值(1.81×1012,1.51×1012,1.28×1012L/(mol·s))均大于生物分子的最大扩散速率常数2.0×1010L/(mol·s)[14],表明DBP对胰蛋白酶荧光猝灭机理为形成复合物的静态猝灭[15].
为了进一步研究DBP与胰蛋白酶之间的结合特性、结合常数(K)和结合位点数(n),可由下列方程求得[16]:
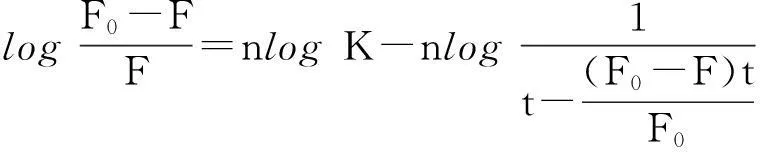
其中:F0和F分别表示加入DBP前后胰蛋白酶的荧光强度;[Q]>t]和[p]t]分别代表猝灭剂DBP以及胰蛋白酶的总浓度.作log(F0-F)/F对log1/([Q]>t]-(F0-F)[p]t]/F0)的关系图(图2),可以算得3个温度下反应体系的结合常数K值并列于表1.K值随着温度的升高而降低,说明温度升高会使复合物的稳定性降低[17].n≈1,表明DBP与胰蛋白酶有1个结合位点.
2.2 热力学参数与作用力
为了进一步阐明二者的作用机理,利用荧光数据对体系的热力学参数进行分析.疏水作用力、静电引力、范德华力和氢键被认为是小分子与生物大分子相互作用的主要驱动力[18].根据体系的热力学参数如焓变ΔH°、熵变ΔS°和自由能变ΔG°的值,可确定驱动DBP与胰蛋白酶结合的主要作用力类型[19].当温度变化不大时,反应的焓变ΔH°可以看作常数,可由下列方程求得反应的热力学参数:

其中K是对应温度下的结合常数,R是气体常数(8.314 (J/mol·K)).利用logK对1/T作图,通过拟合后直线的斜率和截距可以分别计算出体系的ΔH°和ΔS°值,进而计算得到ΔG°值.表1显示,ΔG°<0,说明DBP与胰蛋白酶的结合是一个自发过程,ΔS°<0,ΔH°<0,说明氢键和范德华力是该结合反应的主要驱动力[20].
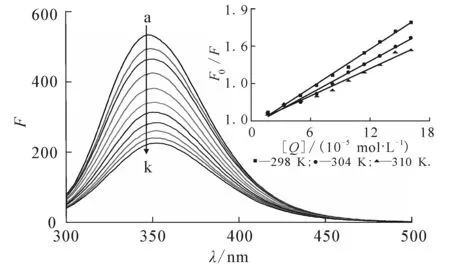
c trypsin=1.5×10 -6 mol/L;c DBP(10 -5 mol/L),curves a→k:0,1.66, 3.32,4.98,6.62,8.26,9.90,11.53,13.16,14.78,16.39. 图1 不同浓度DBP对胰蛋白酶荧光光谱的影响

图2 DBP-胰蛋白酶体系的双对数曲线

T/KKSV/(103L/mol)RaK/(103L/mol)nRbΔH°/(kJ/mol)ΔG°/(kJ/mol)ΔS°/((J/mol·K))2985.070.99834.941.110.9986-21.073044.230.99634.041.070.9944-23.48-21.02-8.093103.580.99183.431.010.9912-20.97
注:Ra为KSV的相关系数,Rb为结合常数K的相关系数.
2.3 DBP对胰蛋白酶结构的影响
图3为胰蛋白酶在不同浓度DBP存在时酪氨酸(Δλ=15 nm)和色氨酸(Δλ=60 nm)的特征光谱.随着DBP的加入,酪氨酸和色氨酸残基的荧光峰强度逐渐降低.当DBP浓度为1.639×10-4mol/L时,酪氨酸荧光峰从295 nm蓝移至288 nm,色氨酸荧光峰由286 nm红移至290 nm,表明DBP诱导酪氨酸残基所处微环境疏水性增加,而色氨酸残基微环境疏水性降低.

c trypsin=1.5×10 -6 mol/L;c DBP(10 -5 mol/L),curves a→k:0,1.66,3.32,4.98,6.62,8.26,9.90,11.53,13.16,14.78,16.39. 图3 DBP对胰蛋白酶同步荧光光谱的影响
胰蛋白酶在205,279 nm处有强、弱2个特征紫外吸收峰(图4),其中205 nm处吸收峰是由蛋白质肽链骨架的π-π*跃迁产生的,其峰强度、峰位变化与蛋白质多肽链的变化有关[21].随着DBP浓度的增加,205 nm处吸收峰的强度逐渐降低并伴随有轻微的红移,表明DBP诱导胰蛋白酶的构象发生了一定的变化.
CD光谱技术是检测蛋白质二级结构变化的一种有效手段.图5为游离胰蛋白酶和不同物质的量之比(nDBP/n胰蛋白酶)DBP-胰蛋白酶体系的CD光谱图.胰蛋白酶在200 nm处负峰的强度随溶液中DBP浓度的增加而逐渐降低,表明DBP引起胰蛋白酶的二级结构发生了变化.在线SELCON3软件计算获得游离胰蛋白酶含α-螺旋13.8%、β-折叠43.8%、β-转角20.6%、无规卷曲21.8%(表2);当DBP与胰蛋白酶的物质的量之比分别为2∶1和5∶1时,α-螺旋的质量分数分别减少为10.2%和7.4%,β-折叠的质量分数分别减少为40.3%和40.1%,β-转角的质量分数分别减少为15.7%和14.5%,而无规卷曲的质量分数则分别增加至33.8%和38.0%.

c trypsin=1.5×10 -6 mol/L;c DBP(10 -5 mol·L -1),curves a→i: 0,0.83,1.66,2.49,3.31,4.13,4.95,5.77,6.58;curve x:the absorption spectrum of DBP only,c DBP=0.83×10 -5 mol·L -1. 图4 同浓度DBP对胰蛋白酶紫外吸收光谱的影响

c trypsin=1.5×10 -5mol/L,and the molar ratios of DBP to trypsin were 0∶1 (a),2∶1 (b) and 5∶1 (c),respectively. 图5 DBP与胰蛋白酶相互作用的圆二色谱图

nDBP∶ntrypsinαHelix/%βSheet/%βTurn/%Randomcoil/%0∶113.843.820.621.82∶110.240.315.733.85∶17.440.114.538.0
2.4 DBP对胰蛋白酶表面形态的影响
原子力显微镜被广泛应用于蛋白质、核酸等生物大分子在空气或溶液中的形态观察研究.图6显示游离胰蛋白酶以及DBP-胰蛋白酶混合物的原子力显微镜图像.游离胰蛋白酶分子颗粒较小(图6a),计算得到平均高度为0.8 nm,平均直径为5.0 nm.当与一定浓度的DBP作用后,胰蛋白酶分子的直径明显增大(图6b),平均高度和平均直径分别为2.24 nm和11.12 nm,说明DBP的加入使得蛋白质表面形态发生变化,改变了蛋白质的微环境,可能导致胰蛋白酶分子更多地暴露在疏水环境中,引起蛋白质分子的聚集[22].
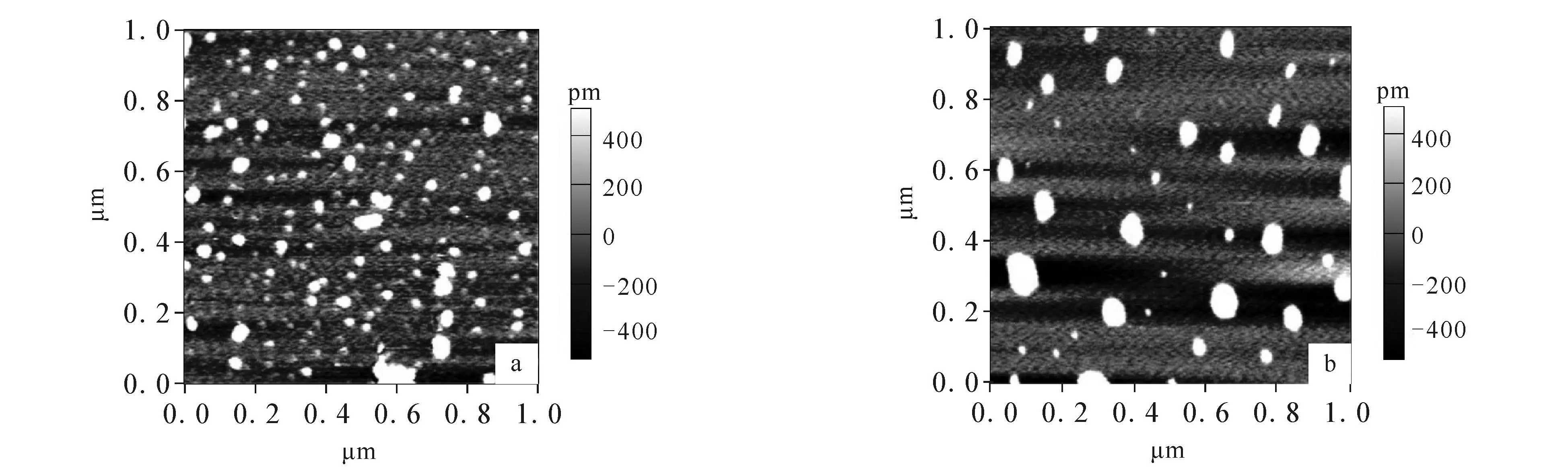
c trypsin=1.5×10 -9 mol/L,and the molar ratio of DBP to trypsin was 10∶1. 图6 胰蛋白酶(a)和DBP-胰蛋白酶复合物(b)的原子力显微镜图
2.5 DBP对胰蛋白酶活性的影响
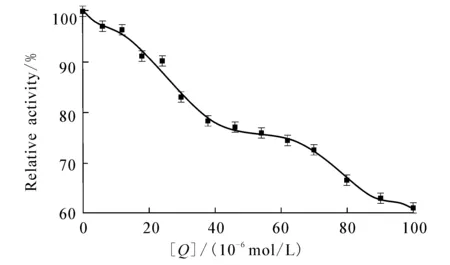
c trypsin=1.5×10 -6 mol/L;c BAEE=7.0×10 -4 mol/L. 图7 DBP对胰蛋白酶的抑制作用
图7显示DBP对胰蛋白酶相对活性的影响.DBP对胰蛋白酶活性的抑制呈现浓度依赖关系,即随着DBP浓度的逐渐增加,胰蛋白酶的活性呈现不断降低的趋势.当DBP的浓度为1.0 × 10-4mol/L时,胰蛋白酶活性降低为原水平的60.8%,表明DBP的结合会导致酶部分失活,影响其生理功能.
2.6 DBP-胰蛋白酶结合模式分子模拟
图8为DBP与胰蛋白酶进行100次独立的分子对接所得的能量分布簇状图(RMSD为0.2 nm).结果显示,具有最低结合能(-4.81 kcal/mol)的结合构象出现的数目最多(红色柱状表示),故选取具有最低结合能的结合姿态进行定位分析.图9显示DBP并未结合于由残基189~195,214~220和225~228组成的S1疏水空腔(primary substrate-binding pocket),而是结合于S1疏水空腔附近,即结合于催化三联体(His 57,Asp 102和Ser 195)周围[23],这可能导致胰蛋白酶的催化活性被抑制.DBP分子中的氧原子分别与氨基酸His 57,Ser 195 和 Gly 193的氢原子形成氢键(键长分别为0.218 7,0.175 1和0.214 6 nm),说明DBP与胰蛋白酶之间的结合存在氢键作用,这与热力学分析结果一致.
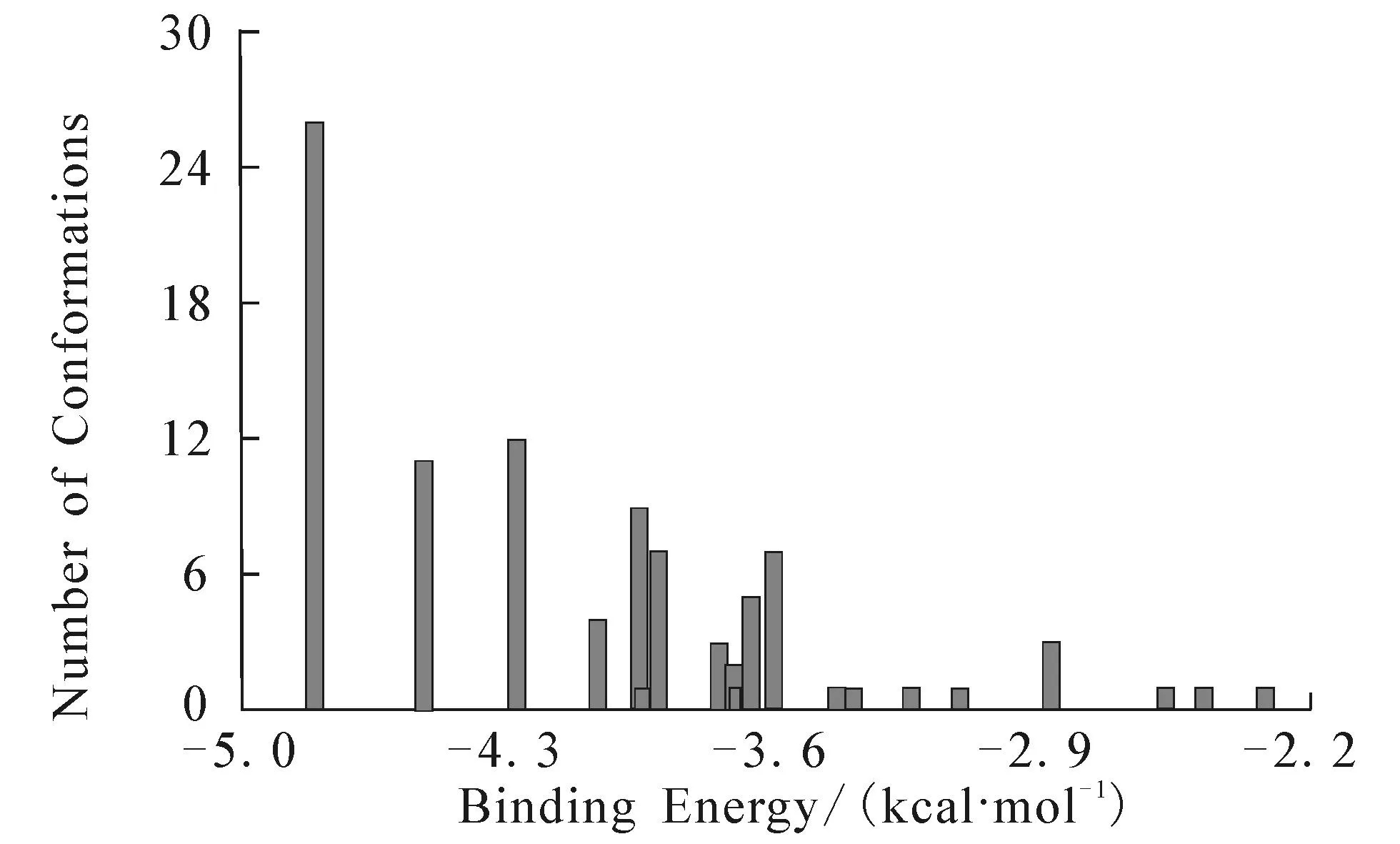
图8 分子模拟能量簇状图

图9 DBP与胰蛋白酶的结合模式
3结论
DBP能够与胰蛋白酶相互作用形成复合物并导致胰蛋白酶的荧光产生静态猝灭,DBP与胰蛋白酶只有1个结合位点,氢键和范德华力是DBP结合胰蛋白酶的主要作用力.DBP的存在使得胰蛋白酶表面形态发生改变,可能导致酶分子更多地暴露在疏水环境中,引起酶分子的聚集.DBP主要结合于胰蛋白酶S1疏水空腔附近,靠近催化三联体(His 57,Asp 102和Ser 195),与氨基酸His 57,Ser 195 和 Gly 193形成氢键,这种结合模式诱导胰蛋白酶的结构发生了变化,并导致酶活性降低.
参考文献:
[1]刘慧杰,舒为群.邻苯二甲酸二丁酯生殖发育毒性研究进展.环境与健康杂志,2004,21(2):122-124.
[2]张蕴晖,陈秉衡.邻苯二甲酸二丁酯研究进展.卫生研究,2003,32(4):407-409.
[3]解玮,蒋颂辉,屈卫东,等.DEHP,DBP 内分泌干扰活性的实验研究.中国环境科学,2004,24(1):45-48.
[4]朱才众,熊鸿燕,李亚斐,等.增塑剂邻苯二甲酸二丁酯低剂量与神经系统毒性效应的评估.中国临床康复,2006,10(8):76-78.
[5]BARBER E D,ASTILL B D,MORAN E J,et al.Peroxisome Induction Studies on Seven Phthalate Esters.Toxicology and Industrial Health,1987,3(2):7-24.
[6]CHAI Jun,XU Qifei,DAI Jinping,et al.Investigation on Potential Enzyme Toxicity of Clenbuterol to Trypsin .Spectrochimica Acta Part A,2013,105:200-206.
[7]WANG Yaping,ZHANG Guowen,WANG Langhong.Interaction of Prometryn to Human Serum Albumin:Insights from Spectroscopic and Molecular Docking Studies.Pesticide Biochemistry and Physiology,2014,108:66-73.
[8]MU Yue,LIN Jing,LIU Rutao,Interaction of Sodium Benzoate with Trypsin by Spectroscopic Techniques.Spectrochimica Acta Part A,2011,83:130-135.
[9]YAN Jiakai,ZHANG Guowen,HU Yuting,et al.Effect of Luteolin on Xanthine Oxidase:Inhibition Kinetics and Interaction Mechanism Merging with Docking Simulation .Food Chemistry,2013,141:3 766-3 773.
[10] CHI Zhenxing,LIU Rutao,YANG Hongxu,et al.Binding of Tetracycline and Chlortetracycline to the Enzyme Trypsin:Spectroscopic and Molecular Modeling Investigations.PLOS One,2011,6(12):e28361.
[11] WU Xuli,HE Weiyi,WANG Wenpu,et al.Investigation of the Interaction Between (-)-Epigallocatechin-3-Gallate with Trypsin and α-Chymotrypsin .International Journal of Food Science & Technology,2013,48(11):2 340-2 347.
[12] LAKOWICZ J R.Principles of Fluorescence Spectroscopy.3rd ed.New York:Springer,2006.
[13] LAKOWICZ J R,WEBER G.Quenching of Fluorescence by Oxygen.Probe for Structural Fluctuations in Macromolecules.Biochemistry,1973,12:4 161-4 170.
[14] 范志飞,曾维才,戴吉领,等.表没食子儿茶素没食子酸酯与猪胰脂肪酶的相互作用.食品科学,2013,34(7):20-23.
[15] WANG Ruiyong,KANG Xiaohui,WANG Ruiqiang,et al.Comparative Study of the Binding of Trypsin to Caffeine and Theophylline by Spectrofluorimetry.Journal of Luminescence,2013,138:258-266.
[16] FEROZ S R,MOHAMAD S B,BAKRI Z S D,et al.Probing the Interaction of a Therapeutic Flavonoid,Pinostrobin with Human Serum Albumin:Multiple Spectroscopic and Molecular Modeling Investigations.PLOS One,2013,8(10):e76067.
[17] ZHANG Hongmei,WANG Yanqing,ZHOU Qiuhua.Fluorimetric Study of Interaction of Benzidine with Trypsin.Journal of Luminescence,2010,130(5):781-786.
[18] 柳全文,徐慧,李桂华,等.咖啡酸与牛血清白蛋白相互作用的荧光光谱法研究.食品科学,2010(1):24-28.
[19] ROSS P D,SUBRAMANIAN S.Thermodynamics of Protein Association Reactions:Forces Contributing to Stability.Biochemistry,1981,20:3 096-3 102.
[20] SHUAI Li,CHEN Zhi,FEI Peng,et al.Spectroscopic Analysis on the Interaction of Ferulic Acid and Tetramethylpyrazine with Trypsin.Luminescence,2014,29(1):79-86.
[21] HU Xinxin,YU Zehua,LIU Rutao.Spectroscopic Investigations on the Interactions Between Isopropanol and Trypsin at Molecular Level.Spectrochimica Acta Part A,2013,108:50-54.
[22] ZHANG Guowen,WANG Lin,PAN Junhui.Probing the Binding of the Flavonoid Diosmetin to Human Serum Albumin by Multispectroscopic Techniques.Journal of Agricultural and Food Chemistry,2012,60(10):2 721-2 729.
[23] ZHANG Hongmei,ZHOU Qiuhua,CAO Jian,et al.Mechanism of Cinnamic Acid-Induced Trypsin Inhibition:A Multi-Technique Approach.Spectrochimica Acta Part A,2013,116:251-257.
Interaction of Dibutyl Phosphate with Trypsin
ZHANG Guowen,WANG Yaping
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,Jiangxi China)
Abstract:The effects of plasticizer dibutyl phosphate (DBP) on the spectral properties,structure and catalytic activity of trypsin were investigated using fluorescence,UV-vis absorption and circular dichroism (CD) spectroscopy along with atomic force microscopy (AFM) and molecular simulation under simulative physiological conditions (pH 7.4).The result of fluorescence quenching indicated that a ground state complex was formed between DBP and trypsin through hydrogen bonds and Van Der Waals forces,resulting in the intrinsic fluorescence quenching of trypsin.There was a single class of binding sites on trypsin for DBP.Analysis of synchronous fluorescence,UV-vis absorption and CD spectra demonstrated that the addition of DBP led to the conformational alteration of trypsin,decreases in the α-helix,β-sheet and β-turn contents and an increase in the random coil content.The AFM topography image showed that the binding of DBP with trypsin caused the surface morphology change of trypsin and the protein aggregation.The molecular modeling results exhibited that the binding site of DBP on trypsin was adjacent to the S1 binding pocket,and three hydrogen bonds formed between the amino acid residues His 57,Ser 195 and Gly 193 of trypsin and the oxygen atom of DBP.The enzymatic activity assay indicated that the binding interaction led to the inhibition of the trypsin activity.
Key words:dibutyl phosphate;trypsin;binding characteristic;molecular modeling
(责任编辑向阳洁)


