LeftyA基因重组慢病毒表达载体的构建及鉴定
2016-01-07邱宇安,陈文学,靳文剑等
·基础研究·
LeftyA基因重组慢病毒表达载体的构建及鉴定
邱宇安陈文学靳文剑陈火国钟宁余洁丽
作者单位:330029 江西省肿瘤医院
【摘要】目的想构建LeftyA基因的慢病毒表达载体,鉴定其在293T细胞中的表达。方法首先扩增LeftyA基因序列,将其与慢病毒骨架载体连接后,鉴定慢病毒表达载体构建成功。将重组慢病毒表达载体质粒及包装质粒共转染293T细胞,鉴定慢病毒转染并包装成功。结果LeftyA基因成功转导至以GV287为骨架质粒的慢病毒系统中,包装后测定病毒滴度达2.0×108 TU/ml,免疫印记法检测到LeftyA蛋白在293T细胞中的表达。结论成功构建了携带人LeftyA基因的慢病毒表达系统。
【关键词】LeftyA;慢病毒载体
基金项目:江西省青年科学基金资助项目(编号:20132BAB215018)
DOI:10.3969/j.issn.1001-5930.2015.12.001
中图分类号:R73-36文献标识码:A
收稿日期(2015-10-12修回日期 2015-10-21)
Construction and Indentification of LeftyA Recombinant Lentiviral Expression Vector
QIUYu'an,CHENWenxue,JINWenjian,etal.JiangxiCancerHospital,Nanchang,330029
Abstract【】ObjectiveTo construct LeftyA gene lentiviral vector system and determine its expression in 293Tcells.MethodsFull-length sequence of LeftyA was amplified by PCR,and was connected with lentiviral vector.Gene sequencing was used to identify that recombinant lentiviral vector was constructed successfully.The plasmids were transfected into 293Tcells.Indentification by fluorescent microscopy confirmed lentiviral transfection and packaging successfully.ResultsLeftyA were subcloned into GV287 as skeleton plasmid for a lentivirus packing system.The virus titer was 2.0×108 TU/ml in the supernatant liquid.The proteins of LeftyA were detected by western blot.ConclusionThe LeftyA gene recombinant lentiviral expression system is constructed successfully.
【Key words】LeftyA;Lentiviral vector
(ThePracticalJournalofCancer,2015,30:1755~1757)
我国是胃癌高发区,其发病率及死亡率均明显高于世界平均水平[1]。本课题前期研究提示体外培养的胃癌细胞株LeftyA基因表达丰度低,LeftyA基因可能对胃癌的发生和发展起着抑制作用。因此,有必要进一步研究LeftyA基因对胃癌细胞功能的影响。我们构建了LeftyA基因重组慢病毒载体,为进一步的功能学研究打下基础。
1材料与方法
1.1 主要试剂
限制性内切酶(NEB公司),In-FusionTMPCRCloningKit(clontech公司),Taq polymerase (SinoBio公司),dNTP(Takara 公司),Plasmid抽提Kit(Promega 公司),DMEM(GIBCO公司),Lipofectamine2000(Invitrogen公司)。
1.2 主要仪器
PCR仪(Applied Biosysems公司),稳压DNA电泳仪(BioRad公司),凝胶成像仪(天能公司),细菌摇床(华利达实验设备公司),高速离心机(日立公司),荧光显微镜(奥林巴斯),Plus-20离心超滤装置(Millipore公司)。
1.3 质粒及细胞株
慢病毒系统包括骨架质粒GV287(pUbi-MCS-3FLAG-SV40-EGFP AgeI /AgeI 酶切),包装质粒pHelper1.0、pHelper2.0和包装细胞293T均由上海吉凯基因化学技术有限公司提供。
1.4 引物设计
使用Primer5软件设计引物,LeftA引物:上游(P1)5'-GAGGATCCCCGGGTACCGGTCGCCACCATGTGGCCCCTGTGGCTCTG-3',下游(P2)5'-TCCTTGTAGTCCATACCTGGCTGGAGCCTCCTTGGCAC-3'。引物含交换配对碱基、酶切位点,并含有目的基因5'端部分序列用于PCR钓取目的基因。PCR产物大小:1142 bp。
1.5 LeftyA慢病毒表达载体的构建
1.5.1PCR扩增目的基因(LeftyA)片段反应条件:94 ℃预变性5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min共30个循环,72 ℃ 10 min。PCR结果见图1。
1.5.2载体酶切GV287载体原件顺序Ubi-MCS-3FLAG-SV40-EGFP,大小10.4 kb,酶切反应温度37 ℃,酶切反应时间2 h。酶切结果见图2。
1.5.3重组质粒构建PCR产物交换入线性化载体,用氯化钙制备新鲜的大肠杆菌感受态细胞,将交换后的连接产物转化大肠杆菌,将已转化的感受态细胞转移到AMP抗性(100 μg/ml)的LB琼脂培养基上。于37 ℃培养16 h。长出的克隆进行后续PCR鉴定。
1.6 LeftyA慢病毒表达载体的鉴定
引物 (P3)5'-CTGCTGCTACAGGTGTCGGT-3', (FLAG-R-2)5'-CCTTATAGTCCTTATCATCGTC-3'一个位于目的基因中,一个位于载体上,用于菌落PCR鉴定转化子。阳性转化子PCR产物大小:574 bp。阳性克隆测序,结果进行同源比对分析。鉴定结果见图3。
转染293T细胞:将3种质粒载体(重组病毒质粒及两种辅助包装原件载体质粒)分别进行高纯度无内毒素抽提,按Lipofectamine 2000试剂盒使用说明进行操作,共转染293T细胞,荧光显微镜下观察细胞内荧光标记基因(GFP)的表达情况,Westernblot检测目的基因的表达。测定病毒滴度。鉴定结果见图4、5。
2结果
2.1 PCR扩增目的基因结果(图1)

图1 PCR扩增目的基因(LeftyA)片段
2.2 载体酶切结果(图2)

1为10kb Marker;2为载体酶切产物,3为未酶切载体。
2.3 阳性转化子电泳结果(图3)

1为阴性对照(ddH2O);2为阴性对照(空载自连对照组);3为阳性对照(GAPDH);4为Marker;5~12为LEFTY 1~8号转化子。
2.4 重组质粒测序结果
将阳性克隆作为模板扩增出目的基因进行测序,将测序结果与目标基因序列进行同源性分析对比。结果显示重组质粒构建成功,同源性100%。
2.5 重组质粒转染293T细胞结果(图4、5)
取培养生长状态良好的293T细胞,质粒转染前一天将细胞分入24-well培养板培养,转染24 h后荧光显微镜下观察细胞内荧光标记基因(GFP)的表达情况,可见细胞内有荧光蛋白表达,提示质粒转染293T细胞成功。转染36 h后收集细胞进行Westernblot检测。可以观察到43 kD附近处有特征条带,其大小和目的基因融合蛋白相吻合。
2.6 病毒滴度测定结果
转染293T细胞后8 h更换为完全培养基,培养48 h后,收集富含慢病毒颗粒的细胞上清液,对其浓缩后得到高滴度的慢病毒浓缩液,在293T细胞中采用ELISA法+荧光法测定并标定病毒滴度,计算出包装的病毒滴度约为2×108TU/ml。
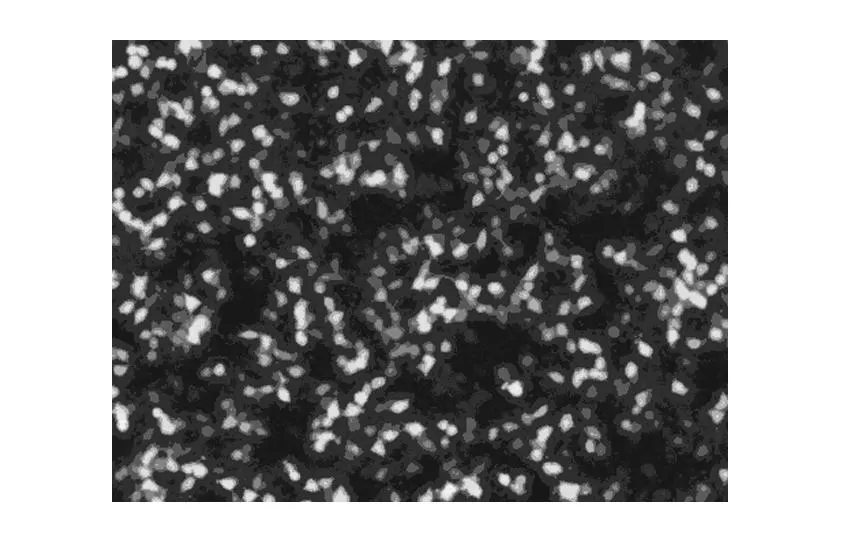
图4 质粒转染293T细胞(×100)

1为阳性对照(标准品SURVIVIN-3FLAG-GFP 分子大小
3讨论
慢病毒载体是以人类免疫缺陷型病毒为基础发展起来的基因治疗载体,它对分裂细胞和非分裂细胞均具有感染能力,并可以较长期稳定的表达目的基因,便于基因功能的研究。
Lefty蛋白是TGFβ大家族的配体,通过与Nodal以及Nodal的受体结合而抑制Nodal信号转导[2]。Nodal是早期胚胎干细胞诱导的关键信号分子,参与中胚层和内胚层形成、前后体轴的位置确定和左-右体轴特化等关键事件[3]。Nodal还可以抑制人类胚胎干细胞的分化,维持人类胚胎干细胞多潜能干性[4]。
有报道指出,Nodal在多种恶性肿瘤(恶性黑色素瘤、乳腺癌、脑胶质瘤等)中能高水平表达,且表达水平与肿瘤浸润和转移等密切相关[5-7]。有关恶性黑色素瘤及乳腺癌的研究提示[8]:在转移性肿瘤细胞中出现Nodal信号通路的抑制因子Lefty缺失,从而导致Nodal的过度表达;胚胎干细胞微环境(含Lefty)将明显下调Nodal的表达,并抑制肿瘤的发生发展,促进肿瘤细胞凋亡。因此Nodal信号通路在胚胎发育和肿瘤转移中的差异可能是:胚胎组织可以通过分泌Lefty等蛋白分子对发育过程进行调控,而肿瘤中出现Lefty等缺失。这提示肿瘤浸润和转移的发生与肿瘤组织缺乏类似胚胎发育时精细有效的调控机制密切相关。基于上述分析及前期研究结果,我们提出假设:胃癌细胞中Lefty等Nodal信号通路的抑制因子缺失,是导致Nodal信号失控的重要原因。
故我们成功进行了LeftyA基因重组慢病毒的构建与包装,为下一步的功能学实验打下基础。
参考文献
[1]Forman D,Burley VJ.Gastric cancer:global pattern of the disease and an overview of environmental risk factors〔J〕.Best Pract Res Clin Gastroenterol,2006,20(4):633-649.
[2]Cheng SK,Olale F,Brivanlou AH,et al.Lefty blocks a subset of TGFbeta signals by antagonizing EGF-CFC coreceptors〔J〕.PLoS Biol,2004,2(2):E30.
[3]Shen MM.Nodal signaling:developmental roles and regulation〔J〕.Development,2007,134(6):1023-1034.
[4]James D,Levine AJ,Besser D,et al.TGFbeta/activin/nodal signaling is necessary for the maintenance of pluripotency in human embryonic stem cells〔J〕.Development,2005,132(6):1273-1282.
[5]Topczewska JM,Pestovit LM,Margaxyan NV,et al.Embryonic and tumorigenic pathways converge via Nodal signaling:Role in melanoma aggressiveness〔J〕.Nat Med,2006,12(8):925-932.
[6]Strizzi L,Postovit LM,Margaryan NV,et al.Emerging roles of nodal and cripto-I:from embryogenesis to breast cancer progression〔J〕.Breast Disease,2008,29:91-103.
[7]Lee CC,Jan HJ,Lai JH,et al.Nodal promotes growth and invasion in human gliomas〔J〕.Oncogene,2010,29(21):3110-3123.
[8]Pestovit LM,Margaryan NV,Seftor EA,et al.Human embryonic stem cell microenvironment suppresses the tumorigenic phenotype of aggressive cancer cells〔J〕.Proc Natl Acad Sci,2008,105(11):4329-4334.
(编辑:吴小红)
