晚期卵巢癌三维适形和调强放疗研究现状与展望*
2016-01-07党亚正黄世高
党亚正 黄世高
(中国人民解放军第323医院肿瘤中心, 陕西 西安710054)
晚期卵巢癌三维适形和调强放疗研究现状与展望*
党亚正黄世高
(中国人民解放军第323医院肿瘤中心, 陕西 西安710054)
【摘要】卵巢癌是妇科肿瘤中死亡率最高的恶性肿瘤,70%以上的卵巢癌患者发现时已属晚期。目前卵巢癌的标准治疗方案是以手术为主,辅以术后化疗、放疗和生物治疗的综合方案,但晚期卵巢癌患者大多不适合手术,并且老年患者不能完成化疗。近年随着三维适形放疗(3-dimentional conformal radiationtherapy,3D-CRT)、调强放疗(intensity modulated radiation therapy,IMRT)、图像引导放疗(image guided radiation therapy,IGRT)和PET-CT引导调强放疗(biological intensity modulated radiation therapy,BIMRT)等技术的出现,使晚期卵巢癌的治疗效果有了新的提高。本文就晚期卵巢癌三维适形及调强放疗的研究现状和展望做一述评。
【关键词】卵巢癌; PET-CT; 三维适形及调强放疗
执行编委简介:党亚正,现任解放军第323医院综合内科主任,主任医师,兼任全军放疗学会委员,全国伽玛刀协会会员,兰州军区肿瘤放疗专业委员会副主委、陕西省抗癌协会放疗委员会副主委、中国生物医学工程肿瘤靶向协会陕西分会副主委,食道癌综合治疗专业委员会陕西分会常委、肿瘤热疗专业委员会常委,陕西省医疗事故鉴定专家;《西部医学》编委。主要从事肿瘤的化疗、热疗、介入治疗、物理消融和化学消融等工作,是从事肿瘤立体定向放射外科治疗较早的专业人员。从医20多年,曾先后在美国、瑞士等国家的多家医院访问学习。在肿瘤的诊断、颅脑及全身肿瘤的普通放疗、三维适形及调强放疗、伽玛刀立体定向放射外科诊疗方面有着丰富的临床经验。荣获全军医疗成果三等奖2项,主持省级科研项目多项。在国际及国家、省级学术杂志上发表专业论文40余篇。
卵巢癌是女性生殖系统常见的三大恶性肿瘤之一,70%以上的卵巢癌患者发现时已属晚期(Ⅲ~Ⅳ期)[1]。卵巢恶性肿瘤是死亡率最高的妇科恶性肿瘤,已成为严重威胁妇女生命和健康的主要肿瘤。以手术为主,辅以术后化疗的联合治疗是卵巢癌的治疗原则。术后残余肿瘤灶的大小受肿瘤灶大小、位置和医生个人手术经验影响较大,仅42%左右的患者能接受满意肿瘤细胞减灭术治疗[2],大部分无法接受满意肿瘤细胞减灭术的患者预后较差。因此,针对肿瘤无法切除或者一般情况较差的患者,需要一种新的治疗模式来改善预后。与手术相比,放疗疗效有限且并发症多,因此长期以来进展较小。近年随着三维适形放疗(3-dimentional conformal radiationtherapy,3D-CRT)、调强放疗(intensity modulated radiation therapy,IMRT)、图像引导的放疗(image guided radiation therapy,IGRT)和PET-CT引导的调强放疗(biological intensity modulated radiation therapy,BIMRT)等技术的出现,使放疗在卵巢癌治疗中的疗效有很大提高。特别是PET-CT在肿瘤的大小、范围、邻近正常组织准确地显示上有很大的优势,利用PET-CT技术引导进行调强放射治疗(BIMRT),通过调节入射束流形状的同时对束流强度进行调节,克服常规放疗的缺点,使得放射治疗更精准,疗效明显提高,副反应大幅减轻,患者生存时间、预后有较大提高。近些年,晚期卵巢癌的放射治疗有了新的研究成果,现将晚期卵巢癌放疗的研究现状和进展做一述评。
1卵巢癌概述
据报道,2008年世界女性肿瘤卵巢癌发病率排在第7位,死亡率排在第4位,在妇科肿瘤中死亡率排在第1位,发病率呈逐年增加趋势[3]。2009年,美国有21550例新诊断病例以及大约14600例死亡病例,能获得治愈的上皮性卵巢癌患者不到40%[3]。卵巢癌的发病率随着年龄增大而上升,在80~89岁达到发病高峰,发病率达57/10万。诊断时的中位年龄为63岁,其中大约70%的患者初诊时已是晚期[4]。卵巢肿瘤来源种类很多,体腔上皮来源的肿瘤占50%~70%,性索间质肿瘤占5%,生殖细胞肿瘤占20%~30%,转移性肿瘤占5%~10%,其它还有脂质细胞瘤、性腺母细胞瘤、非卵巢特异性软组织肿瘤、未分类肿瘤及瘤样病变。其中最常见的是卵巢上皮癌(epithelial ovarian cancer,EOC),75%的组织类型是浆液性,卵巢癌患者早期因无明显特异性症状,2/3的患者诊断时已是晚期,经过手术及铂类化疗后,25%~75%的患者还会复发[5,6]。原发性卵巢恶性肿瘤分4期:Ⅰ期,肿瘤局限于卵巢;Ⅱ期,一侧或双侧卵巢肿瘤,伴盆腔内扩散;Ⅲ期,一侧或双侧卵巢肿瘤,盆腔外有腹膜 转移和/或区域淋巴结转移;Ⅳ期,远处转移(胸水有癌细胞,肝实质转移)。一般称晚期卵巢癌为Ⅱ~Ⅳ期。鉴别肿瘤标志物有甲胎蛋白(alpha-fetoprotein,AFP)、CA125(carcinomicantigen 125)、癌胚抗原(carcinoembryonicantigen,CEA)、人绒毛膜促性腺激素(humanchorionicgonadotropin,hCG)和人附睾蛋白4(Human epididymis protein 4,HE4),而HE4标记物因特异性、准确性高,已成为肿瘤早期诊断的推荐应用指标[7]。
近些年,卵巢恶性肿瘤的诊断与治疗一直是妇科肿瘤领域研究的重点内容,卵巢癌传统治疗方式包括手术治疗、分期手术、肿瘤细胞减灭术和间歇性肿瘤细胞减灭术、再分期手术、再次肿瘤细胞减灭术和化疗。现阶段肿瘤细胞减灭术联合化疗治疗FIGO(The International Federation of Gynecology and Obstetrics)分期为Ⅲc的卵巢癌患者5年生存率是20%~25%[8,9]。S.Kommoss等[10]对267例进展期卵巢癌ⅢB~Ⅳ期患者,在接受手术后,总生存期(overal survival,OS)有显著提高[HR=3.61(1.91~6.61),P<0.001]。接受扩展性手术和标准手术的病人无显著性差异[HR=1.37(0.70~2.69),P=0.358],提示扩展性手术还是鼓励应用的。Pauline Wimberger等[11]在多中心前瞻性临床三期实验中对573例FIGO分期为Ⅳ期的卵巢癌病人,首先进行手术治疗,然后联合化疗治疗,患者中位无进展生存期(Progression Free Survival,PFS)、OS分别是12.6和26.1个月。多因素COX回归分析显示,残留肿瘤、黏液性蛋白组织类型、多发转移是显著性预后因子,当患者接受了肉眼可见的肿瘤切除后,提高了临床治疗效果。在不考虑远处转移的Ⅳ期卵巢癌病人中,切除可见病灶是一个重要的预后因素,细胞减灭术是唯一提高治疗效果的合理优势,并在完成减瘤术中,肿瘤组织病理也是一个重要的预后因子。
近来以铂类为主的联合化疗是早期卵巢癌首选的辅助治疗方案。晚期卵巢癌化疗NCCN(Version 1,2015)指南[12]推荐的一线化疗方案是(紫杉醇)泰素/卡铂联合治疗。然而大多数晚期卵巢癌容易复发,临床上对复发性卵巢癌的处理有靶向治疗、化疗、放疗和激素治疗等。在制定二线化疗方案时,对铂类药物敏感和抵抗的复发卵巢癌分开考虑。对于复发性卵巢癌铂类药物敏感的治疗,可用贝伐珠单抗和奥拉帕尼靶向药物联合铂类药物治疗;对卵巢癌铂类药物抵抗的可用美新(topotecan)、紫杉醇、多西紫杉醇及吉西他宾(Gemeiabine)等联合靶向药物治疗。而其他二线化疗的可用促进治疗方案,包括芳香化酶抑制剂、醋酸亮丙瑞林等激素药物。
传统卵巢癌的放疗仅适用于残余灶直径<2cm、无腹水、无肝肾转移者。治疗途径有体外照射和腹腔内放疗。晚期卵巢癌的放射治疗在NCCN指南[12]中很少推荐使用,但在复发性卵巢癌中可作为局部改善症状的治疗方式选择。2013年,Teckie S等[13]评估了60例EOC脑转移患者在接受放疗后,中位随访18.5个月,47例患者中枢神经系统疾病无进展。近年放射治疗卵巢癌的研究很多,治疗效果也较好。放射治疗未作为NCCN指南推荐治疗选择,主要是国际许多知名肿瘤中心很少使用放疗技术作为晚期卵巢癌首选治疗方案,认为放疗副反应复杂(如放疗后易造成阴道狭窄,影响性功能等),临床试验不够成熟。
未来卵巢癌治疗的发展方向是综合治疗,免疫治疗作为综合治疗的一个重要组成部分,近年得到医学界的广泛关注。北京大学人民医院妇科肿瘤中心制备的鼠单克隆抗独特型抗体6B11(Ab2)可模拟抗原OC166-9,能与COC166-9(Ab1)单抗结合,并抑制OC166-9与COC166-9(Ab1)的结合;在动物模型中应用抗独特型抗体6B11可以诱导出抗-抗独特型抗体(Ab3)和细胞免疫,因此该抗体有可能作为抗独特型抗体疫苗用于卵巢癌的治疗[14]。还有最近应用较多的体内注射免疫细胞(CIK、DC等)进行生物治疗,提高免疫系统以及免疫治疗和放疗、化疗联合治疗卵巢癌的研究都取得了很大的进展。
2卵巢癌适形放射治疗的历史和现状
1959年,日本的Takahashi提出了“适形”放射治疗原理,首创多叶准直器。1974年,美国的Larsson 等人提出了用医用电子直线加速器代替60Co做立体定向放射治疗的建议,开创了以医用电子直线加速器为放射源的精确放射治疗新起点。1977年,美国的Bjangard和Kijewski等提出了“调强适形”放射治疗原理。1984年,出现了以医用电子直线加速器为辐射源,采用非共面弧形旋转放射治疗的头部专用立体定向放射治疗装置,可以达到毫米级甚至更高的立体定向定位精度。2003年之后,美国瓦立安公司(Varian)、瑞典医科达公司(Elekta)和德国西门子公司(Si-emens)等先后开发并推出了以医用电子直线加速器为核心的“调强适形”放疗设备(IMRT)和“影像引导”放射治疗设备(IGRT),标志着放疗设备已经进入了一个以“调强适形”和“影像引导”为核心技术内容的精确放射治疗新阶段。三维适形调强放疗是由3D-CRT和IMRT两部分组成,在适形的前提下利用精确的固定和定位技术,根据需要调节靶区内不同区域的照射量,使其在形态和剂量学分布上双重适形,更均匀,对正常组织的保护更好。图1展示了适形调强放射治疗剂量分布使靶区更适形,对危险器官的保护更有效。这一重大改变,经初步临床验证,能明显降低正常组织的放射损伤,提高了肿瘤的局控率和生存率,是今后肿瘤放疗的发展主流。近年随着PET/CT影像在肿瘤诊断中的应用,将其用于引导调强放疗而形成了生物适形调强放疗技术。至此,放射治疗进入生物适形调强放疗时代。
适形放疗在卵巢癌的治疗中已经有很多临床结果,1950年以后二维放疗到来,外科手术结合全腹部放射治疗(whole abdominal irradiation, WAI)用于卵巢癌曾成为主要的治疗模式,但因治疗的副作用(肝、肾、小肠、骨髓等)较大而逐渐放弃[15]。随后几十年放疗的研究进展不大,直到放疗进入三维适形时代。1999年,因一个回顾性的手术结合化疗、手术结合化疗放疗的研究,结果显示放疗组的生存率明显提高,提示放射治疗的作用需要在前瞻性随机实验研究中重新评估[16]。2003年,一项172例术前诱导化疗,手术完全病理切除的FIGOⅢ期卵巢癌,进行随机全腹放疗和化疗的临床实验,结果显示5年生存率放疗、化疗分别为56%和36%,放疗明显优于化疗,验证了放射治疗的有效性。随着放疗技术的快速发展,更精确的三维适形调强技术(IMRT)的推广应用,尤其是对危险器官(Organ At Risk OARs)如肝、肾、骨髓等的保护,明显地降低了放疗的毒副作用[17]。
2007年,高危期FIGOⅢ卵巢癌辅助全腹IMRT临床Ⅰ/Ⅱ研究晚期卵巢癌手术及泰素铂类化疗后全腹IMRTⅠ期临床研究[18],同样验证了全腹IMRT治疗的有效性。并认为全腹IMRT治疗是卵巢癌治疗选择中一种可行的治疗方法。2010年又提出了三维适形放疗(3DCRT)或调强放射(IMRT)治疗,这是一种全新的治疗手段,用三维影像方法界定照射的靶区体积,增加肿瘤剂量而减小正常组织剂量,具有提高肿瘤局部控制率及减少肿瘤周围正常组织损伤的特点[19]。2012年,Brown等[20]回顾分析了102例局部复发的EOC患者经过涉野照射(IFRT)后,剂量≥45 Gy,5年的涉及野疾病控制率达到75%,5年总生存期及无疾病进展期分别为40%和20%,患者都经过中位次数为3次的化学治疗,表明IFRT可以局部控制卵巢癌患者,延长无疾病进展期,对局部复发卵巢癌患者的治疗是一个有效的工具。
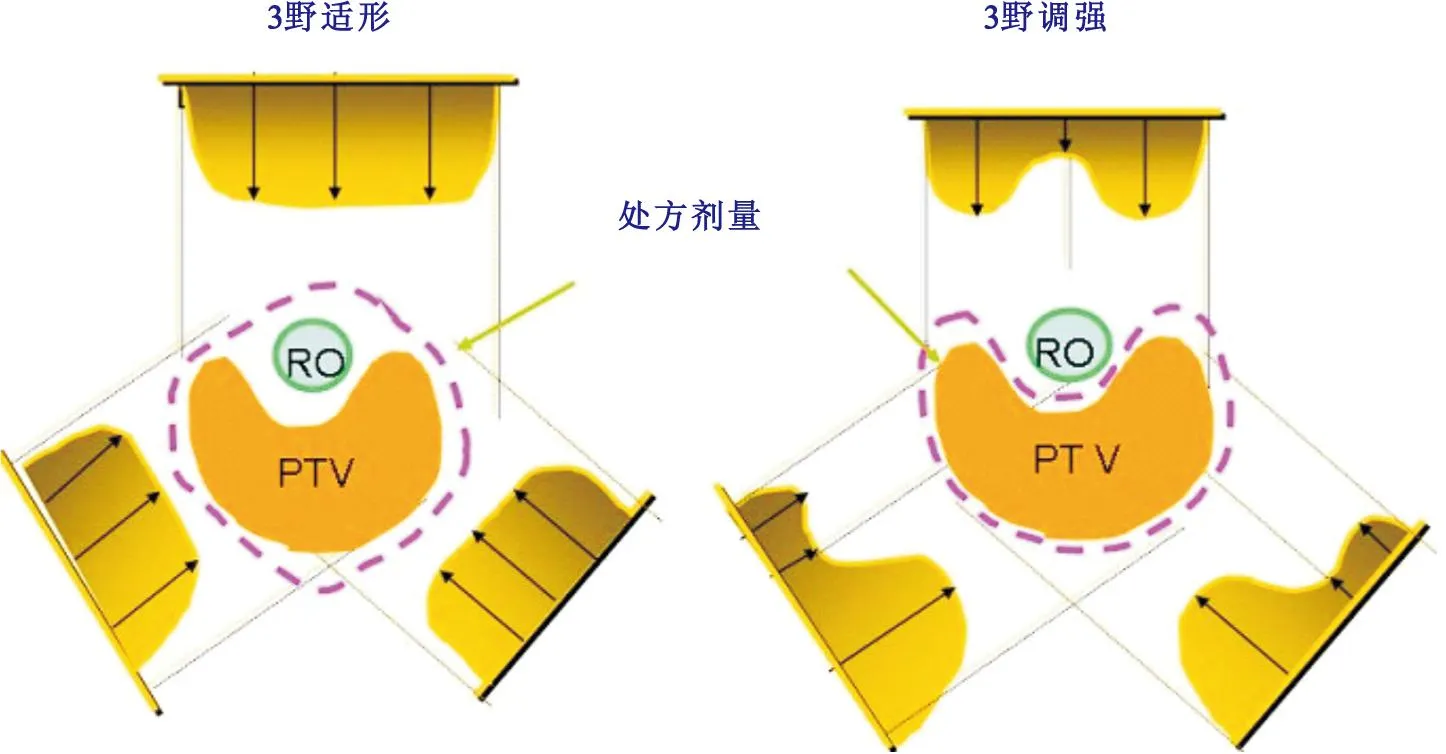
图1调强剂量分布可以与靶区更适形,更能保护危及器官(RO:危险器官;PTV:肿瘤计划靶区)
Figure 1Dose distribution of intensity modulated target area
3PET-CT在晚期卵巢癌临床应用中的价值
PET-CT是继传统CT影像融合PET显像的检查设备,它可从代谢水平直观地评估全身状况,对肿瘤的生理、代谢、增殖、耐药机制进行评价,使其在肿瘤的临床诊断、良恶性鉴别诊断、临床分期、恶性程度判断、疗效评价、转移灶寻找与复发监测等方面提供可靠信息。
3.1PET-CT对卵巢肿瘤的再诊断PET对卵巢癌的诊断是基于示踪原理,利用肿瘤组织的一些特有的生物学或生理学及生物化学代谢特点,采用正电子核素标记葡萄糖、氨基酸、核苷酸、配体拮抗剂或抗体等为示踪剂,引入机体后在病灶内聚集,经PET显像显示肿瘤的位置、形态、大小、数量及放射性分布。2009年,Fulham MJ等[21]对曾经患有EOC且怀疑卵巢癌复发的90例女性患者做了一个前瞻性、多中心的队列研究,验证用PET-CT将这些患者检查出更多的疾病,预测患者在接下来一年中疾病更容易进展。因此,PET-CT比腹部和盆腔CT能检测更多疾病病灶,且对淋巴结、腹膜、肝脏被膜下的疾病检测更优越。
3.2卵巢癌的定位和放疗计划制定及疾病评估PET-CT引导下能精确地开展适形调强放射治疗,FDG-PET/CT在卵巢癌高肿瘤标记物表达或在增强CT怀疑复发和确诊腹腔内转移的作用很明显。2012年,Du XL等[22]比较了PET-CT引导IMRT组和CT引导IMRT组的1、2和3年无疾病生存期,PET-CT/IMRT组显著优于CT/IMRT组。研究表明,PET/CT引导下对复发性卵巢癌患者行调强放疗可提升对可见肿瘤区域的勾画,同时减少可能漏掉的区域,从而达到更好的临床效果。2010年,Caroli P等[23]综述了分子影像(positron emission tomography,PET)中,给癌症患者和放疗计划的管理带来另外一种视角,PET/CT的融合提供了肿瘤体积的划定和患者治疗计划的准备。在妇科肿瘤中对疾病的评估、靶区的勾画等都可以提供指导。
3.3原发灶、转移灶寻找与复发监测18F-FDG PET预测卵巢癌的敏感性为58%~93%,特异性60%~90%。Delgado-Bolton RC等[24]Mate分析了未知肿瘤的原发灶检测,18F-FDG PET的表现良好,对寻找转移瘤原发灶有较高的灵敏度和特异性,一般PET或PET/CT检查未发现原发灶的迹象,大多数病例在随访中也难确诊。
4卵巢癌BIMRT的研究及进展
近年随着三维适形放疗和调强放疗技术的发展以及同步放化疗的研究增多,卵巢癌的放疗有了新的进展,其中主要是EOC,且对放疗中度敏感。尽管化疗对晚期EOC有较好疗效,尤其以紫杉醇和顺铂为主的化疗近期疗效显著,但未明显提高生存期[25]。放疗和化疗相结合可起到协同抗癌的作用。研究表明,对晚期卵巢癌患者特别是老年患者不适宜手术及化疗的行同步放化疗显示出较好的近期疗效。目前关于BIMRT技术产生的新治,疗方法研究不多,但是已有文献证实,BIMRT能改善肿瘤患者生活质量,具有很好的耐受性。Dang等[25]报道了1例68岁女性卵巢癌腹腔转移患者接受放化疗同步治疗后,肿瘤消失,CA-125、CA19-9、CEA肿瘤标记物下降到正常水平,患者症状、体征得到明显改善,生存期延长。图2表明了治疗前后PET/CT显示肿瘤大小、范围及消失情况,充分展示了PET/CT结合放疗在肿瘤寻找、边缘划定、治疗效果评估中的优势。Rochet等[26]在临床一期实验中验证了IMRT全腹放疗联合手术、化疗治疗进展期卵巢癌患者的可行性和有效性,显示了IMRT治疗进展期的EOC是一种新的选择治疗方法。进展期EOC有很高的复发率,过去几年里巩固疗法包括全腹照射(WAR)取得了有限的成功。Shetty UM等[27]报道了一种可行性的研究,利用螺旋断层放疗做的全腹照射8例病人整个腹部(PTV)照射剂量为25Gy/25次,单次剂量1Gy,同时在盆腔PTV照射剂量为45Gy/25次,单次剂量1.8Gy,中位随访时间15个月,5例病人疾病痊愈,3例病人腹部复发。此结果验证了用IMRT做全腹照射治疗可以作为巩固疗法在FIGO-Ⅲ期的上皮性复发卵巢癌患者是可以持续进行和接受的。利用PET-CT、螺旋断层、CT技术进行放射治疗卵巢癌都有可行性,PET-CT引导的放疗临床效果更好。Du XL等[22]比较了PET-CT引导IMRT组和CT引导IMRT组的1、2和3年无疾病生存期,PET-CT/IMRT组显著优于CT/IMRT组(1年PFS:68.4% vs 50.2%,P=0.033;2年PFS:40.2% vs 18.6%,P=0.017;3年PFS:18.3% vs 6.6%,P=0.001)。并且2年和3年的PFS比较结果,PET-CT/IMRT组也高于CT/IMRT组(2年PFS:44.0% vs 17.2%,P=0.001;3年PFS:22.7% vs 8.7%,P=0.001)。表明PET/CT引导下对复发性卵巢癌患者行调强放疗可提升对可见肿瘤区域的勾画,同时减少可能漏掉的区域,从而达到更好的临床效果。随着三维适行调强放射治疗的发展,如何看清病灶,找准部位;提高治疗有效剂量,做好危及器官的防护;提高治疗效果,减少治疗的副反应;扩展放疗的领域,改变治疗的模式,这些是比较关键的,需要更深入的临床试验研究。

图2PET-CT显示治疗前后对比图
Figure 2PET-CT showing cure effective prior and post radiation therapy
5小结与展望
经过近百年放射治疗技术的不断进步,从传统的二维放射治疗发展到三维适形及三维适形调强放疗;近年又随着PET/CT影像在肿瘤诊断中的应用,将其用于引导调强放射治疗而形成生物适形调强放射治疗技术,而生物适形调强放射治疗卵巢癌的效果逐渐变得明显。其地位由最初的辅助治疗逐渐上升到首选治疗,并从最初的姑息治疗到慢慢可以根治早期的卵巢癌;但因放射治疗发展较传统治疗晚,相比传统手术治疗及化疗研究还不是很完善,尤其对身体的副作用影响比较复杂,研究需要更深一步。近几年PET/CT的发展,可以清楚地看清肿瘤大小、代谢及周围正常组织,由PET/CT引导的调强放射治疗晚期卵巢癌可以取得理想的疗效,比传统的放疗更有目的性和准确性。可望在放疗技术的不断创新及临床经验的不断积累中,PET/CT引导的调强放疗技术会有更大的进步,疗效会有更大的提高。
【参 考 文 献】
[1]Hegazy MA,Hegazi RA,Elshafei MA,etal.Neoadjuvant chemotherapy versus primary surgery in advanced ovarian carcinoma[J].World J Sur Oncol,2005,3(1):57-64.
[2]Bristow R E,Tomacruz R S,Armstrong D K,etal.Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinumera:a meta-analysis[J].J Clin Oncol,2002,20(5):1248-1259.
[3]American Cancer Society.Cancer Facts & Figures for Hispanics[M].American Cancer Society,2009:19-23.
[4]Hoskins,William J.Principles and practice of gynecologic oncology[J].Lippincott Williams & Wilkins, 2005,6(5):919-922.
[5]Elattar A,Bryant A,Winter-Roach BA,etal.Optimal primary surgical treatment for advanced epithelial ovarian cancer[J].Cochrane Database Syst Rev,2011,10(8):1231-1233.
[6]Classe JM,Jaffre I,Frenel JS,etal.Prognostic factors for patients treated for a recurrent FIGO stage III ovarian cancer:a retrospective study of 108 cases[J].Eur J Surg Oncol,2011,37(11):971-977.
[7]Azzam AZ,Hashad DI,Kamel NAF.Evaluation of HE4 as an extrabiomarker to CA125 to improve detection of ovarian carcinoma:is it time for a step forward[J].Arch Gynecol Obstet,2013,288(1):167-172.
[8]Morrison J,Haldar K,Kehoe S,etal.Chemotherapy versus surgery for initial treatment in advanced ovarian epithelial cancer[J].Cochrane Database Syst Rev,2007,6(4):CD005343.
[9]Onda T and Yoshikawa H.Neoadjuvant chemotherapy for advanced ovarian cancer:overview of outcomes and unanswered questions[J].Expert Rev Anticancer Ther,2011,11(7):1055-1069.
[10] Kommoss S,Rochon J,Harter P,etal.Prognostic Impact of Additional Extended Surgical Procedures in Advanced-Stage Primary Ovarian Cancer[J].Ann Surg Oncol,17(1):279-286.
[11] Pauline Wimberger,Michael Wehling,Nils Lehmann,etal.Influence of Residual Tumor on Outcome in Ovarian Cancer Patients With FIGO Stage IV Disease[J].Ann Surg Oncol,2010,17(6):1642-1648.
[12] Jennifer Burns,M hughes,Fayna Ferkle,etal.Ovarian Cancer,Version 1.2015[J].Journal of the National Comprehensive Cancer Network, 2014,12(12):1702-1738.
[13] Teckie S,Makker V,Tabar V,etal.Radiation therapy for epithelial ovarian cancer brain metastases:clinical outcomes and predictors of survival[J].Radiat Oncol,2013,8(1):36.
[14] Qian HN,Wang JL,Feng J,etal.Vaccination with monoclonal anti-idiotypic antibody on immunocompetent mice bearing human ovarian cancer[J].Chinese Medical Journal,1997,110(4):259-263.
[15] Lindner H,Willich H,Atzinger A.Primary adjuvant whole abdominal irradiation in ovarian carcinoma[J].Int J Radiat Oncol Biol Phys,1990,19(5):1203-1206.
[16] Einhorn N,Lundell M,Nilsson B,etal.Is there place for radiotherapy in the treatment of advanced ovarian cancer[J].Radiother Oncol,1999,53(3):213-218.
[17] Christophe Tournigand, Christophe Louvet,Jean-Luc Molitor,etal.Long-term survival with consolidation intraperitoneal chemotherapy for patients with advanced ovarian cancer with pathological complete remission[J].Gynecol Oncol,2003,91(2):341.
[18] Thierry Petit,Michel Velten,Anne d'Hombres,etal.Long-term survival of 106 stage III ovarian cancer patients with minimal residual disease after second-look laparotomy and consolidation radiotherapy[J].Gynecol Oncol,2007,104(1):104-108.
[19] Nathalie Rochet,Florian Sterzing,Alexandra D,etal.Intensity-Modulated Whole Abdominal Radiotherapy After Surgery and Carboplatin/Taxane Chemotherapy for Advanced Ovarian Cancer:Phase I Study[J].Int J Radiat Oncol Biol Phys,2010,76(5):1382-1389.
[20] Brown AP,Jhingran A,Klopp AH,etal.Involved-field radiation therapy for locoregionally recurrent ovarian cancer[J].Gynecol Oncol,2013,130(2):300-305.
[21] Fulham MJ,Carter J,Baldey A,etal.The impact of PET-CT in suspected recurrent ovarian cancer:A prospective multi-centre study as part of the Australian PET Data Collection Project[J].Gynecol Oncol,2009,112(3):462-468.
[22] Du XL,Jiang T,Sheng XG,etal.PET/CT scanning guided intensity-modulated radiotherapy in treatment of recurrent ovarian cancer[J].Eur J Radiol,2012,81(11):3551-3556.
[23] Caroli P and Fanti S.PET/CT and radiotherapy in gynecological cancer[J].Q J Nucl Med Mol Imaging,2010,54(5):533-542.
[24] Delgado-Bolton RC,Femandez Perez C,Gonzalez-Mate A,etal.Mate-analysis of the performance of18F-FDG PET in primary tumor detection in unknown primary tumors[J].J Nucl Med,2003,44(8):1301-1314.
[25] SG Huang,YZ Dang,FJ Li,etal.Biological intensity-modulated radiotherapy plus neoadjuvant chemotherapy for multiple peritoneal metastases of ovarian cancer:A case report[J].Onc Lett,2015,9(3):1239-43.
[26] Rochet N,Sterzing F,Jensen AD,etal.Intensity-modulated whole abdominal radio-therapy after surgery and carboplatin/taxane chemotherapy for advanced ovarian cancer: phase I study[J].Int J Radiat Oncol Biol Phys,2010,76:1382-1389.
[27] Shetty UM, Shankar S,Engineer R,etal.Image-guided intensity-modulated whole abdominal radiation therapy in relapsed epithelial ovarian cancers:A feasibility study[J].J Can Res Ther,2013,9(1):17-21.
Research progress of biological intensity modulated radiation therapy for advanced ovarian cancerDANG Yazheng,HUANG Shigao
(CancerCenter, 323HospitalofPLA,Xi'an710054,China)
【Abstract】Ovarian cancer is a gynecological tumor mortality rates which is the highest in the malignant tumor. More than 70% of the patients with ovarian cancer has been found for late stage. Currently, the standard treatment of ovarian cancer are surgery which is given priority to, complementary with postoperative chemotherapy, but the most advanced ovarian cancer patients are not suitable for surgery and chemotherapy. In recent years, with the emergence of three-dimensional radiotherapy, IGRT, IMRT, PET-CT technology, the radiotherapy for advanced ovarian cancer patients have new research results. The purpose of this paper is focus on the status and progress of BIMRT for ovarian cancer patients and future radiotherapy for ovarian cancer patients.
【Key words】Ovarian cancer; PET-CT; BIMRT
(收稿日期:2015-06-06; 修回日期: 2015-07-05; 编辑: 母存培)
通讯作者:黄世高, E-mail: huangshigao2010@aliyun.com
基金项目:陕西省自然科学基金(2010JM4053)
【中图分类号】R 737.31; R 815
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2015.09.001
