胃癌的产气法CT仿真内窥镜诊断及新辅助化疗疗效分析
2015-12-31李昌盛
李昌盛
(昌黎县中医院 河北昌黎 066600)
胃癌是我国高发病率、高死亡率的恶性肿瘤疾病。对胃癌进行及时准确的诊断和治疗对挽救患者生命具有重要意义。CT仿真内窥镜因具有无创伤性、方便快捷、提供信息丰富而在胃肠道疾病的诊断中而发挥了重要作用[1]。相关研究表明新辅助化疗能够有效缩小原发病灶,为手术治疗创造良好时机[2],从而提高治疗效果。本研究针对在我院接受治疗的胃癌患者为研究对象,采用CT仿真内窥镜技术进行诊断,以病理活检结果为参照,判断CT仿真内窥镜技术诊断的准确性,并对患者采用新辅助化疗联合腹腔镜根除术手术治疗,评价新辅助化疗对胃癌患者的疗效,具体分析如下。
1 资料和方法
1.1 一般资料:选取2012年6月至2014年2月在我院经病理活检证实的96例胃癌患者,按照治疗方式不同分为试验组(n=48)和对照组(n=48)。试验组中男性29例,女性19例,年龄在32-71岁之间,平均年龄为(49.46±12.51)岁;肿瘤分化程度:低分化23例,中分化18例,高分化7例;对照组中男性28例,女性20例,年龄31岁-70岁之间,平均年龄(48.79±12.64)岁,肿瘤分化程度:低分化24例,中分化19例,高分化6例。两组患者在年龄、性别、肿瘤分化程度等方面的无显著差异(P>0.05),具有可比较性。
纳入标准:所有患者均经胃镜和病理检查确诊为胃癌;未进行抗肿瘤治疗;血常规、肝肾功能正常;患者及其家属均签署知情同意书,愿意配合治疗。
排除标准:高血压、糖尿病等疾病患者;严重肝肾疾病患者;其他恶性肿瘤患者;严重药物不良反应者予以排除[3]。
1.2 诊断方法:选用多层螺旋CT扫描机(TOSHIBA Aquilior),所有患者晨起空腹4小时以上,检查前20min肌注20mg山莨菪碱。扫描参数为电压120kV,电流200-300mA,层距5 mm,层厚5mm,重建间隔0.5mm,重建层厚1mm。将胃管通过鼻腔插入,胃液和残留物用注射器抽净,根据患者的耐受程度注入800-1000ml空气对比剂。患者保持俯卧位或者仰卧,然后由胃底至胃窦大弯进行螺旋CT轴位扫描。扫描后重建间隔0.5mm,重建层厚为1.0mm,将扫描容积数据传至工作站,通过多平面重建、仿真内窥镜透明法处理后进行CTVE成像,选择有经验的医师用双自法分析对鼻胃管充气的CTVE影像。将诊断结果与胃镜活检或者手术活检诊断结果比较,评价CTVE检查对胃癌病变的检查效果。
1.3 治疗方法
1.3.1 试验组患者采用先新辅助化疗再进行手术治疗。新辅助化疗方案:奥沙利铂(齐鲁制药(海南)有限公司,国药准字H20093168),130mg/m2,每疗程第一天,2h内静注;替加氟(湖北华源世纪药业有限公司,国药准字H20055102),1g/m2,每疗程第1-5天,静滴;亚叶酸钙(江苏恒瑞医药股份有限公司,国药准字 H32022391),200mg/m2,每疗程每疗程第1-5天,2h内静注。以5天为一个化疗疗程,中间间隔3周,共化疗2个疗程。辅以使用胃复安止吐、胸腺肽增强免疫能力,化疗期间给予营养支持,注意保暖,定期检查肝肾功能和血常规。
试验组患者术前新辅助化疗结束后,根据新辅助化疗效果行腹腔镜下胃癌根治术。将患者全身麻醉,平卧,建立气腹,置入腹腔镜,探查肿瘤位置。利用超声刀游离组织,清除1-12组淋巴结。切断十二指肠,行胃十二指肠吻合。待观察无渗血状况时后置引流管。
1.3.2 对照组患者直接进行腹腔镜胃癌根治术治疗,手术方法与试验组患者相同。
1.4 疗效评价:参照WHO肿瘤治疗的相关疗效评价标准[4]。完全缓解:肿瘤病灶完全消失且没有新的病灶出现,维持4周以上;部分缓解:肿瘤体积减小一半以上,没有新病灶出现,并且维持4周以上;病情稳定:肿瘤体积减小不足二分之一或者增大不超过25%,没有新的病灶出现,维持4周以上;病情进展:新病灶出现或者肿瘤体积增大25%以上。治疗的总有效率等于完全缓解和部分缓解之和。
分别抽取两组患者治疗前、治疗后清晨空腹静脉血5ml,3000r/min离心5min,分离血清,-20℃保存。用微粒子酶免疫分析法检测血清CEA和CA19-9水平,用电化学发光法测定血清CA72-4水平,比较治疗前后血清CEA、CA19-9、CA72-4水平变化。
观察并记录两组患者治疗过程中出现肠梗阻、感染、腹腔出血等并发症的发生例数。
1.5 统计学方法:采用统计学软件SPSS19.0对所有数据资料进行统计学分析,采用平均数±标准差的形式表示计量资料,进行t检验;采用百分数(%)的形式表示计数资料,进行卡方检验。若P<0.05,表示数据对比差异显著,具有统计学意义。
2 结 果
2.1 产气法CT仿真内窥镜诊断结果:病理诊断96例患者中,产气法CT仿真内窥镜诊断结果阳性93例,产气法CT仿真内窥镜与病理诊断结果基本相符,准确率高达96.9%。
2.2 两组患者治疗效果比较:试验组患者治疗后总有效28例,总有效率为58.3%;对照组治疗后总有效18例,总有效率为37.5%,试验组患者的治疗效果明显好于对照组,P<0.05,差异具有统计学意义。见表1。
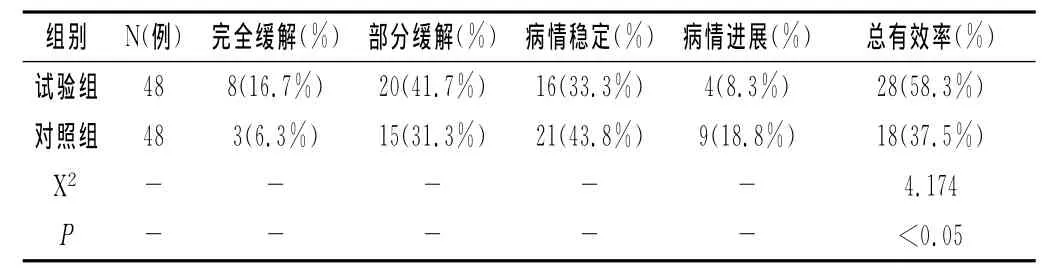
表1 两组患者治疗效果比较
2.3 两组患者治疗前后血清CEA、CA19-9、CA72-4水平比较:治疗前,两组患者血清CEA、CA19-9、CA72-4水平无显著差异,P>0.05,差异不具有统计学意义。治疗后,两组患者血清CEA、CA19-9、CA72-4水平均显著下降(P<0.05),且试验组患者血清CEA、CA19-9、CA72-4水平显著低于对照组(P<0.05),两组差异具有统计学意义。见表2。
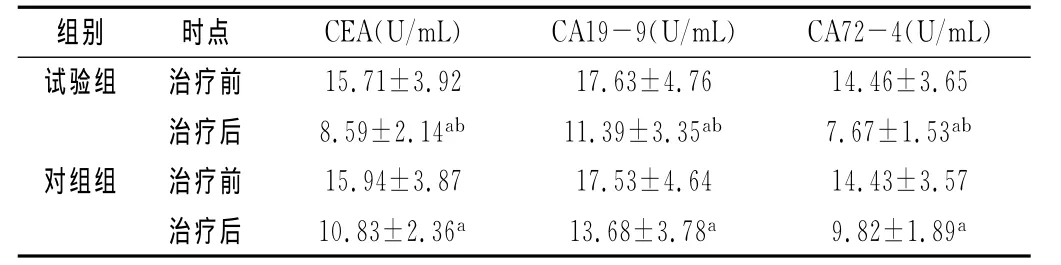
表2 两组患者治疗前后血清CEA、CA19-9、CA72-4水平比较
2.4 两组患者并发症发生率比较:两组患者的并发症统计结果显示,试验组患者并发症共发生4例,并发症发生率为8.3%;而对照组患者并发症共发生5例,并发症发生率为10.4%,P>0.05,两组患者并发症发生率无显著差异。见表3。

表3 两组患者并发症发生率比较
3 讨 论
胃癌是我国发病率较高的恶性肿瘤,死亡率居恶性肿瘤之首。因此对胃癌进行早期准确诊断,对胃癌的确诊和治疗具有重要意义[5]。CT仿真内窥镜因其大范围容积扫描和多模式图像处理技术为胃癌的诊断和治疗提供了重要依据。
CT仿真内窥镜是利用计算机软件技术立体重建胃容积扫描数据,从而获得脏器内表面三维影像,具有无创伤、无痛苦、无风险的优点,易于被患者接受。对胃癌患者采用螺旋CT平扫能够反映胃壁的状态,清晰显示病变的部位、大小、形态,同时能够反映出淋巴结转移情况和与病灶相近的组织结构受侵蚀状况[6]。但螺旋CT平扫并不能显示病灶大体形态,因此对胃癌的诊断具有一定的局限性。CTVE成像能够对病灶进行多方位、多角度观察,肿瘤的隆起、溃疡和病灶周围胃壁的情况能够更清晰的体现,从而更好的反映病灶表面的征象,有利于提高诊断的准确性[7]。本研究中,所有患者采用产气法CT仿真内窥镜检测结果与胃镜或手术活检结果基本一致,准确性较高。对胃癌患者采用产气法CT仿真内窥镜诊断能够为胃癌的诊断提供重要依据,具有较高临床应用价值。
新辅助化疗是指在进行手术或者放疗前对肿瘤进行局部或者全身化疗[8]。新辅助化疗能够有效缩小肿瘤体积,使肿瘤临床分期降低,便于手术切除,为肿瘤的治疗开辟了途径[9]。在胃癌的治疗中,可在手术切除后给予化疗,但术后化疗在杀伤潜在微小病灶方面的作用不及术前化疗。同时单纯手术切除可能由于肿瘤体积大、生长时间长或者部分已发生淋巴结转移,导致手术效果不佳[10]。新辅助化疗可以根据术前化疗效果选择恰当的时机进行手术切除,不但会减轻患者的痛苦,而且能够提高治疗效果,延长患者的生存时间。本研究结果显示,试验组患者采用新辅助化疗再手术治疗后,治疗效果明显好于对照组,表明莫西沙星治疗耐多药肺结核效果更好。
肿瘤标志物是肿瘤发生和增殖的过程中由肿瘤细胞分泌和产生的生化物质。研究表明,血清CEA、CA19-9、CA72-4水平与胃癌的发病密切相关。CEA是一种肿瘤相关抗原,特异性较高,能够提供判断肿瘤的转移和复发方面的依据。CA19-9由腺癌细胞产生,在胃癌等肿瘤中呈阳性表达,研究表明其水平与肿瘤进展正相关[11]。CA72-4是一种相对分子质量糖蛋白,是诊断胃癌的可靠的肿瘤标志物[12]。本研究中,两组患者治疗前血清CEA、CA-19-9、CA72-4水平没有显著差异,试验组患者采用新辅助化疗再手术治疗后,血清CEA、CA-19-9、CA72-4水平明显低于对照组,表明新辅助化疗能够有效调节血清CEA、CA-19-9、CA72-4水平,抑制抑制肿瘤增殖和复发。
腹腔镜手术前患者体质通常较好,因此对化疗药物耐受性较好,不容易发生急性毒性反应和并发症。化疗后进行腹腔镜根治术治疗风险较低,出现腹腔出现、吻合口瘘的概率较小,本研究中观察组患者在肠梗阻、尿潴留等并发症方面少于对直接腹腔镜根治术患者,但两组差异并不显著,表明术前新辅助化疗能够治疗胃癌的并发症发生率较低,安全可靠。
综上,新辅助化疗联合腹腔镜手术治疗低位直肠癌能够有效降低血清CEA、CA242、CA724的水平,减少肿瘤的复发,疗效较好,同时并发症少,安全可靠,值得临床推广应用。
[1] 侯海燕,姜建威,王均干.多层螺旋CT重建技术在输尿管病变中的应用价值[J].现代中西医结合杂志,2009,18(34):4278-4279.
[2] 黄帅,郑朝旭,徐泉,等.进展期胃癌新辅助化疗的临床疗效观察[J].实用肿瘤杂志,2012,27(6):646-649.
[3] Suttie SA,Welch AE,Park KG.Positron emission tomography for monitoring response to neoadjuvant therapy in patients with oesophageal and gastrooesophageai junction carcinoma[J].Eur J Surg Oneo1,2009,35(10):1019-1029.
[4] 李立.进展期胃癌改良FOLFOX6方案新辅助化疗的临床研究[D].浙江大学,2009.
[5] 赵伟.腹腔镜辅助远端胃癌根治术与开腹根治术的临床观察和安全性评估[J].现代中西医结合杂志,2014,23(14):1517-1519.
[6] 孙英,何丹.16层螺旋CT仿真内窥镜对胃癌的诊断价值及应用[J].中国CT和 MRI杂志,2010,8(30):53-54.
[7] Lee SM,Kim SH,Lee JM,et a1.Usefulness of CT volumetry for primary gastric lesions in predicting pathologic response to neoadjuvant chemotherapy in advanced gastric cancer[J].Abdomen Imaging,2009,34(4):430-440.
[8] Ott K,Lordick F,Herrmann L,et al.The new credo:induction chemotherapy in locally advanced gastric cancer:consequences for surgical strategies[J].Gastric Cancer,2008,11(1):1-9.
[9] 朱侃恺.卡培他滨联合奥沙利铂新辅助化疗治疗进展期胃癌的临床研究[D].浙江大学,2008.
[10] 周俊,夏洪.新辅助化疗对Ⅲ期非小细胞肺癌手术疗效的影响[J].现代中西医结合杂志,2009,18(2):118-120.
[11] 武翠玲.联合检测癌胚抗原肿瘤抗原199甲胎蛋自在胃癌中的临床价值[J].山西医药杂志,2013,42(2):214-215.
[12] 刘俊,张素珍.联合检测血清癌胚抗原糖类抗原19-9糖类抗原242在胰腺癌诊断中的价值[J].中国药物与临床,2013,1(7):932-933.
