脱色工艺对鱼皮胶原肽品质的影响
2015-12-31王宝周翁武银
张 萌 王宝周 陈 俊 翁武银
(集美大学食品与生物工程学院,福建 厦门 361021)
近年来,中国淡水渔业快速发展,2013年淡水鱼年产量已经超过2 600万t[1],随着鱼类深加工制品的市场需求和消费比例的上升,加工过程产生了大量的鱼皮、鱼鳞和鱼骨等下脚料。鱼皮中胶原含量占干重的50%左右[2],可以制备成具有抗氧化、降血压、抗肿瘤和抗衰老等生物活性的胶原肽[3-5]。现代营养学研究[6-9]发现,寡肽与氨基酸一样可以被人体直接吸收,而且人体对寡肽的利用效果甚至高于游离氨基酸。然而,随着寡肽含量的增加胶原肽颜色逐渐变黄[10,11],导致鱼皮胶原肽产品的应用受到限制。
目前,蛋白肽脱色大多采用双氧水氧化法、活性炭和大孔树脂吸附法[12-15]。利用双氧水对蛋白肽进行脱色处理,虽然可得到较好的脱色效果[12],但由于双氧水具有强致癌性,残留物将会给具有保健功能的蛋白肽带来负面影响。而活性炭和大孔吸附树脂作为脱色吸附剂具有脱色率高、脱色用时短、安全可靠等特点,已在多肽制备领域得到广泛应用。然而,有关活性炭、大孔吸附树脂对胶原肽脱色的系统比较却未见报道。
本研究拟以罗非鱼皮胶原为原料制备胶原肽,利用活性炭、大孔吸附树脂建立胶原肽脱色工艺,考察脱色前后的胶原肽的分子量分布和氨基酸组成,为优化胶原肽的脱色工艺提供参考数据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
鱼皮胶原:由集美大学水产品加工研究室提供;
复合蛋白酶:20万U/g,龙岩市润宝生物科技有限公司;
粉末活性炭(粒径200目)、LH-301型大孔吸附树脂:龙岩市润宝生物科技有限公司;
DC蛋白测定试剂盒:美国Bio-Rad公司;
羟脯氨酸试剂盒:南京建成生物工程研究所;
乙腈、甲醇:色谱纯,美国INC公司;
三氟乙酸:色谱纯,美国Amresco公司;
盐酸、氢氧化钠、无水乙醇:分析纯,西陇化工股份有限公司;
试验用水:本实验室用Millipore Milli Q RG超纯水系统制备。
1.1.2 仪器与设备
高速冷冻离心机:Avanti J-25型,美国Beckman公司;
pH 计:FE 20型,梅特勒—托利多仪器(上海)有限公司;
紫外分光光度计:UV-2600A型,上海元析仪器有限公司;
高效液相色谱仪:Aglient 1200型,美国Agilent公司;
高速全自动氨基酸分析仪:日立L-8900型,日本日立制造所;
凝胶色谱柱:TSKgel G2000SWXL型,日本Tosho株式会社。
1.2 试验方法
1.2.1 鱼皮胶原肽的制备 将鱼皮胶原溶解后调整至一定浓度,加入相对蛋白质量1%的复合蛋白酶,在pH 7.5,50℃水浴下酶解6h后,利用沸水浴灭酶5min,冰浴冷却、离心(10 000×g,4℃,30min)后,获得的上清液通过冷冻干燥制备成胶原肽粉末。
1.2.2 脱色率和肽损失率的测定 将胶原肽用蒸馏水溶解后,加入活性炭或大孔吸附树脂进行脱色,通过测定脱色前后胶原肽溶液在波长为400nm处的吸光值,按式(1)计算胶原肽脱色率[16]。通过测定胶原肽溶液在脱色前后蛋白含量的变化,按式(2)计算肽损失率。

式中:
A——脱色率,%;
A1——脱色前酶解液在400nm处的吸光值;
A2——脱色后上清液在400nm处的吸光值。
W——肽损失率,%;
W1——脱色前酶解液中蛋白含量,mg/mL;
W2——脱色后上清液中蛋白含量,mg/mL。
1.2.3 活性炭脱色工艺优化 在预试验中,研究了温度(35,40,45,50℃)对胶原肽脱色的影响,发现温度对活性炭脱色没有显著的影响,因此选择在室温条件下,考察pH值、活性炭添加量、脱色时间以及蛋白浓度等4个因素对胶原肽脱色率和肽损失率的影响。
(1)pH值的影响:在蛋白浓度50mg/mL,活性炭添加量1.00%,脱色时间30min的条件下,考察pH对罗非鱼皮胶原肽脱色率和肽损失率的影响。
(2)活性炭添加量的影响:在蛋白浓度50mg/mL,pH 5.0,脱色时间30min的条件下,考察活性炭添加量对罗非鱼皮胶原肽脱色率和肽损失率的影响。
(3)脱色时间的影响:在pH 5.0,蛋白浓度50mg/mL,活性炭添加量1.00%的条件下,考察脱色时间对罗非鱼皮胶原肽脱色率和肽损失率的影响。
(4)蛋白浓度的影响:在pH 5.0,活性炭添加量1.00%,脱色时间30min的条件下,考察蛋白浓度对罗非鱼皮胶原肽脱色率和肽损失率的影响。
(5)正交试验:在单因素试验的基础上进行正交试验,通过脱色率和肽损失率两个指标来综合评定脱色效果[17],按式(3)计算脱色效果的综合评分。
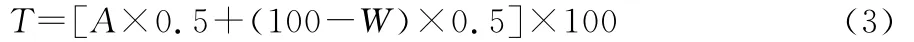
式中:
T——综合评分,%;
A——脱色率,%;
W——肽损失率,%。
1.2.4 大孔吸附树脂脱色工艺的优化 在预试验中,研究了温度(35,40,45,50℃)对胶原肽脱色的影响,发现温度对大孔吸附树脂脱色没有显著的影响,因此选择在室温条件下,考察pH值、大孔吸附树脂添加量、脱色时间以及蛋白浓度等4个因素对胶原肽脱色率和肽损失率的影响。
(1)pH值的影响:在蛋白浓度50mg/mL,大孔吸附树脂添加量1.00%,脱色时间30min的条件下,考察pH对罗非鱼皮胶原肽脱色率和肽损失率的影响。
(2)大孔吸附树脂添加量的影响:在pH 5.0,蛋白浓度50mg/mL,脱色时间30min的条件下,考察大孔吸附树脂添加量对罗非鱼皮胶原肽脱色率和肽损失率的影响。
(3)脱色时间的影响:在pH 5.0,蛋白浓度50mg/mL,大孔吸附树脂添加量0.75%的条件下,考察脱色时间对罗非鱼皮胶原肽脱色率和肽损失率的影响。
(4)蛋白浓度的影响:在pH 5.0,大孔吸附树脂添加量0.75%,脱色时间45min的条件下,考察蛋白浓度对罗非鱼皮胶原肽脱色率和肽损失率的影响。
(5)正交试验:在单因素试验的基础上进行正交试验,通过脱色率和肽损失率两个指标来综合评定脱色效果[17],按式(3)计算脱色效果的综合评分。
1.2.5 胶原肽分子量分布的测定 利用高效液相色谱仪[18]测定胶原肽分子量,并用GPC软件对其分子量分布进行分 析。色 谱 柱 为 TSKgel G2000SWXL (300mm×7.8mm),流动相为乙腈/水/三氟乙酸(45∶55∶0.1,V/V/V),在柱温30℃、流速0.5mL/min条件下,以检测波长214nm对样品进行测定。其中标准品为:细胞色素C(12 327Da)、抑肽酶(6 533Da)、氧化型谷胱甘肽(613Da)、Gly-Gly-Gly(189Da)、Gly(75Da)。
1.2.6 氨基酸组成分析 胶原肽粉末利用可密封的消化管,在抽真空、充氮气、110℃下用6mol/L HCl水解22h后,通过蒸馏除去盐酸,稀释至一定浓度后过0.22"m水系滤膜,利用全自动氨基酸分析仪进行分析。其中羟脯氨酸的含量利用试剂盒进行测定。
1.2.7 数据分析 采用SPSS 17.0软件(SPSS Inc,Chicago,IL,USA)对所得数据进行方差分析(ANOVA),显著性检验方法为Duncan多重检验,显著水平为0.05。
2 结果与分析
2.1 活性炭脱色工艺的优化
2.1.1 pH值的影响 由图1可知,伴随pH的升高,胶原肽的脱色率与肽损失率都出现下降趋势。这与明胶酶解液、大豆多肽的活性炭脱色效果类似[16,19],在弱酸性条件下脱色率高,但多肽容易被吸附。由于在pH 5.0下脱色率已经达到82.57%,因此为了避免pH过低导致胶原肽的损失,选择pH 为5.0。

图1 pH对胶原肽脱色率和肽损失率的影响Figure 1 Effect of pH on the decolorizing rate and peptide loss of collagen peptides
2.1.2 活性炭添加量的影响 由图2可知,当活性炭添加量由0.25%增加到2.00%时,胶原肽的脱色率由61.47%提高到87.46%,然而肽损失率也由2.20%上升至11.07%,这个趋势类似于Ma等[20]的报道。为了尽量减少多肽损失,选择活性炭添加量为1.00%。
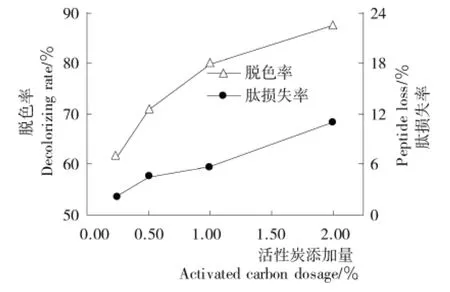
图2 活性炭添加量对胶原肽脱色率和肽损失率的影响Figure 2 Effect of activated carbon dosage on the decolorizing rate and peptide loss of collagen peptides
2.1.3 脱色时间的影响 由图3可知,伴随着脱色时间的延长,胶原肽脱色率与肽损失率都出现逐渐上升并趋向稳定的趋势,其中脱色率在30min时趋于稳定,而肽损失率却在60min后才开始达到平稳。因此,选用脱色时间为30min考察蛋白浓度对脱色效果的影响。

图3 脱色时间对胶原肽脱色率和肽损失率的影响Figure 3 Effect of decolorizing time on the decolorizing rate and peptide loss of collagen peptides
2.1.4 蛋白浓度的影响 由图4可知,蛋白浓度对脱色率具有显著的影响,浓度从50mg/mL时提高到300mg/mL时,胶原肽的脱色率由80.82%降至43.40%。然而蛋白浓度对肽损失率的影响并不明显,基本稳定在4.5%左右。综合考虑,选择蛋白浓度为50mg/mL。
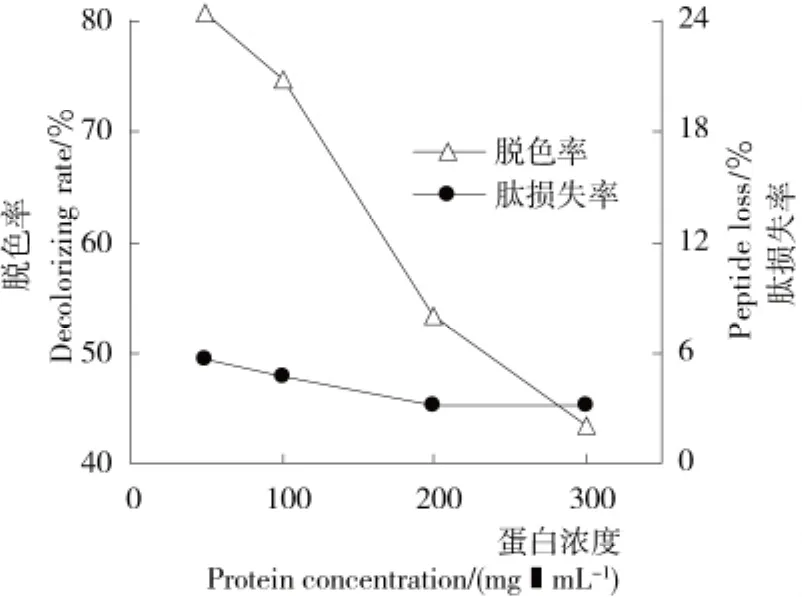
图4 蛋白浓度对胶原肽脱色率和肽损失率的影响Figure 4 Effect of protein concentration on the decolorizing rate and peptide loss of collagen peptides
2.1.5 正交试验结果与分析 根据单因素试验结果,设计了活性炭脱色的正交试验的各因素水平见表1,正交试验结果见表2。
由表2可知:各因素对活性炭脱色率影响大小为:蛋白浓度>活性炭添加量>pH>时间,优化结果为:pH 4.5、活性炭添加量2.00%、脱色时间60min、蛋白浓度50mg/mL。肽损失率影响大小为:活性炭添加量>蛋白浓度>时间>pH,优化结果为:pH 5.0、活性炭添加量0.50%、脱色时间60min、蛋白浓度100mg/mL。
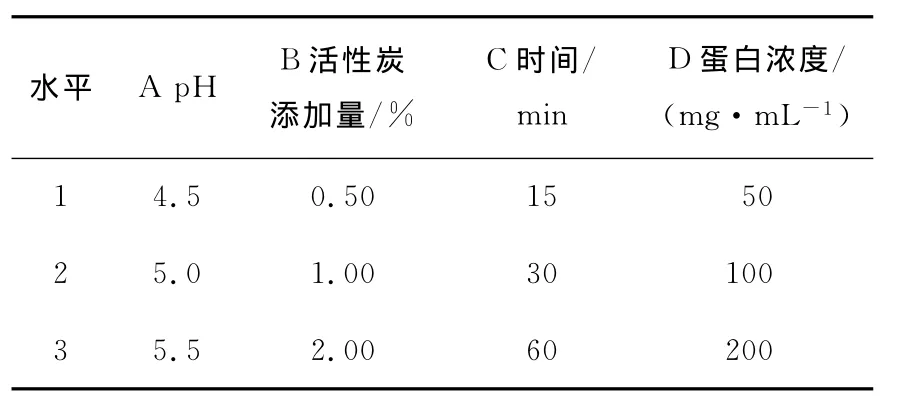
表1 活性炭脱色试验因素水平表Table 1 Factors and levels of decolorizing experiment with activated carbon

表2 活性炭脱色正交试验结果与分析Table 2 Results and analysis of orthogonal tests for decolorizing conditions of activated carbon
为进一步确定最佳试验方案,根据正交试验结果,以综合加权评分的方法对脱色率和肽损失率两项指标进行综合评分,得到各因素对活性炭总体脱色效果的影响与脱色率一致。验证实验(n=5)表明,活性炭脱色效果最佳时,胶原肽的脱色率可以达到(92.66±1.99)%,肽损失率为(11.23±0.18)%,综合评分为(90.72±1.40)%。
2.2 大孔吸附树脂脱色工艺的优化
2.2.1 pH值的影响 由图5可知,伴随pH的升高,胶原肽的脱色率与肽损失率都出现下降趋势,与活性炭类似。当pH为5.0时,胶原肽的脱色率为42.74%,脱色效果不及活性炭。为了避免pH过低导致胶原肽的损失,选择pH为5.0。
2.2.2 大孔吸附树脂添加量的影响 由图6可知,在pH 5.0下增加大孔吸附树脂添加量,胶原肽的脱色率与肽损失率都出现上升趋势,这与大孔树脂对海地瓜胶原多肽的脱色效果类似[13]。以脱色率最高和肽损失率最小为目标,选择大孔吸附树脂添加量为0.75%。
2.2.3 脱色时间的影响 由图7可知,随着脱色时间的延长,胶原肽脱色率与肽损失率都逐渐上升并趋向稳定,二者均在45min时趋于稳定。因此,选用脱色时间为45min考察蛋白浓度对胶原肽脱色效果的影响。

图5 pH对胶原肽脱色率和肽损失率的影响Figure 5 Effect of pH on the decolorizing rate and peptide loss of collagen peptides
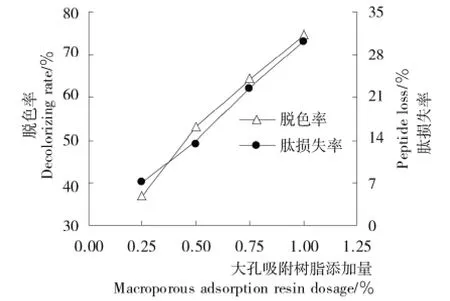
图6 大孔吸附树脂添加量对胶原肽脱色率和肽损失率的影响Figure 6 Effect of macroporous adsorption resin dosage on the decolorizing rate and peptide loss of collagen peptides

图7 脱色时间对胶原肽脱色率和肽损失率的影响Figure 7 Effect of decolorizing time on the decolorizing rate and peptide loss of collagen peptides
2.2.4 蛋白浓度的影响 由图8可知,当蛋白浓度从50mg/mL提 高 到300mg/mL 时,胶 原 肽 的 脱 色 率 从77.04%下降至41.51%,然而蛋白浓度对肽损失率的影响并不明显,这与活性炭脱色效果(图4)类似。因此,根据脱色效果,选择蛋白浓度为50mg/mL。
2.2.5 正交试验结果与分析 根据单因素试验结果,设计了大孔吸附树脂的正交试验的各因素水平见表3,正交试验结果见表4。
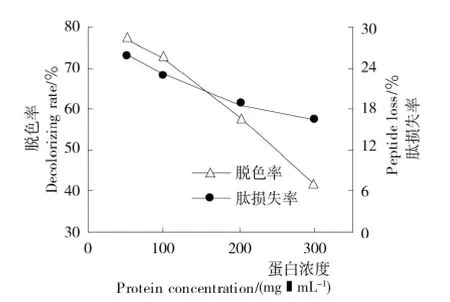
图8 蛋白浓度对胶原肽脱色率和肽损失率的影响Figure 8 Effect of protein concentration on the decolorizing rate and peptide loss of collagen peptides
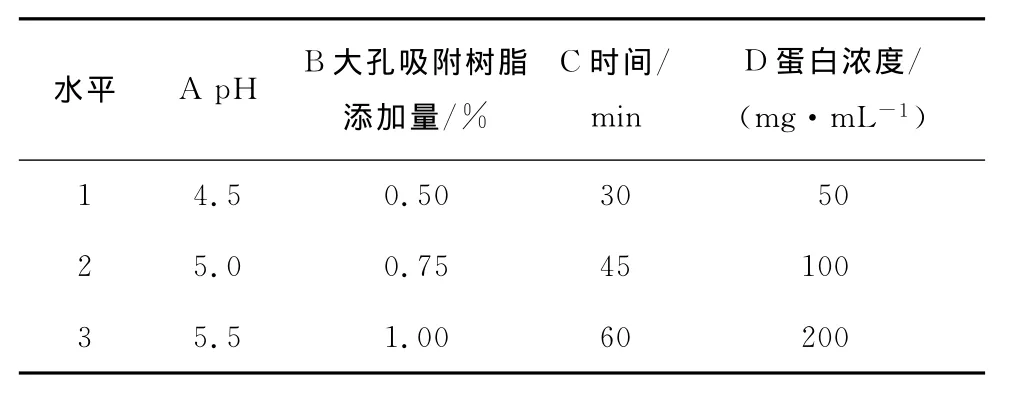
表3 大孔吸附树脂脱色正交试验因素与水平Table 3 Factors and levels of decolorizing experiment with macroporous adsorption resin
由表4可知,各因素对大孔吸附树脂脱色率的影响大小为:蛋白浓度>大孔吸附树脂添加量>时间>pH,优化结果为pH 4.5、大孔吸附树脂添加量1.00%、脱色时间45min、蛋白浓度50mg/mL。各因素对肽损失率影响大小为:大孔吸附树脂添加量>蛋白浓度>时间>pH,优化结果为pH 5.5、大孔吸附树脂添加量0.50%、脱色时间45min、蛋白浓度为200mg/mL。
综合评分优化大孔吸附树脂最佳脱色条件,验证实验(n=5)表明,大孔吸附树脂脱色率为(83.02±1.04)%,肽损失率为(30.77±0.41)%,综合评分为(76.13±0.41)%,结果表明大孔吸附树脂对胶原肽的脱色效果低于活性炭。
综上所述,不管是活性炭还是大孔吸附树脂,影响脱色率的主要因素都是蛋白浓度,而影响肽损失率的主要因素都是吸附材料的添加量。虽然胶原肽溶液中蛋白浓度越低,脱色效果越好,然而考虑到实际应用的生产成本,本试验将溶液中蛋白浓度的最低值设定为50mg/mL。
2.3 脱色工艺对胶原肽分子量分布的影响
利用HPLC对活性炭或大孔吸附树脂脱色前后罗非鱼皮胶原肽的分子量进行测定,并利用GPC软件对胶原肽分子量进行分段分析,结果见图9和表5。由图9和表5可知,本研究制备的胶原肽其分子量分布在150~2 000Da,而且主要集中于350Da和1 400Da附近。其中,分子量小于1 000Da的寡肽含量占总胶原肽的比例为66.3%,高于Julio等[21]利用鲨鱼皮制备的胶原肽。虽然 Wasswa等[22]制备的鲈鱼、草鱼和罗非鱼皮多肽中小于1 000Da的组分占比达到78%左右,但其中含有大量游离氨基酸,分子量分布比较分散。相对氨基酸及大分子多肽,寡肽不仅易于人体吸收代谢,而且具有更高的生物活性[6-9]。因此,本研究制备的胶原肽具有良好的应用价值。
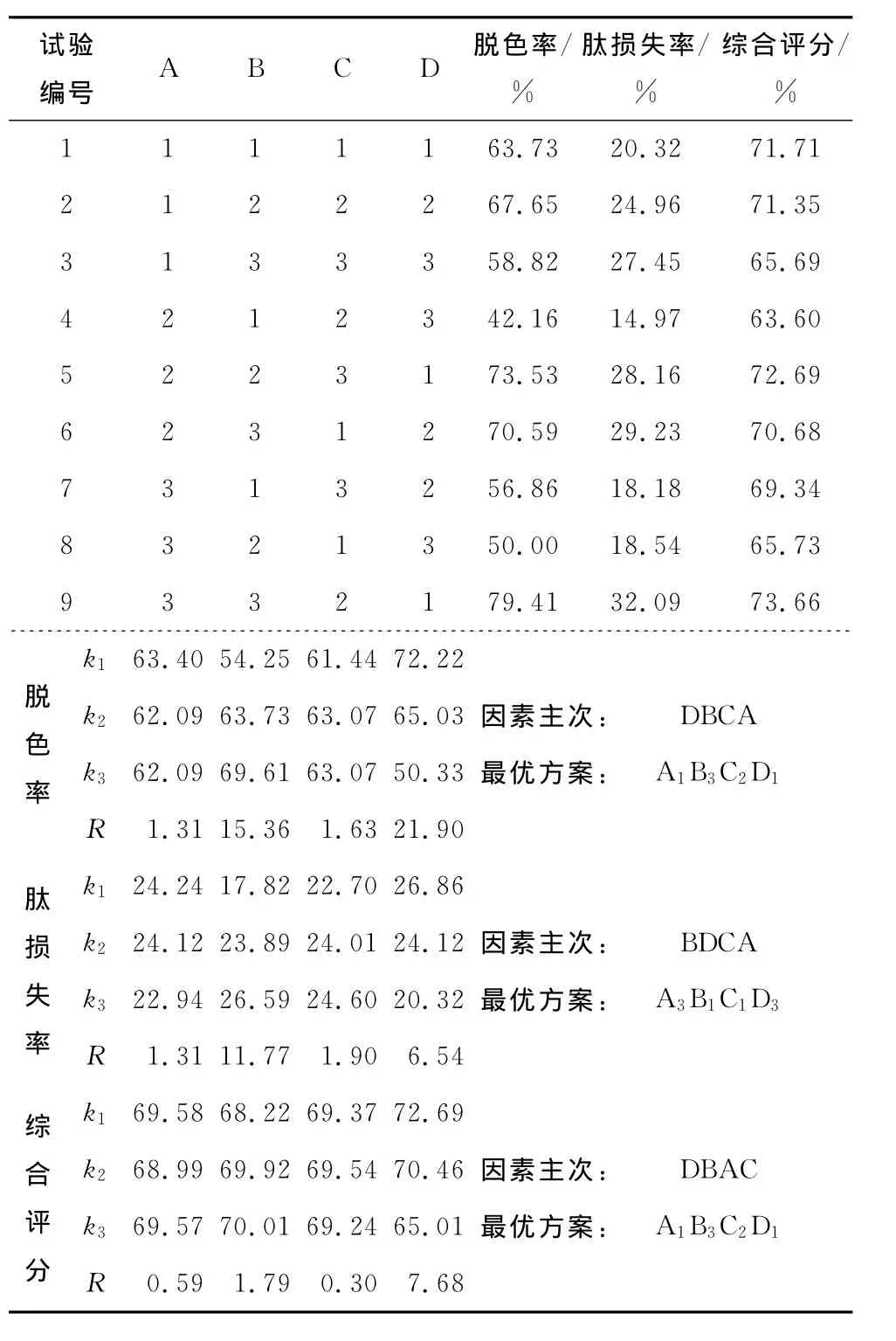
表4 大孔吸附树脂脱色正交试验结果与分析Table 4 Results and analysis of orthogonal tests for decolorizing conditions of macroporous adsorption resin
利用活性炭对鱼皮胶原肽进行脱色后,在HPLC图谱中1 400Da的波峰没有发现明显的变化,但350Da的波峰却转变成310Da。通过分析分子量分布的变化,发现经过活性炭脱色后,500~1 000Da的胶原肽组分含量的占比明显减少的同时,1 500Da以上的胶原肽组分含量也出现一定程度地减少,表明这些组分容易被活性炭吸附脱除。另一方面,利用大孔吸附树脂对鱼皮胶原肽进行脱色时,500~1 000Da的胶原肽组分含量的减少比例明显低于活性炭脱色的样品。这个结果与脱色效果(表2和表4)趋势一致。据报道,活性炭在脱色过程会吸附一定量的氨基酸[23],而大孔吸附树脂除了吸附游离氨基酸外,对肽分子也有较强的吸附作用[24]。而且,Wasswa等[10]研究发现当草鱼鱼皮酶解液中分子量为500~1 000Da组分所占比例升高时,酶解液的颜色会加深。因此,可推测分子量在500~1 000Da的组分可能是影响胶原肽颜色的主要因素。
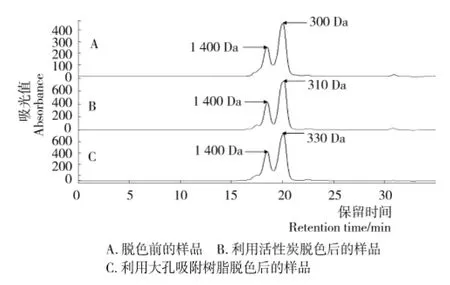
图9 胶原肽高效液相凝胶色谱图Figure 9 SE—HPLC of collagen peptides
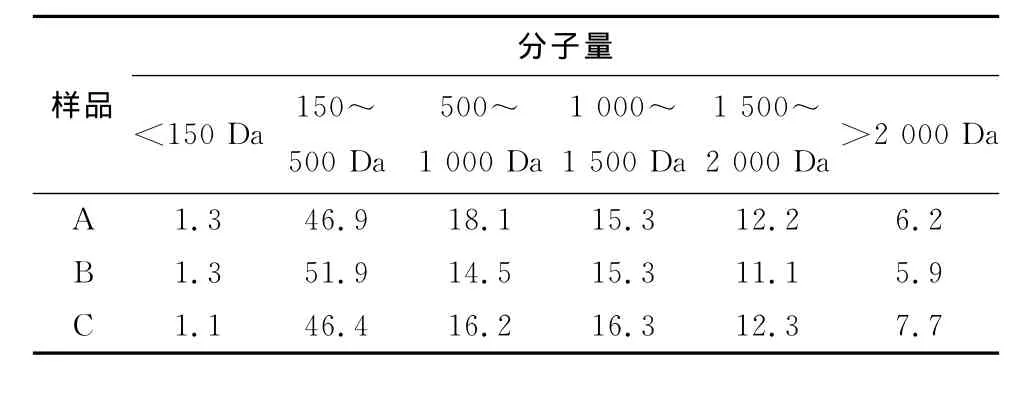
表5 脱色工艺对胶原肽分子量分布的影响Table 5 Effect of decolorizing on the molecular weight distribution of collagen peptides %
2.4 脱色工艺对胶原肽氨基酸组成的影响
脱色工艺对胶原肽氨基酸含量的影响见表6。由表6可知,吸附前酶解液中氨基酸含量为568.7mmol/L。经活性炭脱色后,氨基酸含量减少21.48%,而经大孔吸附树脂脱色后,氨基酸含量减少29.96%,表明大孔树脂对极性氨基酸吸附量略高于活性炭。研究发现,活性炭对芳香族氨基酸具有较强的吸附作用[25];而大孔吸附树脂通过疏水相互作用对色素及蛋白质进行吸附的同时,其本身的多孔性结构还会保留部分多肽[24,26]。因此,利用大孔吸附树脂脱色容易吸附极性氨基酸,导致胶原肽氨基酸损失率高于活性炭。
表6 脱色工艺对胶原肽氨基酸含量的影响Table 6 Effect of decolorizing on the amino acid content of collagen peptides
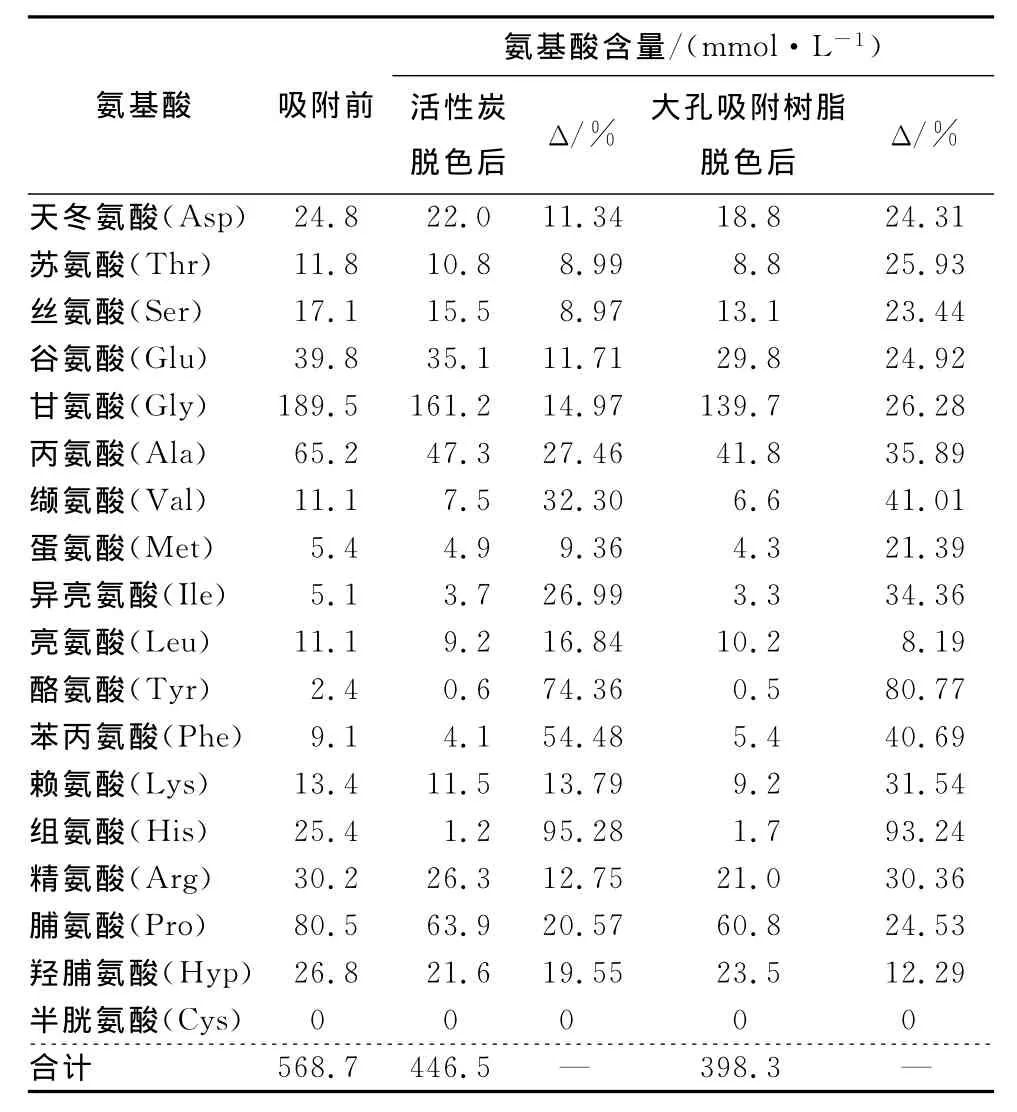
表6 脱色工艺对胶原肽氨基酸含量的影响Table 6 Effect of decolorizing on the amino acid content of collagen peptides
Δ表示活性炭和大孔吸附树脂脱色前后胶原肽氨基酸损失的摩尔数百分比[24]。
氨基酸含量/(mmol·L-1)氨基酸 吸附前 活性炭脱色后 Δ/% 大孔吸附树脂脱色后 Δ/%天冬氨酸(Asp) 24.8 22.0 11.34 18.8 24.31苏氨酸(Thr) 11.8 10.8 8.99 8.8 25.93丝氨酸(Ser) 17.1 15.5 8.97 13.1 23.44谷氨酸(Glu) 39.8 35.1 11.71 29.8 24.92甘氨酸(Gly) 189.5 161.2 14.97 139.7 26.28丙氨酸(Ala) 65.2 47.3 27.46 41.8 35.89缬氨酸(Val) 11.1 7.5 32.30 6.6 41.01蛋氨酸(Met) 5.4 4.9 9.36 4.3 21.39异亮氨酸(Ile) 5.1 3.7 26.99 3.3 34.36亮氨酸(Leu) 11.1 9.2 16.84 10.2 8.19酪氨酸(Tyr) 2.4 0.6 74.36 0.5 80.77苯丙氨酸(Phe) 9.1 4.1 54.48 5.4 40.69赖氨酸(Lys) 13.4 11.5 13.79 9.2 31.54组氨酸(His) 25.4 1.2 95.28 1.7 93.24精氨酸(Arg) 30.2 26.3 12.75 21.0 30.36脯氨酸(Pro) 80.5 63.9 20.57 60.8 24.53羟脯氨酸(Hyp) 26.8 21.6 19.55 23.5 12.29半胱氨酸(Cys) 0 0 0 0 0合计 568.7 446.5 — 398.3—
3 结论
在单因素试验基础上,通过正交试验分别获得罗非鱼皮胶原肽的活性炭和大孔吸附树脂脱色的最优条件,活性炭的脱色效果明显优于大孔吸附树脂。通过比较脱色前后胶原肽的分子量分布发现,500~1 000Da组分可能是影响胶原肽颜色的主要因素。经活性炭或大孔吸附树脂脱色后,胶原肽中氨基酸含量均减少,但利用大孔吸附树脂脱色会使胶原肽氨基酸损失率更高。本研究结果将为胶原肽的脱色工艺优化提供理论基础,有助于提高鱼胶原肽产品品质和扩大其应用范围。
1 中华人民共和国农业部渔业局.中国渔业统计年鉴2014[Z].北京:中国农业出版社,2014.
2 Nagai T,Suzuki N.Isolation of collagen from fish waste material-skin,bone and fins[J].Food Chemistry,2000,68(3):277~281.
3 Alemán A,Pérez-Santín E,Gómez-Guillén M C,et al.Squid gelatin hydrolysates with antihypertensive,anticancer and antioxidant activity[J].Food Research International,2011,44(4):1 044~1 051.
4 Xu Ya-jun,Han Xiao-long,Li Yong.Effect of marine collagen peptides on long bone development in growing rats[J].Journal of the Science of Food and Agriculture,2010,90(9):1 485~1 491.
5 杨国燕,陈栋梁,陈龙,等.胶原三肽的抗氧化功能研究[J].食品与机械,2010,26(6):75~78.
6 李勇.生物活性肽研究现况和进展[J].食品与发酵工业,2007,33(1):3~9.
7 冯秀燕,计成.寡肽在蛋白营养中的作用[J].动物营养学报,2001,13(3):8~13.
8 励建荣,封平.功能肽的研究进展[J].食品科学,2004,25(11):415~419.
9 贺光祖,谭碧娥,肖昊,等.肠道小肽吸收利用机制及其营养功能[J].动物营养学报,2015,27(4):1 047~1 054.
10 Wasswa J,Tang Jian,Gu Xiao-hong,et al.Influence of the extent of enzymatic hydrolysis on the functional properties of protein hydrolysate from grass carp(Ctenopharyngodon idella)skin[J].Food Chemistry,2007,104(4):1 698~1 704.
11 郑拯.胶原蛋白肽[J].明胶科学与技术,2009,29(4):195~201.
12 熊燕飞,陈怀新.H2O2用于蛋白水解物脱色的研究[J].江汉大学学报(医学版),2002,30(3):9~11.
13 张翠玉,王彦超,薛长湖,等.大孔树脂对海地瓜多肽脱色工艺的研究[J].食品与发酵工业,2011,37(7):77~80.
14 吕振磊,王雨生,修方珑,等.活性炭对紫贻贝蛋白酶解液脱色效果的影响[J].食品与机械,2012,28(3):32~36.
15 郭玉华,李钰金,吴新颖,等.鳕鱼皮胶原蛋白肽酶解液脱色脱腥工艺的研究[J].中国食品添加剂,2010(4):125~128.
16 王芙蓉,黄文,陈红秀,等.谷氨酸菌体蛋白酸水解及脱色工艺研究[J].食品科学,2005,26(7):155~158.
17 扈瑞平,敖长金,杜玲,等.沙葱多糖活性炭脱色工艺的研究[J].科学技术与工程,2010,34(10):8 380~8 383.
18 Gu Rui-zeng,Li Chen-yue,Liu Wen-ying,et al.Angiotensin I-converting enzyme inhibitory activity of low-molecular-weight peptides from Atlantic salmon(Salmo salar L.)skin[J].Food Research International,2011,44(5):1 536~1 540.
19 张毅,华欲飞,孔祥珍,等.活性炭对大豆多肽脱色效果的研究[J].粮食与饲料工业,2010(8):31~33.
20 Ma Yong-sheng,Wang Lin-tong,Sun Xian-hui,et al.Study on soybean polypeptide refining process[J].Advanced Materials Research,2013,652~654:439~442.
21 Julio C,Rodríguez-Díaz,Louise E K,et al.Optimization of the enzymatic hydrolysis of Blue shark skin[J].Journal of Food Science.2011,76(7):C938~C949.
22 Wasswa J,Tang Jian,Gu Xiao-hong.Functional properties of Grass carp(Ctenopharyngodon idella),Nile perch(Lates niloticus)and Nile tilapia(Oreochromis niloticus)skin hydrolysates[J].International Journal of Food Properties,2008,11(2):339~350.
23 陈瑞峰,陈璐,陈廷登.用活性碳分离纯化苯丙氨酸与酪氨酸的研究[J].浙江工业大学学报,2006,34(4):373~376.
24 赵谋明,任娇艳,崔春,等.大孔吸附树脂静态吸附草鱼蛋白水解物中氨基酸的研究[J].食品与发酵工业,2006,32(4):22~26.
25 王喜波,迟玉杰,孙波.活性炭吸附分离芳香族氨基酸的研究[J].食品与发酵工业,2009,35(1):62~64.
26 程云辉,王璋,许时婴.大孔吸附树脂对麦胚肽的吸附特性研究[J].食品与机械,2005,21(6):7~12.
