二丙酮缩乙二胺合铜的合成及催化性质的研究*
2015-12-31殷杰
殷 杰
(信阳职业技术学院,河南 信阳 464000)
过氧化氢作为一种绿色试剂,可作为氧化剂、漂白剂、消毒剂、脱氧剂、聚合物引发剂和交联剂等,广泛用于化工、纺织、造纸、电子、航天、医药、食品及环境保护等行业[1]。自1950年代以来,过氧化氢被大量应用于纺织染整行业中漂白织物,同时,H2O2是生物体新陈代谢的产物之一,它很容易发生均裂分解,使得过氧键断裂成羟基自由基HO,HO 是一种极具破坏作用的自由基,可氧化与之接触的几乎所有细胞组分,从而引起衰老、癌变及其他疾病。生物体内过氧化氢酶能有效地将H2O2催化分解成H2O 和O2,在防止H2O2积累而造成DNA 损伤及癌变等方面起着重要的作用[2]。目前,如何利用人工合成的化学品模拟过氧化氢酶也就成为人们关注的焦点,而以金属配合物作为模拟酶的研究成为首选[3-5]。
本文以丙酮、乙二胺和铜的无机盐为原料,合成了金属铜的配合物,并考察了该金属配合物催化分解双氧水的反应性能。研究表明,该铜的配合物对于催化分解双氧水反应均表现出良好的催化活性。
1 实验部分
1.1 试剂与仪器
乙二胺、丙酮、氯化铜、高锰酸钾、无水乙醇、30%过氧化氢均为分析纯。德国Elementar Vario EL III型元素分析仪,FT-IR 8700型红外光谱仪(4000-400cm-1,KBr压片),日本岛津公司;HP-1100MSB型质谱仪;三颈瓶;磁力搅拌器;U 形体积计量管等[6]。
1.2 实验方法
1.2.1 配合物的合成
(1)配体的制备
0.3mol丙酮溶于20ml的无水乙醇,将0.1mol乙二胺加入上述溶液常温搅拌半小时后再在70℃水浴加热回流2h。后将反应液80℃水浴下减压蒸馏除去溶剂乙醇和没反应物得到淡黄色液体,收率为71.6%。
(2)配合物的制备
50mmol二丙酮缩乙二胺和50mmol氯化铜分别溶入20ml的95%乙醇,然后将二者混合,加热回流2h,水浴蒸去大部分乙醇,冷却结晶、抽滤再用少量无水乙醇重结晶,得到蓝紫针状晶体,收率为46.8%。
1.2.2 H2O2的催化分解
一部分通过自行设计的带U 形体积计量管的磁力搅拌装置,测定不同时间下配合物催化H2O2分解出的氧气的体积,以此来表明H2O2分解速率的大小。一部分用高锰酸钾标准溶液滴定并计算双氧水分解率。研究在不同H2O2浓度、催化剂用量等条件下,对过氧化氢分解反应的影响,找出其催化规律。
2 结果与讨论
2.1 配合物结构的IR 红外光谱分析
Schiff碱中含有特殊的官能团结构-C=N-C,在N 原子上存有sp2孤对电子,从而使它成为配位能力较强的配体,能与许多过渡金属离子形成稳定的配合物[8]。本文利用IR 光谱进行测定,结果见表1。
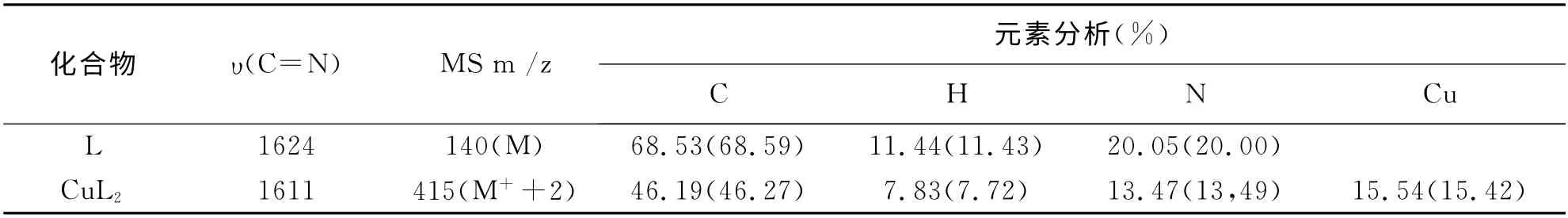
表1 配体及配合物的IR 数据、质谱数据和元素分析
根据表1可知在1624cm-1处出现C=N 官能团的强吸收谱带,证明了Schiff碱的生成。在配合物的IR 谱中,配合物C=N 的吸收谱带与配体的相比红移13个波数,可以证明亚胺中的N 原子和金属离子成键。通过该配合物的质谱数据和元素分析结果可以确定Cu(II)与席夫碱配体属于1:2型配合物,反应式见图1。
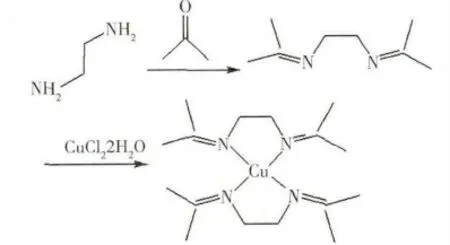
图1 配合物形成反应式
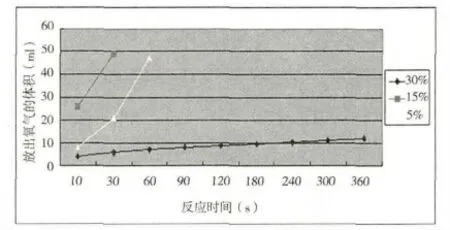
图2 不同过氧化氢浓度下催化反应生成的氧气体积
2.2 过氧化氢浓度对分解速率的影响
取0.03g配合物依次加入到浓度分别为30%、15%、5%的15mL过氧化氢溶液中,测定在20℃时不同时间内反应放出的氧气量,结果见图2。在15ml不同浓度的过氧化氢溶液中依次加入0.2g的配合物,测定在20℃时半小时内反应放出的氧气量,结果见表2。
由图2可知,不同浓度的过氧化氢分解速率不同。30%的过氧化氢分解最慢。在分解初期,15%过氧化氢的分解速率最快,后期实际反应情况也是15%的过氧化氢反应最剧烈。30%的过氧化氢整体分解反应的速率基本都比较平稳,这与过氧化氢浓度过大可能对催化剂有氧化抑制有关。
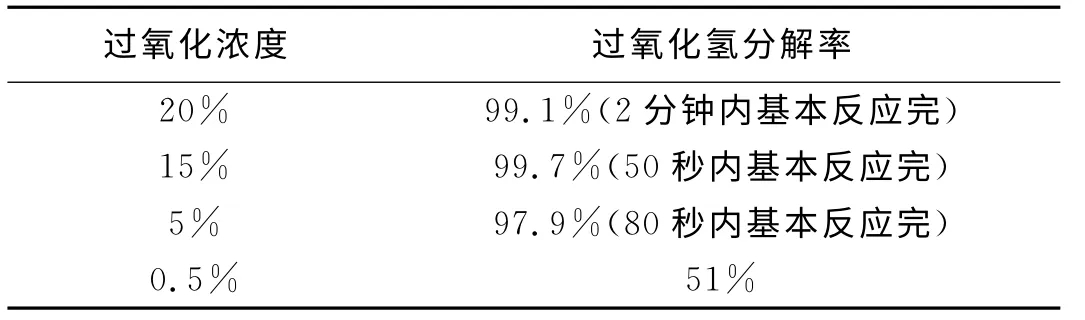
表2 不同过氧化氢浓度下分解率(半小时)
由表2可知,不同浓度的过氧化氢分解率不同。15%的过氧化氢分解最快。从实际反应现象看,浓度大的过氧化氢加入0.2g催化剂后会很快剧烈反应,产生大量的热使得反应体系液体沸腾,过氧化氢很快分解完全,如15%的H2O2反应20秒钟后开始剧烈反应,50秒钟后反应体系基本平静。
2.3 铜配合物用量对分解速率的影响
在15%过氧化氢溶液中,加入不同质量的配合物作催化剂,在20℃下测试过氧化氢分解产生氧气的量,结果见表3。

表3 不同质量的配合物对过氧化氢催化反应生成的氧气体积
15%过氧化氢溶液在不同质量的催化剂催化下放出氧气的体积由表2可知,随着催化剂用量的增加,过氧化氢分解速率逐步提高。0.005g催化剂催化速率最小,0.02g催化剂催化速度最快,说明该催化剂增加用量加大反应速率。
2.4 氯化铜、二丙酮缩乙二胺与铜配合物催化性能的比较
分别取0.2g配合物、氯化铜、乙酰胺作催化剂,加入15%的双氧水20mL,室温(20℃)放置半小时和1d。然后用高锰酸钾标准溶液滴定并计算双氧水分解率。

表4 不同化合物对双氧水分解的催化性能
从表4可知,配体的催化活性很弱,铜金属盐及其配合物都一定的催化活性,二丙酮缩乙二胺合铜的催化活性非常优异,远比其金属盐的催化性能好。
3 结论
通过在配合物用量、过氧化氢的浓度等条件下的实验研究得知:二丙酮缩乙二胺合铜配合物用量的增加,使得过氧化氢分解速率加快。过氧化氢的浓度也影响催化反应速率,适当高浓度会加快起始反应速度。在20ml 15%的过氧化氢中加入0.2g(小于1mmol)的配合物,反应相当剧烈,产生大量热,使得溶液沸腾,过氧化氢分解加快。总之该配合物的催化性能远远高于铜离子本身的催化性能。
[1]孙华林.过氧化氢及其下游产品的开发与应用[J].化工中间体,2003,(11):8-9,16.
[2]邵键,杨宇民.氨基酸葡萄糖-Cu(Ⅱ)配合物清除过氧化氢的研究[J].中国海洋药物,2003,22(5):32-34.
[3]朱伟长.氨基羧酸铁(Ⅲ)配合物催化分解过氧化氢[J].化学研究与应用,2003,15(2):190-192.
[4]李慎新,李建章,谢家庆,等.Schiff碱铜配合物模拟过氧化物酶的研究[J].化学学报,2004,62(6):567-572.
[5]陈勇,张斌,万平,等.金属胶束模拟过氧化氢酶的热动力学研究[J].化学研究与应用,2002,24(3):283-285.
[6]方海林,袁淑军.水杨醛缩牛磺酸合铜配合物催化过氧化氢分解[J].应用化工,2005,34(11):11-13.
[7]刘善斌.新型过渡金属配合物的合成、表征及应用研究[D].青岛:中国海洋大学,2011.
[8]Gaillon L,Bedioui F.First example of exectroassisted biomimetic activation of molecular oxygen by a(salen)Mn epoxidation catalyst in a room-temperature ionic liquid[J].Chem Commun,2001,(16):1458-1459.
