STAT6 蛋白在实验性结肠炎大鼠中的表达及其对细胞因子IFN-γ 和IL-4 的影响
2015-12-31肖明明
杨 立,肖明明
辽宁省人民医院消化内一科,辽宁 沈阳110016
溃疡性结肠炎(ulcerative colitis,UC)是一种原因不明的、以结肠黏膜慢性炎症和溃疡形成为病理特点的慢性非特异性炎症性肠道疾病。其确切的发病原因和机制尚不完全清楚。目前多认为与感染、环境、遗传及免疫反应相关[1]。近年来炎症性肠病发病机制的研究主要集中在免疫方面。益生菌有调节肠道菌群失调、机体局部和系统免疫及增强肠道屏障功能的作用[2],其对炎症性肠病的免疫异常调节也已日益引起人们的重视。STA 蛋白异常表达与许多免疫异常疾病的发生密切相关,其中信号转导和转录活化因子6(TAT6)是T 细胞发育、分化及Th1/Th2 平衡关键调节因子[3]。鉴于磷酸化在STAT6 的活化表达过程中的重要作用[4-5],本文选择磷酸化的STAT6(pSTAT6)和非磷酸化的STAT6 蛋白,采用TNBS/乙醇法建立大鼠实验性结肠炎模型,探讨实验性结肠炎大鼠结肠组织中磷酸化和非磷酸化STAT6 蛋白的表达与细胞因子IFN-γ 和IL-4 的关系,及益生菌VSL#3 对pSTAT6 和STAT6 表达的影响。
1 材料与方法
1.1 主要试剂和设备 2、4、6 -三硝基苯磺酸(TNBS)购自Sigma 公司,浓度5%(w/v),批号107k5008。VSL#3 购自美国Ferring Pharmaceuticals 公司。其总菌含量为450 ×109CFU/袋(2.5 g)。生物素化驴抗山羊IgG,辣根酶标记链酶亲合素,上海碧云天生物技术有限公司;苏木精和山羊血清购自北京Solarbio 科技有限公司。STAT6p35 抗体购自美国Santa Cruz 生物技术有限公司。
QH01-9030A 电热恒温鼓风干燥箱,上海精宏实验设备厂。CM69001-30 ℃恒冷低温切片机,北京Cleica 公司。DH36001B 电热恒温培养箱,天津泰斯特公司。BX51 体式显微镜,日本Olympus 公司。NW10LVF 超纯水系统,香港Heal Force 公司。
1.2 实验对象、造模及实验分组
1.2.1 实验大鼠:8 周左右SD 雄性大鼠30 只,SPF级,购自辽宁长生生物技术有限公司,许可证号:SCXK(辽)2010-0001。体质量180 ~220 g。所有大鼠实验前适应环境1 周。
1.2.2 模型建立:建立TNBS 结肠炎模型[6]。30 只大鼠随机分为5 组,每组6 只。分别为对照组(C 组)、TNBS 模型组(D1 组)、美沙拉嗪组(D2 组)、VSL#3 组(D3 组)、联合治疗(VSL#3 +美沙拉嗪)组(D4 组)。造模前大鼠禁食24 h 排空大便,乙醚麻醉后进行TNBS 造模。将25 mg TNBS 溶解于0.25 ml 的50%乙醇后,用直径2 mm 的无菌聚乙烯管插入大肠内约8 cm处灌肠,保持肛门高位30 s。待清醒后正常喂养。造模完成后第2 天各组开始灌胃治疗。VSL#3 组每只大鼠灌胃0.25 ml/d VSL#3 溶液,含120 mg VSL#3 粉剂;美沙拉嗪组每只大鼠灌胃0.25 ml/d 溶液,含美沙拉嗪80 mg;联合治疗组每只大鼠灌胃0.25 ml/d VSL#3 溶液和0.25 ml/d 美莎拉嗪溶液。模型组造模完成后仅给予0.9%生理盐水灌胃,对照组用50%乙醇溶液灌肠后,等体积(0.25 ml)生理盐水灌胃。连续7 d。实验过程中无大鼠死亡。
1.2.3 标本制备:实验大鼠第8 天水合氯醛腹腔内注射麻醉后处死,观察各组大鼠大肠的大体改变。用预冷生理盐水将大肠洗净,于结肠末端距离肛门1 cm 处剪取0.5 cm 结肠,用0.4%多聚甲醛浸泡、石蜡包埋、切片、HE 染色做病理学分析。其余标本,-70 ℃冰箱保存备用。
1.3 结肠炎表现和病理学观察 参照Hamamoto 等标准[7]计算疾病活动指数(DAI)评分。结肠组织切片常规HE 染色,参照Dieleman 等[8]的方法,在光学显微镜下依据炎症程度、病变深度、隐窝破坏情况、病变范围,进行结肠炎病理学(组织学损伤)评分。
1.4 大鼠结肠肠组织中STAT6、pSTAT6、IFN-γ、IL-4 蛋白表达 采用Western blotting 法完成。主要操作参照试剂盒蛋白提取说明进行,提取结肠黏膜总蛋白,SDSPAGE 蛋白质电泳,采用半干式电转,然后进行Western 杂交。一抗:STAT6,1∶100 稀释;二抗:羊抗兔IgG-HRP,1∶5 000 稀释;一抗:IL-4:1∶1 000 稀释;二抗:羊抗兔IgG-HRP 1 ∶5 000 稀释;一抗IFN-γ 1∶100稀释;二抗:驴抗山羊IgG-HRP 1∶5 000 稀释。内参抗体Mouse anti β-actin-HRP 1 ∶10 000 稀释。GELPRO 凝胶成像系统成像,分析目的条带的灰度值。
1.5 统计学分析 采用SPSS 16.0 统计软件进行分析,实验数据以±s 表示,进行t 检验和方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 肠组织损伤大体形态及组织学观察 对照组大肠腺体规则,可见大量胞质富含黏液的杯状细胞,黏膜固有层、黏膜下层未见炎性细胞浸润。模型组肠组织可见肠壁坏死、变薄,肠黏膜可见溃疡,炎症程度较重,可见肠黏膜和黏膜下组织大量中性粒细胞、淋巴细胞、浆细胞及嗜酸性粒细胞浸润,杯状细胞胞质黏液分泌减少,肠黏膜隐窝变形,隐窝脓肿形成,黏膜下组织充血、水肿,伴急性小血管炎症、出血和纤维素样坏死。与模型组相比,VSL#3 组、美沙拉嗪组和联合治疗组可见不同程度的炎症消散,表现为炎性细胞浸润减少、隐窝变形恢复和杯状细胞胞质黏液增多,溃疡缩小修复。
2.2 大鼠结肠组织中非磷酸化STAT6 的表达Western blotting 方法检测各组大鼠结肠组织的非磷酸化STAT6 表达(见图1)。与对照组(STAT6/β-actin:0.26 ±0.02)比较,模型组STAT6 表达(STAT6/β-actin:0.66 ±0.06)明显增加,差异有显著统计学意义(P <0.01);与模型组比较,美沙拉嗪组(STAT6/β-actin:0.58 ±0.03)、益生菌组(STAT6/β-actin:0.62 ±0.04)和联合治疗组(STAT6/β-actin:0.47 ±0.07)表达下调,其中联合治疗组与模型组比较,差异有统计学意义(P <0.05),但表达量在模型组、美沙拉嗪组、益生菌组间比较,差异无统计学意义(P >0.05)。
2.3 大鼠结肠组织中pSTAT6 蛋白表达 Western blotting 方法检测各组大鼠结肠组织的pSTAT6 表达。以β-actin 为内参,对照组大鼠结肠组织pSTAT6 处于较低水平表达(STAT6/β-actin:0.29 ±0.02);模型组大鼠结肠组织pSTAT6 表达较对照组增多(pSTAT6/βaction:1.49 ±0.08,P <0.01);美沙拉嗪组(pSTAT6/β-action:0.58 ±0.07)pSTAT6 表达与模型组比较,差异有统计学意义(P <0.01);VSL#3 组大鼠结肠组织pSTAT6 表达(pSTAT6/β-action:0.88 ±0.050)与模型组比较明显减少(P <0.05);联合治疗组大鼠结肠组织pSTAT6 表达(pSTAT6/β-action:0.34 ±0.02)与模型组相比明显减少(P <0.01,见图2)。

图1 大鼠结肠组织中STAT6 表达 C:对照组;D1:模型组;D2:美沙拉嗪组;D3:VSL#3 组;D4:联合治疗组Fig 1 Expression of STAT6 in colonic tissue of rats C:control group;D1:model group;D3:probiotics VSL#3 treatment group;D2:Mesalazine treatment group;D4:combined treatment(probiotics VSL#3 plus Mesalazine)group

图2 大鼠结肠组织pSTAT6 蛋白的表达 C:对照组;D1:模型组;D2:美沙拉嗪组;D3:VSL#3 组;D:联合治疗组Fig 2 Expression of pSTAT6 protein in colonic tissue of rats C:control group;D1:TNBS model group;D3:probiotics VSL#3 treatment group;D2:Mesalazine treatment group;D4:combined treatment (probiotics VSL#3 plus Mesalazine)group
2.4 实验性结肠炎大鼠肠组织细胞因子IFN-γ 和IL-4 表达 结肠炎大鼠肠组织中IL-4、IFN-γ 表达(见图3 ~4),其IOD 值见图5。
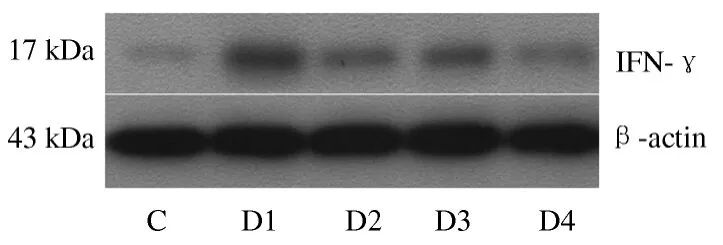
图3 大鼠结肠组织IFN-γ 蛋白的表达 C:对照组;D1:模型组;D2:美沙拉嗪组;D3:VSL#3 组;D:联合治疗组Fig 3 Expression of IFN-γ protein in colonic tissue of rats C:control group;D1:model group;D3:probiotics VSL#3 treatment group;D2:Mesalazine treatment group;D4:combined treatment (probiotics VSL#3 plus Mesalazine)group

图4 大鼠结肠组织IL-4 蛋白的表达 C:对照组;D1:模型组;D2:美沙拉嗪组;D3:VSL#3 组;D:联合治疗组Fig 4 Expression of IL-4 protein in colonic tissue of rats C:control group;D1:model group;D3:probiotics VSL#3 treatment group;D2:Mesalazine treatment group;D4:combined treatment(probiotics VSL#3 plus Mesalazine)group
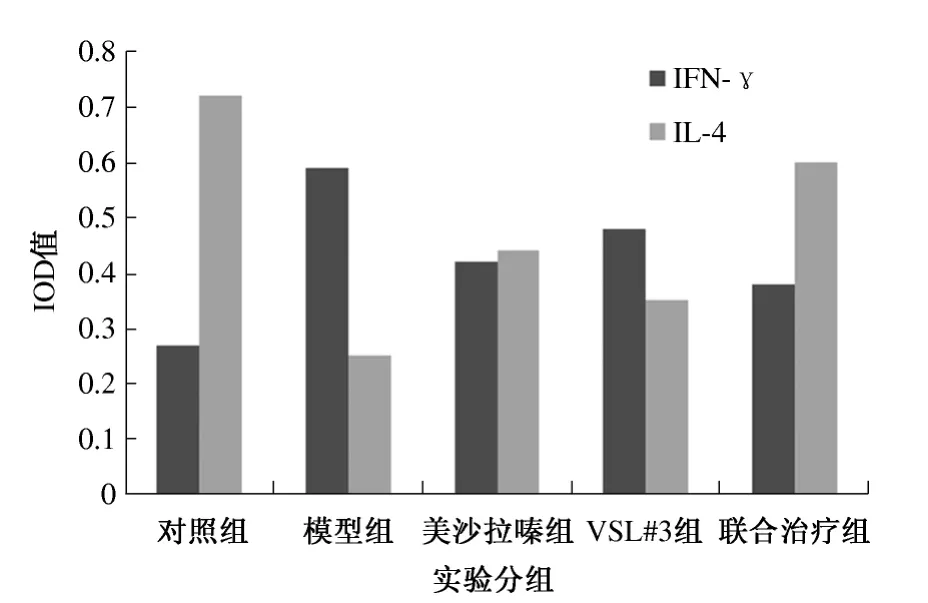
图5 大鼠结肠组织中IFN-γ 和IL-4 蛋白IOD 值比较Fig 5 Comparison of the IOD of IFN-γ and IL-4 proteins in colonic tissues of rats
2.5 实验性结肠炎大鼠肠组织STAT6 表达与细胞因子IFN-γ 和IL-4 的关系 结肠炎大鼠肠组织STAT6 和pSTAT6 IOD 值与IFN-γ 呈正相关,R 值分别为0.9271(P =0. 0234)、0. 9444(P =0. 0156)。而STAT6 和pSTAT6 IOD 值与IL-4 呈负相关,R 值分别为-0.9552(P=0.0113)、-0.9173(P=0.0282)。
3 讨论
目前,在导致UC 发病的因素中,免疫因素在UC的发病机制中作用最为肯定,而Th1 和Th2 亚群的平衡失调可能是炎症性肠病发病免疫机制之一,并通过不同的STAT 信号通路执行促炎与抗炎反应功能。在STAT 家族中,STAT6 是T 细胞发育、分化及Th1/Th2 平衡的关键性调节因子[3],在维持Th1/Th2的平衡中有重要作用[9-10]。在UC 中它通过蛋白酪氨酸激酶/信号转导和转录激活因子(JAK/STAT)信号转导途径介导Th2 细胞因子IL-4 及IL-13 诱导基因表达。在IL-4 或IL-13 的刺激下,通过Jak 激酶的作用,使胞质中处于失活状态即非磷酸化的STAT6 蛋白被激活(磷酸化),形成二聚体,进入细胞核内,启动下游特定基因的转录,产生相应的生物学效应。已有多项研究证实,STAT6 扮演的重要炎症免疫调节角色,通过自身在淋巴细胞中的活性,控制Th2 细胞的产生,并通过活化固有细胞从而控制Th2 细胞的转运[11]。庞艳华等[12]采用电泳迁移率检测法(EMSA 法)检测到UC 患者STAT6 的DNA 结合活性高于对照组,且随炎症程度加重而逐渐增强。证实STAT6 被活化进入核内并与DNA 结合,参与了UC的发病过程。范恒[3]、张夏毅等[13]的研究中也报道了UC 大鼠结肠组织中的STAT6 的表达在对照组中较少,在模型组中显著上调。
本实验中观察到,对照组大鼠结肠黏膜上皮完整,腺体排列整齐,黏膜下血管纹理清晰;而模型组大鼠结肠黏膜缺乏完整,出现糜烂、溃疡、充血明显、水肿产生,甚至出血、腺体中杯状细胞减少、有大量炎细胞浸润及局部小血管炎、部分结肠黏膜坏死脱落,表明结肠炎大鼠肠道局部存在炎症反应和组织损伤。
本实验结果显示,实验性结肠炎大鼠模型组pSTAT6 和STAT6 蛋白表达明显高于对照组,且大鼠结肠组织病理形态学变化中,模型组黏膜组织显示溃疡及淋巴细胞、单核细胞浸润并达固有层以下,提示在造模后,大肠黏膜组织发生了免疫反应,STAT6 及其转导途径可能经激活而参与了免疫系统的过表达,使得免疫细胞浸润,肠道炎症反应发生。与模型组比较,VSL#3 组、美沙拉嗪组及联合治疗组STAT6 和pSTAT6 蛋白表达水平发生一定程度的下调,且结肠病理可见黏膜病变有不同程度的减轻及恢复,提示在应用益生菌VSL#3 对症治疗后,免疫表达得到不同程度的控制。这一实验结果与张夏毅[13]、庞艳华[14]、Zhu[15]等报道结果一致。
根据细胞因子分泌及效应功能的不同,T 细胞分为Th1 型和Th2 型两类。UC 发病的重要基础是Th1/Th2 细胞比例和功能失衡,表现为Th1 细胞数目增多及功能亢进。IFN-γ 和IL-4 分别是Th1 和Th2 免疫反应的代表性细胞因子,体现着Th1 和Th2 细胞的主要生物学效应。
IL-4 主要由激活的淋巴细胞合成,具有多种生物学功能,最令人关注的是其抑制炎症的特性,对淋巴细胞和巨噬细胞发挥免疫调节作用。IL-4 是促进Th0 细胞发育分化为Th2 细胞的最主要因素。而IFN-γ 主要诱导Th1 应答,抑制IL-4 介导的Th2 反应[16]。IFN-γ对Th2 具有抑制作用。可抑制B 细胞内的IL-4 诱导合成及B 淋巴细胞增殖。IFN-γ 的增加必然伴随着Th2 细胞因子IL-4 的减少。文献[17-20]研究中分别指出UC 患者结肠黏膜IL-4 表达明显降低。许多体外细胞培养实验发现UC 患者的IL-4 分泌细胞数下降,IL-4 mRNA 表达及蛋白分泌明显减少。随着IL-4 水平的逐渐降低,其抑制炎症反应的作用减弱,导致体内自身的免疫稳态遭到破坏,从而促使疾病的发展。
本实验提示,与对照组相比,模型组大鼠结肠组织中Th2 类细胞因子IL-4 水平显著降低,而IFN-γ 水平明显增高;与模型组比较,益生菌组、美沙拉嗪组、联合治疗组大鼠结肠组织中IL-4 的表达明显上升,而IFN-γ 水平显著降低。本实验还显示磷酸化的STAT6 蛋白在各实验分组中IOD 值与IFN-γ IOD 值呈正相关,与此相反,与IL-4 呈负相关。也有研究证实,STAT6 敲除的小鼠则不会发生大肠炎[21]。基于他人的研究结论并结合本实验结果,有理由推测:和美沙拉嗪一样,益生菌VSL#3 可能通过下调STAT6 的表达,诱导结肠炎大鼠Th2 型细胞因子IL-4 的产生,减少Th1 型细胞因子IFN-γ 增殖并下调Th1 反应,从而改变Th1/Th2 的比值,使Th1/Th2 趋于平衡,抑制炎症发展,达到缓解和治疗TNBS 诱导的大鼠结肠炎的目的。而益生菌VSL-3 可能通过介导STAT6 达到治疗实验性结肠炎的目的。这可能是益生菌治疗UC 的作用机制之一。
[1] Podolsky DK. Inflammatory bowel disease[J]. N Engl J Med,2002,347(6):417-429.
[2] Sartor RB. Mechanisms of disease:pathogenesis of Crohn’s disease and ulcerative colitis[J]. Nat Clin Pract Gastroenterol Hepatol,2006,3(7):390-407.
[3] Fan H,Liang L,Tang Q,et al. Effects of Wumeiwan on the expression of STAT6 in rats with ulcerative colitis[J]. Research of Integrated Traditional Chinese and Western Medicine,2011,2011,3 (3):127-131.范恒,梁丽,唐庆,等. 乌梅丸对溃疡性结肠大鼠STAT6 表达的影响[J].中西医结合研究,2011,3(3):127-131.
[4] MacDonald TT,Monteleone G,Pender SL. Recent developments in the immunology of inflammatory bowel disease[J]. Scand J Immunol,2000,51(1):2-9.
[5] Christodoulopoulos P,Cameron L,Nakamura Y,et al. T(H)2 cytokine-associated transcriptionfactors in atopic and nonatopic asthma:Evidence for differential signal transducer and activator of transcription 6 expression[J]. J Allergy Clin Immunol,2001,107 (4):586-591.
[6] Morris GP,Beck PL,Herridge MS,et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon[J]. Gastroenterology,1989,96 (3):795-803.
[7] Hamamoto N,Maemura K,Hiram I,et al. Inhibition of dextran sulphate sodium(DSS)induced colitisin mice by intracolonically administered antibodies against adhesion molecules(endothelialleucocyte adhesionmolecule-I (ELAM-1 ) or intercellular adhesion molecule-1(ICAM-1))[J]. Clin Exp lmmunol,1999,117(3):462-468.
[8] Dieleman LA,Palmen MJ,Akol H,et al. Chronic experimental colitis induced by dextran sulphate sodium(DSS)is characterized by Th1 and Th2 cytokines[J]. Clin Exp Immunol,1998,114(3):385-391.
[9] Wang Y,Malabarba MG,Nagy ZS,et al.Interleukin 4 regulates phosphorylation of serine 756 in the transactivation domain of Star 6. Roles for multiple phosphorylation sites and Star 6 function [J]. J Biol Chem,2004,279(24):25196-25203.
[10] Zhang WJ,Kohun WA,Thompson JL,et al. Human B lyrephoblastcell lines defective of Stat6 signaling produce high levels of proinflammatory cytokines IL-12,TNFalpha and IFNgamma[J]. Int J Oncol,2004,24(2):447-453.
[11] Mathew A,MacLean JA,De Haan E,et al. Signal transducerand activator of transcription 6 controls chemokine production and T-helper cell type 2 cells trafficking in allergic pulmonary inflammation[J]. J Exp Med,2001,193(9):1087-1096.
[12] Pang YH,Zheng CQ,Ning B,et al. The expression of signal transducer and activator of transcription 6[J]. World Chinese Journal of Digestology,2004,12(10):2484-2486.庞艳华,郑长青,宁斌,等. 信号转导和转录激活因子6 在溃疡性结肠炎中的表达[J]. 世界华人消化杂志,2004,12(10):2484-2486.
[13] Zhang XY,Shen L,Fan H,et al. Expression of STAT6 mRNA and NF-κB in rats with experimental ulcerative colitis[J]. Int J Dig Dis,2010,30(5):311-314.张夏毅,沈霖,范恒,等. STAT6 mRNA 与NF-κB 在实验性结肠炎大鼠中表达[J]. 国际消化病杂志,2010,30(5):311-314.
[14] Pang YH,Hao JY,Zhang WJ,et al. The role of the activation and expression of signal transducer and activator of transcription 6 in patients with ulcerative colitis [J]. Chin J Dig,2007,27 (10):679-681.庞艳华,郝建宇,张文杰,等. 溃疡性结肠炎中信号转导和转录活化因子6 的活化表达及作用[J]. 中华消化杂志,2007,27(10):679-681.
[15] Zhu R,Fan H,Shen L,et al. Expression of STAT-6 and NF-κB p65 in the colon mucosa of patients with ulcerative colitis[J]. Front Med China,2009,3(4):475-479.
[16] Jin BQ. Cellular and molecular immunology[M]. 2nd ed. Beijing:Science Press,2001:399.金伯泉. 细胞和分子免疫学[M]. 2 版. 北京:科学出版社,2001:399.
[17] Zhao XJ,Wang ZH,Han Y. Expression and role of IL-4,IFN-γ,TNF-α in colonic mucosa of ulcerative colitis patients[J]. Chin J Mis Diagn,2008,8(13):3029-3031.赵晓军,王志红,韩英. 白细胞介素4、干扰素γ、肿瘤坏死因子α在溃疡性结肠炎患者结肠黏膜中的表达及意义[J]. 中国误诊学杂志,2008,8(13):3029-3031.
[18] Pang YH,Zheng CQ,Wang YC,et al. Expression of interleukin-4 and interleukin-13 in ulcerative colitis [J]. Chin J Gastro Hepa,2005,14(4):410-412.庞艳华,郑长青,王轶淳,等. IL-4 和IL-13 在溃疡性结肠炎中的表达[J]. 胃肠病学和肝病学杂志,2005,14(4):410-412.
[19] Rogy MA,Beinhauer BG,Reinisch W,et al. Transfer of interleukin-4 and interleukin-10 in patients with severe inflammatory bowel disease of the rectum [J]. Hum Gene Ther,2000,11 (12):1731-1741.
[20] Liang XJ,Ma ZL,Zeng YJ. The clinical significance of interleukin 4 &interleukin17’s blood plasma level in patients with ulcerative colitis[J].Youjiang Medical Journal,2005,33(1):6-8.梁雄均,马泽粦,曾雅静. 白介素4 和17 在溃疡性结肠炎发生发展中的作用[J]. 右江医学,2005,33(1):6-8.
[21] Chen CC,Louie S,McCormick B,et al. Concurrent infection with an intestinal helminth parasite impairs host resistance to enteric citrobacter rodentium and enhances citrobacter-induced colitis in mice[J].Infect Immun,2005,73(9):5468-5481.
