XAF1 转录变异体在胃肠道肿瘤细胞株中的表达及意义
2015-12-31周永柏张亚历王继德
周永柏,张亚历,王继德,杨 兵
1.深圳市龙岗中心医院消化科,广东 深圳518116;2.南方医科大学附属南方医院消化系病研究所
消化道肿瘤是我国最常见的恶性肿瘤,严重危害人民的生命健康。癌基因及抑癌基因在癌症发生、发展中起重要作用,X 染色体相关凋亡抑制蛋白相关因子1(X-linked inhibitor of apoptosis-associated factor 1,XAF1)是XIAP 相关因子,能与XIAP 直接结合拮抗其抑制caspase 活性而起抗凋亡作用[1-2],XAF1 在肿瘤凋亡、抑制肿瘤血管生成、促进细胞分化等方面有及其重要作用,已被认定为抑癌基因[3-5]。目前发现XAF1的mRNA 有多种转录变异体[6]:其中XAF1A、XAF1B、XAF1C、XAF1D、XAF1E 分别编码不同的蛋白(见图1),由于不同转录变异体所包含的结构不同,可能在肿瘤中起相反的作用[7],目前XAF1B、XAF1C 在肿瘤细胞中的表达及其相应的蛋白的作用尚不清楚。有报道提示干扰素可诱导XAF1A 的表达[8],但对其他转录变异体等影响尚不清楚,我们应用逆转录聚合酶链反应(RT-PCR)技术检测18 种肿瘤细胞及正常转化细胞中XAF1 3 种转录变异体的表达情况,并用干扰素诱导肿瘤细胞,观察3 种转录变异体的变化;初步探讨XAF1 不同转录变异体在肿瘤中的可能作用。
1 材料与方法
1. 1 材料 ECA109、ESO、AGS、BCG823、MKN45、KATOⅢ、MGC803、GES-1、LOVO、COLO205、HCT116、HCT-8、SW1116、SW620、SW480、DLD1、HEK293、ECV304 细 胞 为 本 实 验 室 保 存,ECA109、AGS、BCG823、MKN45、KATOⅢ、MGC803、LOVO、COLO205、HCT-8、SW1116、SW620、SW480、HEK293、ECV304 用含10%的新生牛血清(GIBICO)的RPMI-1640(GIBICO)培养基培养,HCT116、DLD1、ESO、GES-1 用含15%的胎牛血清(GIBICO)的DMEM/F12(GIBICO)培养基培养,培养基中加入100 U/ml 的青链霉素(杭州吉诺),在37 ℃5% CO2的培养箱中传代培养,胰蛋白酶购自GIBICO。人重组IFN-α 购自安徽安科生物公司,TRlzol 试剂盒和Taq 酶premix 购自Takara 公司,第一链cDNA 合成试剂盒购自Fermatas 公司,引物由Invitrogin 公司合成引物序列(见表1)。

表1 XAF1 不同转录变异体引物序列及相应的位置、产物长度Tab 1 Different transcript variants of XAF1,primer sequences,the corresponding location and product length
1.2 方法
1.2.1 RT-PCR:取对数生长期细胞,胰酶消化,PBS洗涤离心2 次后加TRI REAGENT 1 ml,按操作说明进行总RNA 提取;电泳鉴定RNA 的完整性,紫外分光光读计测定RNA 的浓度,取3 μg 总RNA 进行逆转录(总20 μl 体系);取2 μl 逆转录产物进行PCR 反应,反应体系为25 μl,PCR 反应条件为:94 ℃5 min,94 ℃30 s,60 ℃45 s,72 ℃1 min,35 循环(内参β-actin 为25 循环)。72 ℃延伸8 min,引物序列见表1,2%的胶凝胶电泳成像。同时取2 例正常人外周血3 ml,提取外周血淋巴细胞RNA 及20 例正常人胃黏膜组织提取RNA 进行RT-PCR 作为对照。
1.2.2 Western blotting:取对数生长期细胞5×106,4 ℃预冷PBS 洗涤2 次,加RIPA 强效裂解液500 μl 及1%的PMSF 裂解细胞(组织100 mg 加1 ml RIPA 强效裂解液及1%的PMSF 冰上匀浆),冰上放置30 min,4 ℃12 000 r/min 离心15 min,取上清,BCA 法测定蛋白浓度。50 μg/孔总蛋白上样进行SDS-PAGE 电泳,转至PVDF 膜上。5% 脱脂奶粉室温封闭膜2 h,羊抗人XAF1 一抗(1∶300)4 ℃过夜浮育,TBS-T 洗膜3×10 min,兔抗羊二抗(1∶4 000)室温浮育2 h,TBS-T 洗膜3 ×10 min,ECL 发光显影。
1.2.3 药物干预:取对数生长期的MGC803 细胞,胰酶消化,PBS 洗涤离心后计数,以每孔104个细胞的密度种入6 孔板,待细胞贴壁生长良好,60% ~70%瓶底时分别加入人重组IFN-α(1 000 u/ml),24 h 后用4 ℃预冷的pbs 洗涤细胞3 次,加TRI REAGENT 提取总RNA,RT-PCR 检测3 个不同转录变异体的变化。每次实验重复3 次。
1.3 统计学方法 应用SPSS 13.0 统计软件进行分析,RT-PCR 结果采用χ2检验,P <0.05 为差异有统计学意义。
2 结果
RT-PCR 结果显示在人胃肠道肿瘤肿瘤细胞株(ECA109、AGS、BCG823、MKN45、KATO Ⅲ、MGC803、LOVO、COLO205、HCT116、HCT-8、SW1116、SW620、SW480、DLD1)和 人 正 常 转 化 细 胞(ESO、GES-1、HEK293、ECV304)中,XAF1 3 个剪切变异体阳性率分别为66.7%(12/18)、61.1%(11/18)、27.8%(5/18),在2例正常成年男子的外周淋巴细胞中(N1、N2)及正常胃黏膜组织中XAF1A、XAF1B 均100% 表达,而XAF1C 均不表达,差异具有统计学意义(P <0.05),并且在肿瘤细胞中多为低表达,在2 株半悬浮细胞株(COLO205 和KATOⅢ)中,XAF1 3 个剪切变异体均高表达(见图2 ~3)。Western blotting 结果显示,XAF1A 蛋白为分子量为34 kD,其在肿瘤细胞中的水平与mRNA 表达水平相一致,在COLO205 中高表达(见图4)。干扰素α 诱导MGC803 细胞24 h 后,XAF1A、XAF1B 和XAF1C3 转录变异体的表达均上调(见图5)。
3 讨论
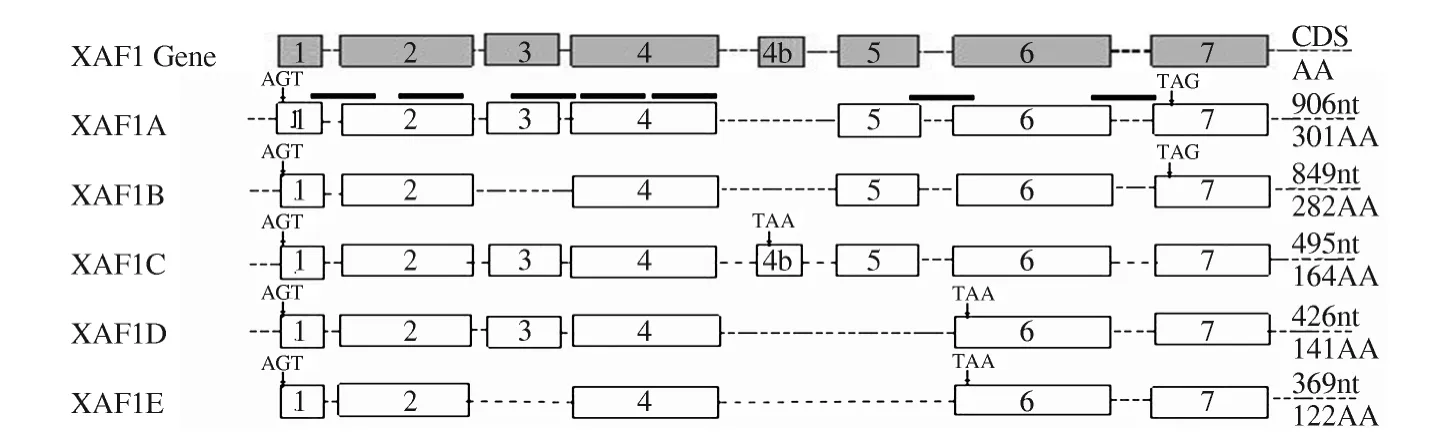
图1 XAF1 基因及已鉴定的5 种转录变异体的结构示意图Fig 1 Structure of XAF1 gene and its five identified splice variants
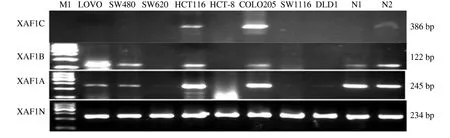
图2 XAF1 3 个不同剪切变异体在人大肠肿瘤细胞株和正常人外周血淋巴细胞中的表达Fig 2 Expressions of the 3 splice variants of XAF1 in colorectal cancer cell lines and peripheral blood lympholeukocyte from health adults

图3 XAF1 3 个不同剪切变异体在人食管、胃肿瘤细胞株和人正常转化细胞中的表达Fig 3 Expression of the 3 splice variants of XAF1 in esophageal,gastric cancer cell lines and normal transformants
细胞凋亡抑制可以促进肿瘤的进展、免疫逃逸及对化疗、放疗的抵抗。近年来,越来越多的凋亡调控基因被发现和阐明,XAF1 由Liston 等[1]首先从酵母双杂交系统中鉴定到的X 染色体相关凋亡抑制蛋白(Xlinked inhibitors of apoptosis protein,XIAP)相关因子。原位荧光杂交分析XAF1 基因位于17p13.2 位点,位于肿瘤抑制基因P53(位于17p13.1 位点)远端3 cm处[2]。XAF1 基因包括8 个外显子,长20. 23 kb。XAF1 mRNA 经软件预测有24 种转录变异体(NCBI网站),其中19 种mRNA 编码完整的蛋白,部分蛋白包含锌指结构和肿瘤坏死因子-α 受体相关因子6 类型(TRAF-type)结构域。目前在人类细胞或组织中检测出 的 转 录 变 异 体 有5 种[6,9]:XAF1A、XAF1B、XAF1C、XAF1D 和 XAF1E,分 别 有906nt、849nt、495nt、426nt 和369nt 的开放阅读框架。XAF1A 及通常说的XAF1,具有7 个锌指结构(见图1),其N-端的5 个锌指结构与FLN 29 及TRAF6 的锌指结构分别有41%和22%的同源性[2]。XAF1A 蛋白C 端的6 个锌指结构在促凋亡中起作用,N 端的一个锌指结构(ZFTRAF)在蛋白的相互作用中起作用[2]。XAF1B 与XAF1A 相比缺失外显子3(57nt),编码的蛋白比XAF1A 少19AA;XAF1C 比XAF1A 在4 和5 外显子之间多一个4 b 外显子(152nt),但由于开放阅读框架内含中止子,而只能编码含164 个氨基酸的蛋白,其C-端含有不同于XAF1A 的24 个氨基酸,N-端的锌指样结构和XAF1 蛋白N-端的锌指样结构(ZF-TRAF)相同。XAF1D 和XAF1E 分别编码141 和122 个氨基酸的蛋白,具体结构(见图1)。实验表明[8]外源性的ZF-TRAF 单独表达能剂量依赖降低内源性XAF1 的促凋亡作用,而外源性缺失ZF-TRAF 部分的XAF1 对干扰素诱导细胞凋亡无影响,Fang 等[7]的研究显示,在前列腺癌中用去甲基化试剂5-aza-DC 处理后XAF1B转变成全长的XAF1A。这说明不同的转录变异体编码的蛋白,由于所含结构域不同,在细胞中可能起着不同或相反的作用。Chung 等[9]研究显示,利用体外构建XAF1 表达载体转染结肠癌细胞HCT116,XAF1 的5 种转录变异体均编码蛋白,并在细胞的凋亡中均起着促进细胞凋亡的作用。具体XAF1 不同表达转录变异体在肿瘤中所起的作用有待进一步研究。
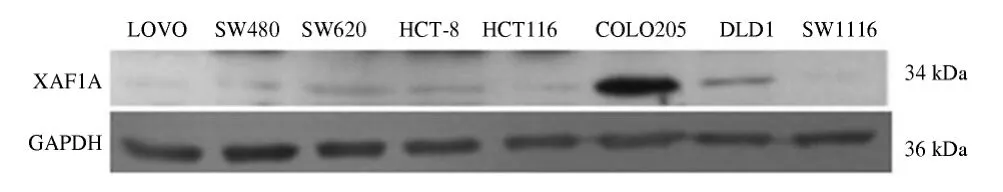
图4 XAF1 A 蛋白在人大肠肿瘤细胞株的表达Fig 4 Expression of XAF1A protein in colorectal cancer cell lines

图5 MGC803 细胞中干扰素α 诱导XAF1 表达Fig 5 Expression of XAF1 in MGC803 cell line induced by IFN-α
本研究中,我们设计3 对分别针对转录变异体1、2 和3 的特异性引物,来检测他们在胃肠道肿瘤中的表达情况。本研究结果发现,XAF1 不同转录变异体在消化道肿瘤细胞株及正常转化的永生化细胞中与正常人外周血白细胞中存在差异表达,消化道肿瘤细胞及正常转化细胞中XAF1 转录变异体1 和2 多不表达或低表达,同时我们作了免疫印迹分析,提示XAF1 mRNA 高表达的细胞株其蛋白也高表达,与以往对XAF1A 的研究结果相似。XAF1 转录变异体3 在正常人外周血白细胞及正常胃黏膜组织中未检出,但在高表达XAF1A 的3 株消化道肿瘤细胞及1 株正常转化细胞中检出,在正常胃黏膜及外周血淋巴细胞中不表达XAF1C,而在部分永生细胞中高表达XAF1A、XAF1B,同时高表达XAF1C,提示XAF1C 与XAF1A、XAF1B 在细胞凋亡上可能起相互拮抗作用。
在研究的细胞系中,SW480 及SW620 来源于同一个51 岁白种男性直肠腺癌患者的直肠原发灶及1 年后的淋巴结转移灶,XAF1A、XAF1B 在原发灶肿瘤细胞株中表达,而在转移灶中不表达,提示XAF1A、XAF1B 与肿瘤的转移呈负相关。在本研究中,其中在细胞株COLO205(来源于结肠癌腹水转移灶)及KATOⅢ(来源于胃癌胸水转移灶)中均高表达XAF1 转录变异体3,提示XAF1C 的高表达可能与肿瘤细胞的转移有关。
干扰素有增强免疫力、抑制肿瘤血管生成、促进凋亡等作用被广泛应用于肿瘤治疗[10],近来的一项研究显示XAF1 启动子ATG 上游的-55 ~-66 bp 含ISRE结合元件(ISRE-XAF1)参与了干扰素诱导的XAF1的表达[11]。本研究提示和XAF1A 一样,XAF1B、XAF1C 也可被干扰素诱导,提示干扰素诱导XAF1 表达在转录前,与上述研究结果相符合。
[1] Liston P,Fong WG,Kelly NL,et al. Identification of XAF1 as an antagonist of XIAP anti-Caspase activity[J]. Nat Cell Biol,2001,3(2):128-133.
[2] Fong WG,Liston P,Rajcan-Separovic E,et al. Expression and genetic analysis of XIAP-associated factor 1 (XAF1)in cancer cell lines[J]. Genomics,2000,70(1):113-122.
[3] Zhu LM,Shi DM,Dai Q,et al. Tumor suppressor XAF1 induces apoptosis,inhibits angiogenesis and inhibits tumor growth in hepatocellular carcinoma[J]. Oncotarget,2014,5(14):5403-5415.
[4] Yang WT,Chen DL,Zhang FQ,et al. Experimental study on inhibition effects of the XAF1 gene against lung cancer cell proliferation[J].Asian Pac J Cancer Prev,2014,15(18):7825-7829.
[5] Sun PH,Zhu LM,Qiao MM,et al. The XAF1 tumor suppressor induces autophagic cell death via upregulation of Beclin-1 and inhibition of Akt pathway[J]. Cancer Lett,2011,310(2):170-180.
[6] Yin W,Cheepala S,Clifford JL. Identification of a novel splice of Xlinked inhibitor of apoptosis-associated factor 1[J]. Biochem Biophys Res Commun,2006,339(4):1148-1154.
[7] Fang X,Liu Z,Fan Y,et al. Switch to full-length of XAF1 mRNA expression in prostate cancer cells by the DNA methylation inhibitor[J].Int J Cancer,2006,118(10):2485-2489.
[8] Leaman DW,Chawla-Sarkar M,Vyas K,et al. Identification of Xlinked inhibitor of apoptosis-associated factor-1 as an interferon-stimulated gene that augments TRAIL-Apo2L-induced apoptosis[J]. J Biol Chem,2002,277(32):28504-28511.
[9] Chung SK,Lee MG,Ryu BK,et al. Frequent alteration of XAF1 in human colorectal cancers:implication for tumor cell resistance to apoptotic stresses[J]. Gastroenterology,2007,132(7):2459-2477.
[10] Zeng JP,Yu Q,Liang MZ,et al. The progression in the study of interferon’s effect on anti tumor[J]. Modern Preventive Medicine,2008,35(18):3650-3652.曾洁萍,余勤,梁茂植,等. 干扰素抗肿瘤作用研究进展[J].现代预防医学,2008,35(18):3650-3652.
[11] Wang J,Peng Y,Sun YW,et al. All-Trans Retinoic Acid Induces XAF1 Expression Through an Interferon Regulatory Factor-1 Element in Colon Cancer[J]. Gastroenterology,2006,130(3):747-758.
