GPC3 通过活化Wnt/β-catenin 通路促进HepG2 生长
2015-12-31尹寿新马美雪羊东晔
尹寿新,马美雪,周 震,羊东晔
1.莱芜市人民医院消化内科,山东 莱芜271100;2.徐州市中心医院消化内科;3.长沙市第一医院消化内科;4.香港大学深圳医院消化及肝病科
肝癌是位居世界第五位的恶性肿瘤[1]。在中国由于乙型肝炎病毒的流行,HCC 成为第三位致死性恶性肿瘤。GPC3 是一种新型HCC 血清标记物,在HCC组织中呈特异性高表达,而在正常肝、肝硬化等良性病变及癌旁肝组织中不表达或低表达[2]。GPC3 作为Glypican 家族中的一员,可以结合Wnts、Hedgehogs、FGFs、BMPs 等生长因子参与这些信号通路的激活,而Wnt/β-catenin 信号通路的异常活化在HCC 中很常见[3]。GPC3 很可能通过活化Wnt/β-catenin 信号通路促进HCC 细胞生长。
1 材料与方法
1.1 主要材料和试剂 人胎盘组织取自北大深圳医院妇产科。Trizol Reagent 购自Invitrogen 公司。Reverse Transcription system 和GoTaq Green Master Mix 购自Promega 公司。Pyrobest DNA Polymerase、EcoR I、EcoR I、DNA A-Tailing Kit、DNA Ligation Kit Ver.2.0及各种DNA Marker 均购自大连宝生物公司。E.Z.N.ATM Gel Extraction Kit 和E. Z. N. ATM Plasmid Mini Kit I 购自美国Omega Bio-Tek。pcDNA3.1(+)质粒由羊东晔老师惠赠。肝癌细胞HepG2 购自中科院上海细胞库。携带人GPC3 全长基因的pcDNA3.1(+)质粒系前期试验合成,储存于中南大学湘雅二医院中心实验室。澳洲胎牛血清(FBS)、DMEM 培养液均购自GIBCO 公司。转染试剂Attractene Transfection Reagent购自Qiagen 公司。GPC3 多克隆抗体(SANTA CRUZ,货号sc-292920),GPC3 单克隆抗体(Epitomics,货号3697-1),β-catenin 单克隆抗体(Epitomics,货号1247-1),c-myc (N-term)单克隆抗体(Epitomics;货号1472-1),Cyclin D1 单克隆抗体(Epitomics,货号1677-1),GAPDH 多克隆抗体(Millipore,货号ABS16),辣根酶标记山羊抗小鼠IgG 购自Jakson 公司,辣根酶标记小鼠抗兔IgG 购自Sigma 公司。RIPA 裂解液、蛋白酶抑制剂、PVDF 膜、显色液均购自Millipore 公司。MTT 和二甲基亚砜DMSO 购自Sigma 公司。
1.2 实验方法
1.2.1 质粒pcDNA3.1(+)/GPC3-ORF 的构建与提取:TRIzol 抽提人胎盘组织总RNA,逆转录为cDNA 备用。以GenBan 号:NM004484 序列为模板利用Primer 5.0 软件设计上游引物5'-ctgccactctcccgcgctctcc-3'和下游引物5'-gtggttcccttatcgaggaagac-3',并在上游引物5'端中加入EcoR I 酶切位点(GAATTC),在下游引物5' 端中加入EcoR I 酶切位点(CTCGAG)。从cDNA中用pyrobest 酶扩增包含GPC3-ORF 的基因片段-L-GPC3(1.851 kb)。1%的琼脂糖凝胶电泳检测PCR扩增产物。按照E. Z. N. ATM Gel Extraction Kit 提供的操作步骤回收DNA。EcoR I、Xho I 双酶切pcDNA3.1(+)和DNA。按照E.Z.N.ATM Gel Extraction Kit 提供的操作步骤回收酶切产物。将胶回收纯化得到的产物按照DNA Ligation Kit Ver.2.0 说明书16 ℃过夜连接。连接产物按照试剂盒说明书转化至LB/氨苄平板上。分别随机挑取几个含上述质粒的菌落于含100 mg/ml 的氨苄青霉素的3 ml LB 液体培养液中,290 r/min 培养12 ~16 h。用所得菌液作PCR 验证。所得产物行1%琼脂糖凝胶电泳,观察条带,分析其分子量大小是否正确。分子量大小正确的菌液,取0.5 ml 送上海生工生物工程有限公司测序进行再验证。按照E.Z.N.ATM Plasmid Mini Kit I 试剂盒操作步骤提取质粒pcDNA3.1(+)/GPC3-ORF。
1.2.2 质粒转染与Wnt/β-catenin 信号通路的检测:采用含10% 胎牛血清、2 mmol/L L-谷氨酰胺和100 U/ml 青霉素/链霉素的DMEM 培养液培养HepG2于5% CO2、37 ℃、湿度100%的恒温培养箱中。转染组和对照组HepG2 细胞分别种板,待细胞融合至40% ~50%时用pcDNA3. 1(+ )/GPC3 质粒和pcDNA3. 1(+)空白质粒分别转染。60 h 后用加入蛋白酶抑制剂的RIPA 裂解液提取蛋白,Western blotting 检测两组GPC3、β-catenin、c-myc、cyclinD1 的表达情况以判断是否转染成功及Wnt/β-catenin 信号通路的活化程度是否有差异。分别将96 孔板中转染后24、48、72 h 的转染组、对照组HepG2 取出,倾去液体,加入5 g/L 的MTT,继续培养4 h 后,吸取上清,每孔加入150 μl 二甲基亚砜,室温下摇床上摇晃10 min,酶标仪检测490 nm的A 值。
1.3 统计学分析 采用SPSS 18.0 软件进行分析。实验数据连续性资料用±s 表示,两样本均数比较采用t 检验;多组间均数比较采用方差分析。P <0.05为差异有统计学意义。
2 结果
2.1 GPC3 转染至HepG2 肝癌细胞 转染60 h 后分别提取蛋白Western blotting 检测GPC3 表达量和Wnt/β-catenin 通路活化程度。用兔抗人GPC3 单克隆抗体(Epitomics,货号3697-1)检测出现4 条带,内参一致情况下,各个条带上相对于对照组,转染组的信号都要高,HepG2 肝癌细胞成功转染GPC3(见图1)。
2.2 Wnt/β-catenin 信号通路的检测与MTT 对Wnt 通路检测发现β-catenin、c-myc、cyclinD1 都升高且差异较大(见图2),GPC3 可活化Wnt/β-catenin 通路。增殖实验示转染后24、48、72 h 的转染组与对照组HepG2 细胞OD 值分别为0. 475 与0. 485(P >0.05)、0. 486 与0. 503(P <0. 05)、0. 500 与0. 525(P <0.05),GPC3 过表达的HepG2 细胞增殖较未转染组加快,Wnt/β-catenin 活化可促进肝癌细胞的生长(见图3)。

图1 Western blotting 检测GPC3 表达量Fig 1 Expression of GPC3 by Western blotting
3 讨论

图2 HepG2 转染组与对照组Wnt/β-catenin 通路的活化情况比较Fig 2 Comparison of the activation of Wnt/β-catenin pathway between the transfected HepG2 cells group and control group
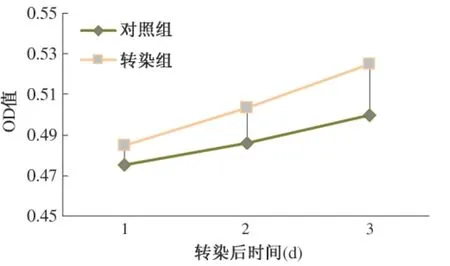
图3 转染组与对照组增殖速度对比Fig 3 Comparison of growth speed between the transfected HepG2 cells group and control group
Wnt/β-catenin 信号异常活化通路在HCC 发生、发展中的意义重大。研究发现突变β-catenin 下Wnt通路的活化和正常β-catenin 下Wnt 通路的活化并不能引起相同的靶基因表达。存在活化的Wnt 通路的肝癌分成有(或多)β-catenin 突变的和无(或少)βcatenin 突变的,前者以肝相对特异的Wnt 靶基因过表达、肿瘤细胞高度分化和低度恶性、染色体相对稳定、预后较好为特征,后者表现为经典的Wnt 通路靶基因(cylinD1、c-myc 等)过表达、染色体高度不稳定、生物学上侵袭生长、与慢性乙型肝炎病毒感染密切相关[3-6]。并且将HepG2 细胞归类于前者,认为突变的β-catenin 不能诱导c-myc、cyclinD1 等Wnt 经典靶基因的表达[3]。我们的研究证明了拥有完整Wnt/β-catenin 信号通路成分的HepG2 细胞在过度活化时同样可以诱导c-myc、cyclinD1 等Wnt 经典靶基因的表达。同时,用兔抗人GPC3 单克隆抗体检测出现4 条带,此前未见HepG2 有类似报道,考虑与GPC3 的不同剪切有关。由于人GPC3 核心蛋白(不含HS 链)分子量约为65 KD,在内质网内被剪切成40 KD、30 KD 大小的两个亚基,30 KD 的小亚基(C 端,可借糖基磷脂酰肌醇GPI 锚定于细胞膜)可因硫酸乙酰肝素HS 链的大小呈现不同的分子量,故推测此抗体识别GPC3 蛋白C端,由上及下分别为含HS 链的核心GPC3、不含HS 链的核心GPC3、含HS 链的C 端GPC3(第359 ~580 位氨基酸)和不含HS 链的C 端GPC3(第359 ~580 位氨基酸)。
Wnt 通路在肝癌中的活化提示抑制Wnt 通路可以阻断此类肝癌的发生、发展。已发现多种分泌蛋白在调控Wnt/β-catenin 通路上发挥重要作用,GPC3 就是其中之一。多项调查研究表明GPC3 与肝癌关系密切,GPC3 已被看作是一个新的肝癌肿瘤标志物:GPC3在肝癌细胞系HepG2、Hep3B、HT17、HuH6、HuH7 和PLC/PRF/5 中高度表达[7];运用免疫组化对不同肝病的研究中也发现GPC3 只在肝细胞癌组织中呈阳性染色,在正常肝、硬化肝或良性病变及癌旁肝组织中均呈阴性染色[2]。早期肝癌诊断国际评议小组声明GPC3在诊断小肝癌方面敏感性和特异性分别为77%、96%,推断GPC3 阳性高度提示病变恶性[8]。更重要的是,与甲胎蛋白(a-fetoprotein,AFP)相比,肝癌中GPC3 在mRNA 和蛋白水平阳性率方面都更高,在<3 cm的肝癌方面优势更明显[9]。美国肝病研究协会在最新指南中声明:“GPC3、HSP70(heat shock protein)和GS(Glutamine Synthetase)免疫染色可辅助肝癌病理学诊断,三者中两个阳性可确定肝癌诊断”[10]。
在血清学诊断方面,多项研究发现血清GPC3 在原发肝癌中的表达显著高于肝硬化、慢性肝炎、其他肿瘤及正常肝组织[2,9,11]。在高度及中度分化肝癌中,GPC3 较AFP 敏感性更高,且与AFP 联合时可将敏感度从50%提高至72%[11]。
GPC3 通过Wnt 通路促进肝癌发生、发展的研究成果为肝癌治疗提供了依据。Ishiguro 等[12]研究发现GC33(一个抗人GPC3 单克隆抗体)明显抑制SCID 小鼠体内GPC3 阳性人肝癌移植物的生长,而GPC3 阴性肝癌移植物不受影响。用此抗体进行的进展期肝癌生物治疗Ⅰ期临床试验表明每周20 mg/kg GC33 静脉给药无明显不良反应[13-14]。另一项Ⅰ期临床试验中,Sawada 等[15]将包含可诱导细胞毒性T 细胞活化的两种GPC3 多肽的疫苗注射入人体,他们发现这种疫苗在绝大多数人体内产生可观测到的免疫反应而不造成明显伤害。可以说GPC3 为肝癌治疗提供了一种新的生物靶点。
[1] Poon D,Anderson BO,Chen LT,et al. Management of hepatocellular carcinoma in Asia:consensus statement from the Asian Oncology Summit 2009[J]. Lancet Oncol,2009,10(11):1111-1118.
[2] Nakatsura T,Yoshitake Y,Senju S,et al. Glypican-3,overexpressed specifically in human hepatocellular carcinoma,is a novel tumor marker[J]. Biochem Biophys Res Commun,2003,306(1):16-25.
[3] Lachenmayer A,Alsinet C,Savic R,et al. Wnt-pathway activation in two molecular classes of hepatocellular carcinoma and experimental modulation by sorafenib[J]. Clin Cancer Res,2012,18(18):4997-5007.
[4] Suzuki T,Yano H,Nakashima Y,et al. Beta-catenin expression in hepatocellular carcinoma:a possible participation of beta-catenin in the dedifferentiation process[J]. J Gastroenterol Hepatol,2002,17(9):994-1000.
[5] Hoshida Y,Nijman SM,Kobayashi M,et al. Integrative transcriptome analysis reveals common molecular subclasses of human hepatocellular carcinoma[J]. Cancer Res,2009,69(18):7385-7392.
[6] Pez F,Lopez A,Kim M,et al. Wnt signaling and hepatocarcinogenesis:molecular targets for the development of innovative anticancer drugs[J]. J Hepatol,2013,59(5):1107-1117.
[7] Midorikawa Y,Ishikawa S,Iwanari H,et al. Glypican-3,overexpressed in hepatocellular carcinoma,modulates FGF2 and BMP-7 signaling[J]. Int J Cancer,2003,103(4):455-465.
[8] International Consensus Group for Hepatocellular Neoplasia The International Consensus Group for Hepatocellular Neoplasia. Pathologic diagnosis of early hepatocellular carcinoma:a report of the international consensus group for hepatocellular neoplasia[J]. Hepatology,2009,49(2):658-664.
[9] Capurro M,Wanless IR,Sherman M,et al. Glypican-3:a novel serum and histochemical marker for hepatocellular carcinoma[J]. Gastroenterology,2003,125(1):89-97.
[10] Bruix J,Sherman M. Management of hepatocellular carcinoma:an update[J]. Hepatology,2011,53(3):1020-1022.
[11] Hippo Y,Watanabe K,Watanabe A,et al. Identification of soluble NH2-terminal fragment of glypican-3 as a serological marker for earlystage hepatocellular carcinoma [J]. Cancer Res,2004,64(7):2418-2423.
[12] Ishiguro T,Sugimoto M,Kinoshita Y,et al. Anti-glypican 3 antibody as a potential antitumor agent for human liver cancer[J]. Cancer Res,2008,68(23):9832-9838.
[13] Zhu AX,Gold PJ,El-Khoueiry AB,et al. First-in-man phase I study of GC33,a novel recombinant humanized antibody against glypican-3,in patients with advanced hepatocellular carcinoma [J]. Clin Cancer Res,2013,19(4):920-928.
[14] Ikeda M,Ohkawa S,Okusaka T,et al. Japanese phase I study of GC33,a humanized antibody against glypican-3 for advanced hepatocellular carcinoma[J]. Cancer Sci,2014,105(4):455-462.
[15] Sawada Y,Yoshikawa T,Nobuoka D,et al. Phase I trial of a glypican-3-derived peptide vaccine for advanced hepatocellular carcinoma:immunologic evidence and potential for improving overall survival [J]. Clin Cancer Res,2012,18(13):3686-3696.
