上皮钙黏素/连环素复合体对大鼠神经干细胞增殖作用的影响
2015-12-31颜建辉,黄丽娟,杨柳等
上皮钙黏素/连环素复合体对大鼠神经干细胞增殖作用的影响
颜建辉1黄丽娟1杨柳1陈雁斌1华力明1
(湘南学院心脑血管研究所,湖南长沙410000)
摘要〔〕目的探讨E-钙黏素/连环素(E-cadherin/catenin)复合体对神经干细胞(NSCs)增殖作用的影响。方法从胎鼠脑组织中分离、培养NSCs,制备细胞悬液,随机分为正常组、实验1组、实验2组。克隆大鼠E-cadherin全长于慢病毒(Lentivirus),转染至实验1组NSCs;采用siRNA法将E-cadherin对应片段克隆进入Lentivirus载体,转染至实验2组。RT-PCR及Western印迹方法检测各组细胞E-cadherin、β-catenin、p120-ctn的mRNA及蛋白表达水平。以MTT法绘制细胞生长曲线,免疫荧光染色标记计数Nestin、BrdU 阳性细胞数目。结果实验1组E-cadherin、β-catenin、p120-ctn的mRNA及蛋白表达水平均显著高于正常组,但NSCs增长率及BrdU 阳性细胞数目显著低于正常组(P<0.05);实验2组E-cadherin、β-catenin、p120-ctn的mRNA及蛋白表达水平显著低于正常组,但NSCs增长率及Nestin、BrdU 阳性细胞数目均显著高于正常组(P<0.05)。结论下调E-cadherin/catenin复合体的表达可能促进体外培养的NSCs增殖。
关键词〔〕E-钙黏素/连环素;神经干细胞;慢病毒
中图分类号〔〕R-36〔文献标识码〕A〔
1湘南学院附属医院
第一作者:颜建辉(1974-),男,副教授,副主任医师,主要从事脑血管病变研究。
神经干细胞(NSCs)是一类具有分化为神经元细胞,并能够提供大量脑组织细胞能力的干细胞,因NSCs的自我更新、多向分化潜能的性质,被誉为“万能细胞”,在中枢神经系统受损的多种疾病中都有重要的治疗价值。上皮钙黏蛋白(E-cadherin)是一种重要的细胞间黏附分子,参与形成和维护正常细胞间的连接〔1〕。E-cadherin功能的发挥离不开连环素(catenin)的作用,它可以与α-catenin、β-catenin、γ-catenin及p120-catenin一起组成E-cadherin/catenin 复合体,在维持上皮细胞的组织结构完整性和新陈代谢过程中起到重要作用。p120ctn是稳定E-cadherin/catenin复合体的主要成分,最新研究表明,E-cadherin与p120-catenin结合,可以调控人胚胎干细胞的微环境以及重编程功能〔2〕。在小鼠的胚胎干细胞中研究发现,E-cadherin/β-catenin介导细胞与细胞间的黏附,同时可以抑制GSK-3β活性,调控干细胞的自我更新活性〔3〕。但是,E-cadherin/catenin复合体对NSCs的增殖作用鲜有报道。本课题观察E-cadherin/catenin复合体内黏附分子变化对移植NSCs的增殖的影响,为提高NSCs移植治疗相关疾病的临床疗效及新药的开发提供实验依据。
1材料与方法
1.1动物孕14 d Wistar大鼠1只,由武汉大学动物实验中心提供。
1.2主要试剂多聚赖氨酸、巢蛋白(nestin)、5-溴脱氧尿嘧啶核苷(Brdu)、Lipofectamine 2000均由Sigma公司提供; B27复合物、胎牛血清、碱性成纤维细胞生长因子(bFGF)、表皮细胞生长因子(EGF)由北京中杉金桥试剂有限公司提供; DMEM/F12基础培养基、Trizol试剂盒、RNA 抽提试剂盒、荧光标记FITC试剂、DAB显色剂、SABC免疫组化试剂盒均由武汉子心生物科技有限公司提供;兔抗山羊IgG-Cy3,山羊抗鼠IgG-FITC均由武汉博士德生物有限公司提供;E-cadherin单克隆抗体及p120-catenin抗体均由Abcam公司提供;Lentivirus病毒由上海吉满生物科技公司提供。
1.3方法
1.3.1NSCs的分离与培养取孕14 d Wistar大鼠,脱臼处死后于无菌条件下取出胎鼠,取出大脑组织D-Hank漂洗后,剪碎,吹打分散制成细胞悬液,离心,弃上清,置于含有2%B27,20 μg/L bFGF的DMEM/F12培养基中,在CO2培养箱中悬浮培养,3 d后待克隆球形成后,换液,用同样的方法传代培养3~4次,收集悬浮神经球制备单细胞悬液,调整浓度至1×105/ml。
1.3.2实验分组将上述NSCs单细胞悬液等分为3份,分别为正常组、实验1组及实验2组。正常组不作任何处理,继续培养。
1.3.3E-cadherin克隆及过表达 克隆大鼠E-cadherin编码序列全长,表达于Lentivirus病毒载体,经293T细胞包装后,收集病毒,转染至实验2组的NSCs,具体转染步骤按Lipofectamine 2000试剂说明书操作。
1.3.4siRNA-Lentivirus病毒载体构建及转染根据siRNA的设计原则,使用Invitrogen公司siRNA设计软件,载体pGenesil-的酶切位点以及GenBank中大鼠E-cadherin(GenBank accession AB017696.1)的编码序列,设计并合成片段如下:siRNA:5'-AAGATAGGAGTTCTCTGATGC-3' 阴性序列:5'-GGCGUGUCUCUCUUACGAC-3'。序列采用慢病毒(Lentivirus)载体,将对应片段克隆进入载体,经293T细胞包装后,收集病毒,转染至实验1组的NSCs,操作同上。
1.4MTT法测定NSCs的生长曲线取上述各组NSCs悬液,以无血清培养基接种于96孔培养板(细胞浓度1×104个),150 μl/孔,观察记录细胞的生长状况,在每孔加入MTT(5 g/L)20 μl,培养4h,手机孔内细胞并离心,每孔加入150 μlDMSO,震荡10 min,并分别于1、2、3、4、5、6和7 d以酶标仪自动测定490 nm波长时OD值。
1.5RT-PCR检测E-cadherin、β-catenin 及p120-ctn 的mRNA的表达Trizol提取总RNA,反转录为cDNA,再以cDNA为模板行PCR 扩增,各基因的引物序列,见表1。PCR 产物以2%琼脂糖凝胶电泳测定扩增带灰度值,得到mRNA的相对表达量,以β-actin为参照。
表1各基因引物序列及扩增片段长度
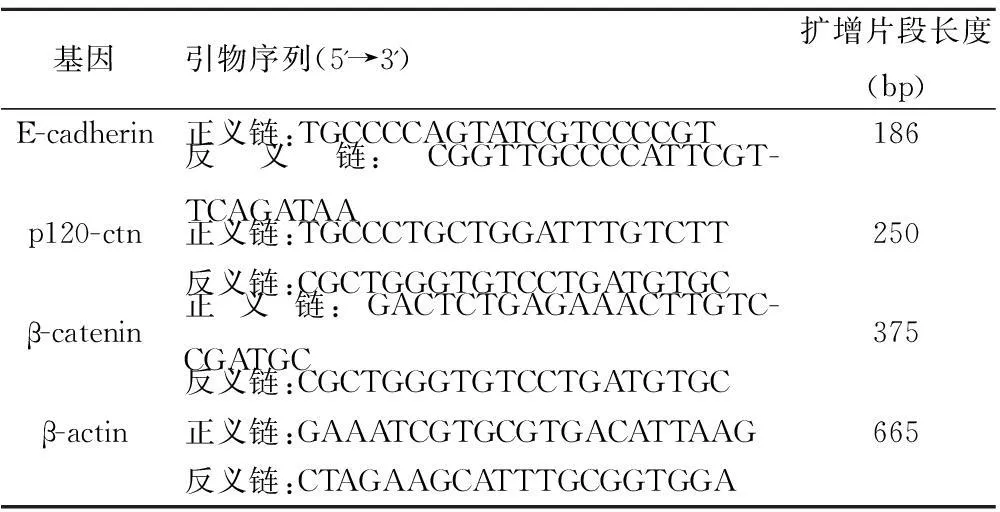
基因引物序列(5'→3')扩增片段长度(bp)E-cadherin正义链:TGCCCCAGTATCGTCCCCGT186反义链:CGGTTGCCCCATTCGT-TCAGATAAp120-ctn正义链:TGCCCTGCTGGATTTGTCTT250反义链:CGCTGGGTGTCCTGATGTGCβ-catenin正义链:GACTCTGAGAAACTTGTC-CGATGC375反义链:CGCTGGGTGTCCTGATGTGCβ-actin正义链:GAAATCGTGCGTGACATTAAG665反义链:CTAGAAGCATTTGCGGTGGA
1.6Western印迹法检测E-cadherin、β-catenin 及p120-ctn的蛋白表达各组NSCs悬液,裂解、变性后离心,取上清液,以Bradford测定总蛋白量。取10 μg蛋白上样,采用SDS-PAGE凝胶电泳后,转印至PVDF膜;然后将膜室温下封闭2 h,PBS漂洗,分别加入一抗E-cadherin(1∶400)、β-catenin(1∶200)及p120-ctn(1∶400) ,4℃过夜;辣根过氧化物酶标记二抗37℃孵育1 h,ECL发光显色,以图像分析系统观察表达情况,以β-actin作为对照。
1.7Nestin、BrdU免疫荧光染色及计数各组NSCs接种于无菌盖玻片的24孔培养板中(预先包被0.01%多聚赖氨酸),于37℃,5%CO2培养箱中培养,收集贴壁细胞制备细胞爬片,4%多聚甲醛固定,PBS冲洗,加一抗Nestin(1∶200)、BrdU(1∶200)进行免疫荧光染色,随机观察100个视野,荧光显微镜下计数每个视野的阳性细胞数,并取其平均值。
2结果
2.1各组E-cadherin、β-catenin 及p120-ctn的表达Western印迹和RT-PCR法显示,实验1组E-cadherin蛋白及mRNA表达较正常组则显著增强(P<0.05),呈过表达状态,β-catenin 及p120-ctn蛋白及mRNA表达也显著增强(P<0.05);而经过siRNA干扰后,实验2组的E-cadherin的蛋白及mRNA表达均较正常组显著减弱,差异均有统计学意义(P<0.05),β-catenin 及p120-ctn的蛋白及mRNA表达较正常组也显著减弱(P<0.05),见图1,图2。
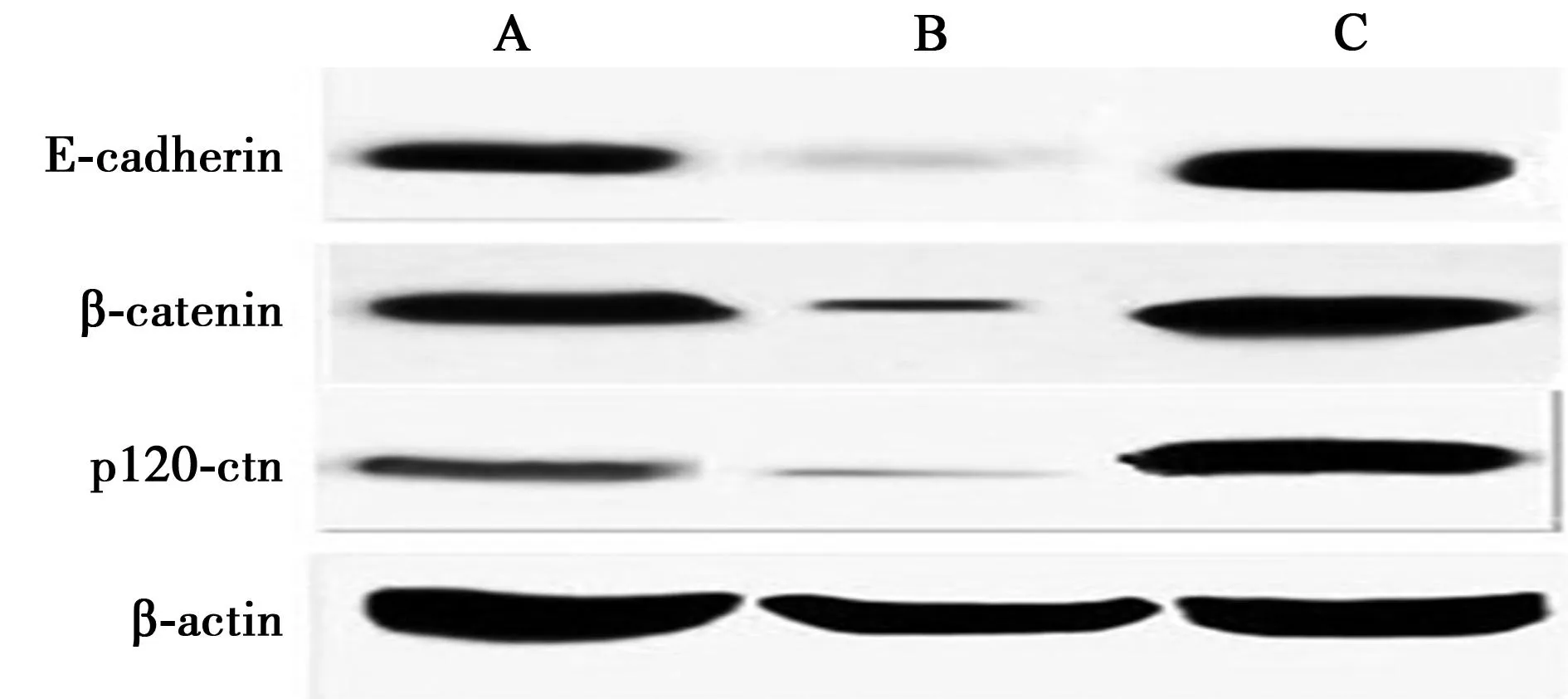
A、B、C:正常组、实验2组及实验1组,下图同 图1 E-cadherin、β-catenin及p120-ctn的蛋白表达
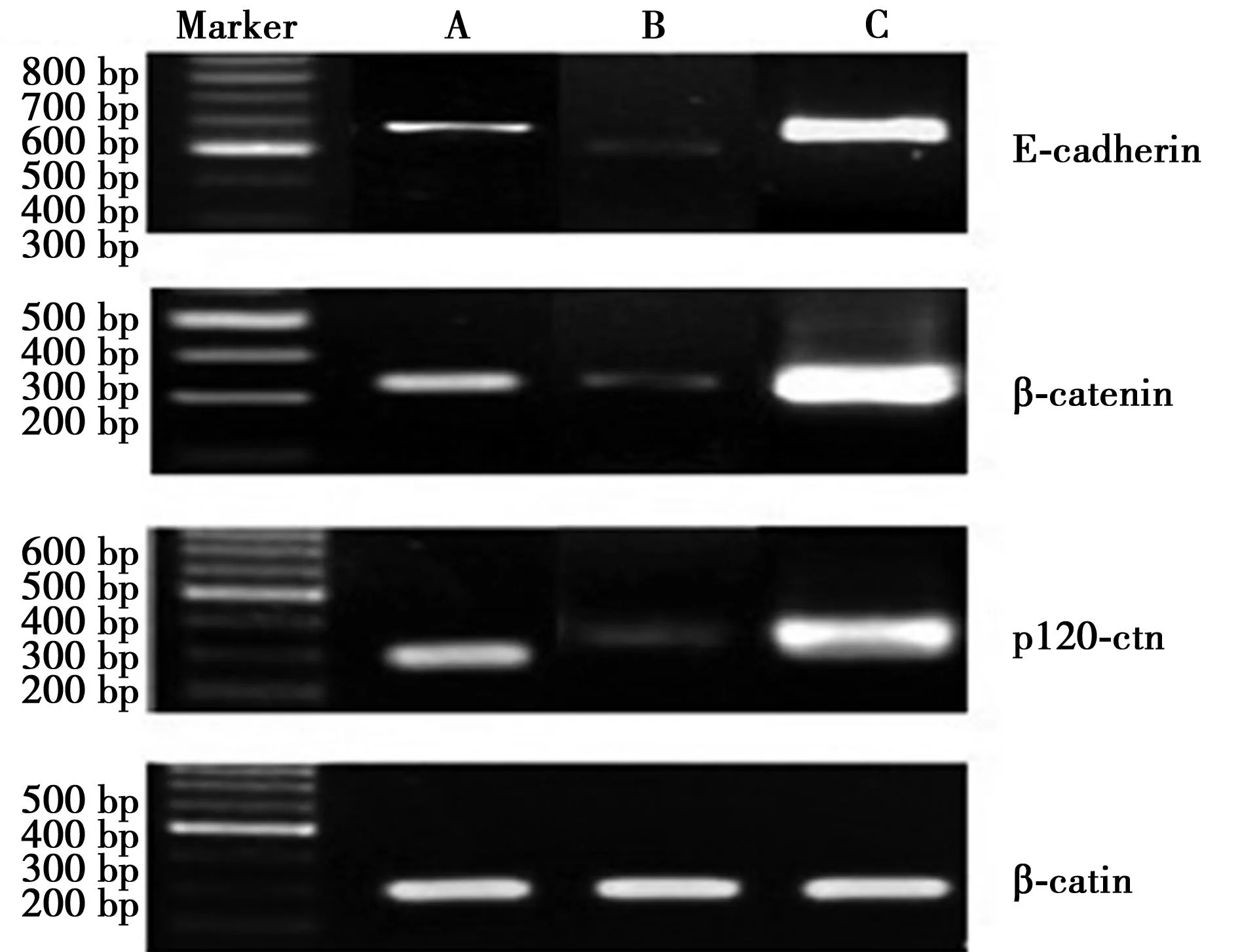
图2 E-cadherin、β-catenin 及p120-ctn的mRNA表达
2.2各组NSCs的生长曲线实验1组的OD值与正常组相比显著降低(P<0.05),而实验2组的OD值则显著高于正常组及实验1组(P<0.05),见图3。
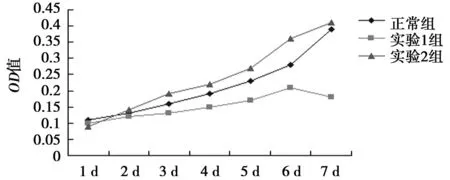
图3 各组NSCs的生长情况
2.3免疫荧光测定各组Nestin及BrdU阳性细胞数目BrdU 荧光染色阳性细胞胞质着红色,Nestin染色阳性细胞则呈绿色;与正常组相比,实验1组的Nestin及BrdU阳性细胞数目显著减少(P<0.05),而实验2组的Nestin及BrdU阳性细胞数目则显著高于正常组及实验1组,差异有统计学意义(P<0.05),见表2及图4,图5。
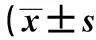

组别Nestin阳性细胞BrdU阳性细胞正常组43.28±12.4532.15±10.64实验1组20.07±9.131)14.22±8.931)实验2组72.63±13.011)2)61.37±11.061)2)
与正常组比较:1)P<0.01;与实验1组比较:2)P<0.01
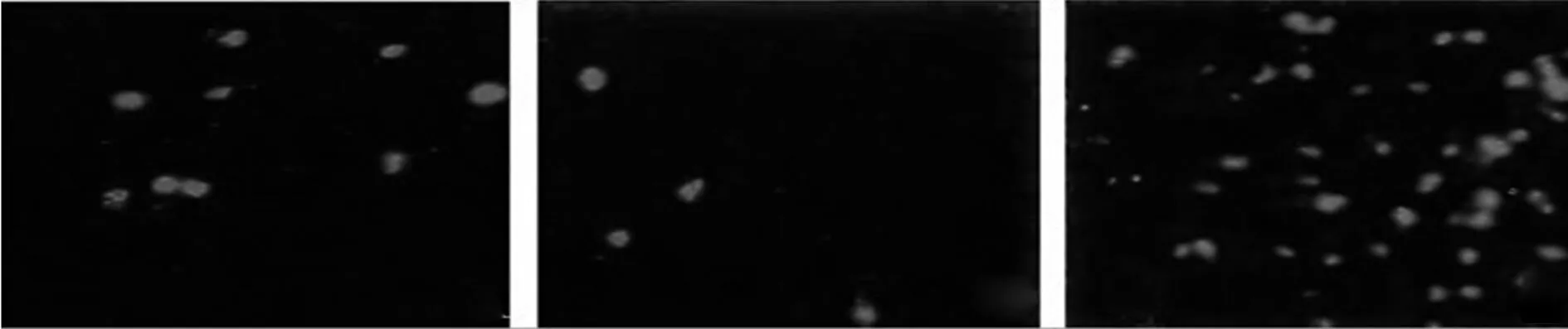
正常组 实验1组 实验2组 图4 BrdU阳性细胞数目(免疫荧光×400)
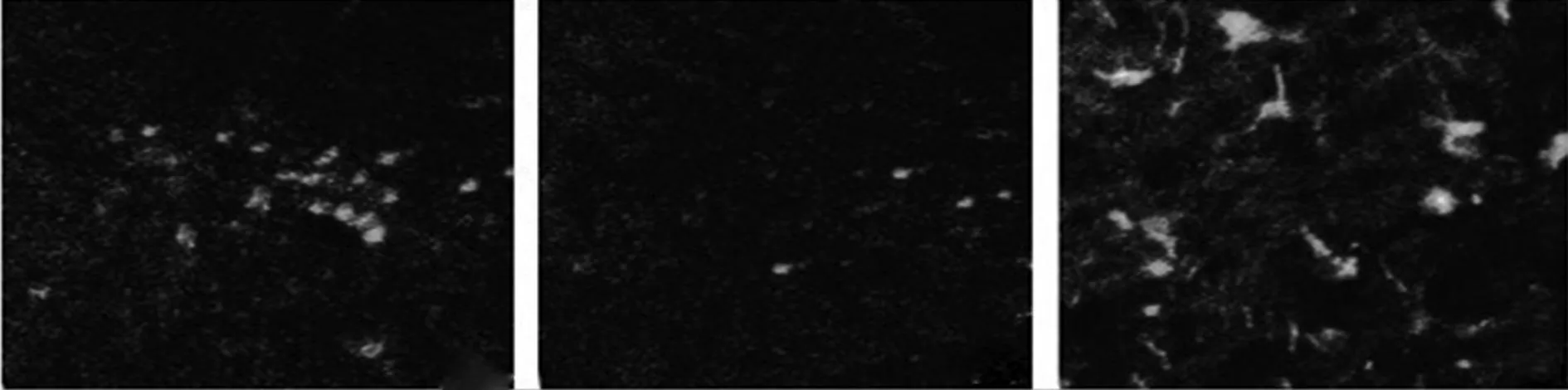
正常组 实验1组 实验2组 图5 Nestin阳性细胞数目(免疫荧光,×400)
3讨论
NSCs能够生成神经组织,在体外能维持未分化状态,因其具有多向分化潜能和自我更新能力〔4,5〕,故而NSCs移植为脑损伤修复以及神经性疾病的治疗带来了希望。近年来,随着人们对影响NSCs增殖的不断深入研究,发现微环境对于干细胞的自我更新,增殖,分化调控以及干细胞迁移和归巢至关重要,而微环境中E-cadherin是其中重要组成部分。研究发现E-cadherin介导的细胞与细胞间连接,可以促进小鼠胚胎干细胞自我更新,且不依赖LIF因子,这表明E-cadherin在干细胞的自我更新中扮演关键性角色〔6〕。catenin是一类位于细胞质内结构相似的糖蛋白家族,也是E-cadherin最为密切的细胞质内黏附相关蛋白配体,E-cadherin黏附功能的正常发挥,主要受catenin的调节。该家族中主要包括α-catenin、β-catenin、γ-catenin及p120-catenin。当胞质内α-catenin将β-catenin和(或)γ-catenin与细胞骨架的肌动蛋白微丝相连,而β-catenin和(或)γ-catenin
直接与E-cadherin 的胞质区结合,即形成了E-cadherin/ catenin 复合体。该复合体能将E-cadherin定位于细胞与细胞间的接触部位,在细胞间黏附、建立细胞极性、维持组织形态中起重要作用。P120ctn 是稳定E-cadherin/catenin复合体的主要成分〔7〕。大量研究表明,肿瘤组织中如果E-cadherin/catenin复合体出现破坏或丢失的现象,细胞间黏附将会丢失,有利于恶性细胞的无限制增生〔8〕。而上皮细胞内E-cadherin过度表达能抑制细胞的游走与增殖,诱导细胞凋亡〔9〕。因此,推测如果下调E-cadherin/catenin复合体的表达,可能会促进体外培养NSCs的增殖。
本实验结果提示随着E-cadherin、β-catenin 及p120-ctn表达的下降,导致E-cadherin与catenin连接受阻,E-cadherin/catenin复合体与细胞骨架相互作用减弱,使E-cadherin不能定位于膜上,被胞质内蛋白酶降解,细胞的黏附功能障碍,细胞间连接松散,黏附力下降,有利于传递增殖信号导,细胞分裂增殖能力增强,从而促进了NSCs的增殖。
综上所述,下调E-cadherin/catenin复合体的表达可能促进体外培养的NSCs增殖,为NSCs治疗中枢神经系统疾病提供了新的视点,但是其具体作用机制尚需要更深入的研究。
4参考文献
1Zhang L,Ju X,Cheng Y,etal.Identifying Tmem59 related gene regulatory network of mouse neural stem cell from a compendium of expression profiles〔J〕.BMC Syst Biol,2011;29(5):152.
2Li D,Zhou J,Wang L,etal.Integrated biochemical and mechanical signals regulate multifaceted human embryonic stem cell functions〔J〕.J Cell Biol,2010;191:631-44.
3Sineva GS,Pospelov VA.Inhibition of GSK3beta enhances both adhesive and signalling activities of beta-catenin in mouse embryonic stem cells〔J〕.Biol Cell,2010;102:549-60.
4Hong BH,Ha S,Joo Y,etal.Amyloid precursor protein binding protein-1 knockdown reduces neuronal differentiation in fetal neural stem cells〔J〕.Neuroreport,2012;23(2):61-6.
5Crockett S,Clarke M,Reeves S,etal.Cystine glutamate exchanger upregulation by retinoic acid induces neuroprotection in neural stem cells〔J〕.Neuroreport,2011;22(12):598-602.
6Soncin F,Mohamet L,Eckardt D,etal.Abrogation of E-cadherin-mediated cell-cell contact in mouse embryonic stem cells results in reversible LIF-independent self-renewal〔J〕.Stem Cell,2009;27(9):2069-80.
7Berx G,van Roy F.Involvement of members of the cadherin super-family in cancer〔J〕.Cold Spring Harb Perspect Biol,2009;1(6):a003129.
8Brooks SA,Lomax Browne HJ,Carter TM ,etal.Molecular interact ions in cancer cell metastasis〔J〕.Acta Histochemica,2010;112(1):3-25.
9赵远,王永忠.上皮钙粘蛋白和β-连环蛋白的研究进展〔J〕.江苏医药,2011;37(13):1581-4.
〔2013-12-07修回〕
(编辑赵慧玲/曹梦园)
