缺氧损伤模型中胰岛素样生长因子-1对少突胶质前体细胞自噬和增殖能力的影响
2015-12-31刘洋,许婧,周韬等
缺氧损伤模型中胰岛素样生长因子-1对少突胶质前体细胞自噬和增殖能力的影响
刘洋许婧1周韬1陈松伊超马春杰沈雷2
(齐齐哈尔医学院第二附属医院神经外科,黑龙江齐齐哈尔161006)
摘要〔〕目的探讨胰岛素样生长因子(IGF)-1对缺氧性少突胶质前体细胞损伤的修复机制。方法分离提纯Wistar大鼠少突胶质前体细胞,设立正常对照组、缺氧组、缺氧IGF-1组,MTT法观察细胞增殖,Western印迹法检测LC-3蛋白表达。结果分离提纯的细胞符合少突胶质前体细胞鉴定标准;缺氧IGF-1组细胞增殖OD值比缺氧组提高1.3倍(P<0.05);缺氧IGF-1组少突胶质前体细胞LC-3的表达逐渐上升,90 min后呈逐渐降低的趋势。结论IGF-1通过增加保护性自噬机制,促进少突胶质前体细胞的增殖,对修复神经损伤具有重要意义。
关键词〔〕少突胶质前体细胞;胰岛素样生长因子-1;自噬;缺氧
中图分类号〔〕R74〔文献标识码〕A〔
基金项目:齐齐哈尔市科学技术计划社会发展项目(No.SFGG-201230)
1齐齐哈尔医学院2013级实验班
2齐齐哈尔医学院解剖教研室
第一作者:刘洋(1975-),男,副主任医师,主要从事神经外科医疗研究。
脑白质中数量最多的少突胶质细胞对缺氧损伤比较敏感〔1〕,缺氧等是导致少突胶质细胞损伤而产生脑白质病变的主要因素〔2〕。近年来研究〔3〕发现,中枢神经系统中广泛分布着少突胶质细胞前体细胞(OPC),在体外培养OPC具有自我更新增殖和不对称分化的能力,说明OPC是具有干细胞或干细胞样特性的细胞,是少突胶质细胞的前体类神经干细胞。所以,少突胶质细胞的损伤有可能通过促进OPC的分化而达到逆转脑白质病变的作用。胰岛素样生长因子(IGF)-1对神经干细胞生长具有促进作用〔4〕,但是关于IGF-1对OPC的作用研究比较少。深入阐述缺氧模型条件下IGF-1对OPC的增殖、自噬和凋亡的影响,可以为探寻以OPC为靶点治疗脑缺氧缺血性疾病的方法提供研究基础。
1材料与方法
1.1OPC的培养动物实验获得齐齐哈尔医学院伦理委员会同意。按文献〔5〕记载的方法培养出生72 h内Wistar 大鼠(齐齐哈尔医学院动物实验中心)的脑组织中OPC。
1.1.1胶质混合细胞的培养按照Armstrong〔6〕的细胞培养流程。取0~3日龄Wistar大鼠幼崽,断头处死,取除去小脑的全脑组织,并置于0.01 mol/L磷酸盐缓冲液(PBS)中。除去内层和外层脑膜后,依次通过尼龙网孔眼为125 μm和36 μm的细胞筛,900 r/min,离心10 min,把细胞悬液重悬于5 ml胶质混合培养基〔按1∶1比例混合DMEM培养基和F12培养基(均购自美国Gibco公司),并添加10%胎牛血清(美国Gibco公司),100 U/ml青霉素和100 g/ml链霉素(碧云天,杭州)〕。将得到的悬浮液接种在细胞培养瓶,37℃,5%CO2培养。
1.1.2OPC分离培养〔7〕在细胞培养箱中,以180 r/min速度摇动细胞培3 h后,用0.01 mol/L PBS溶液洗涤1次,然后添加新鲜的胶质混合培养基,再继续摇晃18 h后,将上清液按1 700 r/min速度离心5 min,种植在涂布着5 μg/ml聚-L-赖氨酸的培养皿内,37℃,5%CO2培养45 min;取上清液,以1 000 r/min转速离心5 min,再重悬于1 ml胶质混合培养基中,37℃,5%CO2培养。
1.2少突胶质细胞的鉴定取纯化培养10 d的OPC细胞,4%多聚甲醛室温固定 20 min;10%山羊血清封闭 50 min;滴加兔抗大鼠A2B5抗体(1∶300,Santa Cruz,美国),4℃过夜;次日滴加异硫氰酸荧光素(FITC)标记山羊抗兔IgG(1∶200,Santa Cruz,美国),37℃避光1 h;二氨基联苯胺(DAB)底物缓冲液(DAKO)水溶性封片液封片;荧光显微镜下观察。
1.3缺氧模型制作以及实验分组用含10 mmol/L Na2S2O4(四川科龙,成都)的胶质混合培养基培养OPC,建立缺氧模型〔4〕,或在缺氧细胞模型中添加100 mmol/L IGF-1(Sigma,美国),分为正常对照组、缺氧组、缺氧IGF-1组。2×104细胞贴壁后30、60、90 min为观察点。
1.4MTT细胞增殖实验按少突胶质前体细胞分组情况,1×104细胞/孔,37℃,5%CO2培养48 h,每孔加入噻唑蓝(MTT)(20 μl,5 mg/ml,Sigma),37℃,5%CO2孵育4 h,更换二甲基亚砜(DMSO)(150 μl,Sigma),使用Emax酶标仪(Molecular Devices),490 nm波长测定每个样品吸光度(OD值)。
1.5Western印迹法检测少突胶质前体细胞中自噬标记蛋白(LC)-3表达使用多能干细胞(IPs)细胞裂解液(碧云天生物公司,福州)裂解细胞,并提取各组细胞的总蛋白;凝胶电泳;将蛋白质转膜到硝酸纤维素膜(Millipore,美国),5%牛血清白蛋白(Santa Cruz,美国)封闭2 h,在4℃条件下,兔抗鼠LC-3(1∶200,Santa Cruz,美国)孵育12 h,然后以山羊抗兔IgG(1∶150,Santa Cruz,美国)和超敏化学发光法(ECL)试剂盒(碧云天生物公司,福州)进行免疫印迹分析,β-actin为上样对照。IPP软件分析图像光密度值差异。
1.6统计学方法采用SPSS18.0软件进行t检验或方差分析。
2结果
2.1OPC的培养和鉴定分离OPC胞体较大,呈卵圆形团状生长,伸出1~2个长突起,向四周发散,细胞增殖不明显;分离培养的OPC A2B5抗体染色阳性。见图1。
2.2IGF-1对OPC增殖的影响缺氧组细胞增殖OD值较正常组降低(P<0.05);而缺氧IGF-1组细胞增殖OD值比缺氧组提高1.3倍(P<0.05)。见表1。
2.3LC-3表达结果缺氧IGF-1组OPC从培养时,LC-3的表达逐渐上升,60 min达高峰,90 min呈现降低趋势;缺氧组和缺氧IGF-1组各时间点LC-3比较差异有统计学意义(P<0.05)。见图 2,表2。
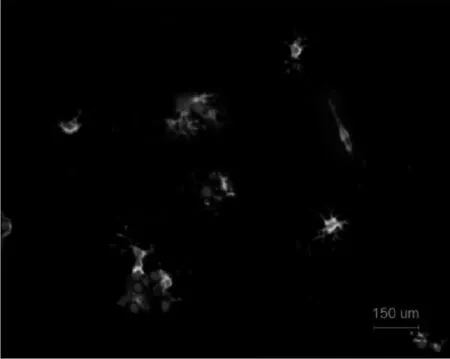
蓝色:DAPI标记;绿色:FITC标记A2B5抗体 图1 A2B5在少突胶质前体细胞的表达(标尺=150 μm)
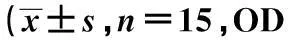
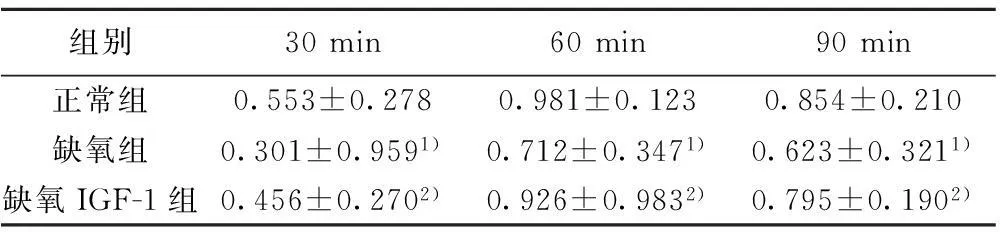
组别30min60min90min正常组0.553±0.2780.981±0.1230.854±0.210缺氧组0.301±0.9591)0.712±0.3471)0.623±0.3211)缺氧IGF-1组0.456±0.2702)0.926±0.9832)0.795±0.1902)
与正常组比较:1)P<0.05,与缺氧组比较:2)P<0.05
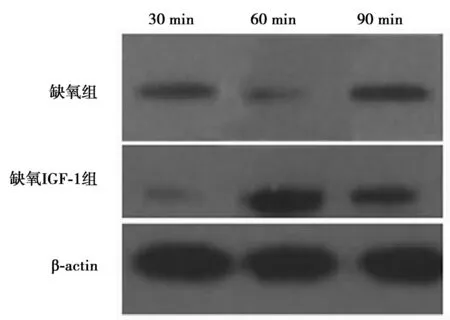
图2 Western印迹法检测缺氧组和缺氧 IGF-1组不同时间点LC-3表达变化

组别30min60min90min缺氧组0.523±0.0750.468±0.0850.610±0.046缺氧IGF-1组0.312±0.0411)0.937±0.0631)0.783±0.0621)
与缺氧组比较:1)P<0.05
3讨论
脑室周围白质软化症(PVL)是老年人好发的脑白质病,危害患者生命和家庭幸福〔8〕。目前认为,缺氧缺血是导致中枢神经系统损伤的主要原因〔9〕。脑白质中含有大量少突胶质细胞、小胶质细胞等胶质类细胞,其中少突胶质细胞对缺氧损伤最为敏感〔10〕,因此认为缺氧导致的脑白质疾病可能是通过损伤少突胶质细胞而引起的〔2〕。OPC属于多能干细胞,在体外一定诱导因素的作用下,OPC分化成星形胶质细胞、少突胶质细胞和神经元的潜能,对神经系统损伤修复将会发挥具有重要作用。
OPC会分化产生成熟的少突胶质细胞,是中枢神经系统发育过程中形成轴突髓鞘的主要成分,如果少突胶质细胞病变损伤就会发生中枢神经系统脱髓鞘疾病。本文培养的细胞体积不大,由开始的双极细胞形,逐渐在胞体周围出现细小突起,随着培养时间的延长,细胞突起逐渐增多,并成2、3级分支,相邻的细胞之间突起相连,形成接触面(点),在外观上符合OPC的形态特点。研究认为,OPC的鉴定除了形态指标外,还可以使用免疫染色、定量实时PCR或Western印迹等技术检测OPC表面A2B5、NG2等特异性抗体进行标记鉴定〔11〕。也有科学家通过miRNA技术下调少突胶质细胞标志物A2B5、NG2〔12〕,抑制OPC分化而确定OPC的培养结果。本文通过免疫组织化学的方法荧光标记证明培养的细胞属于OPC,与其他学者研究一致,也为进一步实验奠定了实验基础。
目前已知神经营养因子(NGF)、脑源性神经生长因子(BDNF)、白血病抑制因子(LIF)等许多生长因子均参与或维持OPC的增殖与存活〔13〕。其中血小板源性生长因子(PDGF)-α、碱性成纤维细胞生长因子(bFGF)〔14〕、神经生长因子(NT)-3〔15〕和IGF-1〔16〕等4种多肽因子与OPC的增殖密切相关。
IGF-1属于IGF家族的成员〔17〕,是神经系统发育的重要调控因子,在中枢神经系统发育和分化中具有重要作用;IGF-1具有减少损伤神经元死亡、促进突起生长和突触形成的作用〔18〕。IGF-1是体内少突胶质前体细胞生长需要的重要生长因子,IGF-1参与中枢神经系统损伤后,对神经元的再生和修复过程〔19〕。本实验尚发现,在缺氧条件下,使用IGF-1刺激OPC可以促进该细胞增殖,也验证了IGF-1是能够促进OPC增殖的营养因子。本实验认为,对于老年性脑白质疾病,有可能通过使用IGF-1通过刺激OPC可以促进该细胞增殖,逆转老年脑白质脱髓鞘性疾病的症状。
自噬参与去除、回收多余的或损坏的细胞器和细胞质,是细胞生存、分化、发育和维持内环境动态平衡至关重要的现象〔20〕。本实验观察到,缺氧条件下,IGF-1刺激的OPC自噬现象明显,而凋亡呈现降低变化,这可能是由于OPC在IGF-1影响下,分泌NGF、VEGF等细胞因子〔21〕,BDNF 与其特异性受体TrK B结合通过Ras能激活PI3K途径〔22〕,激活的PI3K可改变质膜小叶内磷脂肌醇的构成,进一步导致Akt 蛋白激酶 B 易位到质膜,激活PI3K/Akt/mTOR通路这一调节自噬的经典途径〔23〕。激活的保护性自噬行为,可以防止线粒体等细胞器氧化损伤〔24〕。细胞自噬表达升高,降解因为缺氧而引起的结构或功能异常的细胞,产生的氨基酸或ATP可以被其他细胞继续利用,这种自噬现象是生物进化形成的保护机制〔25〕。说明IGF-1促进OPC的增殖有可能通过增加自噬途径而实现,当然,相关的机制研究还需要深入探讨。
4参考文献
1Boyko M,Gruenbaum SE,Gruenbaum BF,etal. Brain to blood glutamate scavenging as a novel therapeutic modality: a review〔J〕.J Neural Transm,2014;202(2): 8-14.
2Verney C,Monier A,Fallet-Bianco C,etal. Early microglial colonization of the human forebrain and possible involvement in periventricular white-matter injury of preterm infants〔J〕.J Anat,2010;217(4): 436-48.
3Almad AA,Maragakis NJ. Glia: an emerging target for neurological disease therapy〔J〕.Stem Cell Res Ther,2012;3(5): 37.
4Madathil SK,Evans HN,Saatman KE. Temporal and regional changes in IGF-1/IGF-1R signaling in the mouse brain after traumatic brain injury〔J〕.J Neurotrauma,2010;27(1): 95-107.
5伍亚民,马海涵,廖维宏. 大鼠星形胶质细胞和少突胶质细胞的纯化培养与鉴定〔J〕.创伤外科杂志,2000;(4): 207-9.
6Armstrong RC. Isolation and characterization of immature oligodendrocyte lineage cells〔J〕.Methods,1998;16(3): 282-92.
其次,在双创教育师资团队建设方面,学校应积极重视打造一支由学校骨干教师和企业专家组成的优秀创新创业导师队伍。由于来自“学院派”的校内导师缺乏在企工作经历和项目合作案例,导师队伍结构中来自校外背景的人员应多些。校外导师的聘用途径包括:一是从已毕业的往届优秀校友中选择一批拥有成功创业历程和经验的;二是与当地政府和创业产业园区合作,甄选出社会责任感强的、经营管理经验丰富的企业专家。
7Kleinsimlinghaus K,Marx R,Serdar M,etal. Strategies for repair of white matter: influence of osmolarity and microglia on proliferation and apoptosis of oligodendrocyte precursor cells in different basal culture media〔J〕.Front Cell Neurosci,2013;7: 277.
8Resch B,Neubauer K,Hofer N,etal. Episodes of hypocarbia and early-onset sepsis are risk factors for cystic periventricular leukomalacia in the preterm infant〔J〕.Early Hum Dev,2012;88(1): 27-31.
9Resch B,Resch E,Freidl T,etal. Preterm twin and triplet pregnancies are at increased risk for the development of cystic periventricular leukomalacia〔J〕.Eur J Paediatr Neurol,2013;17(2): 148-52.
10Perlman JM,Risser R,Broyles RS. Bilateral cystic periventricular leukomalacia in the premature infant: associated risk factors〔J〕.Pediatrics,1996;97(6 Pt 1): 822-7.
11Mangin JM,Li P,Scafidi J,etal. Experience-dependent regulation of NG2 progenitors in the developing barrel cortex〔J〕.Nat Neurosci,2012;15(9): 1192-4.
12Murtie JC,Zhou YX,Le TQ,etal. In vivo analysis of oligodendrocyte lineage development in postnatal FGF2 null mice〔J〕.Glia,2005;49(4): 542-4.
13Niu J,Wang L,Liu S,etal. An efficient and economical culture approach for the enrichment of purified oligodendrocyte progenitor cells〔J〕.J Neurosci Methods,2012;209(1): 241-9.
14Fu SL,Hu JG,Li Y,etal. A simplified method for generating oligodendrocyte progenitor cells from neural precursor cells isolated from the E16 rat spinal cord〔J〕.Acta Neurobiol Exp (Wars),2007;67(4): 367-77.
15Kahn MA,Kumar S,Liebl D,etal. Mice lacking NT-3,and its receptor TrkC,exhibit profound deficiencies in CNS glial cells〔J〕.Glia,1999;26(2): 153-65.
16Zeger M,Popken G,Zhang J,etal. Insulin-like growth factor type 1 receptor signaling in the cells of oligodendrocyte lineage is required for normal in vivo oligodendrocyte development and myelination〔J〕.Glia,2007;55(4): 400-11.
17Zhang Y,Zhang J,Shi Z,etal. Insulin-like growth factor binding protein-2 (IGFBP-2) in Japanese flounder,Paralichthys olivaceus: molecular cloning,expression patterns and hormonal regulation during metamorphosis〔J〕.Fish Physiol Biochem,2013;39(6): 1541-54.
18Apel PJ,Ma J,Callahan M,etal. Effect of locally delivered IGF-1 on nerve regeneration during aging: an experimental study in rats〔J〕.Muscle Nerve,2010;41(3): 335-41.
19Lee W,Frank CW,Park J. Directed axonal outgrowth using a propagating gradient of IGF-1〔J〕.Adv Mater,2014;35(4): 1104-54.
20Codogno P. Shining light on autophagy〔J〕.Nat Rev Mol Cell Biol,2014;15(3): 153.
21Jin C,Guo J,Qiu X,etal. IGF-1 induces iNOS expression via the p38 MAPK signal pathway in the anti-apoptotic process in pulmonary artery smooth muscle cells during PAH〔J〕.J Recept Signal Transduct Res,2014;31(8): 1821-33.
22Reichardt LF. Neurotrophin-regulated signalling pathways〔J〕.Philos Trans R Soc Lond B Biol Sci,2006;361(1473): 1545-64.
23Wolin EM. PI3K/Akt/mTOR pathway inhibitors in the therapy of pancreatic neuroendocrine tumors〔J〕.Cancer Lett,2013;335(1): 1-8.
24Fang L,Zhou Y,Cao H,etal. Autophagy attenuates diabetic glomerular damage through protection of hyperglycemia-induced podocyte injury〔J〕.PLoS One,2013;8(4): e60546.
25Meijer AJ,Codogno P. Autophagy: a sweet process in diabetes〔J〕.Cell Metab,2008;8(4): 275-6.
〔2014-03-12修回〕
(编辑袁左鸣)
