核心蛋白聚糖在两株子宫内膜癌细胞中的表达及意义
2015-12-31邓守恒,李林均,曹风军等
核心蛋白聚糖在两株子宫内膜癌细胞中的表达及意义
邓守恒李林均曹风军蔡晓军孟燕陈萍
(湖北医药学院附属人民医院肿瘤中心,湖北十堰442000)
摘要〔〕目的观察表皮生长因子受体(EGFR)信号通路抑制剂RG-14260(RG)单独及RG联合雷帕霉素靶蛋白(mTOR)信号通路抑制剂Rapamycin(RA)体外对两株子宫内膜癌细胞(PTEN缺失的Ishikawa细胞和PTEN表达完整的HEC-1A细胞)增殖及核心蛋白聚糖(DCN)表达的影响。方法两株子宫内膜癌细胞分别经RG及RG联合RA作用24 h后,免疫组织化学法检测细胞增殖细胞核抗原(PCNA)表达;RT-PCR法和免疫印迹法分别检测细胞内DCN基因和蛋白的表达改变。结果RG单用及联合RA均可降低Ishikawa细胞PCNA阳性细胞表达率,促进细胞DCN基因和蛋白的表达;RG单用或联合RA对HEC-1A细胞的上述作用不明显。结论PTEN基因缺失使相应信号通路抑制剂作用的子宫内膜癌细胞增殖明显受抑,细胞表达DCN增多,反过来又促进细胞增强对相关信号通路抑制剂作用的敏感性。
关键词〔〕子宫内膜癌; RG-14260; Rapamycin; 核心蛋白聚糖
中图分类号〔〕R737.33〔文献标识码〕A〔
基金项目:湖北省教育厅项目(Q20092401); 湖北医药学院创新团队项目(2008CXZ02);湖北省自然科学基金(2013CDZ011)
通讯作者:陈萍(1962-),女,主任医师,教授,硕士生导师,主要从事妇科肿瘤研究。
第一作者:邓守恒(1973-),男,博士,教授,主要从事肿瘤药理研究。
Expression and significance of Decorin in two human endometrial carcinoma cells cultured in vitro
DENG Shou-Heng,LI Lin-Jun,CAO Feng-Jun,etal.
Center of Oncology,People's Hospital Affiliated to Hubei University of Medicine,Shiyan 442000,Hubei,China
Abstract【】ObjectiveTo investigate the effects of RG alone or combined with RA on cell proliferation and Decorin expression in cultured two human endometrial carcinoma cells Ishikawa(PTEN-) and HEC-1A(PTEN+) in vitro. MethodsAfter treated with RG alone or combined with RA for 24 hours,PCNA was measured to determine the proliferative inhibition effects of two inhibitors on tumor cells. The expression of Decorin mRNA and Decorin protein was measured by RT-PCR and Western blot respectively.ResultsIn Ishikawa cells,RG alone or combined with RA could decrease cell PCNA positive rate and promote the expression of Decorin mRNA and protein abundance. The effect of RG combined with RA was better than that of RG alone. But in HEC-1A cells,the effects above were not obvious.ConclusionsLoss of PTEN in endometrial carcinoma cells may inhibit the cell proliferation and promote the expression of Decorin mRNA and protein abundance,which due to the enhancing sensitivity of cells to related signal transduction inhibitors.
【Key words】Endometrial carcinoma; RG-14260; Rapamycin; Decorin
子宫内膜癌是中老年女性最常见的恶性肿瘤之一,按发病机制可将其分为两型〔1~3〕:Ⅰ型与雌激素相关,占85%,主要分子病理改变为:人10号染色体上磷酸酶和张力蛋白基因(PTEN)突变缺失及k-RAS突变等;Ⅱ型与雌激素无关,占15%,PTEN及k-RAS基因表达完整。表皮生长因子受体(EGFR)及雷帕霉素靶蛋白(mTOR)信号通路在子宫内膜癌的发生、发展中起着十分重要的作用。当前,针对相关信号传导通路展开分子靶向治疗已成为肿瘤个体化治疗的新策略,本研究拟采用EGFR及mTOR两条信号通路抑制剂在体外作用于PTEN基因呈不同表达状态的两株子宫内膜癌细胞(PTEN表达缺失的Ishikawa细胞和PTEN表达完整的HEC-1A细胞),观察两株子宫内膜癌细胞在处理前后细胞增殖及细胞内核心蛋白聚糖(Decorin,DCN)基因和蛋白水平的表达变化,进一步探明子宫内膜癌发病机制。
1材料与方法
1.1 药品试剂与仪器DMEM培养基及小牛血清购自美国GIBCO公司;表皮生长因子(EGF)为Sigma产品;EGFR抑制剂RG-14620(RG)、mTOR抑制剂雷帕霉素(RA)购自美国Biomol公司; DCN抗体购于北京中杉金桥生物技术有限公司;小鼠抗人增殖细胞核抗原(PCNA) 单克隆抗体购自美国Santa Cruz公司;SABC免疫组化试剂盒及DAB 显色试剂盒购自武汉博士德公司;Trizol总RNA抽提试剂盒、RevertAidTM First strandcDNA synthesis kit 为Fermentas产品;BMP型倒置相差显微镜(日本OLYMPUS公司);AM-PLITRON Ⅱ型PCR扩增仪(美国Barnscread/Thermolyme公司。
1.2 方法
1.2.1 细胞培养及分组两株子宫内膜癌细胞株(Ishikawa和HEC-1A)由本院临床医学研究所提供,培养于含10%小牛血清的DMEM培养基内,于37℃、饱和湿度,5%二氧化碳(CO2)条件下培养。
1.2.2 免疫组化法检测细胞PCNA表达参照文献〔4〕将各组经EGF预处理2 h的细胞悬液分别接种于铺有盖玻片(按细胞培养用品清洗和高压灭菌)的6孔板中,孵育24 h后各自分为A(对照组)、B(10 μmol/L RG处理组)、C(10 μmol/L RA处理组)、D(10 μmol/L RG+10 μmol/L RA处理组)4组,孵育24 h后取出盖玻片,采用免疫组织化学法检测PCNA表达,比较各组PCNA 阳性细胞率,即每100个细胞中的阳性细胞数。
1.2.3 Western印迹法检测DCN蛋白表达两株细胞接种于6孔板,经EGF预处理2 h后各自分为A(对照组)、B(10 μmol/L RG处理组)、C(10 μmol/L RG+10 μmol/L RA处理组)3组,培养24 h后收集细胞,PBS液洗2次,裂解,离心,收集上清,即为细胞总蛋白,进行蛋白定量,调节每份样品蛋白浓度,加等量蛋白于上样缓冲液,煮沸,在SDS聚丙烯酰胺凝胶中电泳。电泳后转膜,依次加入DCN一抗和二抗,加入底物液显色,拍照,蛋白条带用Quanti Scan软件进行密度扫描分析。
1.2.4 RT-PCR检测DCN mRNA表达细胞分组及处理同1.2.3,用Trizol提取细胞总RNA,cDNA合成体系20 μl,小鼠白血病病毒(M-MLV)逆转录酶200 U,二硫苏糖醇(DTT)0.2 μmol/L,RNA酶抑制剂(RNase 抑制剂,RNasin)20 U,四种脱氧核苷酸混合物(dNTP)20 nmol/L,随机引物100 ng,RNA模板1 μg,25℃10 min,42℃ 60 min,95℃ 1 min灭活逆转录酶,冰浴1 min。PCR反应引物为,DCN上游引物:5′ACC GAA ATC AAA GAT GGA GAC T 3′下游引物:5′ATC AGC AAT GCG GAT GTA GGA G 3′扩增产物为348 bp,反应体系25 μl,94℃预变性5 min,94℃变性30 s,49℃退火30 s,72℃延伸45 s,30个循环,最后72℃ 5 min结束反应。β-actin上游引物:5,ACG GAT TTG GTC GTA TTG GG 3,下游引物为:5,TGA TTT TGG AGG GAT CTC GC 3,扩增产物为230 bp。取10 μl扩增产物行1.5%琼脂糖凝胶电泳,溴乙啶染色,紫外灯下观察并照相,凝胶图像分析仪分析,根据DCN与β-actin灰度比值,进行目的基因表达的半定量分析。
2结果
2.1 两株子宫内膜癌细胞内PCNA的表达显微镜下可见,PCNA阴性细胞核无着色,胞质呈淡黄色。阳性细胞整个核内分布着大小均匀的浅黄色、黄色或棕黄色细小颗粒。细胞计数结果显示,未经处理的两株子宫内膜癌细胞内PCNA阳性细胞数目相当,经RG和RA两种信号通路抑制剂作用后, Ishikawa细胞变化明显,PCNA阳性率明显低于相同处理的HEC-1A细胞组(P=0.022、0.043),二药合用后两株细胞PCNA阳性率差异更为显著(P=0.007)。在Ishikawa细胞内,与未加药的空白组比较,两种抑制剂单用均可降低PCNA阳性表达率 (P=0.036、0.027),合用效果更为显著(P=0.001),而在HEC-1A细胞内,无论抑制剂单独或合用PCNA阳性率与空白组比较变化均不大,作用效果不明显(P=0.061、0.064和0.059),见表1。
表1各组别两株子宫内膜癌细胞PCNA阳性表达百分率比较(n=4,%)
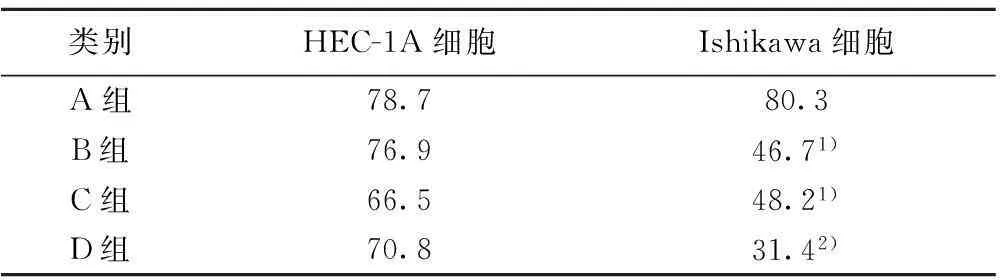
类别HEC-1A细胞Ishikawa细胞A组78.780.3B组76.946.71)C组66.548.21)D组70.831.42)
与同组别HEC-1A细胞比较:1)P<0.05,2)P<0.01
2.2 抑制剂对两株细胞DCN蛋白表达的影响从图1中可见,两株子宫内膜癌细胞中均存在DCN蛋白的表达,经10 μmol/LRG及10 μmol/L RG联合10 μmol/L RA作用24 h后,Ishikawa细胞内DCN蛋白表达量呈不同程度的增多,尤其以两种抑制剂合用增加效果更为显著。定量分析结果显示,未经处理的Ishikawa细胞内DCN的灰度值为0.191±0.025 8,经RG及RG联合RA作用后,灰度值则分别上升至0.288±0.089 9(P=0.031)和0.437±0.016 5(P=0.002)。相比之下,HEC-1A细胞内DCN蛋白的表达量则受抑制剂影响较小,A、B、C组DCN蛋白灰度值分别为0.494±0.021 6、0.477±0.015 9和0.459±0.082 1(P=0.072和0.068)。
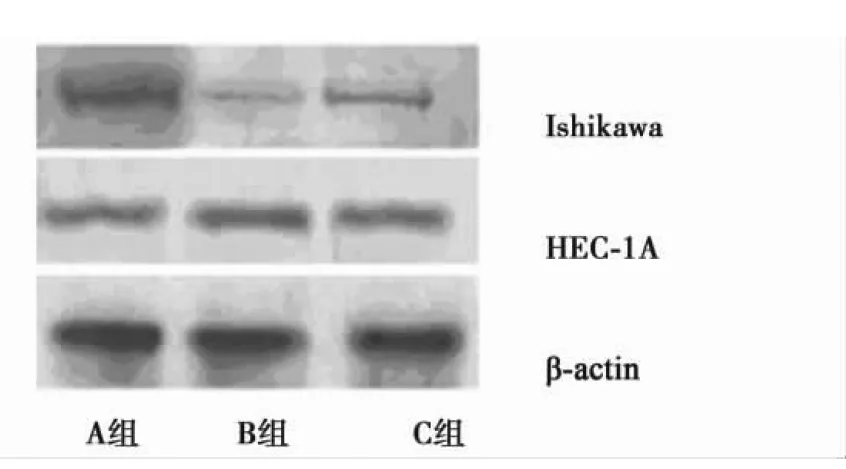
图1 RG与RA单独和合用对两株子宫内膜癌细 胞DCN蛋白表达影响
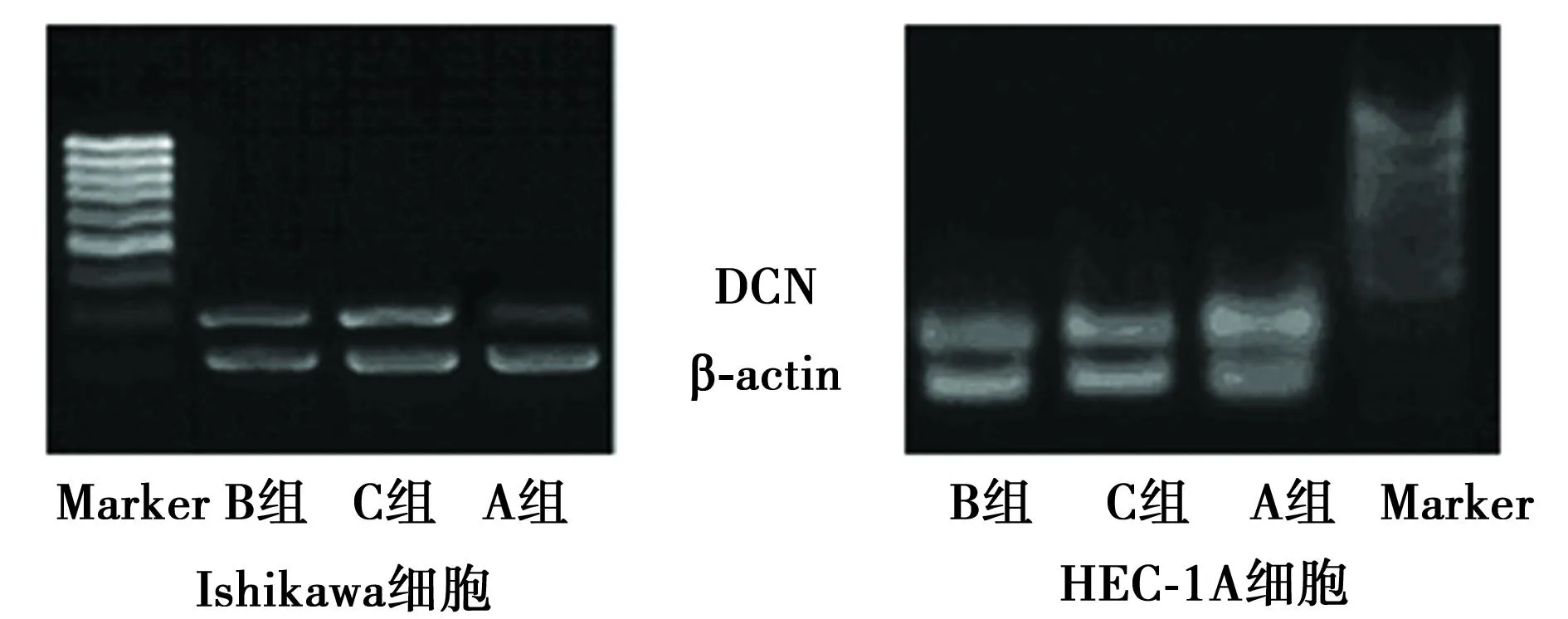
图2 RG与RA单独和合用对两株子宫内膜癌 细胞DCN mRNA表达的影响
2.3 抑制剂对两株细胞DCN mRNA表达的影响从图2中可见,两株子宫内膜癌细胞内均有DCN mRNA的表达, 10 μmol/L RG及10 μmol/L RG联合10 μmol/L RA作用24 h均可明显上调Ishikawa细胞内DCN mRNA的表达水平,尤其以二药合用效果更为显著。半定量分析结果显示,A组Ishikawa细胞内DCN mRNA的比值为0.258±0.033 4,经RG及RG联合RA作用24 h后,比值分别上升至0.595±0.064 2 (P=0.017)和0.858±0.070 6 (P=0.01)。而HEC-1A细胞内DCN mRNA的表达则受抑制剂作用影响较小,对照组及RG或RG联合RA组内DCN mRNA的灰度比值分别为0.775±0.017 3、0.751±0.035 3和0.777±0.032 4(P=0.064,P=0.057)。
3讨论
自Torrance等〔5〕于2000年首次在国际上报道联合应用EGFR酪氨酸激酶抑制剂(Tarceva)和环氧化酶(COX)-2抑制剂(Celecoxib)能有效抑制家族性结肠息肉生长后,对恶性肿瘤实行多靶点联合靶向治疗逐渐引起人们的重视。目前,以EGFR或mTOR为靶点的分子靶向治疗在多种肿瘤的治疗中都取得了较好疗效〔6,7〕。
本研究发现PTEN基因表达缺失的Ishikawa细胞对抑制剂作用敏感,无论RG、RA单独或联用均能降低细胞内PCNA阳性表达率,联用效果更为明显。而PTEN基因表达完整的HEC-1A细胞则对抑制剂作用不敏感。由于PCNA是一种主要表达在细胞增殖周期S期的核内蛋白,其作为DNA复制时δ聚合酶的辅助物,可直接参与核内DNA的合成,与细胞增殖有明显关系,故被认为是另一种可准确反映细胞增殖状态的评判指标〔8〕,PCNA检测结果说明,EGFR和mTOR信号通路抑制剂均可明显抑制Ishikawa细胞增殖,而对HEC-1A细胞生长影响不大,与本研究前期采用MTT法和流式细胞法检测结果一致〔9,10〕。
DCN是一种富含亮氨酸的蛋白聚糖,被认为是一种肿瘤生长的负性调节因子〔11〕,有研究表明,DCN的表达与肿瘤的恶性程度呈负相关,即DCN的表达越高,肿瘤的恶性程度越低,反之,DCN的表达越低,肿瘤的恶性程度则越高〔12,13〕。本实验显示在Ishikawa细胞内,EGFR和mTOR信号通路抑制剂单独或联用均可明显上调DCN基因和蛋白的表达水平,而在HEC-1A细胞内DCN的基因和蛋白表达则不受影响。
两株子宫内膜癌细胞对相关信号通路抑制剂存在不同的敏感性推测主要与PTEN基因有关〔14〕,PTEN基因作为抑癌基因,其表达的PTEN蛋白可通过双重磷酸酯酶活性负性调控PI3K/AKT/mTOR、FAK及MAPK途径进而对细胞增殖、凋亡、迁移等产生影响。Ishikawa细胞内由于缺乏PTEN蛋白,使得原癌基因ErbB1(HER1)的表达产物EGFR及其下游PI3K/AKT/mTOR通路呈一种慢性激活状态,故而对抑制剂作用敏感。此外,有研究报道,DCN的抗肿瘤作用与其能抑制EGFR的酪氨酸激酶活性,减弱EGFR介导的胞内钙动员及激活细胞凋亡蛋白激酶促发细胞凋亡有关〔15,16〕。本实验中,EGFR和mTOR信号通路抑制剂能在基因和蛋白水平上明显上调Ishikawa细胞内DCN的表达,而增多的DCN蛋白反过来又可通过抑制EGFR的酪氨酸激酶活性进而进一步增强其对细胞增殖的抑制作用,这可能也是Ishikawa细胞对信号通路抑制剂作用敏感的另一原因。
4参考文献
1Lax SF,Kurman RJ. A dualistic model for endometrial carcinogenesis based on immunohisto-chemical and molecular geneticanalyses〔J〕. Verh Dtsch Ges Path,1997;81(10):228-32.
2邓守恒,石建国,柯贤柱,等. mTOR信号通路在ishikawa细胞增殖中的作用〔J〕.中国实验方剂学杂志,2011;17(12):223-6.
3熊润青,许相范,马多,等.经阴道超声在子宫内膜病变中的鉴别诊断价值〔J〕.湖北医药学院学报,2008;27(6):519-21.
4韩锐.抗癌药物研究与实验技术〔M〕.北京:北京医科大学中国协和医科大学联合出版社,1996:284-90.
5Torrance CJ,Jackson PE,Montgomery E,etal. Combinatorial chemoprevention of intestinal neoplasia〔J〕. Nat Med,2006;6(9):1024-8.
6Dancey J. Epidermal growth factor receptor inhibition in clinical development〔J〕. Int J Raiat Oncol Biol Phys,2008;58(3):1003-7.
7陈萍,周保锋,曹凤军. 联合靶向阻断EGFR和mTOR信号通路增强紫杉醇对子宫内膜癌细胞化疗敏感性〔J〕. 时珍国医国药,2011;22(12):2945-6.
8周清,郭娴呤,杨晓曦,等. 核心蛋白聚糖对翼状胬肉成纤维细胞增殖的影响〔J〕. 中国病理生理杂志,2012;28(5):919-23.
9邓守恒,喻雄杰,曹凤军,等. RG-14260与雷帕霉素联合给药对两株子宫内膜癌细胞的作用〔J〕.中国老年学杂志,2012;32(1):85-7.
10邓守恒,喻雄杰,曹凤军,等.信号通路抑制剂对两株子宫内膜癌细胞生物学行为的影响〔J〕.中国全科医学,2011;14(7B):2280-3.
11袁媛,周静,姜政.核心蛋白聚糖生物学研究进展〔J〕.医学综述,2011;17(9):1303-6.
12Matsumine A,Shintani K,Kusuzaki K,etal. Expression of decorin,a small leucine-rich proteoglycan,as a prognostic factor in soft tissue tumors〔J〕.J Surg Oncol,2007;96(5):411-8.
13Campo S,Campo GM,Avenoso A,etal.Lymphocytes from patients with early stage of B-cell chronic lymphocytic leukemia and long survival synthesize decorin〔J〕. Biochimie,2006;88(12):1933-9.
14李志伟,李彩红,张智慧,等. 子宫内膜癌中PTEN蛋白、P-AKT蛋白的表达及意义〔J〕. 现代肿瘤医学,2013;21(3):633-5.
15Gokloni S,Lozzo RA,Kay P,etal. A soluble ectodomain of LRIGI inhibits cancer cell growth by attenuating basal and ligand-dependent EGFR activity〔J〕.Oncogene,2007;26(3):368-81.
16鞠文博,王大伟,刘岩峰. 核心蛋白聚糖对HepG2细胞表皮生长因子受体转导蛋白及Ras/Raf信号通路的影响〔J〕. 中国老年学杂志,2013;33(6):1331-3.
〔2013-08-20修回〕
(编辑赵慧玲/曹梦园)
