应用荧光原位杂交检测初治慢性淋巴细胞白血病患者的分子遗传学异常
2015-12-31刘志何,刘春水,李薇等
应用荧光原位杂交检测初治慢性淋巴细胞白血病患者的分子遗传学异常
刘志何刘春水李薇白晶白鸥
(吉林大学第一医院肿瘤中心,吉林长春130021)
摘要〔〕目的探讨荧光原位杂交(FISH)技术检测慢性淋巴细胞白血病(CLL)患者分子遗传学异常的临床意义。方法应用FISH技术,采用4种特异性DNA探针检测88例初治CLL患者的分子遗传学异常,并结合患者临床资料,分析各分子遗传学异常与临床分期的关系。结果88例CLL患者中,52例出现分子遗传学异常,总异常率为59.1%。RB1基因异常发生率最高,为30.7%,其后依次为CSP12(27.3%)、P53及ATM缺失发生率均约为8.0%。结论FISH技术检测分子遗传学异常的敏感性和特异性较高。RB1基因异常是CLL最常见的分子遗传学异常。伴P53及ATM基因异常的的CLL分期较晚,预后较差。
关键词〔〕慢性淋巴细胞白血病;分子遗传学;荧光原位杂交
中图分类号〔〕R446.8〔文献标识码〕A〔
通讯作者:白鸥(1965-),女,教授,主要从事淋巴瘤的临床诊断与治疗研究。
第一作者:刘志何(1987-),男,硕士,主要从事白血病的临床诊断与治疗研究。
慢性淋巴细胞白血病(CLL)以中老年人群为主。CLL患者生存期个体差异很大。1976年Rai等〔1〕提出的Rai分期系统以及1981年Binet等〔2〕提出的Binet分期系统是目前CLL的经典分期系统,但这些分期系统在预测分期早或预后不良患者疾病生物学行为及预后方面仍存在不足〔3〕。文献〔4〕报道,细胞遗传学异常与CLL患者生物学行为及预后密切相关。但CLL分裂期细胞比例低,传统细胞遗传学检测(CC)仅能检测出约20%的细胞遗传学异常,而荧光原位杂交(FISH)技术不仅可检测分裂期细胞,亦可检测间期细胞的分子遗传学异常,故在CLL患者中可检测出80%以上的分子遗传学异常,大大提高了阳性率〔5〕。本研究应用FISH技术,采用4种特异性DNA探针检测88例初治CLL患者的分子遗传学异常,并结合患者的临床资料来探讨各种分子遗传学异常与疾病分期及预后的关系。
1资料与方法
1.1资料2009年7月至2014年7月在我院诊断的门诊和住院CLL患者88例,男49例,女39例,年龄40~84岁,中位年龄61.5岁。所有病例诊断标准参照《血液病诊断及疗效标准》〔6〕。根据Rain分期,0期10例,Ⅰ期30例,Ⅱ期18例,Ⅲ期15例,Ⅳ期15例。选取我科28例健康骨髓捐献者的骨髓标本为对照组。
1.2方法
1.2.1骨髓标本的预处理两组标本均取其新鲜骨髓血2 ml,经1 400 r/min离心7 min后去掉上清液,然后加盛有预热至37℃的0.075 mol/L KCl至8 ml,混匀后37℃温浴30 min,取出后加1 ml固定液(甲醇:冰乙酸为3∶1),混匀后1 400 r/min离心7 min,去上清;再加固定液至8 ml,混匀后室温下静置30 min,离心,去上清,如此再重复2次,再加固定液2 ml混匀后用EP管保存备用。用吸管取EP管里的标本滴于干净的玻片上,自然干燥后将玻片置于56℃的烤片机上30 min,取出玻片后放入2×SSC、2×SSC溶液中各5 min,取出后将玻片依次置于70%乙醇、85%乙醇、100%乙醇各2 min脱水。自然干燥玻片。
1.2.2FISH操作步骤①探针:采用4种特异性DNA探针,分别为RB1、ATM、P53、CSP12,分别定为于13q14、11q22.3、17p13.1、12p11.1-12q11.1,以上探针均购于北京金蓓嘉生物技术公司。②标本的准备及变性:用砂轮在玻片背面固定标本的对应区域标记出杂交区域,保证变性温度达到78℃,杂交温度达到37℃。③探针混合物准备及变性杂交:室温下将7 μl杂交缓冲液、1 μl去离子水、2 μl探针加至离心管,离心3~5 s,置于杂交仪中变性5 min(78℃),杂交16 h(37℃)。④玻片洗涤:将杂交后的玻片取出去掉盖玻片,放入46℃预温的2×SSC溶液中,轻轻晃动,洗涤5 min,后放入46℃预温的0.1×NP40溶液中,轻轻晃动,洗涤3 min,转至室温,置于70%的乙醇中洗涤2 min,室温干燥。⑤复染:加10 μl 4′6-二脒基-2-苯基吲哚(DAPI)复染剂,加盖玻片,荧光显微镜下观察。
1.2.3荧光显微镜检测及结果判读在荧光显微镜选择符合标准的区域观察。在正常间期细胞中RB1为2个绿色(2G),ATM为2个红色(2R),P53为2个绿色(2G),CSP12为2个红色(2R);在异常间期细胞中RB1为1G,ATM为1R,P53为1G,CSP12为3R。
2结果
2.1对照组28例对照组标本中每一种探针均观察300个间期细胞,统计出异常情况的细胞比例并建立阈值(阈值=均值+3×标准差)。RB1阈值为4.6%,ATM阈值为5.0%,P53阈值为4.8%,CSP12阈值为3.8%。
2.2病例组
2.2.1FISH检测结果88例初治CLL患者中,无分子遗传学异常36例(40.9%),59.1%(52/88)的患者至少存在1种以上的分子遗传学异常,52例分子遗传学异常的患者中,单一分子遗传学异常的40例(45.51%),合并2种分子遗传学异常的11例(12.5%),合并3种分子遗传学异常的1例(1.1%)。
最常见的分子遗传学异常类型为RB1缺失,发生率为30.7%(27/88),其次为12号染色体的增加,发生率为27.3%(24/88),发生率最低的为P53和ATM,均为8.0%(8/88)。
2.2.2分子遗传学异常与Rain分期的关系仅RB1分子遗传学异常的患者19例,其中57.9%(11/19)的患者Rain分期为0或Ⅰ期,42.1%(8/19)的患者分期为Ⅱ~Ⅳ期。单独12号染色体异常的CLL患者19例,其中52.6%(10/19)的患者分期为I期,47.4%(9/19)的分期为Ⅱ~Ⅳ期。14例患者P53或ATM单独缺失或者合并RB1缺失,85.7%的患者分期为Ⅲ~Ⅳ期。见表1。
表1根据Rain分期的分子遗传学异常〔n(%)〕
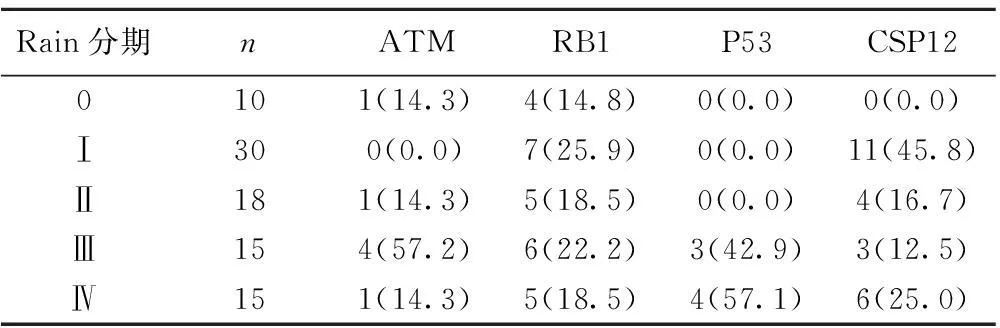
Rain分期nATMRB1P53CSP120101(14.3)4(14.8)0(0.0)0(0.0)Ⅰ300(0.0)7(25.9)0(0.0)11(45.8)Ⅱ181(14.3)5(18.5)0(0.0)4(16.7)Ⅲ154(57.2)6(22.2)3(42.9)3(12.5)Ⅳ151(14.3)5(18.5)4(57.1)6(25.0)
3讨论
CLL是一种低度恶性的克隆性淋巴细胞疾病,其生物学行为存在异质性。目前认为分子遗传学异常与CLL生物学行为及预后密切相关,分子遗传学异常主要涉及RB1、ATM、P53、CSP12。相关资料报道,仅涉及RB1基因异常的CLL患者中位生存时间为133个月,仅涉及12号染色体基因异常的CLL患者生存期为114个月,仅涉及ATM基因异常的CLL患者生存期为79个月,仅涉及P53基因异常的CLL患者生存期为32个月。
Durak等〔4〕对79例初治CLL患者进行FISH检测,其中13q14.3缺失发生率最高,为32.9%,其后依次为P53缺失(7.6%)、ATM缺失(5.1%)、CSP12(15.2%);El-Taweel等〔6〕应用FISH缺失对46例初治CLL患者进行了检测,13q14缺失发生率最高,为70%,其后依次为P53(24%)、ATM(21.7%)、CSP12(17%);曹鹏飞等〔7〕应用FISH检测46例初治CLL患者,分子遗传学异常发生率依次为ATM缺失(17.4%)、13q14.3缺失(30.4%)、P53缺失(15.2%)、CSP12缺失(21.7)、RB1缺失(10.9%);戴丹等〔8〕应用FISH对30例初治CLL患者进行了检测,其中发生率最高的为RB1缺失(43.3%),其后依次为CSP12缺失(23.3%)、ATM缺失(13.3%)、P53缺失(10.0%)。本研究与戴丹报道基本一致,而不同于其他文献报道数据。考虑可能与各研究中心所制定的阈值不同有关。目前国外将FISH检测的阈值定为20%,而国内目前对于CLL的FISH检测尚未制定可参照的标准阈值。
RB1基因为CLL患者最常见的分子遗传学异常,且在伴IgHV基因突变的CLL患者中更易见,相关文献报道〔9〕,伴RB1基因缺失的CLL患者预后较好。
12号染色体三体可见于15%~23%的CLL患者〔10〕,既往文献报道〔11〕,伴CSP12的CLL患者与高增殖、分期晚及生存期短有关。但在生存期上优于伴有P53或者ATM基因异常的CLL患者,本研究提示预后一般。
ATM基因位于11q22,该区域基因异常导致ATM基因成为杂合子〔12〕。ATM基因可传导DNA损伤信号及介导P53基因活化,在维持基因稳定性方面具有重要作用。P53基因为抑癌基因,其功能正常具有重要的临床意义,P53基因缺失后导致P53蛋白失去正常功能,而P53蛋白无功能是疾病进展和治疗耐药的关键环节。
4参考文献
1Rai KR,Sawitsky A,Cronkite EP,etal.Clinical staging of chronic lymphocytic leukemia〔J〕.Blood,1975;46(2):219-34.
2Binet JL,Auquier A,Dighiero G,etal.A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis〔J〕.Cancer,1981;48(1):198-206.
3Binet JL,Caligaris-Cappio F,Catovsky D,etal.Perspectives on the use of new diagnostic tools in the treatment of chronic lymphocytic leukemia〔J〕.Blood,2006;107(3):859-61.
4Durak B,Akay OM,Aslan V,etal.Prognostic impact of chromosome alterations detected by FISH in Turkish patients with B-cell chronic lymphocytic leukemia〔J〕.Cancer Genet Cytogenet,2009;188(2):65-9.
5Döhner H,Stilgenbauer S,Benner A,etal.Genomic aberrations and survival in chronic lymphocytic leukemia〔J〕.N Eng J Med,2000;343(26):1910-6.
6El-Taweel M,Barin C,Cymbalista F,etal.Detection of chromosomal abnormalities associated with chronic lymphocytic leukemia:what is the best method〔J〕?Cancer Genet Cytogenet,2009;195(1):37-42.
7曹鹏飞,陈苏华,张国平,等.荧光原位杂交技术检测慢性淋巴细胞白血病细胞遗传学的异常〔J〕.临床血液学杂志,2014;2(1):25.
8戴丹,张秀群,张学忠,等.30 例慢性淋巴细胞白血病分子遗传学异常的 FISH 检测的意义〔J〕.中国实验血液学杂志,2009;17(1):31-5.
9Chiorazzi N.Implications of new prognostic markers in chronic lymphocytic leukemia〔J〕.Am Soc Hematol Edu Program,2012;2012(1):76-87.
10Quijano S,López A,Rasillo A,etal.Impact of trisomy 12,del (13q),del (17p),and del (11q) on the immunophenotype,DNA ploidy status,and proliferative rate of leukemic B-cells in chronic lymphocytic leukemia〔J〕.Cytometry B Clin Cytom,2008;74(3):139-49.
11Zenz T,Döhner H,Stilgenbauer S.Genetics and risk-stratified approach to therapy in chronic lymphocytic leukemia〔J〕.Best Pract Res Clin Haematol,2007;20(3):439-53.
12Kiefer Y,Schulte C,Tiemann M,etal.Chronic lymphocytic leukemia-associated chromosomal abnormalities and miRNA deregulation〔J〕.Appl Clin Genet,2012;5(1):21-8.
〔2013-12-09修回〕
(编辑袁左鸣)
