Wnt信号通路的组件蛋白DKK-1、β-链接素及周期素D1蛋白表达与胃癌的相关性
2015-12-31李春辉,潘理会,佟晓波等
Wnt信号通路的组件蛋白DKK-1、β-链接素及周期素D1蛋白表达与胃癌的相关性
李春辉潘理会1佟晓波1谢立德1
(承德医学院附属医院病理科,河北承德067000)
摘要〔〕目的探讨Wnt信号通路中的组件蛋白DKK-1、β-catenin及周期素(Cyclin)D1在胃癌的发生、发展及转移的相互关系。方法采用免疫组织化学方法标记DKK-1、β-catenin及CyclinD1蛋白在80例胃癌组织标本,10例正常胃组织中的表达情况。结果①DKK-1在胃癌组织中的表达明显低于胃正常组织(P<0.05),高、中分化胃癌的表达高于低分化胃癌的表达(P<0.05),伴有淋巴结转移的胃癌组织DKK-1较无转移病例阳性率低(P<0.05)。②β-catenin在胃癌组织中的阳性表达率明显高于胃正常组织(P<0.05),高、中分化胃癌的表达低于低分化胃癌的表达(P<0.05),伴有淋巴结转移的胃癌组织β-catenin较无转移病例阳性率高(P<0.05)。③CyclinD1在胃癌组织中的表达明显高于胃正常组织(P<0.05),高、中分化胃癌的表达低于低分化胃癌的表达(P<0.05),伴有淋巴结转移的胃癌组织CyclinD1较无转移病例阳性率较高(P<0.05)。④在胃癌组织中DKK-1与CyclinD1呈负相关关系(r=-0.453,P<0.01),DKK-1与β-catenin呈负相关关系(r=-0.553,P<0.01),CyclinD1与β-catenin呈正相关关系(r=0.562,P<0.05)。结论Wnt信号通路中的组件蛋白DKK-1、β-catenin及CyclinD1在胃癌的发生、发展及转移有一定的相互关系。
关键词〔〕胃癌; Wnt信号通路;DKK-1; β-catenin;CyclinD1; 免疫组化
中图分类号〔〕R735.2〔文献标识码〕A〔
基金项目:河北省2014年政府资助临床优秀人才计划暨河北省医学科学重点课题(ZL20140103)
1承德医学院生物医学工程系
第一作者:李春辉(1963-),男,主任医师,教授,博士,博士生导师,主要从事胃癌的基础与临床研究。
Wnt信号通路的异常与胃癌的发生有着密切的关系,Wnt信号通路由一系列癌基因和抑癌基因编码的蛋白质组成,它们之间彼此联系、相互制约〔1〕。关于Wnt信号通路的β-catenin、DKK-1蛋白及CyclinD1在胃癌发生、发展中相互关系的研究目前国内外尚未见报道。本文用免疫组织化学的方法对三者之间的关系进行探讨。
1材料与方法
1.1标本来源收集承德医学院附属医院2009年9月至2011年3月手术切除经病理证实的胃癌组织标本80例,正常胃组织(距离肿瘤5 cm以外)10例。其中男性59例,女性21例,年龄43~77岁,中位年龄57岁;组织分化程度:高中分化者35例,低分化者45例;无淋巴结转移30例,有淋巴结转移50例。
1.2主要试剂鼠抗人DKK-1、β-catenin、CyclinD1抗体购于福州迈新生物公司。
1.3免疫组织化学染色及定量分析组织切片加一抗DKK-1、 β-catenin和CyclinD1,DAB显色,苏木素复染核,常规脱水、透明封片,另外,部分组织切片用PBS替代DKK-1、β-catenin和 CyclinD1抗体(其余染色步骤相同)作为阴性对照。用已知阳性标本作阳性对照。DKK-1和β-catenin蛋白阳性信号主要表达于细胞质,CyclinD1蛋白阳性信号主要表达于细胞核,采用Volm双评分法进行判定〔2〕在染色均匀的区域,选取5个高倍镜视野(×400):①按阳性细胞百分率(A值)评分:<25%为1分,25%~50%为2分,>50%为3分;②按染色强度(B值)评分:不着色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。综合染色阳性细胞数(A值)与染色强度(B值)相加判断结果:阴性(-):0分,弱阳性(+):1~2分,中度阳性():3~4分,强阳性():5~6分。
1.4统计学方法采用SPSS13.0软件进行秩和检验。
2结果
2.1DKK-1蛋白在正常胃黏膜与胃癌组织中的表达 DKK-1蛋白在胃癌组织中的表达低于在正常胃组织中的表达(P<0.05),高-中分化腺癌与低分化腺癌二组比较高中分化腺癌表达高于低分化腺癌的表达(P<0.05),无淋巴结转移者DKK-1的表达与有淋巴结转移者的DKK-1表达,无淋巴结转移DKK-1表达高于有淋巴结转移组(P<0.05),浸润深度间差异显著(P<0.05),TNM分期间差异显著(P<0.05),但DKK-1的表达在年龄、性别间差异无统计学意义(P>0.05),见表1,图1。
表1DKK-1蛋白在不同胃黏膜组织中的表达(n)
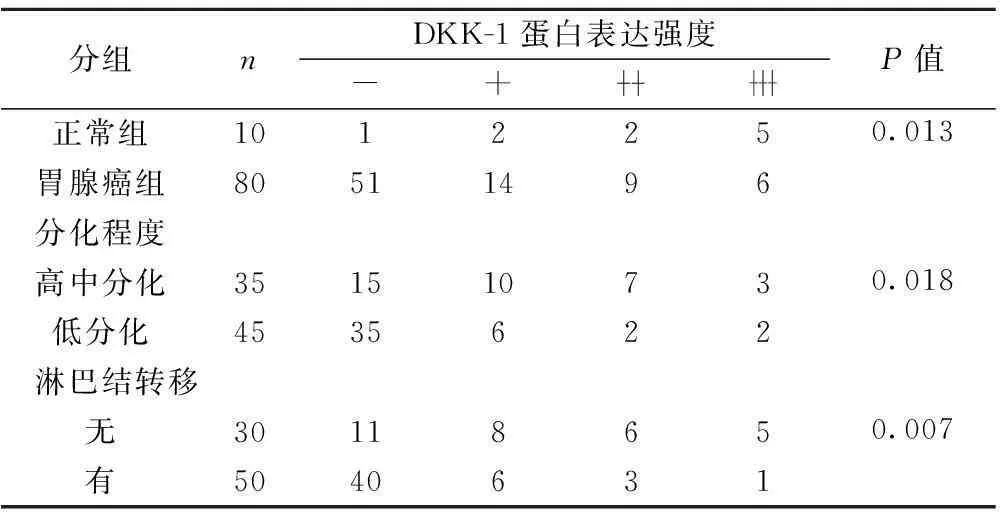
分组nDKK-1蛋白表达强度-+P值正常组101225胃腺癌组805114960.013分化程度高中分化35151073低分化45356220.018淋巴结转移无3011865有50406310.007
2.2β-catenin蛋白在正常胃黏膜与胃癌组织中的表达 β-catenin蛋白在胃癌中的表达强于正常胃黏膜(P<0.05),高-中分化腺癌与低分化腺癌比,低分化者中β-catenin蛋白的阳性表达高于高-中分化者,二者差异有显著性(P<0.05),β-catenin蛋白在有淋巴结转移组中的表达高于有淋巴结转移组(P<0.05),浸润深度间差异显著(P<0.05),TNM分期间差异显著(P<0.05),但β-catenin的表达在年龄、性别间差异无统计学意义(P>0.05),见表2,图2。
表2β-catenin蛋白在不同胃黏膜组织中的表达(n)
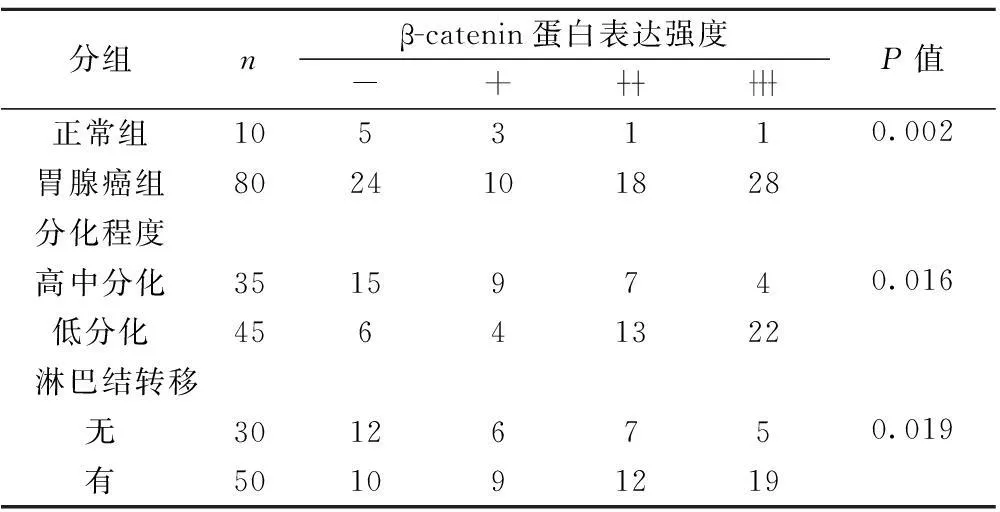
分组nβ-catenin蛋白表达强度-+P值正常组105311胃腺癌组80241018280.002分化程度高中分化3515974低分化456413220.016淋巴结转移无3012675有5010912190.019
2.3CyclinD1蛋白在正常胃黏膜与胃癌组织中的表达CyclinD1在胃癌中的表达高于正常胃黏膜组,二者之间比较差异有显著性(P<0.05),低分化腺癌中CyclinD1的阳性表达程度高于高中分化者(P<0.05),CyclinD1蛋白在有淋巴结转移组中的表达高于有淋巴结转移组差异显著(P<0.05),浸润深度间差异显著(P<0.05),TNM分期间差异显著(P<0.05),但CyclinD1的表达在年龄、性别间差异无统计学意义(P>0.05),见表3,图3。
2.4DKK-1、β-catenin 和CyclinD1蛋白在胃癌中表达的相关性在胃癌组织中DKK-1与CyclinD1呈负相关(r=-0.453,P<0.05),DKK-1与β-catenin呈负相关(r=-0.553,P<0.05),CyclinD1与β-catenin呈正相关(r=0.562,P<0.05)。
表3CyclinD1蛋白在不同胃黏膜组织中的表达(n)
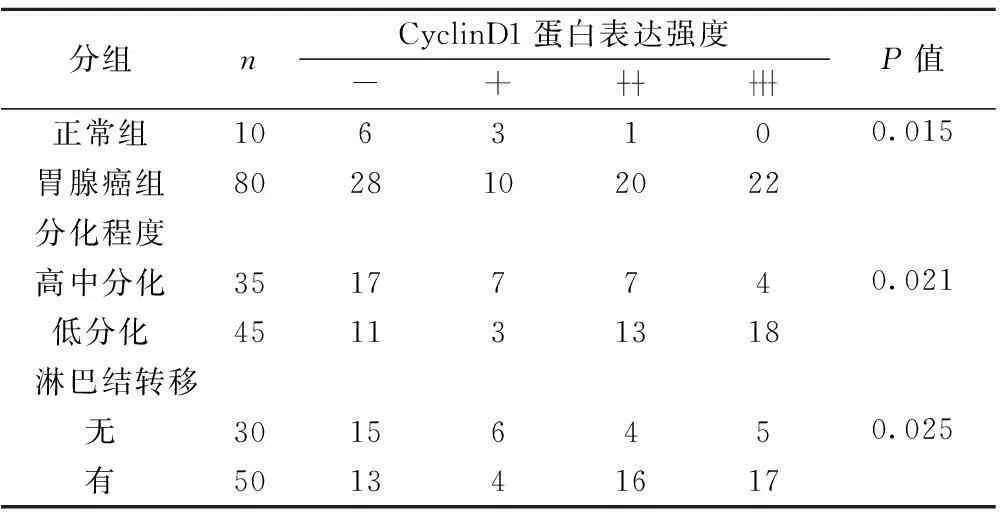
分组nCyclinD1蛋白表达强度-+P值正常组106310胃腺癌组80281020220.015分化程度高中分化3517774低分化4511313180.021淋巴结转移无3015645有5013416170.025
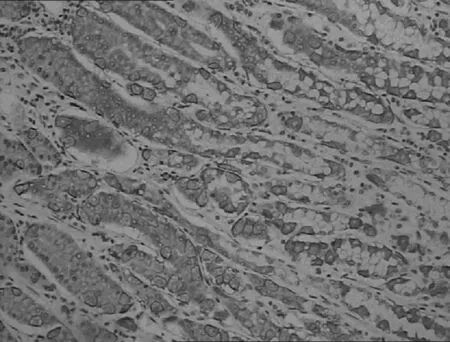
正常胃黏膜
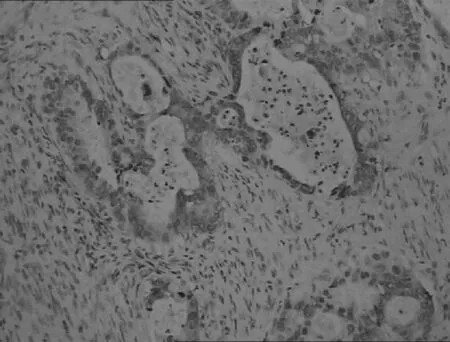
胃高中分化腺癌
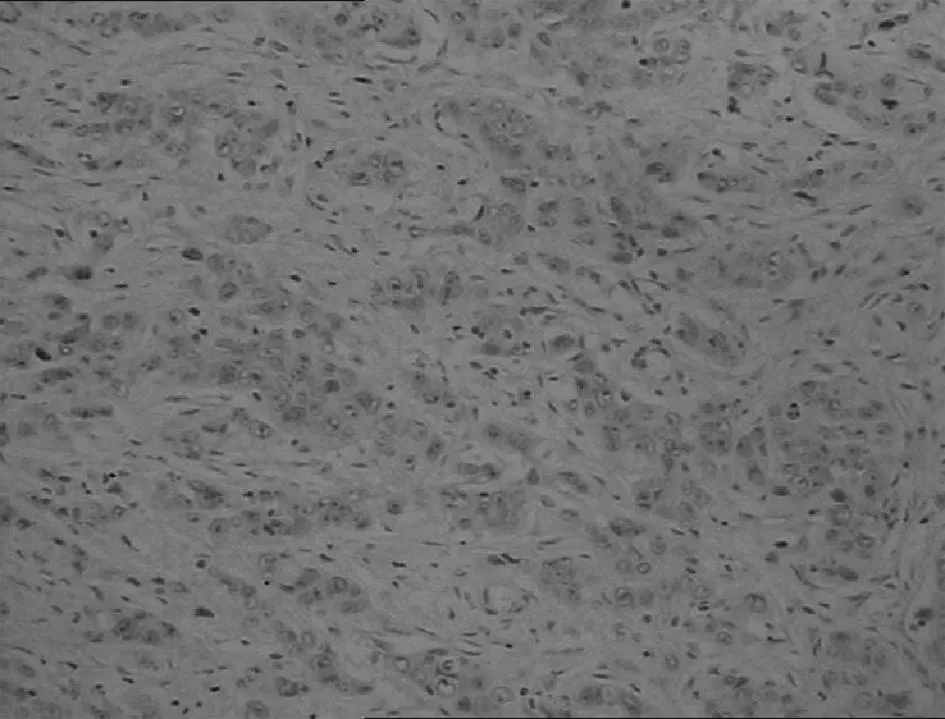
胃低分化腺癌
图1DKK-1蛋白在不同胃黏膜中的表达(IHC,×200)
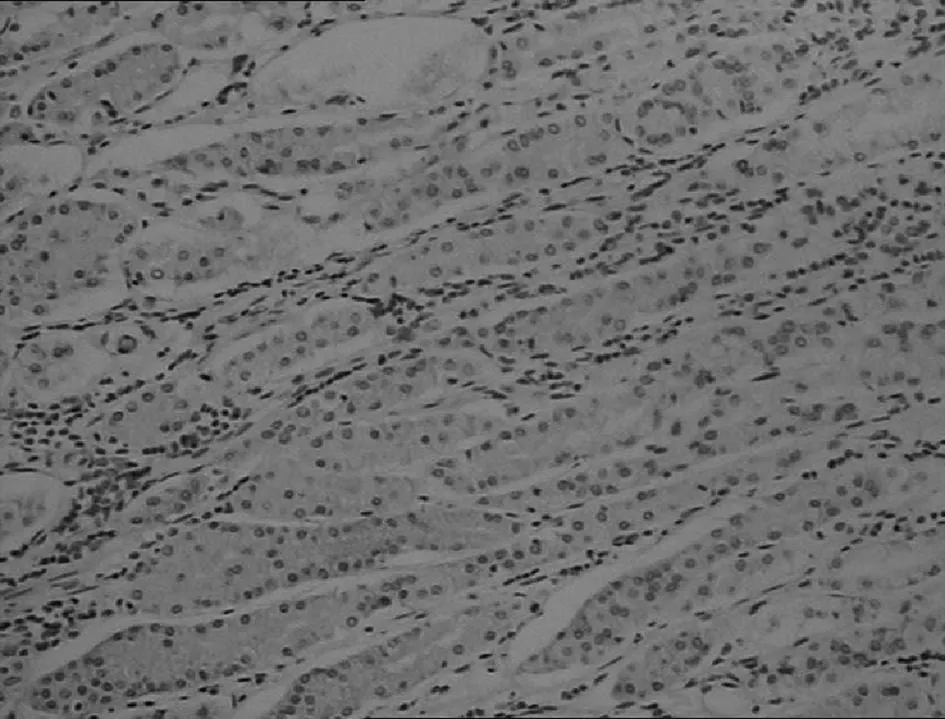
正常胃黏膜
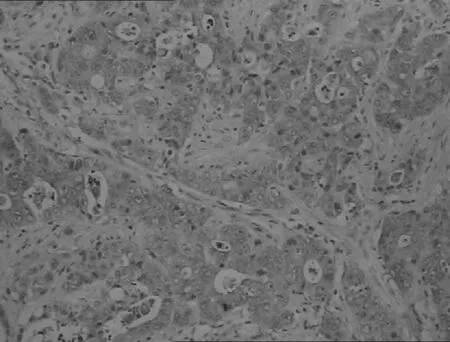
胃高中分化腺癌

胃低分化腺癌
图2β-catenin蛋白在不同胃黏膜中的表达(IHC,×200)
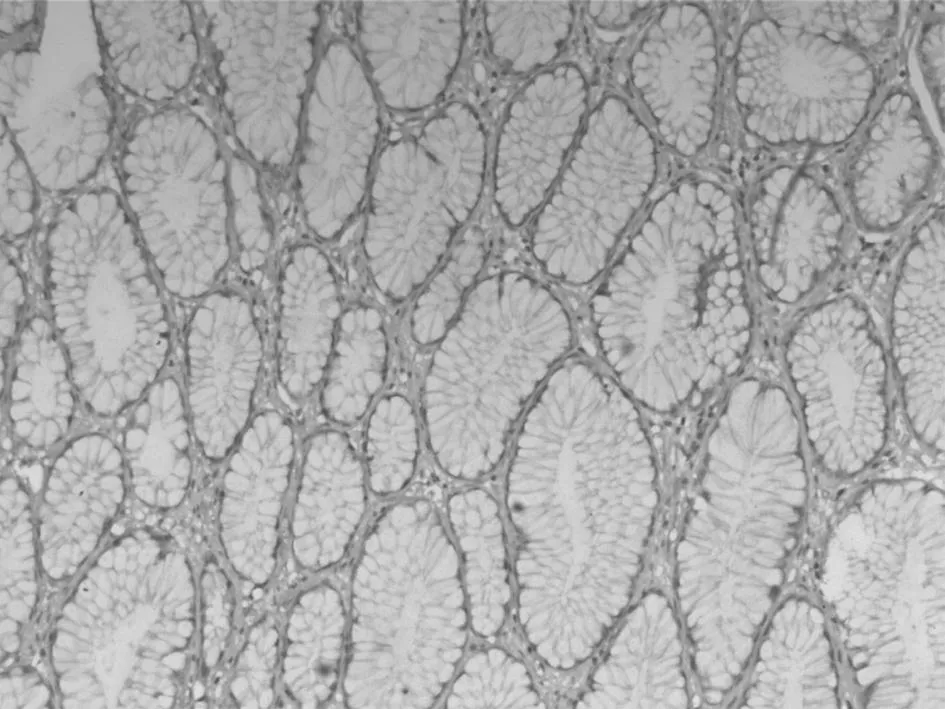
正常胃黏膜中
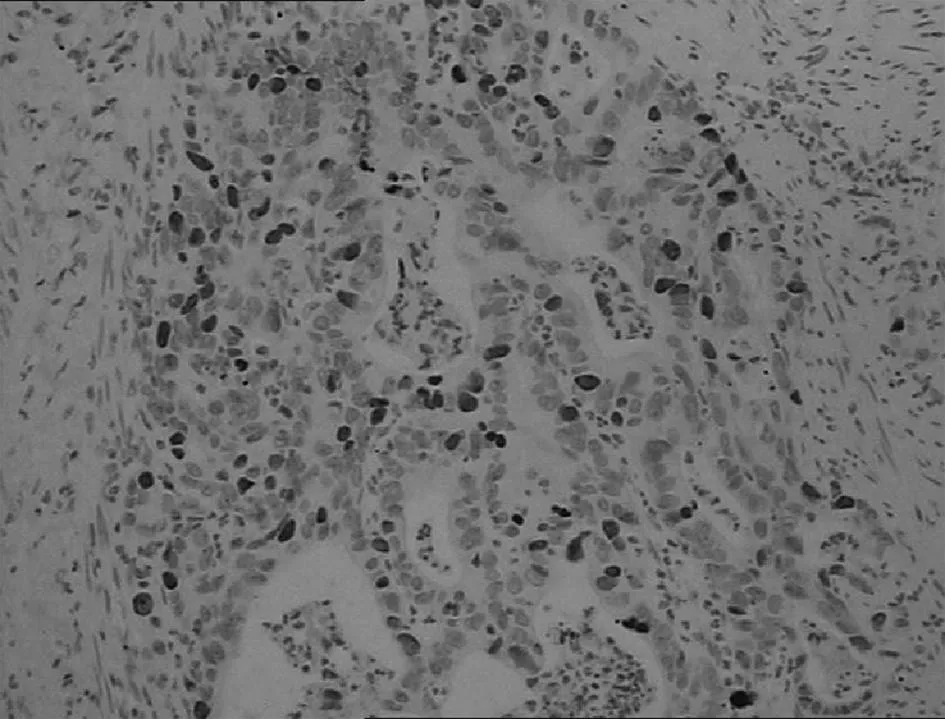
胃高中分化腺癌
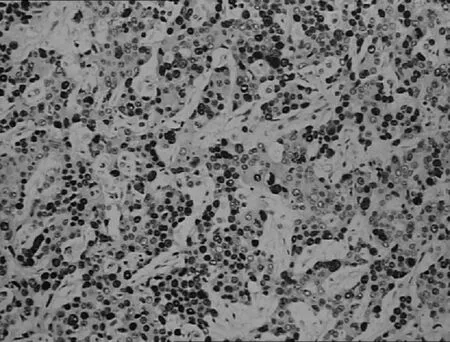
胃低分化腺癌
图3Cyclin D1蛋白在不同胃黏膜组织中的表达(IHC,×200)3讨论
Wnt信号通路由一系列癌基因和抑癌基因编码的蛋白质组成,DKK-1最初是一个隐匿的蛋白质,而后作为Wnt信号通路的抑制因子而被人所知〔3〕。DKK-1的甲基化作用与其在胃癌组织中表达下调显著相关联,研究结果显示在胃癌中促甲基化作用是DKK家族沉默的一个重要机制,国内外关于胃癌中DKK1的研究较少Veeck等〔4〕报道,DKK1在正常及胃癌组织中被沉默,而Ueno等〔5〕报道DKK1在胃癌组织中部分部分下降表达,部分上升表达,由此可见关于DKK-1在胃癌组织中的表达情况的结论不统一,本研究表明DKK-1蛋白在胃癌组织中的表达明显低于正常胃组织,高中分化胃癌的表达高于低分化胃癌的表达,伴有淋巴结转移的胃癌组织较无淋巴结转移者的DKK-1蛋白标记阳性率低,该结果与Ueno等〔5〕等报道有部分相同之处。
β-catenin作为 Wnt信号通路的蛋白构成组件调控细胞的生长,β-catenin蛋白能将细胞黏附和细胞骨架的组成与细胞扩增及分化相关,Wnt信号通路成分β-catenin的突变致其不恰当的激活可能与消化道肿瘤的发生、发展有关,因为Wnt信号通路中β-catenin蛋白结构突变,信号通路就出现异常,β-catenin在细胞内就会集聚,并进入细胞核内激活相关靶基因CyclinD1的转录,导致细胞发生癌变〔6,7〕,王渝等〔8〕研究发现胃腺癌中存在β-catenin基因的失活以及蛋白表达下调,并出现细胞质和(或)细胞核等各种形态的异常表达。同时随着胃癌分化程度的降低、浸润深度的增加、TNM分期的进展β-catenin异常表达显著增强,冯红等〔9〕阐明β-catenin在正常胃黏膜、癌旁组织及胃癌组织中的表达呈下降趋势,在胞质中表达强度呈增强趋势,本研究发现,β-catenin表达其与组织分化程度、分期和预后有显著相关性,从正常胃黏膜上皮到胃癌的发展过程中,β-catenin蛋白表达在胞质中增加,β-catenin在低分化胃癌中的表达阳性率显著高于高中分化胃癌,有淋巴结转移的胃癌β-catenin表达阳性率高于无淋巴结转移者,因此本研究结果与冯红等〔9〕阐明的观点一致。细胞周期是细胞生命活动的基本过程,若细胞周期调控异常将出现细胞生长失控则可能发生癌变〔10〕,本研究发现,CyclinD1在胃癌中的表达比率明显高于正常胃黏膜,低分化胃癌的表达高于高中分化胃癌,而且在分化程度越低的癌肿表达率越高, Wnt/β-catenin信号转导通路在生物进化中极为保守,在Wnt/β-catenin信号转导通路中,β-catenin是一种重要的胞内蛋白,是Wnt信号转导通路中致癌的关键分子,其降解障碍致使胞质内游离的β-catenin积累,激活下游靶基因CyclinD1的转录,引起细胞增殖和分化失控,导致肿瘤发生,而且CyclinD1是Wnt通路中的核心环节,本研究发现,CyclinD1在胃癌中的表达比率明显高于正常胃黏膜,低分化胃癌的表达高于高中分化胃癌,而且在分化程度越低的癌肿表达率越高, DKK1是Wnt /β-catenin 经典信号传导通路的拮抗分子,通过Wnt 信号转导途径来调控细胞的分化、增殖、迁移或癌变。Veeman等〔11〕发现,转染DKK1 的宫颈癌Hela 细胞,其增殖受到明显抑制,高表达的DKK1 可抑制Hela 细胞的生长并诱导凋亡。Nalesso等〔12〔13〕分别对食管癌和胰腺中的研究中也得到类似的结果。但研究显示DKK-1也是β-catenin 调控的靶基因之一,在其启动子区域有多个β-catenin/TCF 结合位点,引导经典Wnt通路的Wnt或者异位表达的β-catenin、TCF 或者LRP6 突变体可以诱导人Dkk-1 基因的转录,这显示在Dkk-1和β-catenin 之间存在一个负反馈作用〔12〕。本实验结果显示,在胃癌中β-catenin和CyclinD1蛋白的表达呈正相关,而DKK和β-catenin蛋白的表达之间呈负相关。该结果上述文献报道的结论基本一致,但是DKK和CyclinD1蛋白的表达亦呈负相关,该结果是否受β-catenin蛋白作用的影响,还有待进一步研究。
4参考文献
1Jullien N,Maudinet A,Leloutre B,etal.Downregulation of ErbB3 by Wnt3a contributes to wnt-induced osteoblast differentiation in mesenchymal cells〔J〕. J Cell Biochem,2012;113(6):2047-56.
2Galli C,Piemontese M,Lumetti S,etal. The importance of WNT pathways for bone metabolism and their regulation by implant topography 〔J〕.Eur Cell Mater,2012;24:46-59.
3Gomceli I,Bostanci EB,Ozer I,etal. A novel screening biomarker in gaastric cancer :serum Dikkopf-1〔J〕.Hepatogas troen terdogy,2011;59(117):10575-1516.
4Veeck J,Bektas N,Hartmann A,etal. Wnt signalling in human breast cancer:expression of the putative Wnt inhibitor Dickkopf-3 (DKK3) is frequently suppressed by promoter hypermethylation in mammary tumours〔J〕. Breast Cancer Res,2008;10(5):82.
5Ueno K,Hirata H,Majid S,etal. Wnt antagonist DICKKOPF-3 (Dkk-3) induces apoptosis in human renal cell carcinoma〔J〕. Mol Carcinog,2011;50(6):449-57.
6Thévenod F,Chakraborty PK. The role of Wnt/beta-catenin signaling in renal carcinogenesis:lessons from cadmium toxicity studies〔J〕.Curr Mol Med,2010;10(4):387-404.
7Saze Z,Terashima M,Kogure M,etal. Activation of the sonic hedgehog pathway and its prognostic impact in patients with gastric cancer 〔J〕.Dig Surg,2012;29(2):115-23.
8王渝,柯昌庶,赵秋,等.E-cadherin,β-catenin,cyclin-D1在胃腺癌中的表达及临床意义〔J〕.世界华人消化杂志,2007;15(4):430-7.
9冯红,梁春华,王建敏.胃癌发生发展中β-连环蛋白的异常表达与Wnt信号传导激活的关系〔J〕.中国全科医学,2009;12(14):5621- 3.
10Sagar S,Green IR. Pro-apoptotic activities of novel synthetic quinones in human cancer cell lines〔J〕. Cancer Lett,2009;285(1):23-7.
11Veeman MT,Axelrod JD,Moon RT.A second camon. Functions and mechanisms of betabrate-catenin-independent Wnt signaling〔J〕.Dev Cell,2003;5(3):367-77.
12Nalesso G,Sherwood J,Bertrand J,etal. WNT-3A modulates articular chondrocyte phenotype by activating both canonical and noncanonical pathways 〔J〕. J Cell Biol,2011;193(3):551-64.
13马杰,魏冰,买玲.DKK1和β-链接素表达与食管癌的相关性分析〔J〕.河南医学研究,2011;20(4):390-4.
〔2013-09-16修回〕
(编辑赵慧玲/曹梦园)
