牛源ISG15蛋白的原核表达及抗血清的制备
2015-12-31廖金虎张信军朱国强
陶 洁,廖金虎,张 倩,张信军,朱国强
(1.扬州大学兽医学院,扬州225009;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州225009;3.上海市农业科学院畜牧兽医研究所,上海 201106)
·其他·
牛源ISG15蛋白的原核表达及抗血清的制备
陶 洁1,2,3,廖金虎1,2,张 倩1,2,张信军1,2,朱国强1,2
(1.扬州大学兽医学院,扬州225009;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州225009;3.上海市农业科学院畜牧兽医研究所,上海 201106)
本研究利用人重组干扰素IFNα-2A刺激牛肾细胞(Mardin-Darby bovine kidney cells, MDBK),并提取细胞总RNA。RT-PCR扩增牛源干扰素刺激基因15(interferon-stimulated gene 15, ISG15),将其克隆入pCold-TF表达载体中,转化大肠杆菌BL21(DE3)。经IPTG诱导表达后,获得约70 kDa可溶性ISG15重组蛋白。用试剂盒对重组蛋白ISG15进行纯化回收,经BCA法测定其蛋白浓度为1 mg/mL。用纯化的ISG15重组蛋白免疫ICR小鼠,制备多克隆抗体血清,用间接ELISA方法测定多抗血清效价为1:102 400。利用Western blot进一步鉴定ISG15多抗血清,结果发现其与纯化的ISG15重组蛋白能发生特异性反应,可用于后续研究。
ISG15;蛋白表达;多抗血清
1979年,Farrell等[1]首次发现干扰素可诱导产生一种15 kDa的蛋白质,但当时并没有引起重视。直到1984年,Korant等[2]报道使用干扰素处理人和牛细胞系,可诱导表达一种分子质量为15 kDa的蛋白质,且依赖细胞RNA合成。Blomstrom等[3]在1986年从Daudi细胞中克隆获得人类ISG15的cDNA,当时所测定的ISG15序列中含有一个额外核苷酸,导致终止密码子提前,由该序列所推导的翻译产物分子质量恰好为15 kDa,与先前试验测定的分子质量相一致,因此该基因被命名为干扰素刺激基因15(interferon-stimulated gene 15, ISG15),编码蛋白为ISG15蛋白。目前已从多种物种体内扩增出ISG15,包括人、猴、熊猫、绵羊、奶牛、马、狗、小鼠和大鼠、猫、兔等,ISG15在不同物种间同源性高低不等,最低为38%,最高为98%,但在绝大多数动物中,ISG15 C-末端都具有一个高度保守序列LRLRGG[4]。
ISG15蛋白是先天免疫抗病毒过程中一个重要因子。研究报道,ISG15主要通过ISG化和去ISG化参与宿主抗病毒作用,同时还通过细胞信号通路调节相关酶类参与细胞相关功能,这需要很多蛋白和细胞因子共同参与,例如JAK-STAT(酪氨酸激酶JAK)信号通路、细胞周期蛋白D1等[5]。目前对ISG15蛋白功能研究日渐深入,本研究克隆表达牛源ISG15,并制备抗ISG15多克隆抗体,为后续探索ISG15蛋白功能奠定基础。
1 材料和方法
1.1 细胞、菌株和载体牛肾细胞(Madin-Darby bovine kidney cell, MDBK)由宾夕法尼亚大学Dr.Leonard R.Bello 赠与;大肠杆菌工程菌DH5α和重组蛋白表达受体菌大肠杆菌BL21(DE3)均由本实验室保存;冷休克表达载体pCold-TF购于TaKaRa公司;pEASY-T1-simple载体购自北京全式金公司。
1.2 主要试剂T4 DNA链接酶、rTaq DNA聚合酶、DL2000、PrimeScriptTM1st strand cDNA Synthesis Kit购自TaKaRa公司;Trans 2k Plus II Marker、TransStart FastPfu DNA Polymerase购自北京全式金公司;PageRulerTMPrestained Protein Ladder购自Thermo Scientific;TIANgen Midi Purification Kit购自 TIANGEN BIOTECH 公司;Donor Equine Serum(HS)购自Hyclone;DMEM细胞培养基购自CORNING公司;Protino Ni-TED 2000 packed columns购自德国Macherey-Nagel公司;HRP标记羊抗鼠IgG和DAB显色液购自博士德公司;其他试剂均为国产分析纯试剂。
1.3 实验动物6~8周龄ICR小鼠购自扬州大学实验动物中心。
1.4 引物设计根据GenBank中ISG15序列设计一对引物,并在上下游引物末端分别添加Hind III和Pst I酶切位点(下划线标注)。引物由上海基康生物技术有限公司合成,ISG15-up:5'-CAAGCTTATGGGCGGGGAC CTGA-3'(Hind III),ISG15-low:5'-CTGCAGCC TACCCACCCCGAAGACGTA-3' (Pst I)。
1.5 干扰素刺激因子ISG15的克隆
1.5.1 人重组干扰素刺激MDBK细胞 将MDBK细胞铺于6孔细胞板中,待单层细胞融合度达90%左右时,在细胞培养基中加入终浓度为6000 U/mL人重组干扰素IFNα-2A,刺激MDBK细胞7 h[6]。
1.5.2 细胞总RNA提取及反转录 按照参考文献[7],提取经IFNα-2A刺激后的MDBK细胞的总RNA并反转录成cDNA。
1.5.3 ISG15 PCR扩增 以反转录的cDNA为模板,PCR扩增ISG15,反应体系(50 μL):2 μL cDNA、2 μL dNTP、上游和下游引物各1 μL、1 μL Pfu DNA Polymerase和43 μL超纯水。PCR反应程序:94℃预变性2 min;94℃变性20 s、55℃退火20 s、72℃延伸20 s,进行25个循环;72℃延伸5 min。最后给PCR产物添加“A”尾巴,在上述PCR产物溶液中直接加入2 μL rTaq,PCR仪上72℃延伸20 min即可。1.5%的琼脂糖凝胶进行电泳,检测PCR扩增条带的特异性及其大小。
1.5.4 PCR产物的纯化 利用TIANgen Midi Purification Kit进行PCR扩增产物的纯化。
1.5.5 连接与转化 取4 μL PCR纯化产物与1 μL pEASY-T1-simple载体混合均匀后在恒温金属浴上25℃连接10 min,然后参照文献[8]操作步骤将连接产物转化至DH5α感受态细胞。
1.5.6 阳性克隆的筛选及测序 在转化的氨苄抗性平板上挑取单个菌落接种于氨苄抗性LB培养基,37℃振荡培养16 h。然后用碱裂解法提取质粒,用1%琼脂糖凝胶电泳鉴定大小正确的阳性克隆重组质粒pEASY-ISG15。将筛选出的阳性克隆送上海生物工程技术服务有限公司测序,每个样品重复测序3次。1.5.7序列比对与分析 利用Lasergene软件对测序所得序列进行剪接,并将其与GenBank中原序列进行比对分析。
1.6 重组原核表达质粒的构建与鉴定用Hind III和Pst I双酶切质粒pEASY-ISG15和pCold-TF载体,回收目的片段ISG15和线性载体pCold-TF,然后用T4 DNA 连接酶将两片段(目的片段∶载体= 3∶1)在16℃连接过夜。按上述操作步骤,将连接产物转化DH5α感受态细胞,并通过重组质粒大小和双酶切方法双重鉴定,筛选阳性重组原核表达质粒pCold-ISG15。
1.7 ISG15在pCold-TF载体中的原核表达[9]按照上述操作,将重组原核表达质粒pCold-ISG15转化至BL21(DE3)感受态细胞(制作方法同DH5α感受态细胞)中,37℃培养过夜;次日从平板上挑取单菌落接种到氨苄LB液体培养基中制备种子液,37℃培养过夜;种子液按1∶100转接并扩大培养,待菌液OD600达0.5左右时,15℃静置30 min;然后加入终浓度为1.0 mol/L 的IPTG,15℃诱导培养24 h。取1 mL菌液,10 800×g离心2 min,收集菌体并用等体积PBS洗涤2次;然后将PBS重悬物超声破碎裂解,4℃、10 800×g离心5 min,取上清和沉淀分别制样并配制12%的SDS-PAGE凝胶进行电泳。同时用pCold-TF转化BL21(DE3)感受态细胞,作阴性对照。
1.8 ISG15重组蛋白的纯化及浓度测定参考文献[10],利用Protino Ni-TED 2000试剂盒纯化 ISG15重组蛋白,并用BCA法测定纯化蛋白的浓度。
1.9 ISG15重组蛋白多抗血清的制备与鉴定
1.9.1 免疫小鼠 选取6~8周龄的ICR雄性小白鼠,用纯化的ISG15重组蛋白进行免疫。免疫程序:颈背部皮下多点注射弗氏完全佐剂乳化的ISG15蛋白,50 μg/只,2周后皮下注射弗氏不完全佐剂乳化的等量ISG15蛋白,二免后2周再次皮下注射弗氏不完全佐剂乳化的等量ISG15蛋白,三免后1周加强免疫ISG15蛋白,50 μg/只,不加弗氏佐剂。
1.9.2 ELISA法测定血清效价 四免后1周断尾法采集每只小鼠的血液,4℃过夜析出血清,收集血清用ELISA方法测定效价。以未进行免疫的ICR雄性小鼠血清作阴性对照,PBST作为空白对照调零孔,在酶标板上进行方阵试验。将纯化的ISG15蛋白用0.05 mol/L碳酸盐缓冲液(pH 9.6)稀释成不同梯度:10、8、4、2、1 μg/mL,横向加入酶标板中,每孔100 μL,37℃孵育2 h后4℃过夜;次日, PBST洗涤3次,每次5 min,拍干,加封闭液(10% HS+PBST)封闭,150 μL/孔,37℃孵育2 h,洗涤;加入待检血清,用PBST进行800、1600、3200、6400、12 800、25 600倍稀释,纵向加样,100 μL/孔,37℃孵育1 h,洗涤;加入辣根过氧化物酶标记的羊抗鼠IgG(按1∶6000用PBST进行稀释),100 μL/孔,37℃孵育30 min,洗涤;加入TMB显色液,100 μL/孔,37℃作用10~15 min;加入2 mol/L H2SO4(50 μL/孔)终止反应,测OD450。判断标准:待检孔的OD值/阴性孔的OD值≥2.1即可判为阳性。
1.9.3 Western blot检测ISG15多克隆抗体 取4 μg纯化后的ISG15重组蛋白进行SDS-PAGE电泳,电泳结束后通过湿转膜仪将蛋白条带转印至硝酸纤维素膜(nitrocellulose filter membrane, NC)上,转印条件为恒流0.35 A,转印时间为90 min;转印结束后,将NC膜置于5%脱脂奶粉中37℃封闭2 h;PBST洗涤3次,每次5 min;用ISG15多抗血清(1∶3000稀释)孵育1 h,洗涤;然后加入HRP标记的羊抗鼠IgG (1∶3000稀释)孵育1 h,洗涤;最后,配制DAB显色液(在10 mL 超纯水中分别加入3滴A、B、C试剂混匀)进行显色并拍照记录结果[11]。
1.9.4 分离血清 摘眼球法采集小鼠血液后,37℃放置30 min,然后4℃放置2 h,10 000×g离心10 min,吸取的上清即为ISG15多抗血清,经过滤除菌后4℃保存。
2 结果
2.1 ISG15的PCR产物提取IFNα-2A刺激后MDBK细胞的总RNA,RT-PCR扩增ISG15,经1.5%琼脂糖凝胶电泳分析,结果显示ISG15 PCR扩增产物大小约为500 bp,与理论大小469 bp相符(图1)。
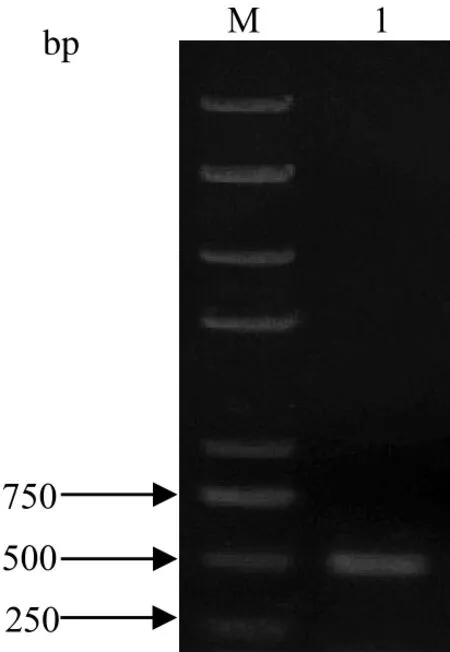
图1 ISG15的RT-PCR产物Fig.1 PCR amplifi cation of ISG15
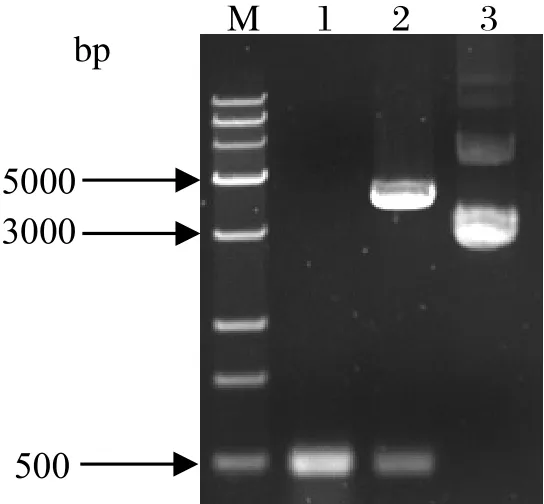
图2 pEASY-ISG15质粒的PCR检测和双酶切鉴定Fig.2 Identifi cation of pEASY-ISG15 by PCR and double restriction enzyme digestion
2.2 重组T载体质粒的鉴定将ISG15目的片段克隆入pEASY-T1-simple载体后,提取重组质粒pEASY-ISG15进行PCR和双酶切鉴定。如图2,pEASY-ISG15质粒大小约为4300 bp,与预期相符。以pEASY-ISG15质粒为模板,用ISG15扩增引物进行PCR鉴定,结果能扩增出约500 bp条带。此外,用Hind III和Pst I双酶切pEASY-ISG15质粒,获得约3850 bp和469 bp两条目的片段,电泳结果与预期相符,说明ISG15成功插入pEASY T1 simple载体中。将鉴定正确的重组质粒送华大基因有限公司测序,用Lasergene软件进行序列剪切,并与GenBank中牛ISG15原序列进行比对,结果确定成功插入pEASYT1-simple载体的ISG15序列没有突变,该重组质粒可用于后续克隆操作。
2.3 原核表达重组质粒的鉴定参照上述方法,对原核表达重组质粒pCold-ISG15进行鉴定。如图3,质粒pCold-ISG15大小约为6200 bp,用Hind III和Pst I双酶切pCold-ISG15后,获得约5700 bp的载体片段和469 bp的ISG15目的条带,电泳结果与预期相符。此外,PCR鉴定结果显示能扩增出大小约500 bp的条带,亦与预期相符。说明ISG15原核表达重组质粒构建成功。
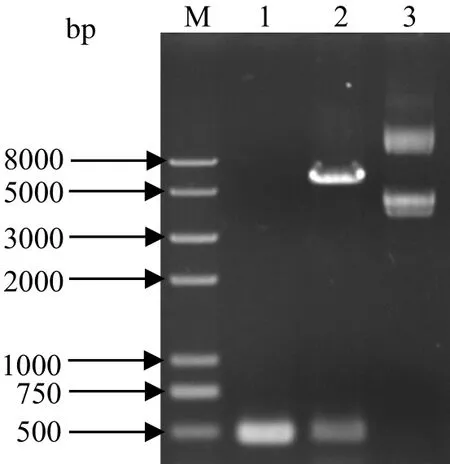
图3 pCold-ISG15质粒的PCR检测和双酶切鉴定Fig.3 Identifi cation of pCold-ISG15 plasmid by PCR and double restriction enzyme digestion
2.4 ISG15重组蛋白的表达与鉴定将ISG15克隆至冷表达载体pCold-TF中进行原核表达,重组菌诱导表达后用SDS-PAGE鉴定。如图4,与空载体对照相比,诱导表达的重组质粒pCold-ISG15明显多出一条分子量约为70 kDa的特异条带(标签TF约55 kDa)。用超声波破碎裂解菌体,发现ISG15重组蛋白存在于菌体裂解上清中,即ISG15重组蛋白以可溶性融合蛋白形式存在(图5)。
用Protino Ni-TED 2000试剂盒进行ISG15重组蛋白纯化,如图6,与重组蛋白的过柱液相比较,我们获得了ISG15重组蛋白的纯化产物,且蛋白浓度较高。
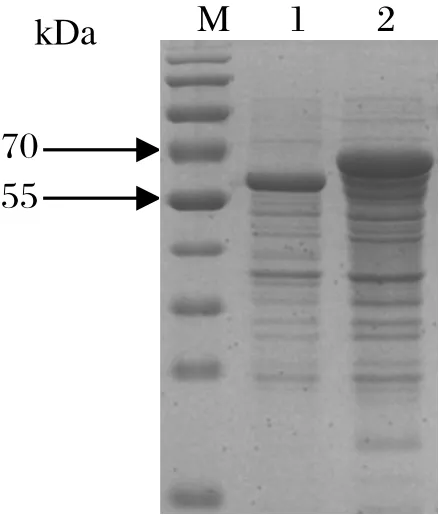
图4 ISG15蛋白诱导表达鉴定Fig.4 Identifi cation of the recombinant protein ISG15
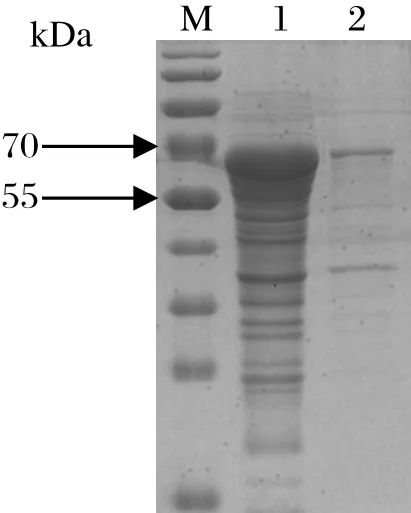
图5 ISG15重组蛋白可溶性鉴定Fig.5 Identifi cation of the solubility of the recombinant protein ISG15

图6 ISG15重组蛋白纯化结果Fig.6 Purifi cation results of recombinant protein ISG15
2.5 ISG15多克隆抗体的鉴定
2.5.1 ELISA方法检测多抗血清效价 以纯化的ISG15重组蛋白为检测抗原,以非免疫小鼠的血清作为阴性对照,以PBST作为空白调零对照,经酶标仪读取OD450值。判断标准:待测孔的OD值/阴性孔的OD值≥2.1即可判定为阳性。经测定,在ISG15蛋白浓度为0.8 μg/mL时,小鼠多抗血清效价为1∶102 400。
2.5.2 Western blot检测多抗 用纯化的ISG15重组蛋白进行SDS-PAGE电泳,然后用制备的小鼠多抗血清作为一抗进行Western blot检测,结果表明,在约70 kDa大小处有明显的显色带(图7),说明制备的多克隆抗体能很好和重组蛋白发生反应。
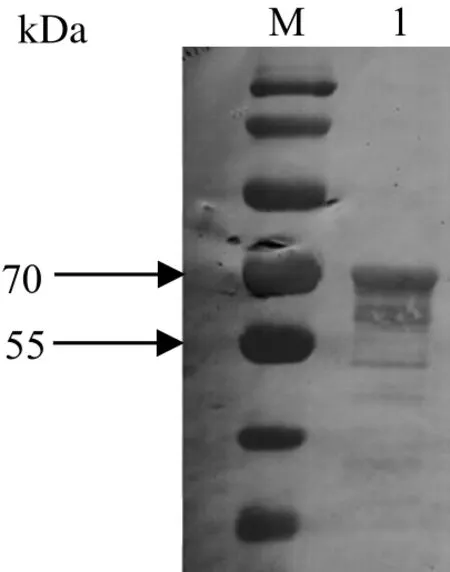
图7 ISG15蛋白多克隆抗体的Western blot检测Fig.7 Detection of anti-ISG15 polyclonal antibodies by Western blot
3 讨论
ISG15是干扰素诱导表达最强的ISG之一,也是第一个被鉴定的ISG[12]。ISG15蛋白由ISG15编码,病毒感染和I型干扰素刺激均能强烈诱导其表达,在抗病毒天然免疫过程中具有重要调节作用[13]。为了开展ISG15和BVDV相关作用关系的探究,本研究将ISG15克隆至pCold-TF原核表达载体上,利用其ATG作为目的基因的起始密码子,在噬菌体T7 lac启动子强转录及翻译信号控制下,ISG15重组蛋白在E.coli BL21(DE3)中得到正确且高效的表达。将纯化后ISG15重组蛋白免疫小鼠,为了提高多抗血清效价,我们将免疫程序进行了稍微调整,即在常规免疫程序二免2周后,按照二免程序再加免1次(弗氏不完全佐剂和纯化的蛋白等体积混合),隔2周直接用纯化的重组蛋白加强免疫。经间接ELISA检测证实,我们获得的抗ISG15蛋白多抗血清效价较高,达1∶102 400。Western blot鉴定结果也证实获得的ISG15蛋白多抗血清能与纯化的ISG15蛋白发生较好的特异性反应,说明此多抗血清可用于后续实验,为后续开展ISG15的相关研究奠定了基础。
本研究所用pCold-TF是一种冷休克表达载体,它利用冷休克基因cspA启动子进行外源蛋白质表达,在cspA下游的lac operator可以严格调控目的基因表达。载体上Trigger factor(TF)是大肠杆菌来源的分子伴侣基因,作为可溶性蛋白标签,可与目的基因进行融合表达,提高目的蛋白的可溶性。通常,重组菌经15℃低温诱导24 h后,表达的目的蛋白几乎都在细胞质中呈可溶性表达,而且表达产量高。可溶性蛋白具有天然的空间结构,能够保持天然构象,直接作为抗原免疫动物时,激活B细胞产生的抗体能识别的表位包括构象表位和线性表位,增强了多克隆抗体的免疫原性。此外,表达的目的蛋白氨基端带有6个His融合标签,便于使用商品化Ni柱蛋白纯化试剂盒进行重组蛋白纯化。
[1] Farrell P J, Broeze R J, Lengyel P.Accumulation of an mRNA and protein in interferon-treated Ehrlich ascites tumour cells[J].Nature, 1979, 279(5713)∶ 523-525.
[2] Korant B D, Blomstrom D C, Jonak G J, et al.Interferoninduced proteins.Purification and characterization of a 15,000-dalton protein from human and bovine cells induced by interferon[J].J Biol Chem, 1984, 259(23)∶14835-14839.
[3] Blomstrom D C, Fahey D, Kutny R, et al.Molecular characterization of the interferon-induced 15-KDa protein.Molecular cloning and nucleotide and amino acid sequence[J].J Biol Chem, 1986, 261(19)∶ 8811-8816.
[4] Zhang D, Zhang D E.Interferon-stimulated gene 15 and the protein ISGylation system[J].J Interferon Cytokine Res, 2011, 31(1)∶ 119-130.
[5] Malakhova O A, Kim K I, Luo J K, et al.UBP43 is a novel regulator of interferon signaling independent of its ISG15 isopeptidase activity[J].EMBO J, 2006, 25(11)∶2358-2367.
[6] Peterhans E, Schweizer M.BVDV∶ a pestivirus inducing tolerance of the innate immune response[J].Biologicals, 2013, 41(1)∶ 39-51.
[7] 蔡新斌.ISG15 的原核表达和多克隆抗体的制备及其与猪瘟病毒相互作用的初步研究[D].南宁∶ 广西大学, 2011.
[8] 萨姆布鲁克 J.分子克隆实验指南 [M].3版.北京∶ 科学出版社, 2002, 1256-1265.
[9] 任敏, 焦海宏, 林燕清, 等.基因 2 型牛病毒性腹泻病毒新疆及山东分离株的鉴定[J].中国动物传染病学报, 2009, 18 (4)∶ 20-25.
[10] 舒燕.金黄色葡萄球菌 Fe 摄取调节蛋白 SirA 的原核表达及其功能的初步研究[D].扬州∶ 扬州大学, 2011.
[11] 林燕清.BVDV-2 分离株 XJ-04 全基因组测序和抗BVDV 单克隆抗体制备及初步应用[D].扬州∶ 扬州大学, 2010.
[12] Whitmarsh A J.Filamin B∶ a scaffold for interferon signalling[J].EMBO Rep, 2009, 10(4)∶ 349-351.
[13] 刘畅, 乔文涛, 王琛, 等.类泛素蛋白 ISG15 及其在先天免疫中的作用[J].生物化学与生物物理进展, 2006, 33(11)∶ 1023-1029.
PROKARYOTIC EXPRESSION OF ISG15 PROTEIN AND PREPARATION OF ANTI-ISG15 POLYCLONAL ANTIBODIES
TAO Jie1,2,3, LIAO Jin-hu1,2, ZHANG Qian1,2, ZHANG Xin-jun1,2, ZHU Guo-qiang1,2
(1.College of Veterinary Medicine, Yangzhou University, Yangzhou 225009,China; 2.Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Disease and Zoonosis, Yangzhou 225009,China; 3.Institute of Animal Sciences and Veterinary Medicine, Shanghai 201106,China)
In the present study, total RNA was extracted from MDBK cells stimulated with recombinant human interferon IFN α-2A and interferon-stimulated gene 15 (ISG15) was amplifi ed using RT-PCR.Then, ISG15 gene was cloned into prokaryotic expression vector pCold-TF and transformed into E.coli BL21 (DE3) competent cells.Soluble ISG15 protein with molecular mass of 70 kDa was expressed following induction with IPTG and purifi ed.The concentration of the purifi ed ISG15 was 1mg/mL as measured in BCA kit.Subsequently, ICR mice were inoculated with the purifi ed ISG15 for preparation of polyclonal antibodies.Blood samples were collected from mice post the fourth immunization and antibody titer was 1: 102 400 as detected in indirect ELISA.The reactivity of antiserum preparation to purifi ed ISG15 was confi rmed in Western blot.
ISG15; protein expression; antiserum
S852.4
A
1674-6422(2015)02-0068-06
2014-12-16
江苏高校优势学科建设工程资助项目;重大动物疫病防控技术引进(国家农业部948计划,2011-G24);江苏省属高校自然科学重大基础研究项目(14KJA230001);江苏省农业支撑项目(BE2014358);泰州市农业科技计划项目(TZ201421)
陶洁,女,硕士研究生,微生物学专业;廖金虎,男,硕士研究生,微生物学专业
朱国强,E-mail:yzgqzhu@hotmail.com; yzgqzhu@yzu.edu.cn
