下调VEGF基因表达对人大肠癌细胞株SW480的增殖抑制作用
2015-12-30孙鹏达,刘天舟,孙冬
下调VEGF基因表达对人大肠癌细胞株SW480的增殖抑制作用
孙鹏达刘天舟孙冬
(吉林大学第二医院,吉林长春130041)
摘要〔〕目的利用RNA干扰技术特异性抑制人大肠癌细胞株SW480的VEGF基因表达,并进行大肠癌的基因治疗。方法体外合成带有T7启动子的VEGF基因DNA片段、转录针对VEGF mRNA的siRNA、利用脂质体转染法导入SW480细胞内,MTT染色法观察转染后的SW480细胞增殖抑制率,ELISA法检测蛋白表达水平。RT-PCR检测转染后VEGF mRNA表达水平的变化。结果设计的两个靶位点siRNA能有效抑制SW480细胞生长,VEGF mRNAR 的表达受到有效抑制,而阴性对照的错义序列组siRNA细胞生长良好。结论体外合成的VEGF siRNA可有效抑制SW480细胞增殖和VEGF mRNA蛋白表达水平。
关键词〔〕siRNA;SW480细胞;血管内皮生长因子;基因治疗
中图分类号〔〕R392.11〔文献标识码〕A〔
通讯作者:孙冬(1979-),女,讲师,硕士,主要从事消化系统疾病研究。
第一作者:孙鹏达(1976-),男,主治医师,在读博士后,主要从事胃肠肿瘤诊治研究。
近年研究表明血管内皮生长因子(VEGF)在多种肿瘤组织中呈高表达,其中VEGF165表达较高,VEGF在血管生成信号途径中起着关键的促进作用〔1〕。抑制VEGF基因表达,就可阻止肿瘤细胞的生长,故本研究应用siRNA干扰技术观察其对人大肠癌细胞株(SW480)细胞的增殖抑制作用,旨在为人大肠癌的基因治疗提供理论依据。
1材料与方法
1.1材料人大肠癌细胞株SW480细胞由吉林省肿瘤研究所惠赠;Lipofectamine TM2000、TRIzol rengent、RPMI1640、培养基等购自Invitrogen,T7ribomax TM Express RNAI,Systen 购自Promege。人VEGF ELISA Kit购自武汉博士德生物工程有限公司,胎牛血清购自长春生物制品研究所,噻唑蓝(MTT)试剂购美国Sigma公司。
1.2方法
1.2.1siRNA的制备从GenBank中获取已知的人VEGF mRNA序列(ACCESSION:ABO 21221),采用Promega在线siRNA设计工具设计两组siRNA序列(每组中第一条链为正义链,第二条为反义链)和错义序列组SCR序列作为阴性对照,体外转录出来的siRNA分别标记为siRNA1,siRNA2,siRNASCR。
siRNA1:5′-GAUCAAACCUCACCAAGGCUU-3′,5′-GCCUUGGUGAGGUUUGAUCUU-3′;siRNA2:5′-GGAGUACCCUGAUG-AGAUCUU-3′,5′-GAUCUCAUCAGGGUACUCCUU-3′;siRNASC-R:5′-GCGUAACGCGGGAAUUUACUU-3′,5′-GUAAAUUCCCGC-GUUACGCUU-3′。所有siRNA都通过T7RNA聚合酶体外转录法,具体操作参照Promega T7 RiboMAXTm Express RNAI Syste试剂盒方案。
1.2.2细胞培养及siRNA转染取2×104/ml SW480细胞加入到24孔塑料培养板内,每孔1 ml,进行siRAN染,siRNA转染采用脂质体包裹的方式〔2〕,siRNA1,siRNA2分别设立200、400、800 nmol/L 3个浓度梯度,siRNA1,siRNA2共用一套对照组,对照组除正常细胞换液外不加任何试剂,实验重复3次。
1.2.3MTT法检测SW480细胞增殖抑制率取转染siRNA的SW480细胞,于结束前6 h分别加入MTT试剂100 μl/孔,终浓度为500 ng/L继续培养6 h后加入二甲基亚砜(DMSO)100 μl/孔,振荡10 min,使MTT还原产物完全溶解,于酶标仪570 nm处测量各孔吸光度A值按下列公式计算SW480细胞增殖抑制率。SW480细胞抑制率=(1-实验孔细胞A值÷对照孔细胞A值)×100%。
1.2.4VEGF基因表达分析取转染siRNASW480细胞应用TRIZOL法提取各组细胞总RNA,采用1 μg总RNA进行RT-PCR检测。VEGF引物:上游:5′-AATCGAGACCCTGGTGGACA-3′,下游:5′-TTAACTCAAGCTGCCTCGCC-3′,内参照甘油醛-3-磷酸脱氢酶(GAPTH)引物上游:5′-CGTGGAAGGACTCATGACCA-3′,下游:5′-TCCAGGGGTCTTACTCCTTG-3′。反应体系体积为50 μl,然后按着Promega“Access RT-PCR Introductory System”试剂盒方案:45℃ 45 min进行反转录反应,PCR反应条件为94℃ 2 min逆转录病毒(AMV)反转录酶灭活和RNA/CDNA引物预变性,94℃ 30 s,52.5℃ 1 min,68℃ 2 min,共40个循环,最后68℃延伸7 min,RT-PCR产物应用2%琼脂糖凝胶电泳,凝胶紫外摄像,光密度扫描,计算实验组与其对应的内参RT-PCR产物比值进行比较分析。
1.2.5VEGF蛋白分泌量分析取转染24 h后的SW480细胞上清液用于检测VEGF蛋白分泌量,严格按照试剂说明操作,将不同浓度的VEGF标准品(7.8,15.6,31.2,62.5,125,250,500,1 000 pg/ml)以及不同组的细胞上清液于Rayto2100C酶标仪中检测450 nm吸光度值和上清¥VEGF吸光度值,计算VEGF含量。
1.3统计学方法应用SPSS11.0软件行t检验。
2结果
2.1siRNA转染24 h后SW480细胞增殖变化转染后24 h各组SW480细胞的增殖有明显的变化,与脂质体对照相比SW480细胞明显减少。见图1。
2.2MTT比色法结果siRNA1组、siRNA2组与脂质体组及正常对照组相比吸光度有明显差异(0.97±0.21、0.86±0.24、1.48±0.13、1.51±0.11,均P<0.05),而脂质体组与正常对照组相比无显著性差异(P>0.05)。siRNA1组、siRNA2组抑制率分别为34.05%,43.3%。
2.3siRNA组转染后24 h各组SW480细胞VEGF mRNA表达变化电泳结果表明siRNA1组、siRNA2与正常对照组及错义序列组VEGF mRNA表达水平明显降低,与细胞增殖实验结果相符。见图2。
2.4ELISA法检测siRNA转染后24 h各组SW480细胞上清液中VEGF蛋白分泌量的变化siRNA1和siRNA2组VEGF分泌量〔(172.11±29.02)、(161.34±31.24)pg/ml〕明显低于脂质体组〔(345.33±27.25)pg/ml〕及正常对照组〔(359.46±32.31)pg/ml〕组间比较差异显著。

图1 siRNA转染24 h后SW480细胞增殖变化
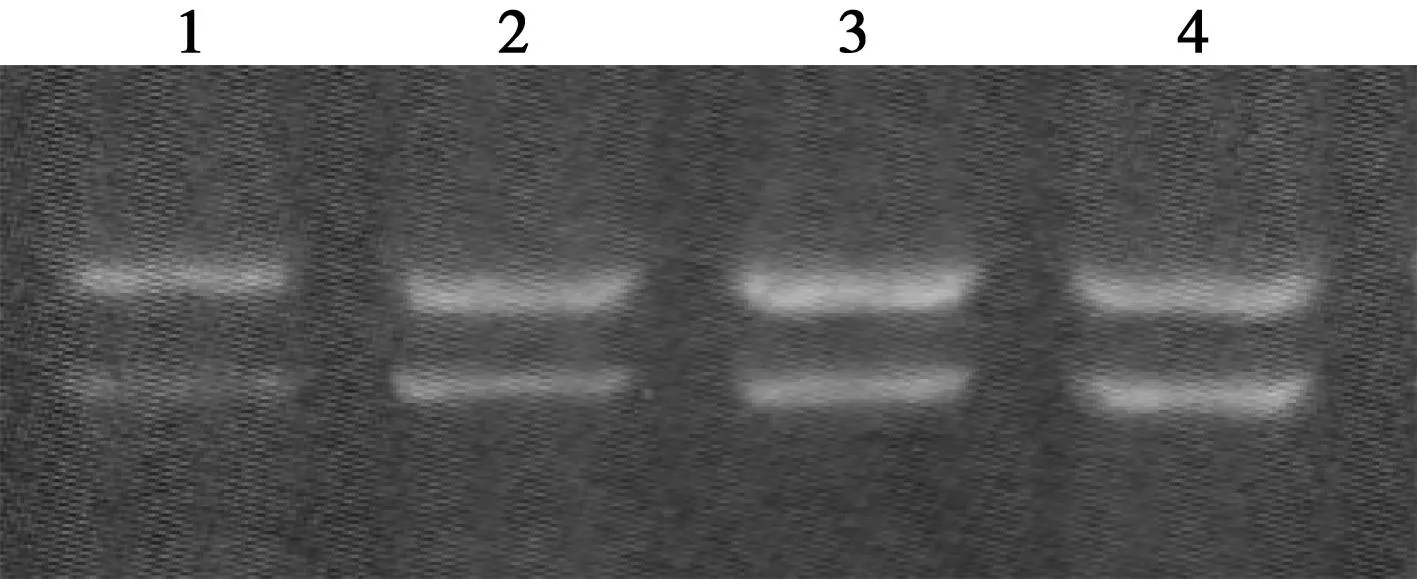
1.siRNA1组;2.siRNA2组;3.脂质体组;4.正常对照组 图2 siRNA转染后24 h各组SW480细胞 VEGF mRNA表达水平
3讨论
近年来,结直肠癌治疗技术有了很大的发展,但是单纯手术治疗效果仍难让人满意,局部复发率高达15%~50%〔3〕。因此,许多学者从肿瘤分子生物学角度对结直肠癌基因治疗进行了研究,发现结直肠癌组织中VEGF含量异常表达,与肿瘤侵袭复发转移密切相关。肿瘤如果没有新生血管的支持,当肿瘤体积达到1 mm3时就会停止生长并发生退化〔4〕。因此,抑制VEGF的表达,就可以阻止肿瘤的生长,RNAi作为生命科学领域的新技术,其应用非常广〔5〕。
本研究利用分子生物学技术,构建合成了针对VEGF的siRNA真核表达载体并把基因转染至SW480细胞内,结果显示,无论是从mRNA水平,还是蛋白质水平,都对VEGF基因的表达发挥出明显的抑制效果,并且抑制SW480细胞的增殖。
本研究结果表明,siRNA转染至SW480细胞后VEGF mRNA蛋白表达受到抑制,从而诱发了癌细胞的凋亡及增殖抑制,而且该表达载体能够在哺乳动物细胞中稳定的抑制目的基因的表达,可引起基因沉默〔6〕。此外,由于构建的质粒可以复制扩增,易于标准化生产,远优于化学合成法。
4参考文献
1Zhou WB,Bai M,Jin Y.Diagnostic value of vascular endothelial growth factor and endostatin in malignant pleural effusions〔J〕.Int J Tuberc Lung Dis,2009;13(3):381-6.
2张灵敏,王亚旭.微小RNA与结直肠癌〔J〕.国际肿瘤学杂志,2014;41(4):290-3.
3Pichler M,Winter E,Stotz M,etal.Downregulation of KRAS-interacting miRNA-143 predicts poor prognosis but not response to EGFR-targeted agents in colorectal cancer〔J〕.Br J Cancer,2012;106(11):1826-32.
4Chen HH,Chair L,Wang SQ,etal.Angiopoietin-2 inhibits the growth of tongue carcinoma without affecting expression of vascular endothelial growth factor〔J〕.Int J Oral Maxillofac Surq,2011;40(6):628-32.
5Takei Y,Kadomatsu K,Yuzawa Y,etal.A small interfering RNA targeting vascular endothelial growth sactor as cancer therapeutics〔J〕.Cancer Res,2004;64(10):3365-70.
6Czanderna F,Fechtner M,Aygun H.Functional studier of the PI(3) kinase signaling pathway employing synthetic and expressed siRNA〔J〕.Nucl Acid Res,2003;31(2):670-82.
〔2014-09-17修回〕
(编辑袁左鸣)
