铝负荷致慢性脑损伤大鼠皮层前列腺素合酶-前列腺素-前列腺素受体信号通路变化特征
2015-12-30魏玉玲,王健峰,阳群芳等
铝负荷致慢性脑损伤大鼠皮层前列腺素合酶-前列腺素-前列腺素受体信号通路变化特征
魏玉玲王健峰阳群芳胡馨月纪超男杨洋匡胜男麦少珊杨俊卿
(重庆医科大学药理学教研室 重庆市生物化学与分子药理学重点实验室,重庆400016)
摘要〔〕目的观察铝负荷致慢性脑损伤大鼠皮层前列腺素(PGs)合酶-PGs-PGs受体信号通路的变化特征。方法SD雄性大鼠经灌胃给予葡萄糖酸铝溶液(Al3+ 200 mg/kg),1次/d,每周持续灌胃5 d,共20 w,建立慢性铝负荷致大鼠脑损伤模型。采用Morris水迷宫、组织病理学、生化酶学指标观察慢性铝负荷大鼠皮层神经元损伤,采用ELISA方法检测皮层组织PGs(PGD2、PGE2、PGF2α、6-keto-PGF1α、TXB2)含量变化,RT-PCR方法测定大鼠皮层PGs合酶(cPGES、mPGES-1、H-PGDS、PGIS、TXAS)和PGs受体(EP1、EP2、EP3、EP4、DP1、FP、TP、IP)mRNA表达,Western印迹方法检测皮层PGs受体(EP2、EP3、DP1、FP、TP、IP)蛋白含量。结果与对照组相比,慢性铝负荷大鼠空间学习记忆能力明显下降,皮层神经元核固缩;皮层组织SOD活性均降低,MDA含量增加;皮层PGE2、PGD2、PGF2α、6-keto-PGF1α、TXB2 的含量均显著升高;mPGES-1、PGIS、TXAS、EP2、DP1、IP 、EP4 mRNA表达明显升高,EP3、FP、TP mRNA表达明显降低,H-PGDS、cPGES、EP1 mRNA无明显变化;皮层EP2、IP蛋白表达显著升高,而EP3蛋白表达明显降低,DP1、FP、TP蛋白无明显变化。结论铝负荷大鼠的皮层PGs合酶-PGs-PGs受体信号通路平衡失调,其可能参与了铝负荷致大鼠皮层神经损伤机制。
关键词〔〕铝负荷;大脑皮层;前列腺素;前列腺素合酶;前列腺素受体
中图分类号〔〕R964〔文献标识码〕A〔
基金项目:国家自然科学基金资助项目(No.81070972)
通讯作者:杨俊卿(1969-),男,博士,教授,博士生导师,主要从事神经药理学研究。
第一作者:魏玉玲(1990-),女,硕士,主要从事神经药理学研究。
Change of PGs synthase-PGs-PGs receptor signal pathway in rat cerebral cortex caused by chronic aluminum overload
WEI Yu-Ling, WANG Jian-Feng,YANG Qun-Fang,etal.
Department of Pharmacology, Chongqing Medical University, Chongqing 400016, China
Abstract【】ObjectiveTo investigate the change of PGs synthases-PGs-PGs receptor signal pathway in cerebral cortex of chronic aluminum overload rat.MethodsThe chronic aluminum overload rats were induced via intragastric administration of aluminum gluconate(Al3+ 200 mg/kg), once a day, with 5 d a week ,for total 20 w. The functions of spatial learning and memory were evaluated by Morris water maze. Pathomorphological changes of rat cortical neurons were observed by HE staining. SOD activity and MDA content were detected by biochemistry methods. Changes of PGs levels in cortical tissues were assessed by ELISA, PGs synthase and PGs receptor mRNA expression were measured by RT-PCR, PGs receptor protein expression was measured by Western blot.ResultsCompared with those of control group, the spatial learning and memory functions were notably impaired in aluminum overload group, and the cortical neurons of aluminum overload rats appeared nuclear condensation. In the cerebral cortical tissues, the contents of PGE2, PGD2, PGF2α, 6 -keto-PGF1α, TXB2 were increased. The mRNA expressions of mPGES-1, PGIS, TXAS, EP2, DP1, IP, EP4 were increased and EP3, FP, TP were decreased. The protein expressions of EP2, IP were increased and EP3 was decreased.ConclusionsPGs synthase-PGs-PGs receptor signaling pathway disorder is presented in cortical tissue of aluminum overload rat. However, further discussion on the specific mechanisms of the imbalance of signaling pathways induced by chronic aluminum overload in SD rat cerebral cortex is needed.
【Key words】Aluminum overload;Cerebral cortex;Prostaglandin;Prostaglandin synthase;Prostaglandin receptor
过量的铝异常沉积于脑会产生严重的中枢系统毒性,表现为行为和认知功能障碍、神经元损伤,甚至神经元退行性变〔1~3〕。但是其机制并不完全清楚。我们前期研究发现慢性铝负荷可致大鼠空间学习记忆能力减退,皮层和海马组织出现明显的神经元损伤;同时,环氧合酶(COX)-2 mRNA和蛋白的表达均显著增加,给予COX-2抑制剂美洛昔康能明显改善铝负荷大鼠行为学和形态学的病理性改变,COX-2 mRNA和蛋白表达显著降低;同时抑制COX-2不会明显导致5-脂氧酶途径的明显代偿〔4〕,提示COX-2信号通路可能是干预慢性脑损伤的重要环节之一。然而,长期使用选择性 COX-2 抑制剂只能预防而不能治愈脑损伤所引起的认知缺失,且该类药物的长期使用会增加病人发生胃肠道溃疡、出血、心脑血管疾病的风险〔5~7〕。前列腺素(PGs)是一类以前列烷酸为骨架的不饱和脂肪酸衍生物。细胞膜磷脂在磷脂酶A2的作用下生成花生四烯酸(AA),AA在COX作用下生PGG2,随后转变成PGH2,PGH2分别在PGs合酶(PGDS、PGES、PGFS、PGIS和TXAS)的酶促反应下生成系列PGs(PGD2、PGE2、PGF2a、PGI2和TXA2)。PGs通过作用于相应的G蛋白耦联的PGs受体(DP、EP、FP、IP和TP)而发挥不同的生理作用和病理效应。一些学者也提出,在对急、慢性脑损伤的治疗中,低位干预COX-2下游PGs合酶-PGs-PGs受体信号通路的靶点会优于高位阻断COX-2〔8〕。本实验拟进一步观察慢性铝负荷大鼠大脑皮层PGs合酶-PGs-PGs受体信号通路的变化。
1材料与方法
1.1动物、主要试剂及仪器由重庆医科大学实验动物中心提供清洁级雄性Sprague-Dawley(SD)大鼠34只,体重220~250 g,动物许可证:SCXK(渝):2010-0001。
D-葡萄糖酸钠、六水合三氯化铝均购于国药化工试剂有限公司,多聚甲醛、水合氯醛均为国产分析纯,蛋白定量试剂盒、超氧化物歧化酶(SOD)检测试剂盒、丙二醛(MDA)检测试剂盒均购于南京建成生物技术有限公司,ELISA试剂盒、大鼠PGs受体多抗(一抗)、辣根过氧化物酶标记山羊抗兔IgG(二抗)均购于美国Cayman公司,SDS-PAGE制胶试剂盒、WIP组织细胞裂解液、BCA蛋白定量试剂盒、5×Loading上样缓冲液、BeyoECL plus化学发光试剂盒均购于碧云天生物技术有限公司,BIOZOL总RNA提取试剂、BioFlux逆转录试剂盒均购于杭州博日科技有限公司,Premix PCR混染试剂购于北京康为世纪生物科技有限公司、兔抗小鼠β-actin购于北京中杉金桥生物技术有限公司。
DMS-2 Morris水迷宫为中国医学科学院药物研究所研制,全自动酶标仪购于美国Spectra Max M2公司,Western印迹电泳仪购于北京六一仪器厂,定量PCR仪、凝胶成像图像分析系统购于美国Bio-Rad公司。
1.2动物分组与建模SD大鼠34只,随机分成慢性铝负荷模型组和对照组各17只,模型组每天灌胃葡萄糖酸铝溶液(Al3+200 mg/kg),对照组同时灌胃等体积葡萄糖酸钠溶液,每周灌胃给药5 d,持续20 w〔9〕。给药结束后第2天进行空间学习记忆能力检测,之后每组各取3只进行组织病理学检查,其余大鼠分离皮层组织储存于-80℃。所有相关实验均在重庆医科大学道德与伦理委员会的指导和许可下进行。
1.3大鼠空间学习记忆能力的检测水迷宫实验参考Yu等〔9〕的方法并做一定改进,给药结束第2天,用电脑全自动程控 Morris水迷宫检测大鼠空间学习记忆能力,水温 21℃~25℃。在学习记忆阶段,第一天,将大鼠放到平台上1 min 后让其自由游泳至平台;90 s内未找到平台的大鼠,实验者将其引至平台。第2天起,将大鼠分别从A、B、C、D四个方位面向池壁放入水中,记录其寻台潜伏期,持续检测4 d。若90 s内未找到平台者,记录其寻台潜伏期为90 s。每只大鼠每天四次寻台潜伏期的平均值作为该大鼠当天的空间学习成绩。在记忆检测阶段,撤去水平台,随机选取方位将大鼠面壁放入水中,记录第1次跨越水平台的时间,作为空间记忆成绩(超过90 s者记为90 s)。
1.4组织病理学检查给药结束第3天,每组各取3只大鼠进行在体脑组织固定,大鼠腹腔注射4%水合氯醛麻醉后仰卧位固定于鼠板上,打开胸腔并于肝脏上剪适量切口作为血液及灌注液的出口,将灌注针头插入心尖并用止血钳固定,快速滴入预冷的150 ml肝素化生理盐水,然后缓慢注入200 ml 4%多聚甲醛。分离大鼠全脑组织并置于10%多聚甲醛中固定,行冠状面切片,每片厚约 5 μm,经HE 染色,光镜下观察皮层神经元形态和数目的变化。
1.5皮层组织SOD活性和MDA含量测定行为学测试结束后处死各组大鼠,分离其大脑皮层,用预冷的生理盐水制成10%匀浆,按相关试剂盒说明书检测SOD活性及MDA含量。
1.6ELISA法测定PGs含量称取适量皮层组织,加入9倍体积匀浆液(含10 μmol/L吲哚美辛,1 mmol/L EDTA,0.01 mol/L PBS, pH7.4),冰上充分匀浆后离心10 min(4℃,12 000 r/min),收集匀浆液上清液存放于-20℃。由于PGI2和TXA2会迅速代谢为6-keto-PGF1α和TXB2,因此使用其代谢产物含量代表其变化,分别按照PGE2、PGD2、PGF2α、6-keto-PGF1α、TXB2 的 ELISA含量测定说明书操作。使用全自动酶标仪于波长405~420 nm处测定各孔吸光度值(OD值)。
1.7RT-PCR检测PGs合酶和PGs受体mRNA表达参照GenBank基因库,依据大鼠PGs合酶(cPGES、mPGES-1、H-PGDS、TXAS、PGIS)以及PGs受体(EP1、EP2、EP3、EP4、DP1、IP、FP、TP)的mRNA序列由上海生工生物有限公司设计合成各引物。见表1。
按照按照BIOZOL总RNA提取试剂说明书提取RNA,将1 μl RNA加入5 μl上样缓冲液,0.8%琼脂糖凝胶电泳鉴定其完整性,紫外分光光度法进行检测,1.8≤OD260/OD280≤2.0即可判断RNA浓度和纯度合格。按照BioRT逆转录扩增试剂盒说明书逆转录mRNA为cDNA,按照康为世纪Premix PCR试剂说明书进行cDNA的扩增,2%琼脂糖凝胶电泳扩增产物,电泳结果经Bio-Rad凝胶成像分析系统成像与分析。

表1 各引物序列及扩增片段长度
1.8Western印迹方法检测大鼠脑组织中PGs受体蛋白含量取约50 mg大鼠大脑皮层组织,混合适量组织裂解液并在冰上充分匀浆,低温离心后取上清液,BCA测定蛋白浓度,以4∶1比例加入上样缓冲液充分煮沸变性之后储存于-20℃,每次取适量蛋白进行10%SDS-PAGE,切胶后转移至硝酸纤维素膜后用封闭液封闭2 h,摇床上洗膜3次,每次5 min,加一抗于4℃孵育过夜,洗膜3次,每次5 min,加辣根过氧化物酶标记的二抗室温孵育2 h,洗膜3次后,用可见-紫外光凝胶扫描分析系统对蛋白条带进行分析。
2结果
2.1铝负荷对大鼠空间学习记忆能力的影响与对照组相比,在学习阶段第3~4天,模型组大鼠寻台潜伏期明显延长(P<0.05,P<0.01),在记忆检测阶段其寻台潜伏期也明显延长(P<0.01)。见表2。
表2 铝负荷对大鼠空间学习记忆能力的影响 ± s, n=17)
与对照组比较:1)P<0.05,2)P<0.01;下表同
2.2铝负荷对大鼠皮层组织病理形态学的影响光镜下可见对照组大鼠皮层神经元层次分明、排列整齐、核膜核仁清晰,无明显核固缩与核深染。与对照组相比,模型组大鼠皮层神经元胞体边缘模糊、数目减少,可见明显的核固缩和深染。见图1。以百分比计数核固缩神经元数目,模型组的大鼠核固缩神经元(88.70%±1.50%)比对照组(35.30%±3.80%)明显增加(P<0.01)。

图1 铝过负荷对大鼠皮层组织病理形态学的影响(HE,×400)
2.3铝负荷大鼠皮层组织SOD活性和MDA含量的变化与对照组相比,模型组皮层组织的SOD活性明显降低(P<0.05),MDA含量明显增多(P<0.05),见表3。

表3 铝过负荷大鼠皮层组织SOD活性和
2.4铝负荷大鼠皮层组织PGs含量的变化ELISA结果表明,对照组大鼠皮层组织PGs含量由低到高依次为6-keto-PGF1α、PGE2、PGF2α、TXB2、PGD2;模型组大鼠皮层组织PGs含量由低到高依次为6-keto-PGF1α、PGF2α、PGE2、TXB2、PGD2。与对照组比较,模型组大鼠皮层组织PGD2、PGE2、PGF2α、6-keto-PGF1α、TXB2含量均明显增多,差异有统计学意义(P<0.05,P<0.01),依次增加80.91%、157.28%、74.14%、111.35%、79.63%(表4)。

表4 铝过负荷大鼠皮层组织PGD2、PGE2、PGF2α、6-keto-PGF1α和TXB2含量变化
2.5铝负荷大鼠皮层组织PGs合酶、PGs受体mRNA的表达变化对照组大鼠皮层组织PGs合酶mRNA表达水平由低到高依次为TXAS、mPGES-1、PGIS、cPGES、H-PGDS;模型组大鼠皮层组织PGs合酶mRNA表达水平由低到高依次为TXAS、mPGES-1、PGIS、cPGES、H-PGDS。与对照组比较,模型组大鼠皮层组织H-PGDS、 mPGES-1、PGIS、TXAS mRNA表达依次升高2.50%、43.40%、42.62%、30.00%,mPGES-1、PGIS、TXAS mRNA升高具有显著性(P<0.05),H-PGDS mRNA的升高无显著性;cPGES mRNA表达降低1.27%,无显著性(表5和图2)。
对照组大鼠皮层组织PGs受体mRNA表达水平由低到高依次为DP1、EP4、IP、EP2、FP、EP1、EP3、TP;模型组大鼠皮层组织PGs受体mRNA表达水平由低到高依次为FP、EP3、DP1、EP4、IP、EP1、TP、EP2。与对照组比较,模型组大鼠皮层组织DP1、EP1 EP2、EP4、IP mRNA表达均升高,依次升高64.52%、13.24%、68.00%、39.53%、43.48%,EP2、DP1、IP、EP4 mRNA升高均具有显著性(P<0.05),EP1 mRNA升高无显著性;EP3、FP、TP mRNA表达依次降低44.16%、39.06%、15.05%,均具显著性(P<0.05)(图3和表6)。
2.6铝负荷对大鼠皮层组织PGs受体蛋白表达的影响对照组大鼠大脑皮层组织PGs受体蛋白表达水平由低到高依次为EP2、EP3、IP、TP、DP1、FP;模型组大鼠大脑皮层组织PGs受体蛋白表达水平由低到高依次为EP3、EP2、FP、TP、IP、DP1。与对照组相比,模型组大鼠大脑皮层组织EP2、DP1、IP蛋白表达依次升高42.31%、32.08%、9.52%,EP2、IP升高具有显著性(P<0.05);EP3、FP、TP依次降低17.95%、40.00%、11.29%,EP3降低具有显著性(P<0.05),其余均无显著性(图4和表7)。
图2 铝过负荷大鼠大脑皮层组织PGs合酶mRNA表达

图3 铝过负荷大鼠皮层组织PGs受体mRNA表达

组别H-PGDS/β-actincPGES/β-actinmPGES-1/β-actinPGIS/β-actinTXAS/β-actin对照组1.60±0.121.58±0.160.53±0.060.61±0.100.50±0.06模型组组1.64±0.091.56±0.080.76±0.081)0.87±0.061)0.65±0.021)

表6 铝过负荷组大鼠皮层组织PGs受体mRNA表达变化
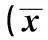
表7 铝过负荷大鼠皮层组织PGs受体蛋白表达变化 ± s, n=3)

图4 铝过负荷大鼠皮层组织PGs受体蛋白表达
3讨论
PGDS有谷胱苷肽依赖性生血型PGD合酶(H-PGDS)和非谷胱苷肽依赖性脂质运载蛋白型PGD合酶(L-PGDS)两种亚型,为脑脊液含量最高的痕迹蛋白之一,并随年龄增加其脑脊液中的含量也增加〔10〕。有研究报道,H-PGDS通过阻止小胶质细胞的炎性浸润以及降低炎性因子核因子(NF)-κB 的产量从而保护缺血再灌注损伤的小鼠神经元〔11〕。PGD2是脑内最丰富的前列腺素,其DP受体包括DP1受体和DP2受体,在缺血脑损伤及兴奋毒损伤模型中,激动DP1受体对神经元起保护作用,激动DP2受体却起损伤作用〔12〕。也有文章报道PGD2通过合成环戊烯酮的代谢物而对原代培养的神经元产生毒性作用,用DP1和DP2进行干预也不能逆转其损伤〔13〕。我们的研究结果发现铝负荷大鼠脑组织H-PGDS mRNA未增加,而PGD2含量却明显增加,可能是L-PGDS表达上调所致,DP1受体蛋白表达明显上调,我们初步认为在慢性铝负荷致脑损伤大鼠的皮层组织中,PGD2可能通过激动DP1而介导损伤作用,而PGDS-PGD2-DP受体信号通路的具体作用机制还有待进一步探究。
催化PGE2生成的PGES有三种亚型,胞质型PGES (cPGES)、微粒体型 PGES(mPGES)-1和mPGES-2。诱导型的mPGES-1通过与COX-2耦联,在病理过程中发挥作用。EP受体主要包括EP1、EP2、EP3和EP4四种亚型,且在所有的器官均有不同程度的分布和表达。目前研究发现,PGE2既参与缺血性和兴奋毒性脑损伤作用,也可能产生神经保护作用,并认为其原因可能与EP亚型和分布不同有关,也可能取决于采用炎症损伤模型还是兴奋毒损伤模型,如对于炎症损伤模型PGE2为保护性PGs〔14,15〕。经EP1受体激动剂预处理的野生小鼠在纹状体内注射NMDA后,损伤体积相比单一给予NMDA明显增加,而EP1受体拮抗剂却能明显减少NMDA造成的损伤体积〔16〕。EP2和EP4受体通过参与中枢神经系统炎症、脂质过氧化而介导神经元退变损伤〔17〕。一些研究发现EP3受体对神经元有保护作用,给予C57BL/6小鼠NMDA和EP3受体激动剂硫前列酮处理,硫前列酮能够明显对CA1区的椎体神经元起保护作用〔14〕。我们的研究结果提示EP2和EP4受体可能主要介导慢性铝负荷大鼠神经元的损伤,而EP3受体则可能介导神经保护作用。
免疫组化研究显示PGIS广泛表达于CNS神经元和胶质细胞,特别是在皮层和海马神经元高表达。IP受体广泛表达于大鼠血管、海马、皮层和纹状体等神经元。研究发现PGI2能保护海马神经元损伤,IP敲除的转基因小鼠海马神经元数目与野生小鼠之间没有显著差异,但是IP敲除能明显增强全脑缺血海马神经元损伤〔18〕。我们的结果表明在慢性铝负荷损伤中PGIS- PGI2-IP通路可能起保护作用。
TXA2半衰期较短,经TXA2合成之后主要代谢为TXB2,缺血再灌注能够明显诱导脑组织产生和释放TXA2〔19〕。另有研究显示,在中风病人以及AD患者尸检脑组织TXA2水平增加,TXA2可能介导了Aβ对运动神经元的毒性作用〔20〕。TXA2受体 (TP) 表达于中枢神经系统的神经元和胶质细胞。有研究表明缺血再灌注诱导大鼠脑组织PGI2/TXA2比值反馈性升高,从而降低神经元损伤〔21〕。本研究发现慢性铝负荷大鼠脑组织中TXAS mRNA、TP受体mRNA和蛋白表达以及TXB2含量明显增加,初步认为TXAS- TXB2-TP信号通路可能参与慢性铝负荷对皮层组织的损伤。
有研究报道,给予大鼠注射红藻酸建立癫痫模型,海马中PGF2α含量明显增加,注射FP受体拮抗剂可加重癫痫〔22,23〕。另一些研究则表明在大鼠缺血再灌注脑损伤中,给予FP受体激动剂后脑损伤明显加重,给予FP受体拮抗剂AL-8810脑损伤能明显减轻〔24〕。而我们研究发现铝负荷大鼠脑组织中PGF2α含量增多,FP受体mRNA和蛋白表达却明显下调,考虑到模型的不同,PGFS-PGF2α-FP信号通路在慢性铝负荷大鼠脑损伤过程的具体作用及机制待进一步研究。
4参考文献
1Walton JR .Cognitive deterioration and associated pathology induced by chronic low-level aluminum ingestion in a translational rat model provides an explanation of Alzheimer's disease,tests for susceptibility and avenues for treatment 〔J〕.Alzheimers Dis,2012;2012:914947.
2Kramer MF,Heath MD.Aluminum in allergen-specific subcutaneous immunetherapy-a German perspective 〔J〕.Vaccine,2014;32(33):4140-8.
3苏强,杨俊卿,唐婕,等.美洛昔康对慢性铝过负荷致神经元退变大鼠脑内金属离子含量的影响〔J〕.中国老年学杂志,2014;34(4):938-40.
4Yang JQ,Liu BZ,He BC,etal.Protective effects of meloxicam on aluminum overload-induced cerebral damage in mice〔J〕.Eur J Pharmacol,2006;547(1-3):52-8.
5Cote S,Carmichael PH,Verreault R,etal.Nonsteroidal anti-inflammatory drug use and the risk of cognitive impairment and Alzheimer's disease 〔J〕.Alzheimers Dement,2012;8 (3):219-26.
6Khansari PS,Coyne L.NSAIDs in the treatment and/or prevention of neurological disorders 〔J〕.Inflammopharmacology,2012;20 (3):159-67.
7Cannon CP,Cannon PJ.Physiology.COX-2 inhibitors and cardiovascular risk〔J〕.Science,2012;336(6087):1386-7.
8Hampel H,Lista S,Khachaturian ZS,etal.Development of biomarkers to chart all Alzheimer's disease stages:the royal road to cutting the therapeutic Gordian Knot〔J〕.Alzheimers Dement,2012;8 (4):312-36.
9Yu LJ,Jiang R,Su Q,etal.Hippocampal neuronal metal ion imbalance related oxidative stress in a rat model of chronic aluminum exposure and neuroprotection of meloxicam〔J〕.Behav Brain Funct,2014;10:6.
10Chen CP,Chen RL,Preston JE.Age-related increase of prostaglandin D(2) synthase concentrationand glycation in ovine cerebrospinal fluid〔J〕.Exp Gerontol,2009;44(10):639-45.
11Liu M,Eguchi N,Yamasaki Y,etal.Protective role of hematopoietic prostaglandin D synthase in transient focal cerebral ischemia in mice 〔J〕.Neuroscience,2009;163(1):296-307.
12Liang X,Wu L,Hand T,etal.Prostaglandin D2 mediates neuronal protection via the DP1 receptor〔J〕.J Neurochem,2005;92(3):477-86.
13Liu H,Li W,Rose ME.Prostaglandin D2 toxicity in primary neurons is mediated through its bioactive cyclopentenone metabolites 〔J〕.Neurotoxicology,2013;39:35-44.
14Wu L,Wang Q,Liang X,etal.Divergent effects of prostaglandin receptor signaling on neuronal survival〔J〕.Neurosci Lett,2007;421(3):253-8.
15Liang X,Wang Q,Shi Jetal.The PGE2 EP2 receptor accelerates disease progression and inflammation in a model of amyotrophic lateral sclerosis〔J〕.Ann Neurol,2008;64(3):304-14.
16Ahmad AS,Saleem S,Ahmad M,etal.Prostaglandin EP1 receptor contributes to excitotoxicity and focal ischemic brain damage〔J〕.Toxicol Sci,2006;89(1):265-70.
17Montine TJ,Milatovic D,Gupta RC,etal.Neuronal oxidative damage from activated innate immunity is EP2 receptor-dependent〔J〕.J Neurochem,2002;83(2):463-70.
18Wei G,Kibler KK,Koehler RC,etal.Prostacyclin deletion aggravates hippocampal neuronal loss after bilateral common carotid artery occlusion in mouse 〔J〕.Neurosci,2008;156(4):1111-7.
19Kong DL,Prough DS,Whitley JM,etal.Hemorrhage and intracranial hypertension in combination increase cerebral production of thromboxane A2〔J〕.Crit Care Med,1991;19(4):532-8.
20Yagami T,Tkahara Y,Ishibashi C,etal.Amyloid β protein impairs motor function via thromboxane A2 in the rat striatum〔J〕.Neurobiol Dis,2004;16:481-9.
21杨彬,余丽娟,王佳,等.全脑缺血再灌注大鼠皮层PGI2和TXA2时辰变化特征〔J〕.中国药理学通报,2013;29(12):1667-71.
22Baran H,Heldt R,Hertting G,etal.Increased prostaglandin formation in rat brain following systemic application of kainic acid〔J〕.Brain Res,1987;404(1-2):107-12.
23Kim HJ,Chung JI,Lee SH,etal.Involvement of endogenous prostaglandin F2α on kainic acid-induced seizure activity through FP receptor:The mechanism of proconvulsant effects of COX-2 inhibitors〔J〕.Brain Res,2008;1193:153-61.
24Saleem S,Ahmad AS,Maruyama T,etal.PGF(2alpha) FP receptor contributes to brain damage following transient focal brain ischemia〔J〕.Neurotox Res,2009;15(1):62-70.
〔2014-09-11修回〕
(编辑徐杰)
