日本血吸虫SjCHGC06822蛋白诱导BALB/c小鼠免疫保护效果观察
2015-12-30段明明苑纯秀冯新港
段明明,刘 群,2,葛 程,2,苑纯秀,陆 柯,李 浩,冯新港
(1.中国农业科学院上海兽医研究所,上海200241;2.上海师范大学生命与环境科学学院,上海 200234)
·研究论文·
日本血吸虫SjCHGC06822蛋白诱导BALB/c小鼠免疫保护效果观察
段明明1,刘 群1,2,葛 程1,2,苑纯秀1,陆 柯1,李 浩1,冯新港1
(1.中国农业科学院上海兽医研究所,上海200241;2.上海师范大学生命与环境科学学院,上海 200234)
利用PCR技术扩增日本血吸虫SjCHGC06822 ORF全长序列,以pET28a(+)为载体构建重组质粒,大肠杆菌表达系统进行表达,His-Ni柱层析纯化rSjCHGC06822/His蛋白后,生物信息学分析其可能结构,Western blot分析其抗原性。利用重组蛋白免疫BALB/c小鼠评估其免疫效果,ELISA分析血清抗体亚型变化。结果显示,获得日本血吸虫SjCHGC06822的完整ORF序列591 bp,编码192个氨基酸,序列aa37~aa72含一个EF-hand手性域结构,无信号肽及跨膜结构。获得的SjCHGC06822/His重组蛋白具有较好的抗原性,在2次独立BALB/c小鼠实验中,与PBS对照组相比,SjCHGC06822/His蛋白免疫组诱导小鼠获得30.36%、40.26%减虫率和30.14%、12.28%肝脏减卵率,血清IgG抗体免疫及感染后持续增高,IgG2a和IgG1水平随免疫次数增高,感染后出现下降,但IgG2a/IgG1(<1)水平持续增加。本研究成功克隆了SjCHGC06822基因,并成功表达纯化了rSjCHGC06822/His蛋白,且免疫原性和反应原性良好。SjCHGC06822蛋白免疫可以诱导BALB/c小鼠产生一定的保护力,诱导宿主的免疫应答更偏向于Th1型。
日本血吸虫;SjCHGC06822;免疫原性;Th1应答
体被是血吸虫童虫、成虫与宿主直接接触结构。研究发现,包括日本血吸虫在内的一些蠕虫,如曼氏血吸虫[1]、大片吸虫[2]、肝片吸虫[3]以及华支睾吸虫[4]等,其体被结构中存在一类含有EF-hand结构域蛋白。这类蛋白的EF-hand结构域中包含一种钙结合位点的螺旋-中央环-螺旋结构,主要生物学功能与细胞钙离子相关吸虫表膜中存在的蛋白类似[5]。研究表明这些含EF-hand手性域的分子可以诱导小鼠产生一定的抗血吸虫免疫病理保护,而其免疫调节机制仍不清楚[6-8]。查阅大量文献发现,日本血吸虫EF-hand手性分子SjCHGC06822分子可能通过抗原提呈细胞(antigen presenting cell, APC)提呈活化不同的CD4+T细胞,进而调节日本血吸虫肝脏虫卵肉芽肿炎症反应。本研究克隆表达了SjCHGC06822分子,对其进行生物信息学分析,Western blot检测该分子免疫原性,并利用重组蛋白免疫BALB/c小鼠建立肉芽肿炎症调节模型,评估其免疫保护效应,为后续研究奠定基础。
1 材料方法
1.1 主要试剂Ex Taq聚合酶、T4 ligase、限制性内切酶BamHⅠ和XhoⅠ、小型质粒抽提试剂盒、DNA片段纯化试剂盒均购自大连宝生物工程有限公司(TaKaRa);DNA Marker购自北京天根生物科技有限公司;蛋白分子量Marker购自麦约尔生物技术有限公司;Odyssey辣根过氧化物酶标记的山羊抗小鼠IgG购自上海仪涛生物有限公司;辣根过氧化物酶标记的山抗小鼠IgG、IgGa、IgG1购自武汉三鹰生物有限公司;Ni-NTA His·Bind 树脂、Ni-NTA缓冲液试剂盒购自Novagen公司。 E.coli DH5α感受态细胞、E.coli BL21(DE3)感受态细胞购自北京天根生物科技有限公司;BALB/c小鼠购自上海斯莱克实验动物公司;尾蚴由中国农业科学院上海兽医研究所钉螺室提供;pET28a(+)、不同期别天然虫体蛋白、感染日本血吸虫42 d小鼠血清由中国农业科学院上海兽
1.2 菌种、实验动物医研究所农业部动物寄生虫学重点实验室保存或制备。
1.3 SjCHGC06822基因的克隆根据GenBank已注册序列(GenBank登录号:ACE06906.1),利用Primer Premier 5.0软件设计引物。上游引物:5′-GC GCGGATCCATGGCGAGTACAATGG-3′,5′端加入保护碱基和BamHⅠ酶切位点,下游引物:5′-CG CGCTCGAGTTAATTGTTTGGTGTAC-3′,3′端加入XhoⅠ酶切位点。以上引物均由上海Invitrogen公司合成。以42日龄虫体cDNA为模板,扩增全长SjCHGC06822 ORF序列。扩增体系:Ex Taq酶0.5 μL、上下游引物各0.5 μL(50 pmol/μL)、42日龄成虫cDNA模板1 μL(100 ng)、dNTP mix 8 μL、10×Ex Taq buffer 5 μL、灭菌ddH2O 33.5 μL,PCR程序设定:94℃ 5 min;94℃变性45 s,56℃退火45 s,72℃延长2 min,35个循环;最72℃延伸10 min。产物经2%琼脂糖凝胶电泳检测后,按胶回收试剂盒说明进行切胶回收纯化。
1.4 pET28a(+)-SjCHGC06822/DH5α克隆载体构建PCR纯化产物和pET28a(+)经BamHⅠ、XhoⅠ37℃水浴双酶切5 h,片段纯化后亚克隆至pET28a(+)。连接体系:目的片段15 μL、pET28a (+) 5 μL、T4 ligase 1 μL、10×T4 ligase buffer 2 μL,16℃水浴连接17 h。重组质粒进行双酶切鉴定,将连接产物5 μL与100 μL DH5α混合冰浴30 min,42℃热激90 s,冰浴2 min后加入800 μL LB培养基,37℃、150 r/min培养45 min。取200 μL涂于卡纳抗性LB培养板,37℃培养12 h,挑取单个阳性菌落,进行菌液鉴定。鉴定体系:Es Taq Master Mix 12.5 μL、上游引物 0.5 μL、下游0.5 μL、菌液1.5 μL、ddH2O 10 μL。PCR程序同1.3。鉴定得到的阳性菌液送上海桑尼公司测序。将菌液鉴定和测序均阳性的pET28a(+)-SjCHGC06822/DH5α按1∶100接种于含1 mmol/L 卡那霉素的LB培养基中,37℃、200 r/ min培养14 h,按TaKaRa质粒抽取试剂盒说明抽取质粒。阳性质粒用BamHⅠ、XhoⅠ37℃水浴双酶切5 h,2%琼脂糖凝胶检测双酶切结果。
1.6 生物信息学分析利用在线分析软件ExPAsy Compute pI/Mw tool(http∶//web.expasy.org/compute_ pi/),预测SjCHGC06822蛋白大小及其等电点。利用在线软件TMHMM Server v 2.0(http∶//www.cbs.dtu.dk/services/TMHMM/)分析SjCHGC06822蛋白跨膜结构,SignalP 4.1 Server(http∶//www.cbs.dtu.dk/ services/SignalP/)预测是否含有信号肽,ScanProsite tool(http∶//prosite.expasy.org/scanprosite/)分析其可能结构。
1.7 大肠杆菌中表达将pET28a(+)-SjCHGC06822质粒导入BL21(DE3),构建pET28a(+)- SjCHGC06822/ BL21表达克隆,方法同1.4。接种含1 mmol/L卡那霉素的LB培养基,37℃、200 r/min培养,并不断测定OD600值。OD600值达到1时,加入终浓度为1 mmol/L 的 IPTG,继续培养6 h,离心收集菌体,溶于binding buffer,SDS-PAGE电泳检测重组蛋白表达情况。选取阳性表达克隆菌,接种500 mL LB培养基,同样方法收集菌体,溶于binding buffer,溶液反复冻融3次后,超声裂解菌体,10 800×g离心收集上清与沉淀,SDS-PAGE电泳检测蛋白表达情况。上清用Ni-NTA His●Bind 树脂纯化,滤去25%乙醇,依次用3倍体积灭菌去离子水、5倍镍离子化缓冲液、3倍体积binding buffer平衡柱体,加1~2倍体积样品,4℃孵育30 min,10倍体积binding buffer平衡,6倍体积washing buffer漂洗,4倍体积eluting buffer洗脱,分段收集,SDS-PAGE电泳检测纯化rSjCHGC06822蛋白。将目的蛋白透析至1×PBS,浓缩后,SDSPAGE电泳检测,改良BCA法测定蛋白浓度,经0.22 μm滤膜过滤后分装保存于-20℃。
1.8 多抗制备调整rSjCHGC06822蛋白浓度至500 mg/mL,按46∶54比例与206佐剂充分混合,多点免疫6 周龄BALB/c小鼠,每只200 μL。连续免疫3次,每次间隔2 w。第3次免疫后眼眶采血,-80℃保存。
1.9 Western blot分析rSjCHGC06822蛋白的免疫原性rSjCHGC06822蛋白和不同期别的可溶性成虫虫体蛋白分别经SDS-PAGE电泳(固定电流0.2 A、2 h)后,转移至硝酸纤(NC)维膜上,1×PBS冲洗,5% 脱脂奶粉4℃过夜封闭,PBST洗3次,每次5 min;以感染日本血吸虫42日龄小鼠血清和rSjCHGC06822蛋白免疫42日龄小鼠血清分别1∶100稀释后作为一抗,与NC膜室温孵育 3 h,1×PBS洗3次,每次5 min;Odyssey辣根过氧化物酶标记的山羊抗小鼠IgG1∶15 000稀释后作为二抗,室温避光与NC膜孵育40 min,PBST洗3次,PBS洗2次,每次5 min。Odssy双色红外激光扫描仪检测。
2.0 小鼠免疫保护实验选12只BALB/c雌鼠,随机分2组,每组6只,分别为rSjCHGC06822/His蛋白免疫组与 PBS 对照组。蛋白免疫组每次注射rSjCHGC06822/His蛋白-ISA 206佐剂乳化液(46∶54),PBS对照组每次注射同体积PBS-ISA 206佐剂乳化液(46∶54)。首次免疫蛋白50 μg,二次免疫和三次免疫量减半,每次间隔时间2 周。三免后10 d腹部贴片法感染(40±1)条日本血吸虫尾蚴,感染后42 d剖杀,肝门静脉法收集虫体计数。分别收集各组小鼠肝脏称重后加入20 mL PBS,高效组织匀浆仪匀浆后取1 mL,加入1 mL 10%NaOH混匀,56℃水浴锅消化30 min,虫卵计数,每份样品计3次,取平均数,最后换算成每克肝脏荷虫卵数(egg per gram,EPG)。实验组小鼠分别在一次免疫后7 d、二次免疫后7 d、三次免疫后7 d、感染14 d后和感染42 d后眼眶采血,分离血清,常规ELISA法检测IgG、IgG2a和IgG1抗体效价。
2 结果
2.1 SjCHGC06822基因克隆及pET28a(+)-SjCHGC06822/DH5α克隆载体构建根据GenBank中已载入序列设计引物,并加入BamHⅠ和XhoⅠ酶切位点,以42日龄日本血吸虫cDNA为模板,PCR克隆得到一段大小为591 bp片段,经酶切纯化连接至pET28a (+) 质粒,导入DH5α,双酶切鉴定及测序比对,证明扩增序列及插入位置和方向正确,pET28a (+)- SjCHGC06822/DH5α克隆载体构建成功。
2.2 SjCHGC06822基因生物信息学分析结果ExPAsyCompute pI/Mw tool分析结果显示:SjCHGC06822基因编码196个氨基酸,预计分子量大小22.98 kDa,等电点7.67。ScanProsite 分析显示SjCHGC06822 在aa37~aa72处有一个明显的EF-hand 结构域,SignalP4.1 Server在线分析显示SjCHGC06822分子无信号肽结构,TMHMM Server v 2.0分析显示SjCHGC06822分子无跨膜结构。
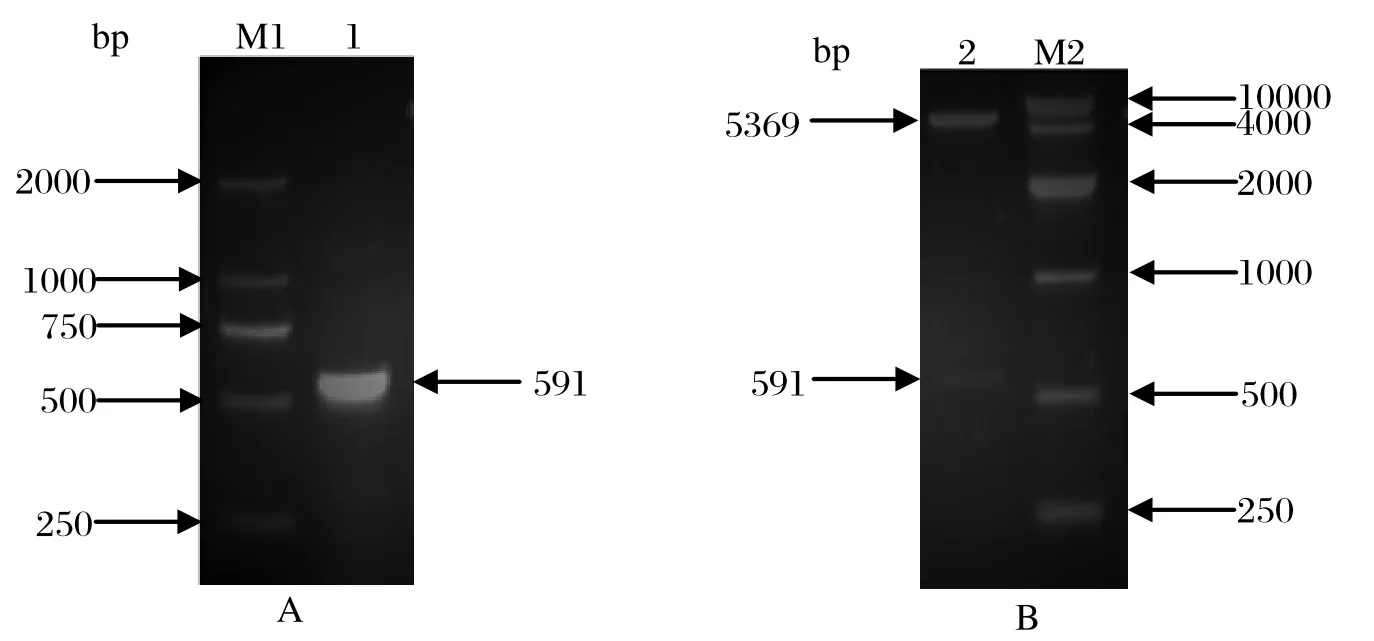
图1 SjCHGC06822基因的PCR扩增(A)及重组 pET28a(+)-SjCHGC06822的双酶切鉴定(B)Fig.1 The application of SjCHGC06822 gene by PCR(A) and the restriction enzyme analysis of recombinant pET28a(+)-SjCHGC06822 plasmid(B)
2.3 pET28a(+)-SjCHGC06822在大肠杆菌中的表达与重组蛋白纯化结果重组质粒pET28a(+)-SjCHGC06822导入BL21(DE3)大肠杆菌,经IPTG诱导6 h后,SDS-PAGE电泳结果显示23 kDa处有明显过表达带,与预期蛋白大小相符(图2)。经Ni-NTA His●Bind 树脂纯化得到rSjCHGC06822/His蛋白。
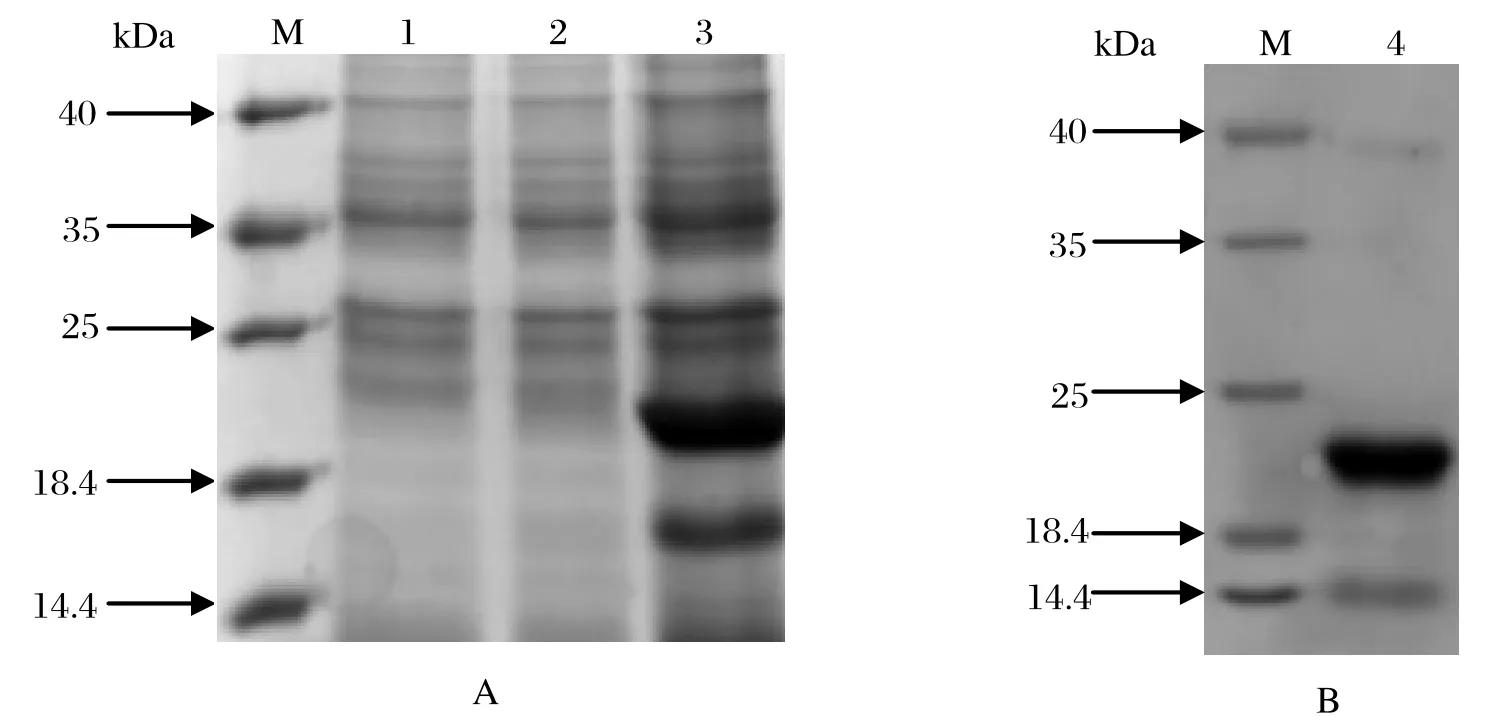
图2 rSjCHGC06822蛋白的原核表达(A)和rSjCHGC06822蛋白的纯化(B)Fig.2 Expression of rSjCHGC06822 protein(A)and purifi cation of rSjCHGC06822 protein(B)
2.4 rSjCHGC06822蛋白免疫原性鉴定以感染日本血吸虫42日龄小鼠血清为一抗对纯化的重组蛋白rSjCHGC06822/His进行Western blot分析,结果在23 kDa处有明显识别带;以rSjCHGC06822蛋白制得抗血清为一抗,分别对42、35、23、14、10日龄虫体可溶性蛋白进行Western blot分析,同样在23 kDa处同样有明显识别带(图3)。结果表明rSjCHGC06822蛋白具有较强的免疫原性,在不同期别童虫及成虫中有表达。
2.5 小鼠免疫试验结果统计2次独立实验的减虫率和减卵率结果见表1。与PBS对照组相比,rSjCHGC06822/His蛋白免疫诱导了30.36%、40.26%的减虫率(P<0.01)和30.14%、12.28%(P<0.01)的肝脏减虫卵率。
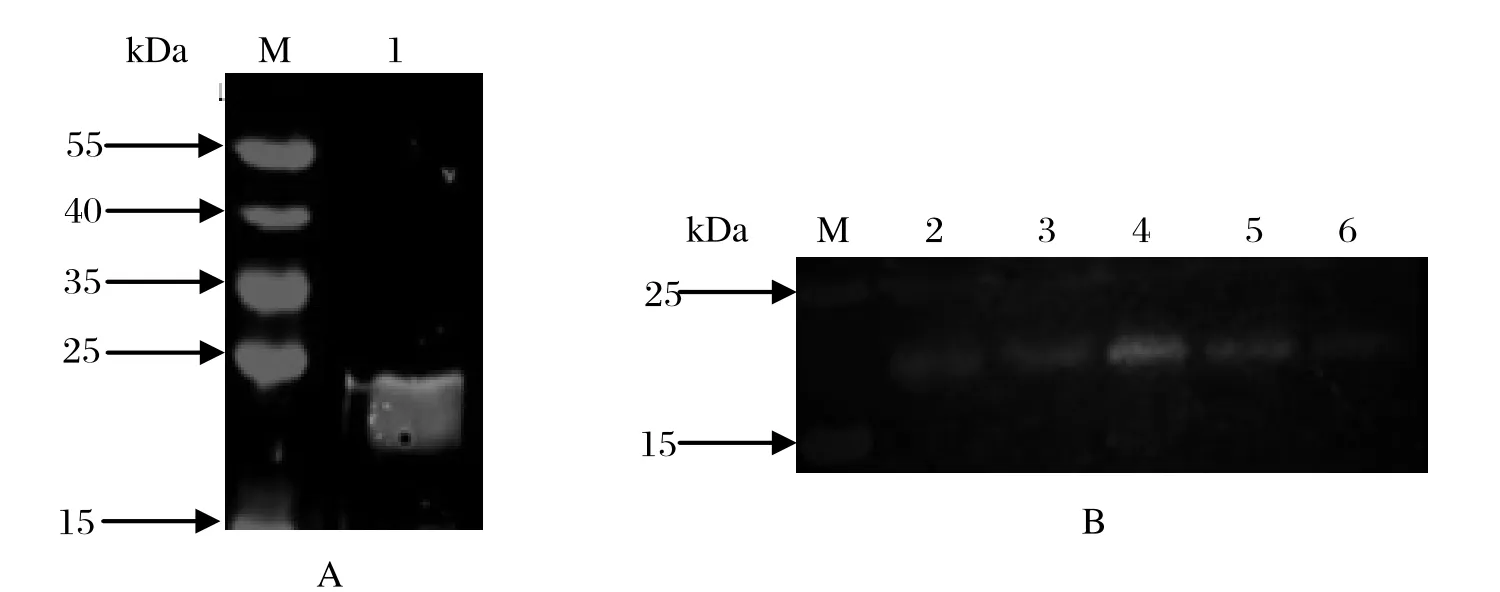
图3 Western blot 分析rSjCHGC06822/His蛋白免疫原性和反应原性Fig.3 Immunogenicity and reactogenicity analysis of rSjCHGC06822/His protein by Western blot
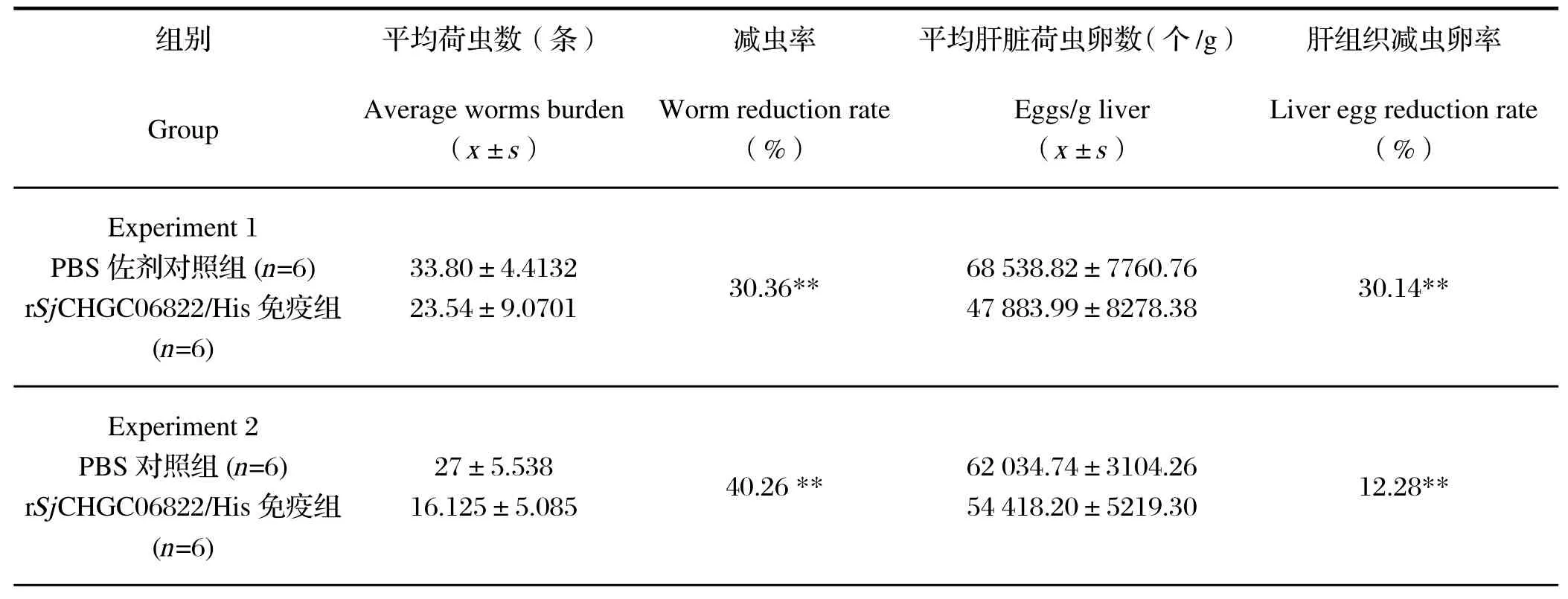
表1 rSjCHGC06822/His蛋白诱导BALB/c小鼠免疫保护结果Tabel 1 Evaluation of protective effi cacy of rSjCHGC06822/His protein in BALB/c mice
2.6 血清抗体水平结果表明rSjCHGC06822/His蛋白免疫能够诱导高水平的IgG抗体(见图4)。同时rSjCHGC06822/His蛋白免疫组IgG2a 和IgG1水平随着免疫次数增加而增加,但是攻击感染后二者水平呈下降趋势。值得注意的是IgG2a在感染d14出现显著的增高。另外,PBS佐剂对照组中IgG2a/IgG1比值呈免疫过程中减小感染后增加的“波谷”状变化,而rSjCHGC06822/His蛋白免疫组中,整个过程IgG2a/IgG1比值缓慢增加,感染d14与免疫过程相比增加尤为明显(P<0.01)(图5)。
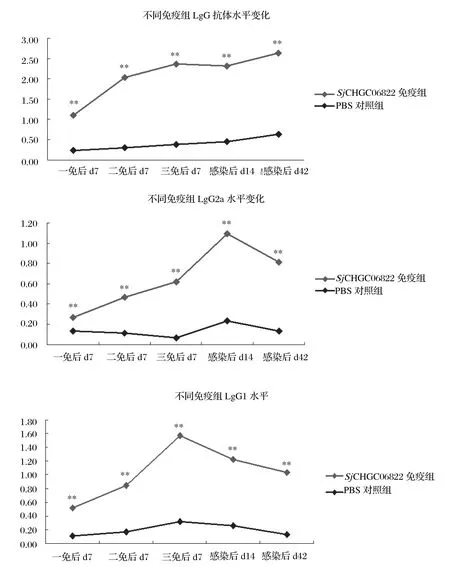
图4 ELISA检测不同免疫组BALB/c小鼠血清抗SjCHGC06822/His IgG、IgG2a和IgG1抗体水平变化(**表示P<0.01)Fig.4 Analysis of anti- SjCHGC06822/His IgG, IgG2a and IgG1 antibody levels in BALB/c mice serum by ELISA (**means P<0.01)
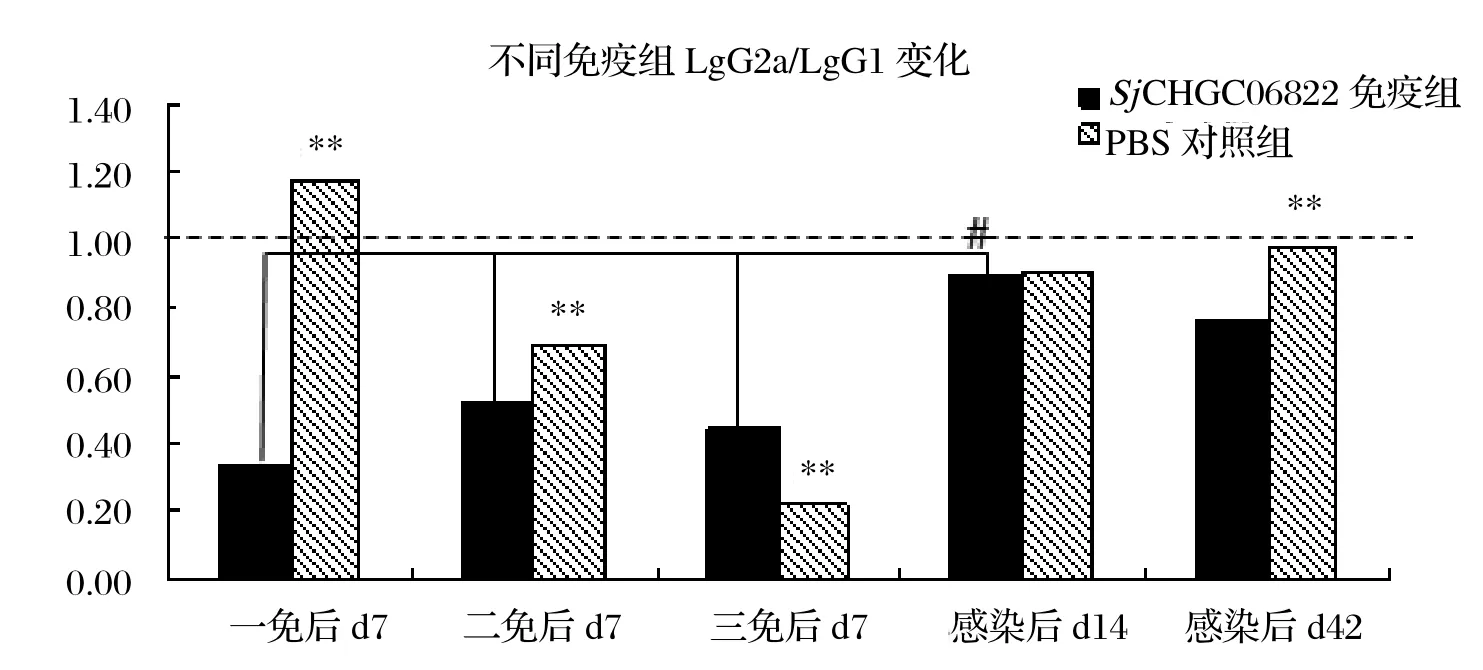
图5 ELISA检测不同免疫组BALB/c小鼠血清抗SjCHGC06822/His IgG2a/IgG1抗体水平变化(#、**表示P<0.01 )Fig.5 Analysis of anti- SjCHGC06822/His IgG2a/ IgG1 antibody levels in BALB/c mice serum by ELISA (#,**mean P<0.01 )
3 讨论
体被蛋白是血吸虫与宿主之间直接相互作用分子,参与血吸虫的营养吸收、信号转导及自身稳态的维护,更重要的是直接参与血吸虫与宿主之间的免疫作用,如免疫逃避、免疫调节。EF-hand结构域蛋白是血吸虫和一些蠕虫体被特有蛋白,已报道的Sm21.7、Sm21.6、SjTP22.4共同含有EF-hand结构域[6-8],这些蛋白分子免疫小鼠可不同程度的减小虫卵肉芽肿的病理损伤。因此我们选择对日本血吸虫SjCHGC06822分子进行研究,以期为相似蛋白分子筛选和鉴定提供科学依据。
本研究对日本血吸虫SjCHGC06822基因进行了克隆,构建了pET28a(+)- SjCHGC06822重组质粒,并在大肠杆菌中成功表达得到约23 kDa重组蛋白,免疫原性和反应原性显示rSjCHGC06822可以作为抗原用于动物实验。重组蛋白免疫小鼠制得多克隆抗体能够识别不同期别的虫体蛋白,推断SjCHGC06822分子在童虫及成虫期均有表达。而Liu等[9]基于蛋白质组分析显示日本血吸虫SjCHGC06822蛋白在尾蚴期呈现高表达,而在童虫期、成虫期及虫卵中表达较低,这点需要进一步的验证。
两次动物保护试验显示,SjCHGC06822蛋白免疫能够起到一定的减虫和肝减卵作用,并且在诱导虫卵肉芽肿炎症浸润模型中,rSjCHGC06822/His蛋白免疫组能够募集到更多的炎性细胞(数据未显示),整体反应过程呈急性反应。血清抗体水平分析表明,SjCHGC06822蛋白免疫小鼠能够诱导高水平的IgG抗体,可能与宿主的杀虫作用有关。
同时,抗体亚型监测发现,IgG2a 和IgG1水平随着免疫次数增加而增加,但是攻击感染后二者水平呈下降趋势。值得注意的是IgG2a在感染d 14出现显著增高,我们推测感染诱导宿主免疫迅速出现偏向Th1型的应答。Th1型免疫应答往往启动早期的急性感染过程,其作用在于阻止童虫的迁移和成虫的成熟[10]。而血吸虫虫卵肉芽肿的病理基础是基于虫体或虫卵抗原刺激宿主免疫系统,引发的由CD4+T细胞介导的,虫卵周围大量的炎性细胞浸润为特征的超敏反应[11,12]。rSjCHGC06822/His蛋白免疫组中,与免疫过程相比,感染后d14 IgG2a/IgG1比值增加明显(P<0.01),即感染初期rSjCHGC06822/His蛋白诱导宿主的免疫应答更偏向于Th1型,这可能是SjCHGC06822蛋白免疫组能够募集到更多的炎性细胞和具有一定减虫卵作用的重要原因。
本研究成功克隆了SjCHGC06822基因,并成功表达纯化了rSjCHGC06822/His蛋白,且免疫原性和反应原性良好。SjCHGC06822蛋白免疫可以诱导BALB/c小鼠产生一定的保护力,且诱导宿主的免疫应答更偏向于Th1型,为进一步研究该蛋白调节虫卵肉芽肿炎症过程鉴定基础。
[1] Fitzsimmons C M, Stewart T J, Hoffmann K F, et al.Human IgE response to the Schistosoma haematobium22.6 kDa antigen [J].Parasite Immunol, 2004, 26(8-9)∶371-376.
[2] Mohamed M M, Shalaby K A, LoVerde P T, et al.Characterization of Sm20.8, a member of a family of schistosome tegumental antigens [J].Mol Biochem Parasitol,1998, 96(1-2)∶ 15-25.
[3] Vichasri-Grams S, Subpipattana P, Sobhon P, et al.An analysis of the calcium-binding protein 1 of Fasciola gigantica with a comparison to its homologs in the phylum Platyhelminthes [J].Mol Biochem Parasitol, 2006, 146(1)∶ 10-23.
[4] Ruiz de Eguino A D, Machín A, Casais R, et al.Cloning and expression in Escherichia coli of a Fasciola hepatica gene encoding a calcium-binding protein [J].Mol Biochem Parasitol, 1999, 101(1-2)∶ 13-21.
[5] 于复东, 康斌, 李园园, 等.预测和分析血吸虫含有 EF-hand结构域的表膜蛋白的功能[J].科学通报, 2007, 52(13)∶ 1529-1535.
[6] Zhang Z, Xu H, Gan W, et al.Schistosoma japonicum calcium-binding tegumental protein SjTP22.4 immunization confers praziquantel schistosomulumicide and antifecundity effect in mice [J].Vaccine, 2012, 30(34)∶ 5141-5150.
[7] Rezende C M, Silva M R, Santos I G, et al.Immunization with rP22 induces protective immunity against Schistosoma manson∶ effects on granuloma downmodulation and cytokine production [J].Immunol Lett, 2011, 141(1)∶ 123-133.
[8] Lopes D O, Paiva L F, Martins M A, et al.Sm21.6 a novel EF-hand family protein member located on the surface of Schistosoma manson adult worm that failed to induce protection against challenge infection but reduced liver pathology [J].Vaccine, 2009, 27(31)∶ 4127-4135.
[9] Liu F, Chen P, Cui S J, et al.SjTPdb∶ integrated transcriptome and proteome database and analysis platform for Schistosoma japonicum[J].BMC genomics, 2008, 9(1)∶ 304.
[10] Chuah C, Jones M K, Burke M L, et al.Cellular and chemokine-mediated regulation in schistosome-induced hepatic pathology[J].Trends Parasitol, 2014, 30(3)∶141-150.
[11] Warren K S, Domingo E O, Cowan R B.Granuloma formation around schistosome eggs as a manifestation of delayed hypersensitivity [J].Am J Pathol, 1967, 51(5)∶735-756.
[12] Angyalosi G, Pancré V, Herno J, et al.Immunological response of major histocompatibility complex class II-deficient (Abeta(o)) mice infected by the parasite Schistosoma mansoni [J].Scand J Immunol, 1998, 48(2)∶159-169.
IMMUNE PROTECTIVE RESPONSE OF RECOMBINANT SJCHGC06822 PROTEIN AGAINST SCHISTOSOMA JAPONICUM
DUAN Ming-ming1, LIU Qun1,2, GE Cheng1,2, YUAN Chun-xiu1, LU Ke1, LI Hao1, FENG Xin-gang1
(1.Key Laboratory of Animal Parasitology of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2.College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234, China)
The present study aimed at obtaining the recombinant SjCHGC06822 protein by using prokaryotic expression system and evaluating the immune response in BALB/c mice.A full-length ORF encoding SjCHGC06822 of S.japonicum was amplifi ed in PCR.The obtained cDNA was subcloned into pET28a(+) vector that was then transformed into BL21(2E).The recombinant protein was purifi ed using His-Ni resin.Bioinformatics analysis showed that the full-length ORF was 591 bp, encoding 192 amino acids.The SjCHGC06822 protein had an EF-hand domain without signal peptide and transmembrane peptide.The recombinant protein was visualized as a band at molecular mass of 23 kDa in Western blot.BALB/c mice were immunized with the recombinant protein and antibody responses were detected in ELISA.The immunized mice along with non-immunized controls were challenged with S.japonicum and worm reduction rate and liver egg reduction were recorded.In two separate animal experiments, worm reduction rates of the immunized mice were 30.36% and 40.26% and liver egg reductions were 30.14% and 12.28%.The specifi c IgG, IgG2a and IgG1 were detected using ELISA.The antibody responses gradually increased post immunization and subsequent challenge.However, IgG2a and IgG1 levels increased post immunizationbut decreased post challenge while the ratio of IgG2a/IgG1 (<1) was climbing.In conclusion, the recombinant SjCHGC06822 protein can induce good immunogenicity.
Schistosoma japonicum; SjCHGC06822; immunogenicity; Th1 type response
S852.735
:A
:1674-6422(2015)01-0039-08
2014-04-17
中央级公益性科研院所基本科研业务费项目
段明明,男,硕士研究生,预防兽医学专业
冯新港,E-mail:boming666@163.com
